Развитие теории инверсионной вольтамперометрии на твердых электродах
На правах рукописи
УДК543.253:541.135
ГУНЦОВ АЛЕКСАНДР ВЛАДИМИРОВИЧ
РАЗВИТИЕ ТЕОРИИ ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ НА ТВЕРДЫХ ЭЛЕКТРОДАХ
02.00.04 – физическая химия
Автореферат диссертации на соискание ученой степени
доктора химических наук
Тюмень –
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Тюменский государственный нефтегазовый университет» (ТюмГНГУ) Министерства образования РФ
Официальные оппоненты: доктор химических наук,
профессор,
Н.А. Колпакова
доктор химических наук,
старший научный сотрудник
В.А. Исаев
доктор технических наук,
профессор,
В.П. Ганяев
Ведущая организация: Государственное образовательное учреждение
высшего профессионального образования
«Уральский государственный технический
университет-УПИ» Министерства образования РФ
Защита диссертации состоится 14 мая 2002 г. в 1415 часов на заседании диссертационного совета Д 212.273.06 в Государственном образовательном учреждении высшего профессионального образования «Тюменский государственный нефтегазовый университет» Министерства образования РФ по адресу: 625000, г. Тюмень, ул. Володарского, 38.
С диссертацией можно ознакомиться в библиотеке ТюмГНГУ по адресу: 625000, г. Тюмень, ул. Володарского, 38.
Автореферат разослан ___ апреля 2002 г.
Ученый секретарь
диссертационного совета,
доктор химических наук,
профессор И.Г. Жихарева
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. В современной аналитической химии большое значение имеют электрохимические методы анализа. Особое место среди них занимают инверсионные электрохимические методы. Они дают возможность разрабатывать методы анализа, отличающиеся простотой, экспрессностью, селективностью и хорошей воспроизводимостью. Инверсионные электрохимические методы используются для анализа и контроля загрязнённости окружающей среды, аттестации стандартных образцов, послойного анализа кристаллов и плёнок, автоматического контроля отдельных технологий в цветной металлургии и микроэлектронике. Одно из наиболее ценных качеств инверсионных электрохимических методов - высокая чувствительность. Определяемые концентрации в ряде объектов достигают n·10-8 - n·10-9 %.
Инверсионные электрохимические методы на твердых электродах, не полностью покрытых осадком исследуемого вещества, позволяют изучать различные физико-химические процессы, связанные с образованием на электроде микроколичеств осадка. Изучение начальных стадий электрокристаллизации один из наиболее важных вопросов современной физической химии, что связано с производством химических источников тока, а также с такими отраслями химической промышленности как электроосаждение металлов, гальванопластика, гальваностегия и некоторые другие.
Теория инверсионных электрохимических методов для электрода не полностью покрытого осадком в настоящее время только начинает развиваться. Некоторые основные положения этой теории не являются общепринятыми. В то же время накоплен большой экспериментальный материал, позволяющий выявить ряд общих закономерностей по электрорастворению и электронакоплению микроколичеств исследуемого вещества на твердом электроде. Остаётся актуальной задача по теоретическому описанию процессов роста и растворения отдельных зародышей осадка на твердых электродах. Большое значение для развития теории инверсионных электрохимических методов имеет постановка и решение задачи Стефана в условиях инверсионных электрохимических методов.
Основные метрологические характеристики метода инверсионной вольтамперометрии существенно зависят от взаимного влияния определяемых и мешающих элементов на всех этапах инверсионно-вольтамперометрического анализа. Эффект взаимного влияния может заключаться в аддитивном взаимном наложении пиков этих элементов в стадии регистрации вольтамперограмм или взаимодействии элементов в стадии концентрирования с образованием на поверхности электрода сложных соединений. Работы в данном направлении проводились в основном при анализе металлов. Значительно в меньшей степени изучены условия определения галогенид-ионов, а также условия определения галогенид-ионов при их совместном присутствии в растворе.
В литературе отсутствуют данные о влиянии температуры, произведения растворимости малорастворимого соединения, образующегося на электроде, или эти данные носят противоречивый характер. Детальное изучение влияния этих факторов позволит решить вопросы оптимизации аналитического сигнала и выявить условия, при которых возможно определение анионов при их совместном присутствии в растворе.
Работа выполнялась в соответствии с координационными планами АН СССР по аналитической химии на 1981-1985 гг., 1986-1990 гг. (направление 2.20.4.7), находилась в соответствии с координационными планами научно-исследовательских работ Тюменского государственного нефтегазового университета на 1986-1996гг. (гос. рег. № 0186.0096007).
Цель работы. Основной целью диссертационной работы является разработка метода решения диффузионной задачи Стефана в условиях инверсионных электрохимических методов анализа для процессов электрорастворения и электронакопления осадков металлов на твердом электроде в виде зародышей или сплошной пленки. На основе решения задачи Стефана необходимо было вывести уравнения вольтамперограмм, хроноамперограмм и хронопотенциограмм процессов электрорастворения микроколичеств осадка, а также вывести соотношения для аналитического сигнала: тока пика вольтамперограммы, потенциала тока пика вольтамперограммы, броскового тока и переходного времени для обратимого, необратимого и квазиобратимого электродных процессов.
Вторая цель работы заключалась в математическом моделировании процессов электронакопления и электрорастворения простых и смешанных малорастворимых соединений на металлическом электроде; изучении электрохимического поведения галогенид-ионов при их совместном присутствии в растворе методом инверсионной вольтамперометрии; исследовании условий протекания электродных процессов электронакопления и электрорастворения некоторых серосодержащих соединений.
Для достижения поставленной цели в работе необходимо было решить следующие задачи:
На основе выбранной физико-химической модели процессов электрорастворения и электронакопления микроколичеств осадка на твердом электроде необходимо было осуществить математическую постановку диффузионной задачи Стефана для условий инверсионных электрохимических методов и разработать метод решения поставленной задачи.
Получить решение задачи для осадков металлов, а также для процессов образования и электрорастворения простых и смешанных осадков малорастворимых соединений галогенид-ионов и некоторых серосодержащих соединений на твердом электроде.
Изучить влияние потенциала электронакопления на аналитические сигналы процессов электрорастворения галогенидов серебра и ртути с поверхности серебряного и ртутного электродов и выбрать потенциалы электронакопления галогенидов на поверхности электродов с целью их определения при совместном присутствии в растворе.
Исследовать влияние температуры на процессы электронакопления и электрорастворения галогенидов серебра на поверхности серебряного электрода.
Установить характер взаимовлияния галогенид-ионов при их совместном присутствии в растворе на аналитические сигналы процессов электрорастворения галогенидов серебра.
Выбрать условия определения микроконцентраций галогенид-ионов при их совместном присутствии в растворе методом инверсионной вольтамперометрии.
Научная новизна. Впервые разработан квазистационарный метод решения диффузионных задач Стефана для разбавленных растворов в условиях метода инверсионной вольтамперометрии.
Выведены новые уравнения вольтамперограммы, хроноамперограммы и хронопотенциограммы; соотношения для тока пика, потенциала тока пика и ширины полупика вольтамперограммы, броскового тока хроноамперограммы и переходного времени хронопотенциограммы; формулы для радиуса отдельных зародышей для обратимого и необратимого анодных электродных процессов электрорастворения зародышей осадка.
Получены оригинальные уравнения вольтамперограмм и соотношения для тока пика процессов электрорастворения диффузионно-взаимодействующих зародышей осадка для обратимого и необратимого электродных процессов.
Для квазиобратимого электродного процесса электрорастворения отдельных зародышей осадка впервые выведены уравнения хроноамперограммы, хронопотенциограммы и хроновольтамперограммы; радиуса зародышей и броскового тока, тока пика вольтамперограммы.
Рассмотрена стадия электронакопления микроколичеств исследуемого вещества на твёрдом электроде. По-новому выведены уравнения потенциостатических кривых, а также уравнения для количества вещества на электроде и выражения для радиуса отдельных зародышей осадка. Предлагаются формулы для оценки числа зародышей.
Впервые выведены уравнения потенциодинамических кривых для процессов электронакопления и электрорастворения отдельных и диффузионно - взаимодействующих зародышей осадка для обратимого и необратимого электродных процессов. Выведены соответствующие формулы для тока максимума и времени его достижения. Получены уравнения для количества вещества на электроде и выражения для радиуса отдельных зародышей осадка для потенциодинамических обратимого и необратимого электродных процессов электронакопления.
По-новому проанализированы рост и растворение малых двумерных зародышей осадка для условий инверсионной вольтамперометрии.
По мнению автора впервые получено аналитическое уравнение вольтамперограммы с двумя пиками для необратимого электрорастворения зародышей и адсорбированных атомов на твердом электроде.
Проанализировано влияние поверхностного натяжения на рост отдельных зародышей осадка в потенциостатических условиях. Впервые показано, что влиянием поверхностного натяжения можно пренебречь в условиях проведения инверсионного вольтамперометрического анализа.
В работе по-новому изучено влияние характера (адсорбция или фазовая пленка) образования осадка в стадии, электронакопления на величину аналитического сигнала в процессе электрорастворения осадка малорастворимого соединения с поверхности металлического электрода. Впервые проведено теоретическое рассмотрение влияния температуры на величину пиков в катодной инверсионной вольтамперометрии. Теоретические выводы подтверждены экспериментально на примере процессов электронакопления и электрорастворения галогенидов серебра на серебряном электроде.
Разработана оригинальная теория компенсационного эффекта при гетеродиффузии в растворах и расплавах.
Впервые предложена математическая модель и получены уравнения, описывающие процессы образования и электрорастворения смешанных малорастворимых соединений и некоторых серосодержащих соединений на твердом электроде в условиях катодной инверсионной вольтамперометрии. Теоретические выводы подтверждены экспериментально на примере электрорастворения осадков галогенидов серебра, полученных при одновременном присутствии в растворе двух галогенид-ионов, а также осадков некоторых серосодержащих соединений.
По-новому исследовано взаимовлияние галогенид-ионов при их совместном присутствии в растворе на процесс инверсионно - вольтамперометрического определения галогенид-ионов.
Впервые разработаны оптимальные условия определения хлорид-иона в присутствии бромид - или иодид-ионов, бромид-ионов в присутствии хлорид-ионов, иодид-ионов в присутствии бромид - и хлорид-ионов методом катодной инверсионной вольтамперометрии.
На защиту выносятся следующие положения:
- Квазистационарный метод решения диффузионной задачи Стефана для условий метода инверсионной вольтамперометрии.
- Уравнения поляризационных кривых в инверсионных электрохимических методах: хроноамперометрии, хронопотенциометрии и вольтамперометрии для обратимого, необратимого и квазиобратимого электродных процессов электрорастворения отдельных зародышей осадка.
- Формулы для тока пика, потенциала тока пика и ширины полупика вольтамперограммы; переходного времени и броскового тока в случае электрорастворения отдельных зародышей осадка.
- Уравнения потенциостатических и потенциодинамических кривых в случае роста отдельных зародышей осадка.
- Выражения для радиуса зародышей в случае их роста и электрорастворения на твердом электроде.
- Математические модели процессов образования и электрорастворения простого и смешанного осадков малорастворимых соединений в условиях метода инверсионной вольтамперометрии.
- Аналитическое уравнение вольтамперограммы с двумя пиками для электрорастворения двух форм осадка в случае необратимого электродного процесса.
- Анализ влияния поверхностного натяжения на рост изолированных зародышей осадка в потенциостатических условиях.
- Вывод уравнения для компенсационного эффекта при гетеродиффузии в жидких растворах и расплавах.
- Способ определения энергетического состояния малорастворимого соединения на твердом электроде.
- Математические модели и экспериментальные результаты по влиянию температуры на процессы электронакопления и электрорастворения галогенидов серебра на поверхности серебряного электрода.
- Экспериментальные результаты по исследованию электрохимического поведения и взаимовлияния галогенид-ионов при их совместном присутствии в растворе на процесс инверсионно - вольтамперометрического определения галогенид-ионов.
Практическое значение. Развиваемая теория имеет большое практическое значение для инверсионных электрохимических методов исследования и анализа на электроде не полностью покрытым осадком. Выведенные выражения для аналитического сигнала и количества вещества на электроде позволяют оптимизировать величину аналитического сигнала при электрорастворении зародышей либо пленки осадка на твердом электроде. Выражения для радиуса зародышей и их числа могут найти применение в практике при исследовании электроосаждения металлов.
Результаты работы дают возможность планировать аналитический эксперимент при электроконцентрировании анионов на металлических электродах в виде малорастворимых солей при наличии в растворе нескольких анионов, способных образовывать такие соединения. Предложен инверсионно-вольтамперометрический способ определения энергетического состояния труднорастворимых соединений на металлах (А.с. № 1807379 ).
Апробация работы. Результаты работы докладывались и обсуждались на VII Всесоюзной конференции по физической химии и электрохимии расплавленных и твердых электролитов, Свердловск, 1979 г., III Уральской конференции по высокотемпературной физической химии и электрохимии, Свердловск, 1981 г., VI Всесоюзной конференции по электрохимическим методам анализа, Томск, 1981г., I зональной научной конференции «Аналитическая химия Сибири» Тюмень, 1982г., VIII Всесоюзном совещании по полярографии, Днепропетровск, 1984г., научно-технической конференции по химии и химической технологии, Тюмень, 1985г., IX Всесоюзном совещании по полярографии, Усть-Каменогорск, 1987г., Всесоюзной конференции «Анализ – 90», Ижевск, 1990 г., V Всероссийской конференции с участием стран СНГ «Электрохимические методы анализа (ЭМА-99)» Москва 1999 г., IV Всероссийской конференции с международным участием «Экоаналитика-2000», Краснодар, 2000г., симпозиуме «Теория электроаналитической химии и метод инверсионной вольтамперометрии», Томск, 2000г., международной научно-технической конференции «Новые материалы и технологии в машиностроении», Тюмень, 2000г., конференции «Проблемы электрокристаллизации металлов», Екатеринбург, 2000г.
Публикации. По результатам исследований опубликовано 53 печатных работы, в том числе 18 статей, 1 авторское свидетельство и 3 монографии.
Объем и структура работы. Диссертация состоит из введения, 7 глав, обсуждения результатов, выводов, списка использованной литературы из 215 наименований, содержит 302 страницы машинописного текста, рисунки, таблицы.
Глава 1 (литературный обзор) посвящена обсуждению литературных источников по вопросу о физико-химической природе осадка, полученного при электронакоплении исследуемого вещества из разбавленных растворов, анализу начальных стадий процесса электрокристаллизации и определению галогенид ионов в условиях метода инверсионной вольтамперометрии.
В главе 2 развивается теория инверсионных электрохимических методов для процессов электрорастворения микроколичеств осадка на твердых электродах.
Глава 3 посвящена моделированию процессов электронакопления и электрорастворения малорастворимых соединений на твердых электродах.
В главе 4 приводятся сведения по методике и технике выполнения экспериментальных работ в условиях метода инверсионной вольтамперометрии.
Глава 5 посвящена исследованию электрохимического поведения галогенид – ионов.
В главе 6 приводятся экспериментальные данные по взаимовлиянию галогенид – ионов при их определении методом инверсионной вольтамперометрии.
В главе 7 сравниваются основные выводы развиваемой теории процессов электрорастворения микроколичеств осадка на твердых электродах с экспериментальными данными.
КРАТКОЕ СОДЕРЖАНИЕ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Основные уравнения, которые предлагались ранее для описания процессов осаждения и электрорастворения микроколичеств осадка в условиях метода инверсионной вольтамперометрии, не учитывают электрорастворения отдельных зародышей осадка. Рост сплошной пленки осадка на твердых электродах, либо ее электрорастворение рассматривались в основном для стационарных электрохимических процессов. Следовательно, для развития теории инверсионных электрохимических методов необходимо было сделать постановку и решить диффузионную задачу Стефана для нестационарных процессов роста и растворения зародышей и сплошной пленки осадка. С другой стороны анализ литературных данных показал, что остался неисследованным вопрос о взаимовлиянии анионов при их совместном присутствии в растворе.
Развитию теории инверсионных электрохимических методов анализа для процессов электрорастворения зародышей осадка на твердых электродах посвящена глава 2. Вначале главы 2 дается постановка диффузионной задачи Стефана для инверсионных электрохимических методов анализа ионов в разбавленных растворах.
Предполагается, что на электроде находится N полусферических зародышей одинакового радиуса R. На начальном этапе зародыши растут, не взаимодействуя друг с другом. Это позволяет свести задачу о росте N зародышей к задаче о росте (либо растворении) одного зародыша. Задача о росте и растворении зародышей новой фазы представляет собой известную задачу Стефана. Это достаточно сложная диффузионная задача. Её решение вызывает большие математические затруднения. Точные решения этой задачи известны лишь для некоторых частных случаев.
В работе предлагается квазистационарный метод решения задачи Стефана для условий инверсионной вольтамперометрии.
Рассмотрим анодный процесс электрорастворения зародышей осадка:
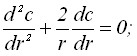 C(r)=C0 ; C(r =R) = CS ; (1)
C(r)=C0 ; C(r =R) = CS ; (1)
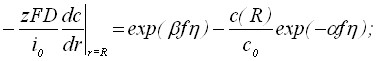 (2)
(2)
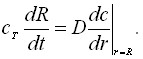 (3)
(3)
Для роста зародышей вместо (2) надо записать
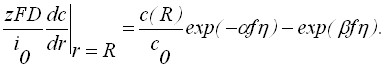 (4)
(4)
Здесь: t – время; r – расстояние; D – коэффициент диффузии; z – число электронов; F – число Фарадея; i0 – плотность тока обмена;, - коэффициенты переноса; f=(zF)/(RГТ);RГ – универсальная газовая постоянная; Т – абсолютная температура; - перенапряжение; сТ = 1/Vm; Vm - мольный объем вещества осадка.
Квазистационарный метод применим, когда C0 < 10-3 М.
Хронопотенциометрическое граничное условие имеет вид:
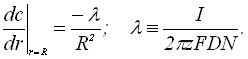 (5)
(5)
где I – ток электролиза; N – число зародышей на электроде.
Результаты решения соответствующих диффузионных задач квазистационарным методом приведены в таблице 1, для модели диффузионно-невзаимодействующих полусферических зародышей осадка.
Таблица 1
Стадия электрорастворения
| Обратимый электродный процесс | Необратимый электродный процесс |
| Вольтамперометрия с линейной развёрткой потенциала | |
| 1) Радиус зародыша | |
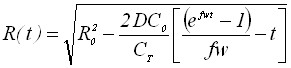 | 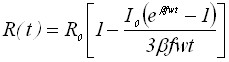 |
| 2) Уравнение вольтамперной кривой | |
| 3) Ток пика вольтамперограммы | |
 | |
| 4) Потенциал тока пика | |
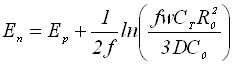 | 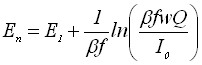 |
| Хроноамперометрия | |
| 1) Радиус зародыша | |
 | 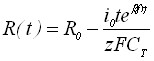 |
| 2) Бросковый ток | |
| Хронопотенциометрия | |
| 1) Радиус зародыша | |
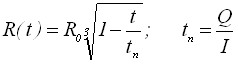 | |
| 2) Уравнение хронопотенциограммы | |
 | 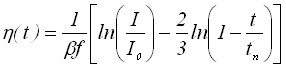 |
Для квазиобратимого электродного процесса электрорастворения можно записать
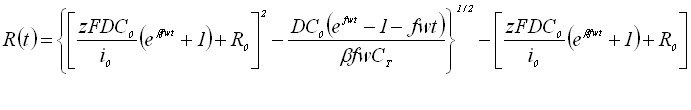 (6)
(6)
Запишем выражения для тока и тока пика вольтамперограммы:
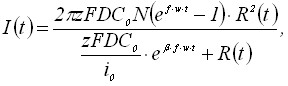
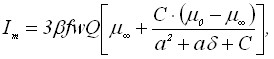 (7)
(7)
где 0,,, С, а, некоторые параметры квазиобратимого электродного процесса.
Из таблицы 1 видно, что в уравнения, характеризующие стадию электрорастворения, входят параметры, которые определяются на стадии электронакопления. Главным из них является величина радиуса зародыша R0.
Результаты решения диффузионных задач для электронакопления осадка на поверхности электрода приведены в таблицах 2 и 3.
Таблица 2
Выражения для радиусов зародышей
| Режим электролиза | Электродный процесс | ||
| Обратимый | Необратимый | ||
| Гальваностатический | 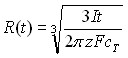 | ||
| Потенциостатический | 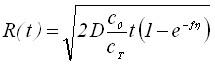 |  | |
| Потенциостатический | Квазиобратимый | ||
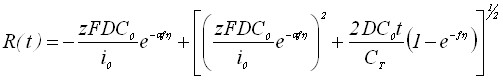 | |||
| Потенциодинамический | 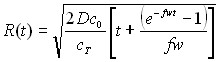 | 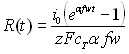 | |
Таблица 3
Уравнения потенциостатических кривыхI(t) и выражения для Q(t)
| Зародышеобразование | Электродный процесс | |
| Обратимый | Необратимый | |
| Мгновенное | ||
| Прогрессирующее | ||
Запишем выражения для приведенных в таблице констант k2 = (2/3)zFCT; k3={(2DC0/CT)[1-exp(-f)]}1/2 =k6; k4=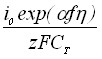 ; k5 =[zFDC0exp(-f)]/i0.
; k5 =[zFDC0exp(-f)]/i0.
Диффузионное взаимодействие зародышей осадка можно учесть, в соответствии с известным соотношением А.Н. Колмогорова для доли закристаллизовавшегося объема x(t)=V(t)/Vm. Количество электричества на электроде с учетом ряда приближений в случае мгновенного зародышеобразования можно оценить по формуле
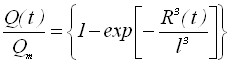 , (8)
, (8)
где ![]() ;
; ![]() .
.
Для обратимого и необратимого электродных процессов получим следующее уравнение для Q(t):
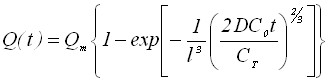 ;
;  (9)
(9)
Продифференцируем выражение (8)
 . (10)
. (10)
Уравнение (10) описывает экспериментально наблюдаемый максимум потенциостатической кривой в случае роста на электроде диффузионно взаимодействующих зародышей осадка.
Рассмотрим рост зародышей осадка в потенциодинамических условиях. Уравнения вольтамперных кривых для роста зародышей осадка в потенциодинамическом режиме для обратимого и необратимого электродного процесса не имеют максимума.
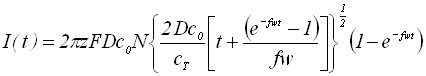 ;
;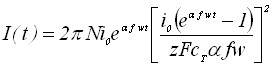 . (11)
. (11)
Рост диффузионно взаимодействующих зародышей осадка в потенциодинамическом обратимом и необратимом случае описывается кривой с максимумом. Решение задачи по нахождению экстремума приводит соответственно к уравнениям:
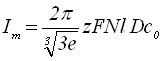 ;
; ![]() . (12)
. (12)
В случае электрорастворения диффузионно-взаимодействующих зародышей, для необратимого электродного процесса выражение для тока пика вольтамперной кривой имеет вид:
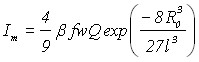 ;
;![]() , (13)
, (13)
где 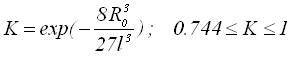 ;
; ![]() - определяется формулой для изолированных зародышей.
- определяется формулой для изолированных зародышей.
Для обратимого электродного процесса вольтамперная кривая электрорастворения диффузионно-взаимодействующих зародышей осадка также имеет максимум, но выражение для Im в аналитическом виде не получено.
На поверхности электрода могут быть как трехмерные, так и двумерные зародыши осадка. Рассмотрим рост двумерных зародышей в потенциостатических условиях.
Запишем выражение для количества электричества:
![]() . (14)
. (14)
В результате решения задачи о растворении двумерных зародышей осадка в потенциодинамических условиях получим следующее уравнение вольтамперной кривой и величину тока пика
![]() ;
; ![]() . (15)
. (15)
Из уравнения (15) следует, что в этом случае ток пика прямо пропорционален концентрации ионов деполяризатора в растворе электролита.
В общем случае на твердом электроде могут быть адсорбированные атомы и зародыши осадка. Как было показано выше, растворение зародышей осадка в потенциодинамическом режиме описывается кривой с одним максимумом. Растворение адсорбированных атомов также описывается кривой с одним максимумом. В аналитическом виде уравнение вольтамперной кривой с двумя пиками можно записать для необратимого электродного процесса.
Уравнение общей вольтамперной кривой будет иметь вид I(t)=I1(t)+I2(t-), где - некоторый промежуток времени, в общем случае не равный нулю, I1-известное в литературе уравнение вольтамперной кривой для электрорастворения адсорбированных атомов; I2- полученное нами уравнение вольтамперной кривой для электрорастворения зародышей осадка.
Графики зависимости I(t)=I1(t)+I2(t-) имеют два пика. Их взаимная величина зависит от соотношения q1/q2, а их взаимное расположение зависит от величины. Типичные графики I(t)приведены на рис.1.

Рис.1. Вольтамперные кривые, рассчитанные по уравнению I(t)=I1(t)+I2(t); I11(t) q1>q2; I12(t) q1<q2
При решении диффузионной задачи о росте полусферического зародыша осадка с учетом поверхностного натяжения получим уравнение, решение которого имеет вид
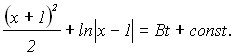 . (16)
. (16)
где x=R/Rкр ; Rкр.=2Vm/zF - радиус критического зародыша; - поверхностное натяжение График функции x(t) имеет точку перегиба при xn=2, т.е. при Rn=2Rкр. Численные оценки дают величины tn порядка 10-5 –10-3 сек.
При достаточно продолжительном электронакоплении вещества на электроде зародыши перекрываются, и начинает расти сплошная плёнка осадка. Будем рассматривать тонкие плёнки, диффузией внутри которых можно пренебречь. В случае обратимого и необратимого электродных процессов получим:
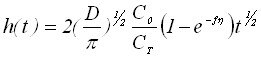
![]() . (17)
. (17)
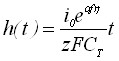 ,
, ![]() . (18)
. (18)
Полученные нами формулы для Q позволяют построить график общей Q - t кривой (рис.2). Условно график зависимости Q(t) можно разбить на три участка. Первый участок 0 - t1 соответствует стадии электронакопления монослоя вещества за счет адсорбции ионов деполяризатора. Q1 - количество электричества, эквивалентное адсорбционному слою вещества осадка. Qm1 – количество электричества, эквивалентное максимальному адсорбционному монослою вещества осадка. Второй участок t1 – t2 характеризует рост зародышей. Q’’2 – описывает рост диффузионно-невзаимодействующих, а Q2’ - характеризует рост диффузионно-взаимодействующих зародышей осадка. Qm2=zFCT (2/3)l3N. Q2 – соответствует росту сплошной пленки. Q = Q1+Q2. Третий, последний, участок общей Q-t кривой соответствует росту плёнки осадка на твёрдом электроде.
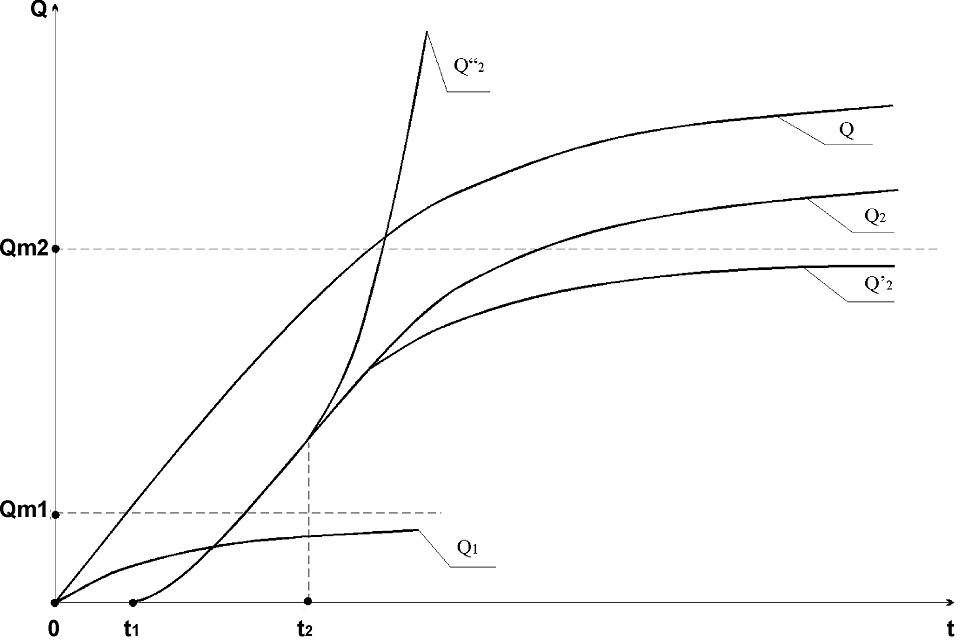
Рис.2. Схематическая зависимость количества осадка на электроде от времени электронакопления
В главе 3 выполнено математическое моделирование процессов электронакопления и электрорастворения малорастворимых соединений на электроде в условиях метода инверсионной вольтамперометрии анионов
Рассмотрим нестационарный процесс образования фазовой пленки малорастворимого соединения на твердом электроде.
Уравнение баланса массы на фазовой границе электрод-раствор в данном случае можно записать в виде: ![]() , где h - толщина пленки; t - время электронакопления; jMe, jA- диффузионные потоки ионов металла и анионов.
, где h - толщина пленки; t - время электронакопления; jMe, jA- диффузионные потоки ионов металла и анионов.
Решение соответствующей диффузионной задачи Стефана квазистационарным методом имеет вид:
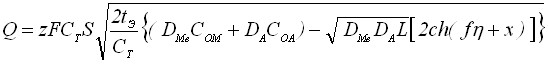 , (19)
, (19)
где  ; ch(f+x) – гиперболический косинус; L – произведение растворимости осадка; DA – коэффициент диффузии анионов в растворе; DMe - коэффициент диффузии катионов в пленке; СOM - концентрация ионов металла у поверхности металлического электрода; СOA - концентрация определяемых анионов в объеме раствора.
; ch(f+x) – гиперболический косинус; L – произведение растворимости осадка; DA – коэффициент диффузии анионов в растворе; DMe - коэффициент диффузии катионов в пленке; СOM - концентрация ионов металла у поверхности металлического электрода; СOA - концентрация определяемых анионов в объеме раствора.
Максимум зависимости Q = f() характеризуется уравнениями:
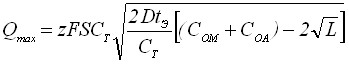 ;
; 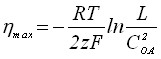 . (20)
. (20)
Из уравнения (20) видно, что с увеличением произведения растворимости образующегося на электроде осадка мах смещается в положительную область.
Таким образом, в случае образования сплошной пленки осадка на поверхности электрода количество осадка будет уменьшаться с увеличением произведения растворимости. В этом случае при прочих равных условиях будет наблюдаться ряд ![]() .
.
В случае малых концентраций определяемых анионов наиболее вероятен процесс адсорбции анионов на поверхности твердого электрода.
Адсорбцию ионов деполяризатора для необратимого электродного процесса можно описать уравнением
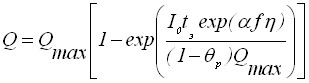 , (21)
, (21)
где Q - количество электричества при данной степени заполнения поверхности электрода осадком; Qмах - количество электричества при максимальной степени заполнения электрода; tэ - время электронакопления осадка. Аналогичная зависимость будет верна и для обратимого электродного процесса.
Если учитывать только адсорбцию анионов на поверхности электрода, то в случае необратимого процесса количество электричества, идущего на электрорастворение осадка, пропорциональное количеству вещества на электроде, будет описываться формулой (21), в которой Qмах = zF (где - количество вещества в молях ). Оценим связь количества вещества с количеством ионов. Число частиц, способных адсорбироваться на поверхности электрода, до полного заполнения поверхности монослоем осадка можно оценить следующим образом (условно принимая, что частицы имеют сферическую форму):
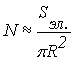 ,
, ![]() , где R - радиус частиц; Sэл. - площадь электрода. То есть количество электричества, идущего на электрорастворение осадка с электрода, обратно пропорционально квадрату радиуса его частиц.
, где R - радиус частиц; Sэл. - площадь электрода. То есть количество электричества, идущего на электрорастворение осадка с электрода, обратно пропорционально квадрату радиуса его частиц.
Если данный вывод применить к галогенид-ионам, то получим в данном случае ![]() .
.
Эти результаты позволили нам предложить инверсионно - вольтамперометрический способ установления энергетического состояния малорастворимого соединения на металлическом электроде.
Рассмотрим влияние температуры на процесс образования сплошной пленки осадка малорастворимого соединения. Анализ зависимости Q(T) показывает, что она имеет максимум при температуре
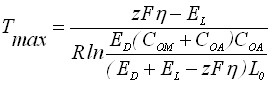 . (22)
. (22)
Здесь учтено, что ![]() ;
; ![]() .
.
В случае необратимой адсорбции анионов от температуры зависят параметры I0, f, p. При малых временах электронакопления и некоторых других предположениях можно получить: 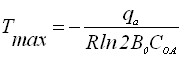 .
.
Таким образом, и в случае образования фазовой пленки, и в случае адсорбции ионов температурная зависимость количества электричества, соответствующего количеству осадка на электроде, может проходить через максимум, положение которого зависит от концентрации определяемого иона и произведения растворимости осадка, образующегося на электроде.
Влияние температуры на определение микроконцентраций металлов на твердых электродах описывается функцией Q(T), экстремум которой будет определяться по формуле:
Tmax=zF/Rln(1+zF/ED). (23)
Для необратимого электрохимического процесса роста пленки следует, что зависимость Q=f(T) экстремума не имеет. Происходит возрастание количества электричества с ростом температуры по экспоненте.
В конденсированных системах температурная зависимость коэффициентов диффузии, как правило, описывается уравнением Аррениуса и аппроксимируется прямой в координатах lgD— 1/T. Однако в некоторых случаях наблюдается отклонение от линейности.
Нами были проведены исследования диффузии ионов серебра в расплавленной солевой смеси 3LICl — -2KCl в широком температурном интервале 685—1192oК. В пределах ошибок хронопотенциометрического метода температурная зависимость коэффициентов диффузии ионов серебра в расплаве 3LiCl — 2КСl описывается экспоненциальным уравнением, а коэффициенты диффузии, рассчитанные по уравнению Свэлина, не подтверждаются опытными данными.
Некоторые экспериментальные работы по гетеродиффузии показывают, что существует линейная связь между логарифмом предэкспоненциального множителя lnD0 и энергией активации диффузии ЕD : lnD0=a+bED.
Нами выведено это уравнение с использованием представлений теории свободного объема и допущения о линейной зависимости теплоты испарения от температуры:=0 -T![]() ,тогда
,тогда
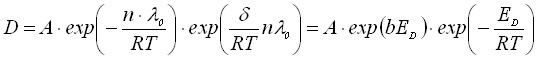 (24)
(24)
где ED=n0, D0=Aexp(bED), b=/R0.
Из уравнения (24) следует линейная связь между логарифмом предэкспоненциального множителя и энергией активации, т. е. компенсационный эффект.
Рассмотрим электрорастворение и рост трехмерных зародышей осадка с учетом диффузии внутри зародышей.
Запишем уравнение вольтамперной кривой:
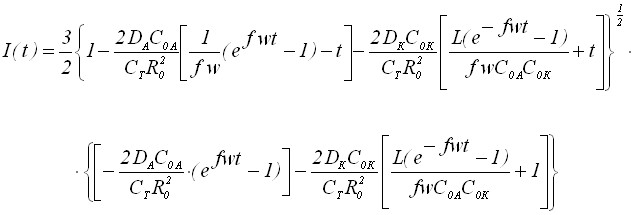 (25)
(25)
Количество осадка Q, накапливаемого на электроде, определяется следующим уравнением:
 . (26)
. (26)
Уравнение вольтамперной кривой (26) нами было рассчитано на ЭВМ в системе MathCAD-7. Были построены вольтамперные кривые при различных потенциалах электронакопления, при различных концентрациях аниона в растворе, при различных временах электронакопления осадка малорастворимого соединения на электроде. По уравнениям вольтамперных кривых построены графики зависимости Jn=f(Eэ), Jn=f(C0), Jn=f(tэ). Из сравнения расчетных и экспериментальных данных следует, что расчетные зависимости качественно согласуются с результатами эксперимента.
Присутствие в растворе двух анионов может привести к образованию смешанного малорастворимого соединения состава Mem+n(A1)m(A2)n (Me – металл, A1 и A2 – анионы первого и второго видов, присутствующие в растворе). Смешанное соединение получается, если простые соединения, из которых оно образуется, имеют близкие произведения растворимости, что часто встречается на практике.
Нами выполнено математическое моделирование процессов образования и электрорастворения смешанных малорастворимых соединений на границе раздела электрод - раствор в предположении протекания обратимых электродных процессов в условиях инверсионной вольтамперометрии.
Процесс можно описать следующим уравнением:
 . (27)
. (27)
Предположим, что малорастворимое соединение электроосаждается на поверхности электрода в виде полусфер. Нестационарные диффузионные задачи роста и растворения зародышей осадка решаем квазистационарным методом.
В результате решения соответствующей задачи Стефана получим, что количество электричества Q описывается уравнением:
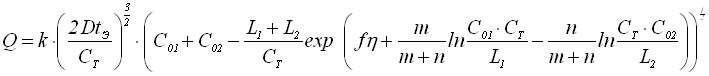 , (28)
, (28)
где k=(2/3)NzFCT ; N-количество зародышей малорастворимого соединения на электроде, tэ-время электронакопления осадка.
Если смешанное соединение находится на электроде в виде сплошной пленки, то рост пленки можно описать следующим уравнением:
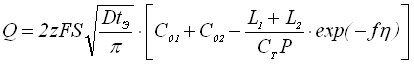 . (29)
. (29)
Поляризационная кривая процесса электрорастворения имеет форму пика.
Значение максимума тока пика определяется по формуле
![]()
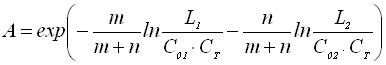 . (30)
. (30)
Из уравнения (30) видно, что ток максимума процесса электрорастворения осадка смешанного состава при протекании обратимого электродного процесса зависит от скорости изменения потенциала электрода, времени электронакопления, количества зародышей на электроде, концентрации анионов в растворе, произведения растворимости простых соединений, состава смешанного соединения и потенциала электронакопления.
В главе 4 описывается техника эксперимента в методе инверсионной вольтамперометрии. Исследования по инверсионной вольтамперометрии галогенид-ионов проводились в основном на стандартном оборудовании и по стандартным методикам.
В главе 5 выполнено исследование электрохимического поведения галогенид-ионов методом инверсионной вольтамперометрии. Поскольку процесс определения галогенид-ионов связан с образованием малорастворимого соединения между материалом электрода и анализируемым анионом раствора электролита, то одним из наиболее важных факторов, влияющих на это определение, является выбор индикаторного электрода. Сведения о величинах произведений растворимости галогенидов металлов взятые из литературных источников позволили выбрать в качестве материала для рабочего электрода ртуть и серебро. Известно, что если при определении анионов на электроде одновременно накапливаются несколько малорастворимых соединений, то они мешают определению - друг друга. Одним из возможных путей избирательного электронакопления малорастворимых осадков является проведение электронакопления при определенных потенциалах электролиза. Нами изучено инверсионно-вольтамперометрическое поведение галогенид-ионов на стационарном ртутном электроде в растворах 0,01 М перхлората натрия и 0,1 М ацетата натрия, так как анионы этих солей не образуют комплексов с ионами ртути и cepeбpa. Электронакопление осадков проводилось в потенциостатических условиях в течение трех минут, после чего осадок восстанавливался в потенциодинамических условиях путем изменения потенциала электрода в электроотрицательную область. На рис. 3 приведены поляризационные кривые процессов электрорастворения галогенидов ртути на исследованных фонах.
Потенциалы пиков вольтамперограмм процессов электрорастворения различных галогенидов серебра, так же, как и в случае галогенидов ртути, существенно различаются между собой, что позволяет предположить возможность их совместного определения, особенно в сочетании с варьированием потенциала электронакопления.
Нами изучены зависимости высот пиков процессов электрорастворения галогенидов серебра от потенциала электронакопления на указанных фонах. Результаты измерений представлены на рис.4. Из рисунка видно, что данные зависимости на обоих фонах для всех галогенид-ионов проходят через максимум. Использование серебряного электрода в качестве индикаторного имеет ряд преимуществ по сравнению с ртутным электродом. Во-первых, серебро является более удобным материалом для практического использования по сравнению с ртутью, в силу его физических свойств. Во-вторых, пики, получаемые при инверсионно-вольтамперометрическом определении галогенид-ионов, имеют более четкий вид и удобней для обработки результатов анализа; определение практически не уступает при этом в чувствительности результатам, полученным на ртутном электроде. Изучение зависимостей In=f(Eэ) для различных галогенидов серебра и ртути позволяет более обоснованно судить о возможности определения галогенид-ионов при их совместном присутствии в растворе.
Исследования влияния температуры на вольтамперометрическое определение всех галогенидов проводились при следующих условиях: время электронакопления осадка на электроде - 2 минуты, концентрация галогенид - ионов в растворе 1·10-5 М, скорость изменения потенциала электрода - 0,02 В/с. Потен-
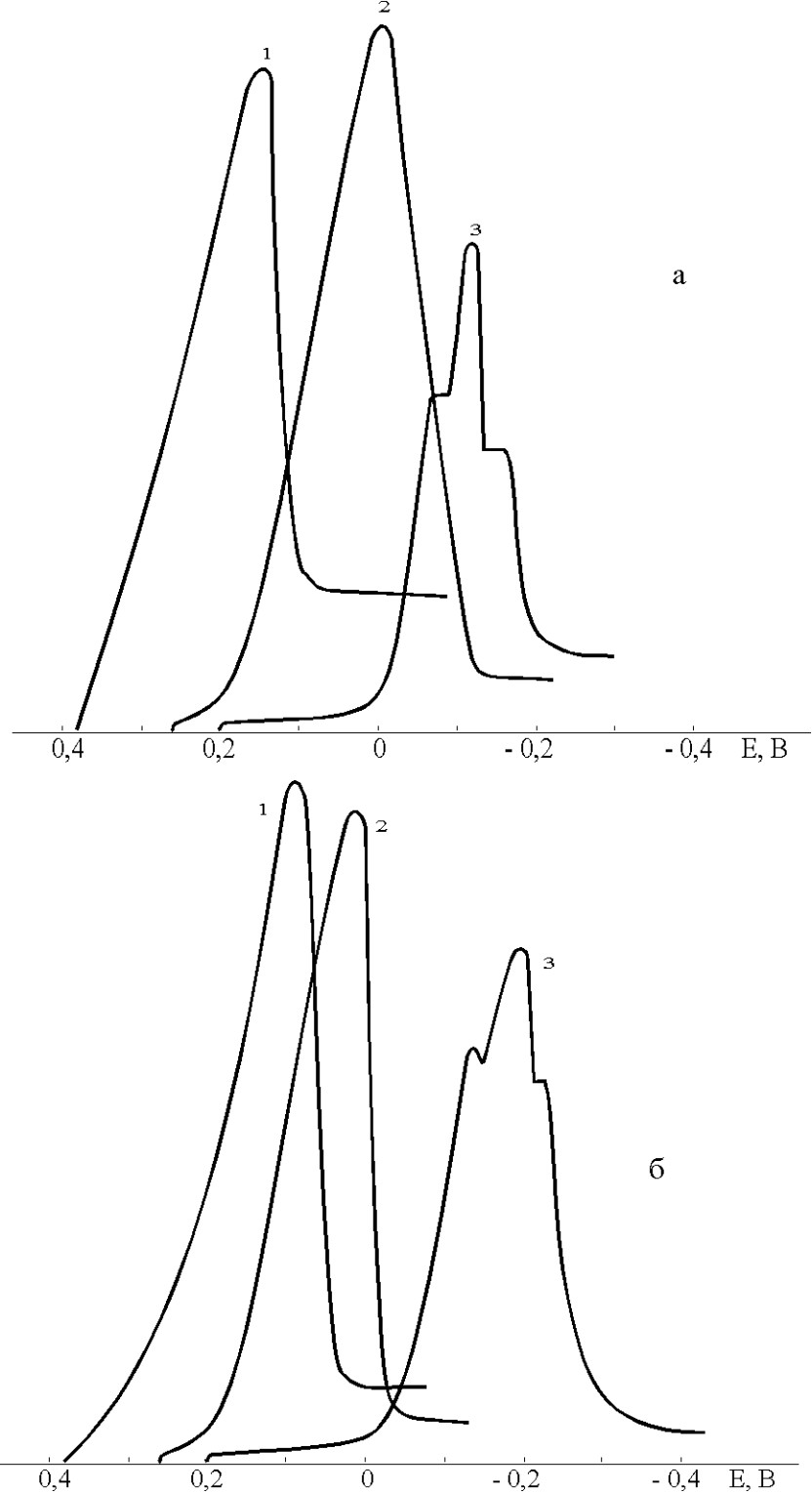
Рис. 3. Поляризационные кривые процессов электрорастворения осадков хлорида (1), бромида (2) и иодида (3) ртути, полученных в стадии накопления на ртутном электроде на фоне 0,01 М перхлората натрия (а) и 0,1 М ацетата натрия (б).
Условия: W = 0,02 B/c, tэ =3 мин, СBr- = CJ- = 1.10 –5 M, CCl- (a) = 2.10 –5 M, CCl- (б) = 5.10 –5 M
циал электронакопления хлорида серебра в данных исследованиях составлял 0,33 В, бромида серебра - 0,27 В, иодида серебра -0,05 В.
Нами были проведены четыре серии исследований. В первой серии изучалось влияние температуры на скорость процесса электрорастворения серебряного электрода при заданных потенциалах. С этой целью были получены кривые анодного растворения серебряного электрода и измерены значения тока при потенциалах, оптимальных для электронакопления соответствующих галогенидов серебра.
Во второй серии изучалось влияние температуры на характеристики пиков в стадии электронакопления. В этом случае температура исследуемого раствора в стадии электронакопления изменялась в интервале от 10 до 70°С. Процесс электрорастворения во всех опытах осуществлялся при 20°С. Электронакопление проводилось в трёхэлектродной электролитической ячейке с водяной рубашкой, через которую непрерывно циркулировала вода с заданной температурой. Индикаторный электрод после электронакопления переносился в другую ячейку, температура раствора в которой равнялась 20°С.
Составы растворов в обеих ячейках были одинаковыми. Процесс электрорастворения во всех опытах с переносом индикаторного электрода из одной ячейки в другую осуществлялся по истечении 30 секунд после прекращения процесса электронакопления в предыдущей ячейке.
В третьей серии опытов изучалось влияние на величину пиков вольтамперограмм электрорастворения галогенидов серебра температуры в стадии электрорастворения. Электронакопление проводилось в растворе с температурой 20°С. После этого индикаторный электрод вносился в термостатическую ячейку с заданной температурой раствора, которая изменялась в интервале от 10 до 70°С. Составы растворов в обеих ячейках были одинаковыми.
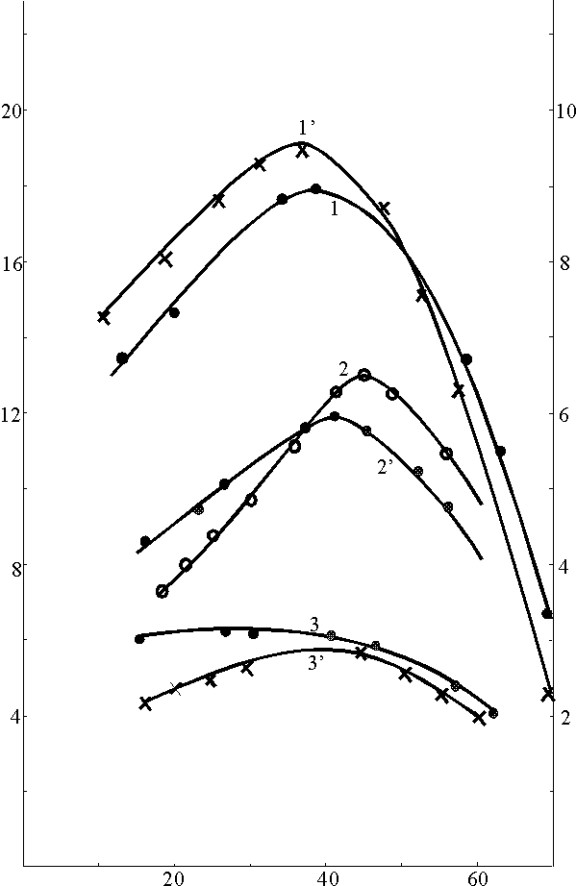
В четвертой серии исследований температура раствора в стадии электронакопления и в стадии электрорастворения была одинаковой. Обе стадии проводились в одной и той же электролитической ячейке. Результаты исследований одной из серии опытов представлены на рис. 5.
Зависимости величин токов пиков вольтамперограмм от температуры проходят через максимум, характерный для каждого галогенид-иона. Увеличение температуры до 30 - 35 °С при анализе галогенидов имеет смысл лишь в случае хлорид-иона, так как приводит к значительному увеличению высоты пика. В случае же бромид - и иодид-ионов повышение температуры не приводит к существенному увеличению аналитического сигнала.
В главе 6 представлены результаты изучения взаимовлияния галогенид-ионов на их определение методом инверсионной вольтамперометрии.
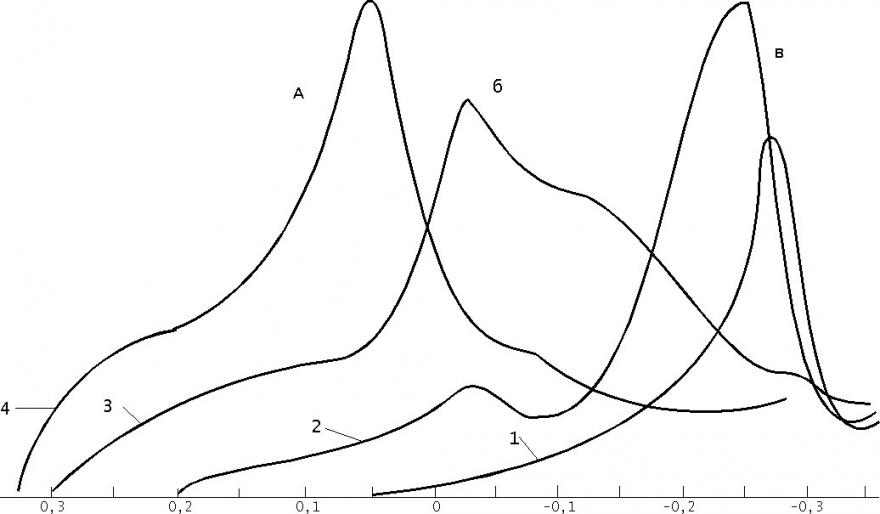
На рис. 6 представлены поляризационные кривые для процессов электрорастворения осадков, полученных на электроде при совместном присутствии в растворе хлорид-, бромид - и иодид-ионов на серебряном электроде, на фоне 0,01 М перхлората натрия при различных потенциалах электролиза.
Из рисунка видно, что при потенциале электролиза +0,05 В (кр. 1) на поляризационной кривой наблюдается один пик, соответствующий процессу электрорастворения иодида серебра. При потенциале электролиза 0.20 В на поляризационной кривой наряду с ростом пика электрорастворения иодида серебра появляется второй пик, соответствующий процессу электрорастворения бромида серебра (кр.2), но его величина значительно меньше величины пика бромида серебра при отсутствии других галогенид-ионов в растворе. При потенциале электролиза 0,30 В на вольтамперограмме наблюдается один общий пик, природу которого трудно определить. При потенциале электронакопления 0,35 В
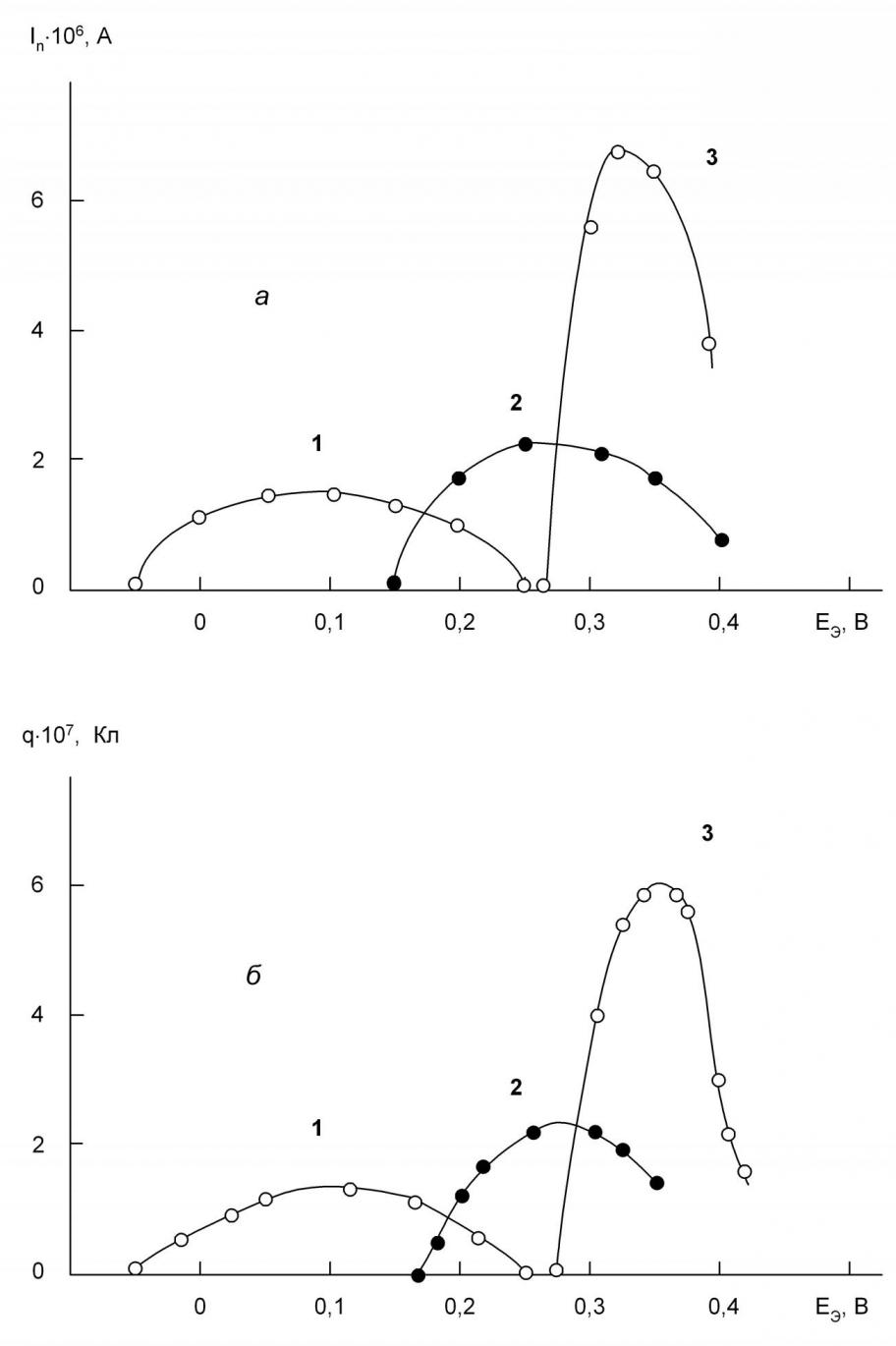
Рис. 4. Зависимость тока пика (а) и количества электричества (б) процессов электрорастворения осадков иодида серебра (1), бромида серебра (2) и хлорида серебра (3) от потенциала электронакопления на фоне 0,1 М ацетата натрия. Условия: tэ=3мин; W=0,02 В/с; СГ-=1·10-5 М
q. 10 6, Кл In'. 10 6, A
T,0C
Рис. 5. Зависимости количеств электричества (q) и тока пика (In’) процессов электрорастворения хлорида (1, 1’), бромида (2, 2’) и иодида (3, 3’) серебра от температуры в стадии электронакопления на фоне 0,1 М ацетата натрия.
Условия: Еэ(1) = 0,33 В; Еэ(2) = 0,27 В; Еэ(3) = 0,07 В; W = 0,02 В/с; СГ- = 1.10 –5 М; tэ = 2 мин. Тэл. раств = 200С
образуется один пик на поляризационной кривой, соответствующий, вероятно, электрорастворению хлорида и бромида серебра.
Таким образом, при наличии в растворе всех трех гадогенид-ионов количественно можно определить только иодид-ион. Определение хлорид - и бромид-ионов в данном случае невозможно.
В связи с этим в работе проведено изучение условий определения галогенид-ионов при наличии в растворе двух из них в различных сочетаниях. Проведенные исследования по взаимовлиянию различных пар галогенид-ионов в растворе позволили предложить методики определение хлорид – и йодид – ионов, хлорид - и бромид-ионов при их совместном присутствии в растворе, а также определение йодид – ионов в присутствии хлорид - и бромид-ионов. Данные методики были проверены методом «введено-найдено».
В главе 7 дается сравнение основных выводов развиваемой теории процессов электрорастворения микроколичеств осадка (глава 2)с экспериментальными данными на примере процессов электрорастворения осадков металлов и электрорастворения осадков малорастворимых солей.
I - 5.10-8, А
Рис.6. Поляризованные кривые процессов электрорастворения осадков, полученных при совместном присутствии в растворе хлорид-, бромид - и иодид-ионов на фоне 0,01 М перхлората натрия. Пики процессов электрорастворения: а)- хлорида серебра, б)- бромида серебра, в)- иодида серебра.
1 - Еэ=0,05 В; 2 - Еэ=0,20 В; 3 - Еэ=0,3 В; 4 - Еэ=0,35 В; tэ = 2 мин.; W= 0,02 В/с; СГ-=1.10-5 М
Диффузионную задачу о растворении малорастворимого соединения можно свести к аналогичной задаче о растворении осадков металлов с поверхности индифферентного электрода, если предположить, что различные процессы переноса в тонкой плёнке осадка (а тем более в зародышах осадка) протекают очень быстро и ими можно пренебречь. Постановка задачи Стефана формально будет описываться теми же уравнениями, что и для зародышей осадков металлов. Следовательно, все формулы и уравнения, выведенные в главе 2, могут быть справедливы для процессов образования и электрорастворения зародышей и тонкой плёнки осадков малорастворимых солей.
Многие экспериментальные работы по электрорастворению микроколичеств осадков металлов с поверхности индифферентного электрода посвящены изучению зависимостей Im (либо Q) от параметров стадии электронакопления: времени предэлектролиза, потенциала предэлектролиза и объёмной концентрации ионов деполяризатора. Схематическая зависимость общей Q-t кривой представлена на рис.1. Эта зависимость соответствует обратимому электродному процессу. На общей Q-t кривой можно выделить три участка: первый соответствует росту диффузионно-невзаимодействующих зародышей осадка и описывается степенной функцией с показателем степени n=5/2; третий участок - рост сплошной плёнки осадка, показатель степени n=1/2. Очевидно, между ними имеется участок с n = 1.Это второй участок, он соответствует росту пористой плёнки. Для необратимого электродного процесса график общей Q-t кривой представлен на рис. 7. Показатель степени в данном случае изменяется от n=4 до n=1.
Наиболее важной является зависимость Q-С0. График этой зависимости представлен на рис.8. Он соответствует схематической зависимости Q-C0 для обратимого электродного процесса. На рис.9 показана схематическая зависимость Q-С0 для необратимого электродного процесса. Показатель степени степенной функции, описывающей различные участки общей Q-С0 кривой, меняется от n=5/2 до n=1 в случае обратимого, n=1/2 в случае необратимого электродных процессов. Здесь принято, что для малых концентраций число зародышей прямо пропорционально концентрации.
Число зародышей осадка можно оценить из экспериментальных данных. Для этого надо оценить радиус зародышей осадка. Затем число зародышей осадка определяется из соотношения N= 3Qэксп/2zFCTR3.
Таким путём из экспериментальных данных можно выяснить зависимость числа зародышей осадка от концентрации ионов деполяризатора и от времени предэлектролиза. Расчёт числа зародышей и их радиуса для процесса электрорастворения микроколичеств исследуемых веществ представлен в табл. 4.
Таблица 4
Расчётные величины числа и радиуса зародышей осадка из данных
инверсионных электрохимических измерений
| Элемент | Pb2+ | Sn2+ | Tl1+ | Cd2+ | Bi3+ | In3+ |
| C0, M | 2.410-7 | 110-5 | 7.810-5 | 10-5 | 1.210-7 | 510-7 |
| t, c | 180 | 600 | 180 | 120 | 600 | 600 |
| E, B (н.к.э.) | -1 | -1.1 | -1.2 | -1.2 | -0.6 | -1.2 |
| Фон | 0.1M KNO3 | 1M HCl | 0.5M KNO3 | 0.2M HCl | 0.1М NH4Cl | 0.01M HCl0;1M HСlO4 |
| R, м | 3.910-8 | 4.410-7 | 2.210-7 | 1.810-7 | 5.510-8 | .710-8 |
| N, м-2 | 2.7109 | 0.5107 | 1.2109 | 2.5108 | 3.51010 | 8.2108 |
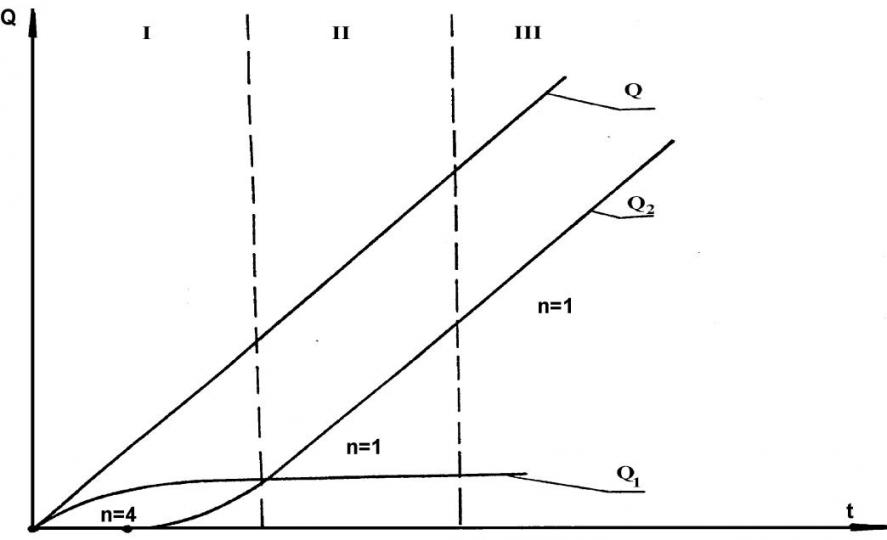
Рис. 7. Схематическая зависимость Q от t для необратимого
электродного процесса
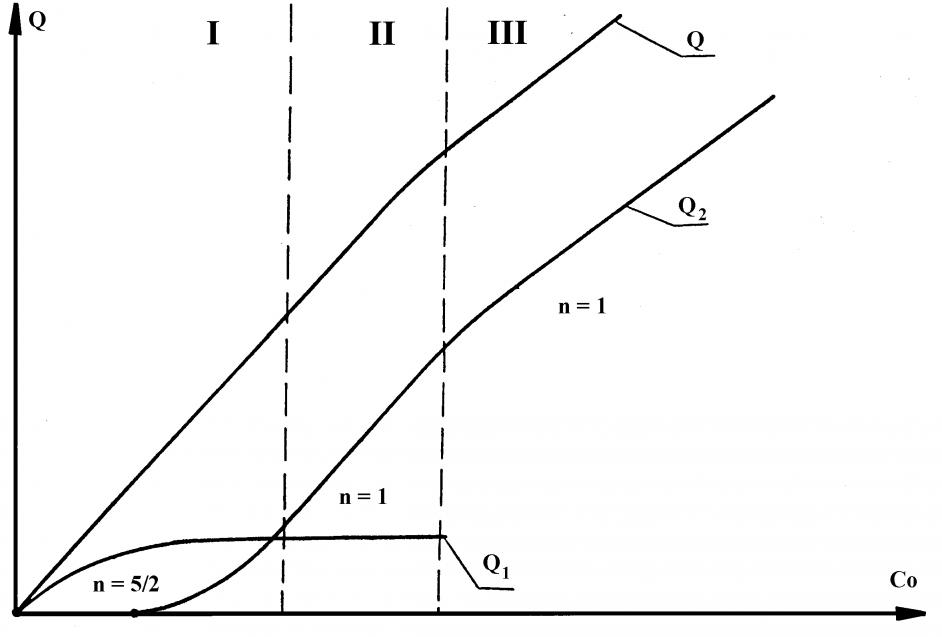
Рис. 8.Схематическая зависимость Q от с0 для
обратимого электродного процесса
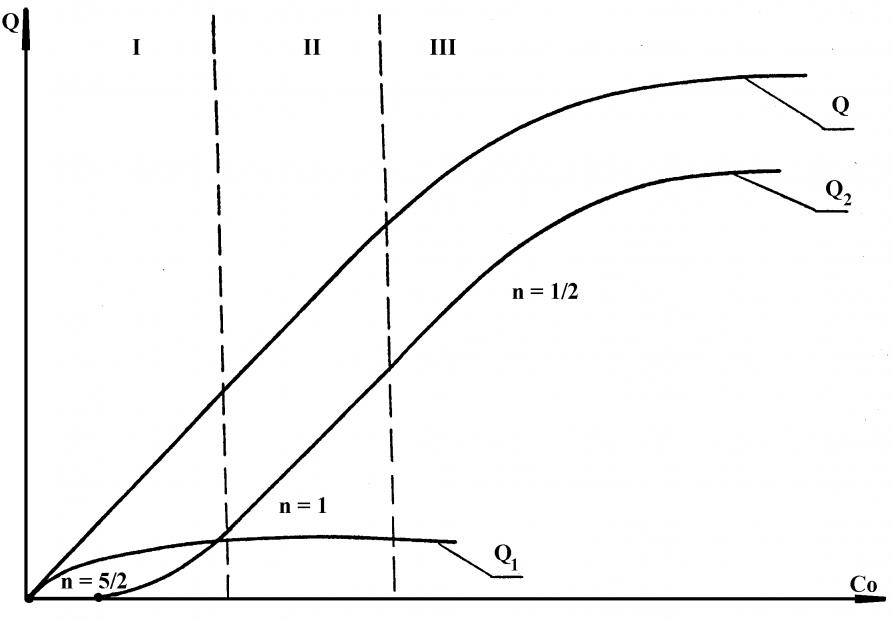
Рис. 9. Схематическая зависимость Q от с0
для необратимого электродного процесса
ВЫВОДЫ
- Дана постановка диффузионной задачи Стефана и разработан квазистационарный метод ее решения для условий инверсионных электрохимических методов на твердых электродах.
- На основе выбранной модели выведены в аналитическом виде уравнения поляризационных кривых в инверсионных электрохимических методах и получены формулы для расчёта тока пика, потенциала тока пика и ширины полупика вольтамперограммы, переходного времени, броскового тока и радиуса зародышей в случае электрорастворения зародышей осадка. В случае роста отдельных зародышей осадка выведены уравнения потенциостатических и потенциодинамических кривых; получены соответствующие выражения для радиуса зародышей.
- Учёт диффузионного взаимодействия зародышей осуществлён на основе уравнения А.Н. Колмогорова. Рассмотрены процессы образования сплошной плёнки осадка. Учитывается влияние выбора уравнения массового баланса на полученные уравнения инверсионных электрохимических методов.
- В аналитическом виде выведено уравнение потенциодинамической кривой с двумя максимумами для необратимого электродного процесса.
- Проанализировано влияние поверхностного натяжения на обратимый потенциостатический рост зародышей осадка.
- При наличии в растворе двух анионов, способных образовывать малорастворимые соединения с металлом электрода, возможно образование смешанного соединения, количество которого прямо пропорционально времени электронакопления, а зависимость концентрации близка к линейной, если концентрации ионов соизмеримы.
- Проведенное математическое моделирование влияния температуры на образование осадков на твердых электродах показало, что для обратимого электрохимического процесса зависимость Q(T) должна иметь экстремум.
- Разработана теория компенсационного эффекта при гетедиффузии в растворах и расплавах.
- Проанализированы электрорастворение и рост трехмерных зародышей осадка с учетом диффузии внутри зародышей.
- Экспериментально изученные зависимости тока пика вольтамперограммы от потенциала электронакопления для различных галогенидов серебра и ртути позволяют выбрать такое значение потенциала электронакопления отдельного галогенид-иона, при котором влияние других присутствующих в растворе галогенид-ионов будет наименьшим.
- Изучено влияние температуры на характеристики токов пиков вольтамперограмм для процессов электрорастворения галогенидов серебра с поверхности серебряного электрода. Изучено влияние температуры на а) скорость процесса электрорастворения серебряного электрода; б) характеристики токов пиков в стадии электронакопления; в) характеристики токов пиков в стадии электрорастворения; г) характеристики токов пиков при одинаковом изменении температуры в стадиях электронакопления и электрорастворения. Установлено, что зависимости тока пика и количества электричества от температуры проходят через максимум, наблюдаемый для всех галогенид-ионов области 30-400С. Изучено влияние температуры на определение микроконцентраций ионов свинца на поверхности стеклографитового и графитового электродов на фоне ацетата натрия.
- Предложена математическая модель образования и электрорастворения осадков малорастворимых и смешанных малорастворимых соединений на металлических электродах.
- Изучено влияние потенциала электронакопления на ток пика и количества электричества, идущего на электрорастворения галогенидов серебра и ртути с поверхности серебряного и ртутного электродов на фонах ацетата и перхлората натрия. На основании проведённых исследований могут быть выбраны оптимальные условия определения микроконцентраций галогенид-ионов методом инверсионной вольтамперометрии при их совместном присутствии в растворе.
- Для ряда металлов оценены величины радиуса и числа зародышей осадка на поверхности электрода в условиях метода инверсионной вольтамперометрии.
Основное содержание диссертации изложено в следующих
опубликованных работах:
- Комаров В.Е., Бородина Н.П., Гунцов А.В. Температурная зависимость коэффициентов диффузии ионов серебра в расплаве //Ионные расплавы и твердые электролиты: Труды института электрохимии. - Свердловск,1978. - Вып.27. - С.52-56.
- Комаров В.Е., Гунцов А.В., Бородина Н.П. Компенсационный эффект при гетеродиффузии в солевых расплавах //Журнал физ. химии. - 1979. -Т.53, Вып.10. -С.2582-2585.
- Комаров В.Е., Бородина Н.П., Гунцов А.В. Коллективная составляющая диффузии в расплавленных галогенидах щелочных металлов //Физическая химия и электрохимия расплавленных и твердых электролитов. 1.Физич. Химия ионных расплавов:Тезисы докл. VII Всесоюзн. конф. - Свердловск,1979. - С.51.
- Гунцов А.В., Пнев В.С., Захаров М.С. Учет поверхностной диффузии в уравнениях кривых инверсионной вольтамперометрии //Химия - народному хозяйству Тюменской области: Тезисы докл. Зональной научно-технической конференции. - Тюмень,1980. - С.45.
- Гунцов А.В. К теории диффузии в жидкости //Журнал физ. химии. – 1981. - Т.55, Вып.1.- С.213-214.
- Гунцов А.В. Квазистационарный метод решения диффузионных задач электрорастворения с подвижной границей //Высокотемпературная физическая химия и электрохимия: Тезисы докл. 3 Уральской конф. - Свердловск, 1981, - С. 42.
- Гунцов А.В. Вывод уравнения для переходного времени электрорастворения дискретных зародышей труднорастворимых солей на твердых электродах // Химия и химическая технология промышленного производства: Тезисы областной науч.- тех. конф.- Тюмень, 1981, - С. 106.
- Гунцов А.В. Теоретические вопросы инверсионной хронопотенциометрии осадков труднорастворимых солей //Электрохимические методы анализа: Тезисы докл. Всесоюз. конф. Часть 2. - Томск, 1981, - С. 31.
- Гунцов А.В., Захаров М.С. Электрорастворение отдельных зародышей осадка в условиях хронопотенциометрии //Электрохимия. – 1982. - Т.18.- Вып.4.- С. 521-522.
- Гунцов А.В. Исследование стадии электронакопления при постоянном токе // Аналитическая химия Сибири - 82: Тезисы 1 зональной научн. конф. - Тюмень, 1982, - С. 113.
- Гунцов А.В., Захаров М.С. Хронопотенциометрическое определение ионов йода // Аналитическая химия Сибири - 82: Тезисы 1 зональной научн. конф. - Тюмень, 1982, - С. 127.
- Гунцов А.В. Теоретический анализ стадии электронакопления // Физико-химические методы исследования анализа. Межвузовский тематический сборник. - Тюмень, 1982, - С. 80-83
- Гунцов А.В. Уравнение анодной кривой растворения цилиндрических зародышей при линейно-меняющемся потенциале для обратимого процесса // Физико-химические методы исследования анализа. Межвузовский тематический сборник. - Тюмень, 1982, - С. 79-80
- Захаров М.С. Гунцов А.В. Теория инверсионной вольтамперометрии с инертным электродом не полностью покрытым деполяризатором. Модель диффузионно-невзаимодействующих зародышей осадка. – Тюмень,1983. - 8 с. Деп. в ОНИИТЭХИМ 03.02.83 Черкассы, № 424 хп-83.
- Гунцов А.В. Теория инверсионной вольтамперометрии с инертным электродом не полностью покрытым деполяризатором. Модель диффузионно-взаимодействующих зародышей осадка. – Тюмень,1983. - 6 с. Деп. в ОНИИТЭХИМ 03.02.83 Черкассы, № 425 хп-83.
- Гунцов А.В., Захаров М.С. Численное исследование квазиобратимого процесса электрорастворения зародышей осадка в условиях инверсионной вольтамперометрии // 8 Всесоюзное совещание по полярографии. Тезисы докл., ч.1 - Днепропетровск, 1984, - С.125.
- Гунцов А.В. Влияние поверхностного натяжения на кинетику роста зародышей осадка // Науч. - техн. конф. по химии и хим. технологии: Тезисы докл. Тюмень, 1985, - С. 116.
- Гунцов А.В., Райкова Н.С. Электронакопление смешанного малорастворимого соединения в потенциостатических условиях. – Тюмень,1987. - 5 с. Деп. в ОНИИТЭХИМ 12.06.87 Черкассы, № 820 хп-87.
- Гунцов А.В., Захаров М.С., Райкова Н.С. Математическое моделирование процессов образования и электрорастворения смешанных труднорастворимых соединений в условиях инверсионной вольтамперометрии. – Тюмень,1987. - 13 с. Деп. в ОНИИТЭХИМ 12.06.87 Черкассы, № 821 хп-87.
- Гунцов А.В., Захаров М.С., Райкова Н.С. Инверсионная вольтамперометрия смеси анионов на металлических электродах // 9 Всесоюзное совещание по полярографии. Тезисы докл. Часть 2. - Усть-Каменогорск, 1987 - С. 252-253.
- Гунцов А.В., Райкова Н.С. Рост сплошной пленки смешанного труднорастворимого соединения на металлических электродах в потенциостатических условиях // 9 Всесоюзное совещание по полярографии. Тезисы докл. Часть 2. - Усть-Каменогорск, 1987 - С. 253-254.
- Гунцов А.В., Захаров М.С., Райкова Н.С. Определение галогенид-ионов методом инверсионной вольтамперометрии с серебряным электродом // 9 Всесоюзное совещание по полярографии. Тезисы докл. Часть 2. - Усть-Каменогорск, 1987 - С. 395.
- Гунцов А.В. Рост и растворение двумерных зародышей осадка в условиях метода ИВА.// Химические проблемы отраслей народного хозяйства тюменского региона. Тезисы докл. обл. конф. - Тюмень, 1989, - С. 44.
- Гунцов А.В., Захаров М.С., Райкова Н.С. Определение галогенид-ионов при их совместном присутствии в растворе методом ИВА с серебряным электродом //Журнал аналитической химии. –1988. - Т.19, Вып.4. - С. 666-672.
- Гунцов А.В., Захаров М.С., Райкова Н.С. Влияние механизма электронакопления труднорастворимого соединения на электроде в методе инверсионной вольтамперометрии //Анализ-90. Совр. методы анализа металлов, сплавов, объектов окружающей среды. Тезисы докл. Всесоюз. конф. Ижевск, 1990, - С. 57
- Гунцов А.В., Захаров М.С., Райкова Н.С. Влияние температуры на количество образующегося на электроде в стадии электронакопления осадка труднорастворимого соединения в методе инверсионной вольтамперометрии анионов //Анализ-90. Совр. методы анализа металлов, сплавов, объектов окружающей среды. Тезисы докл. Всесоюз. конф. Ижевск, 1990, - С. 58.
- Гунцов А.В., Захаров М.С., Райкова Н.С. Моделирование процесса электронакопления осадка труднорастворимого соединения на электроде в условиях катодной инверсионной вольтамперометрии // Математические методы и ЭВМ в аналитической химии. 2 Всесоюзная конф. Тезисы докл. - Москва, 1991, - С. 139.
- Гунцов А.В., Захаров М.С., Райкова Н.С. Моделирование влияния температуры на количество образующегося на электроде труднорастворимого осадка на электроде в условиях катодной инверсионной вольтамперометрии // Математические методы и ЭВМ в аналитической химии. 2 Всесоюзная конф. Тезисы докл. - Москва, 1991, - С. 140.
- А.с. 1807379 СССР МКИ G 01 27/48. Инверсионно - вольтамперометрический способ установления энергетического состояния труднорастворимых соединений на металле / Гунцов А.В., Захаров М.С., Райкова Н.С. – Опубл. 07.04.93, Бюл. №13.
- Гунцов А.В., Захаров М.С., Ларина Н.С., Влияние условий электронакопления на процесс образования осадка на электроде в условиях катодной инверсионной вольтамперометрии 1.Рост фазовой пленки осадка в стадии электронакопления// Химия и хим. технология. Сб. науч. Трудов, ТюмГНГУ, 1998.- С.22-31.
- Гунцов А.В., Захаров М.С., Ларина Н.С. Влияние условий электронакопления на процесс образования осадка на электроде в условиях катодной инверсионной вольтамперометрии. 2.Образование осадка при адсорбции ионов деполяризатора // Химия и хим. технология. Сб. науч. Трудов, ТюмГНГУ, 1998.- С.32-36.
- Гунцов А.В., Захаров М.С., Ларина Н.С. Влияние параметров стадии электронакопления на потенциал пика и тока пика для процесса электрорастворения смешанных труднорастворимых соединений // Химия и хим. технология. Сб. науч. Трудов, ТюмГНГУ, 1998.- С. 37-43.
- Гунцов А.В., Захаров М.С., Ларина Н.С. Влияние температуры на процесс образования осадка на электроде в методе катодной инверсионной вольтамперометрии // Химия и хим. технология. Сб. науч. Трудов, ТюмГНГУ, 1998.- С43-54.
- Захаров М.С., Ларина Н.С., Гунцов А.В. Влияние температуры на характеристики катодных вольтамперограмм процессов электрорастворения галогенидов серебра с поверхности серебряного электрода // Химия и хим. технология. Сб. науч. Трудов, ТюмГНГУ, 1998.- 69-77.
- Гунцов А.В. Квазистационарный метод решения диффузионных задач в методе инверсионной вольтамперометрии на твердом электроде // Электрохимические методы анализа (ЭМА-99).V Всерос. конф. с участием стран СНГ. Тезисы докл. Москва. ГЕОХИ РАН.6-8 декабря 1999 г., С.59.
- Гунцов А.В., Захаров М.С. Теория катодной инверсионной вольтамперометрии при осаждении нескольких малорастворимых соединений // Электрохимические методы анализа (ЭМА-99).V Всерос. конф. с участием стран СНГ. Тезисы докл. Москва. ГЕОХИ РАН.6-8 декабря 1999 г., С.60.
- Гунцов А.В., Захарова О. М. Рост и растворение зародышей малорастворимых соединений осадка на твердом электроде для условий метода инверсионной вольтамперометрии // Электрохимические методы анализа (ЭМА-99).V Всерос. конф. с участием стран СНГ. Тезисы докл. Москва. ГЕОХИ РАН.6-8 декабря 1999 г., С.60.
- Гунцов А.В., Захарова О. М. Электрорастворение и рост трехмерных зародышей осадка в условиях метода инверсионной вольтамперометрии с учетом диффузии внутри зародышей //Известия Вузов. Нефть и газ.-2000. - №2.-С.109-113.
- Гунцов А.В., Захаров М.С. Электрорастворение зародышей осадка с поверхности твердого инертного электрода в условиях метода инверсионной // Вестник ТГУ. – 2000. - №3.-С.76-83.
- Гунцов А.В. Электронакопление малорастворимого соединения на поверхности индифферентного электрода в условиях метода инверсионной вольтамперометрии // Известия Вузов. Нефть и газ.-2000.-№4.-С.96-101.
- Гунцов А.В., Гунцова Л.В. Квазиобратимое электрорастворение зародышей осадка с поверхности твердого индифферентного электрода в условиях метода инверсионной вольтамперометрии //Анализ объектов окружающей среды. Тезисы докладов. IV Всерос. конф. «Экоаналитика-2000»с международным участием. Краснодар 2000 КубГУ, С.171-172.
- Гунцов А.В. Некоторые теоретические вопросы изучения начальных стадий электрокристаллизации методом инверсионной вольтамперометрии // Материалы симпозиума. Теория электроаналитической химии и метод инверсионной вольтамперометрии. Томск: Изд-во ТПУ.- 2000.-С.274-275.
- Гунцов А.В., Гунцова Л.В. Рост отдельных зародышей осадка с учетом их поверхностной энергии // Новые материалы и технологии в машиностроении: Сб. материалов междунар. науч. - техн. конф. 31октября-3 ноября 2000, Тюмень, ТюмГНГУ, С.75-77.
- Гунцов А.В. Рост изолированных зародышей осадка на твердом индифферентном электроде // Проблемы электрокристаллизации металлов: Тезисы докладов конф.- Екатеринбург, 2000. С.14-15.
- Гунцов А.В. Электронакопление малорастворимого соединения на поверхности электрода при адсорбции ионов деполяризатора // Известия Вузов. Нефть и газ. – 2001. - №1. - С.86-89.
- Гунцов А.В. Рост отдельных зародышей осадка с учетом их поверхностной энергии //Расплавы. – 2001.- №3.- С.93- 94.
- Гунцов А.В. Основы теории инверсионной вольтамперометрии. Электрорастворение зародышей осадка. - Тюмень: ТюмГНГУ, 2001.-123с.
- Гунцов А.В., Захаров М.С., Захарова О.М., Ларина Н.С. Катодная инверсионная вольтамперометрия галогенид-ионов и некоторых органических веществ. – Тюмень: ТюмГНГУ, 2001.- 95с.
- Захаров М.С., Гунцов А.В., Чемезова К.С. Инверсионные электрохимические методы анионов. - Тюмень: ТюмГНГУ, 2001.- 212с.
- Ларина Н.С., Гунцов А.В., Захаров М.С., Адешина А.В. Влияние температуры на определение микроконцентраций металлов на твердых электродах в условиях метода инверсионной вольтамперометрии // Известия Вузов. Химия и химическая технология.- 2001.-Т.44.- Вып.6.- С.52-54.
- Гунцов А.В. Основы теории инверсионной вольтамперометрии зародышей осадка.1. Обратимый электродный процесс // Известия Вузов. Химия и химическая технология 2001.-Т.44.-Вып.6.- С.54-56.
- Гунцов А.В. Основы теории инверсионной вольтамперометрии зародышей осадка. 2. Необратимый электродный процесс // Известия Вузов. Химия и химическая технология 2002.-Т.45.-Вып.1.- С.19-21.
- Гунцов А.В. Основы теории инверсионной вольтамперометрии зародышей осадка.3. Квазиобратимый электродный процесс // Известия Вузов. Химия и химическая технология 2002.-Т.45.-Вып.1.- С.21-23.
Соискатель А.В.Гунцов
ЛР № 020520 от 23.04.92
Подписано в печать Бум. писчая № 1
Заказ № Уч.- изд. л.
Формат 60 x 90 / 16 Усл. печ. л. 7.7
Отпечатано на RISO GR 3750 Тираж 100 экз.
---------------------------------------------------------------------------------------------------
Издательство “Нефтегазовый университет”
Государственного образовательного учреждения высшего профессионального образования
«Тюменский государственный нефтегазовый университет»
625000, Тюмень, ул. Володарского,38
Отдел оперативной полиграфии издательства “Нефтегазовый университет”
625000, Тюмень, ул. Володарского,38

