Взаимодействие 4-оксоалкан-1,1,2,2-тетракарбонитрилов с аммиаком и аминами
На правах рукописи
БЕЛИКОВ МИХАИЛ ЮРЬЕВИЧ
ВЗАИМОДЕЙСТВИЕ 4-ОКСОАЛКАН-1,1,2,2-ТЕТРАКАРБОНИТРИЛОВ С АММИАКОМ И АМИНАМИ
02.00.03 - органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Казань – 2011
Работа выполнена на кафедре органической химии и химической технологии органических веществ ФГОУ ВПО «Чувашский государственный университет имени И.Н. Ульянова»
Научный руководитель: доктор химических наук, профессор
Насакин Олег Евгеньевич
Официальные оппоненты: доктор химических наук, профессор
Овчинников Виталий Витальевич
кандидат химических наук
Татаринов Дмитрий Анатольевич
Ведущая организация: Российский химико-технологический университет имени Д.И. Менделеева, г. Москва
Защита состоится «31» марта 2011 г. в 14 час. 30 мин. на заседании диссертационного совета Д 212.081.03 при Казанском (Приволжском) федеральном университете по адресу: ул. Кремлевская, 18, Химический институт им. А.М. Бутлерова КФУ, Бутлеровская аудитория.
С диссертацией можно ознакомиться в научной библиотеке им. Н.И. Лобачевского Казанского (Приволжского) федерального университета.
Отзывы на автореферат просим направлять по адресу: 420008, г. Казань, ул. Кремлевская, 18, КФУ, Химический институт им. А.М. Бутлерова.
Автореферат разослан « » февраля 2011 г.
Ученый секретарь
диссертационного совета,
кандидат химических наук Казымова М. А.
![]()
Общая характеристика работы
Актуальность работы. Одной из характерных тенденций современной органической химии является поиск новых оригинальных подходов для использования простых и доступных реагентов в синтезе полифункциональных гетероциклических соединений. В этом аспекте, безусловно, актуальным является применение полинитрильных соединений, что связано с широкими синтетическими возможностями, обусловленными наличием нескольких цианогрупп в одной молекуле. В то же время известно, что цианогруппа придает органическим соединениям физиологически активное действие, о чем свидетельствует применение нитрилов, например, в качестве пестицидов. Присутствие в структуре полинитрилов конкурирующих с цианогруппами электрофильных центров позволяет разнообразить пути превращений за счет управляемого задействования заданных функциональных групп. С этой точки зрения перспективными реагентами являются аддукты тетрацианоэтилена и кетонов – 4-оксоалкан-1,1,2,2-тетракарбонитрилы (тетрацианоалканоны, ОТК), содержащие в своей структуре конкурирующие реакционные центры: карбонильную группу, две цианогруппы при -углеродном атоме относительно CO-группы, две терминальные цианогруппы, СН-кислотный центр. Производные данных соединений известны в качестве потенциальных противоопухолевых препаратов, а также координационных полимеров с редкой топологией.
Ключевой стадией в реакциях полинитрилов является процесс нуклеофильного присоединения по цианогруппе, в результате которого образуется новый нуклеофильный центр. Генерация последнего в полиэлектрофильных соединениях приводит к многостадийным каскадным превращениям, которые могут быть использованы в эффективных схемах направленного синтеза биологически активных гетероциклов. Исходя из структурных особенностей тетрацианоалканонов, содержащих несколько электрофильных центров, можно ожидать, что процесс их взаимодействия с N-нуклеофилами будет протекать многовариантно. Имеющиеся в литературе данные о химических свойствах ОТК не раскрывают вопрос о предпочтительности и возможности варьирования направленности атак N-нуклеофилов по реакционным центрам 4-оксоалкан-1,1,2,2-тетракарбонитрилов. Решение данного вопроса позволит предсказывать и при необходимости изменять направление взаимодействия, тем самым контролируя его результат.
Работа выполнена при финансовой поддержке гранта РФФИ 10-03-97013-р_поволжье_а «Направленный синтез и модификация гетероциклических соединений, происходящий через образование дигидро-2(3Н)-фураниминного фрагмента» (2010 г.), а также в рамках государственных контрактов № 16.740.11.0160 «Разработка новых подходов к направленному синтезу гетероциклических систем в уникальном функциональном обрамлении» (2010-2012 г.), 14.740.11.0715 «Направленное изменение реакционной способности электрофильных центров полинитрилов для синтеза заданных соединений» (2010-2011 г.) Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы.
Цель работы. Изучение основных направлений превращений 4-оксоалкан-1,1,2,2-тетракарбонитрилов под действием представителей N-нуклеофилов – аммиака и аминов, демонстрирование возможности трансформации различных реакционных центров ОТК при изменении условий процессов, разработка препаративных методов синтеза полифункциональных производных пиридина, пиррола, спиросочлененных и конденсированных гетероциклов, ионных соединений, описание структуры и особенностей строения полученных веществ.
Научная новизна работы состоит в том, что впервые:
– систематически изучено взаимодействие 4-оксоалкан-1,1,2,2-тетракарбонитрилов с аммиаком и аминами, показано влияние таких факторов, как строение исходных соединений, природа растворителя, температура на ход превращений ОТК;
– разработан способ получения аммонийных солей 4-оксо-1,1,2-трицианобут-2-ен-1-идов на основе твердофазного превращения солей ОТК;
– продемонстрирован синтез 5,6-диалкил-2-оксо-1,2-дигидропиридин-3,4-дикарбонитрилов и их солей, на основе которых выработан подход к синтезу 2-гидрокси-3,8,8-тринитро-5,6,7,8-тетрагидрохинолин-4-карбоновой кислоты;
– осуществлен регионаправленый синтез, позволяющий в зависимости от условий взаимодействия ОТК с водным аммиаком, получать 4-амино-3-имино-2,3-дигидро-1H-пирроло[3,4-c]пиридин-1-оны и представители малоизученных азагетероциклов – цианозамещенных 3Н-пирролов;
– предложен оригинальный способ синтеза 5-амино-2-морфолин-4-ил-3-(2-оксоциклоалкил)-3H-пиррол-3,4-дикарбонитрилов из 12-имино-9-фенил-10,11-диоксатрицикло[5.3.2.01,6]додекан-7,8,8-трикарбонитрилов;
– найдены условия одностадийного превращения ОТК под действием морфолина в представители редкой спиросочлененной гетероциклической системы – 8-амино-1-имино-6-морфолин-4-ил-2-окса-7-азаспиро[4.4]нона-3,6,8-триен-9-карбонитрилы, для которых при комнатной температуре методом ЯМР зафиксирована E/Z-изомерия с участием протона иминогруппы.
Практическая значимость. Синтез значительного количества соединений осуществлен в водной среде, что весьма важно в связи с бурным развитием «зеленой химии». Среди полученных 5,6-диалкил-3,4-дицианопиридин-2-олятов и 4-оксо-1,1,2-трицианобут-2-ен-1-идов аммония, обладающих значительной растворимостью в воде, имеются потенциально биологически активные производные природного стероида – прегненолона. Синтезирован ряд 4-оксо-1,1,2,2-тетрацианобутан-1-идов – полицианосодержащих лигандов, аналоги которых известны как структурные составляющие редких координационных полимеров. Подобраны условия для модификации биологически активных 12-имино-9-фенил-10,11-диоксатрицикло[5.3.2.01,6]додекан-7,8,8-трикар-бонитрилов. В ходе проведения исследования осуществлены синтезы 88 новых соединений. Разработанные методики отличаются простотой в выполнении, высокими выходами конечных соединений, что позволяет использовать их как препаративные. Стоит отметить, что полифункциональность полученных соединений открывает возможность их легкой модификации с целью направленного синтеза биологически активных веществ.
Положения, выносимые на защиту:
– описание основных закономерностей взаимодействия 4-оксоалкан-1,1,2,2-тетракарбонитрилов с аммиаком и аминами;
– использование дезактивации терминальных цианогрупп ОТК основными реагентами, за счет образования ионных соединений по СН-кислотному центру, в синтезе гетероциклических соединений;
– реализация изменения направленности взаимодействий ОТК с аммиаком и аминами для синтеза различных полифункциональных гетероциклов путем варьирования условий реакций.
Личный вклад автора заключается и анализе литературных данных, постановке проблемы исследования, планировании и осуществлении экспериментальной работы, интерпретации и обобщении полученных результатов.
Публикации. По материалам диссертационной работы опубликовано 5 статей в изданиях, рекомендованных ВАК, и 8 тезисов докладов Всероссийских и Международных научных конференций.
Апробация. Основные результаты работы представлены и обсуждены на следующих конференциях: 1) Международная конференция студентов, аспирантов и молодых ученых «Ломоносов-2010» (Москва, 12-15 апреля 2010 г.); 2) Всероссийская научно-практическая конференция «Современные проблемы в контексте естественно-научных исследований» (Чебоксары, 22 апреля 2010 г.); 3) Всероссийская конференция с элементами научной школы для молодежи «Актуальные проблемы органической химии» (Казань, 6-8 октября 2010 г.); 4) III Международная конференция «Химия гетероциклических соединений», посвященная 95-летию со дня рождения проф. А.Н. Коста (Москва, 18-21 октября 2010 г.).
Структура и объем диссертации. Диссертация изложена на 170 страницах, содержит 45 таблиц и 19 рисунков. Работа состоит из введения, трех глав, выводов, списка цитируемой литературы из 104 наименований.
Обзор литературы, приведенный в первой главе, посвящен анализу методов синтеза и реакционной способности 4-оксоалкан-1,1,2,2-тетракарбо-нитрилов. Вторая глава включает обсуждение полученных результатов. Третья глава содержит описание экспериментальной части работы.
Автор выражает благодарность научным консультантам Ершову Олегу Вячеславовичу (ЧГУ имени И.Н. Ульянова) и Липину Константину Владимировичу (ЧГУ имени И.Н. Ульянова).
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Образование солей 4-оксоалкан-1,1,2,2-тетракарбонитрилов и их превращение в 4-оксо-1,1,2-трицианобут-2-ен-1-иды
Задачей начального этапа работы было получение солей 4-оксоалкан-1,1,2,2-тетракарбонитрилов, которые являются продуктами начального взаимодействия данных соединений с аммиаком и аминами. Для этого были подобраны оптимальные условия, при которых электрофильные центры ОТК в реакциях с аммиаком и аминами не задействуются, а превращению подвергается СН-кислотный центр.
Показано, что результатом взаимодействия 4-оксоалкан-1,1,2,2-тетракар-бонитрилов 1а-д на основе жирноароматических кетонов и кетонов со стерически затрудненной карбонильной группой, с аммиаком и аминами в безводной среде является образование 4-оксо-1,1,2,2-тетрацианобутан-1-идов аммония 2а-п – солей тетрацианоалканонов, с выходами 72-95%.
Схема 1
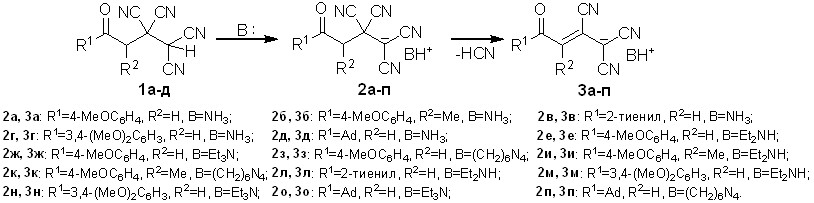
Полученные 4-оксо-1,1,2,2-тетрацианобутан-1-иды 2а-п являются полицианосодержащими лигандами, аналоги которых известны как структурные составляющие редких координационных полимеров. Для известных солей ОТК с катионами металлов (Ag+, Сu+, K+, Na+) в литературе не имеется данных об их устойчивости. Оказалось, что аммонийные соли 2 являются нестабильными соединениями – они всегда содержат значительную примесь продукта дальнейшего превращения и при выдерживании на воздухе твердофазно и практически количественно претерпевают элиминирование циановодорода с формированием 4-оксо-1,1,2-трицианобут-2-ен-1-идов аммония 3а-п.
Разработанный метод синтеза солей 3 был распространен на производное природного соединения – тетрацианоэтилированный стероидный кетон прегненолон. Соединение 1е было вовлечено во взаимодействие с аммиаком и аминами при пониженной температуре, в результате чего с выходами 83-91% получены 3-гидрокси-20-оксо-23,24,24-трициано-21-нор-17-хол-5,21-диен-24-иды 5а-г.
Схема 2
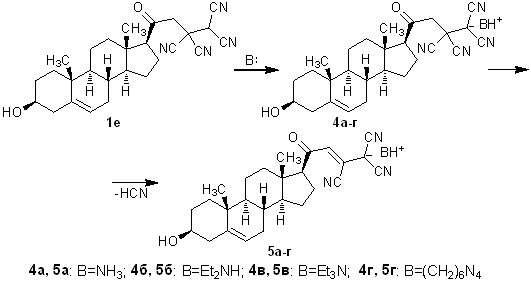
Строение соединений 3,5 подтверждено с использованием методов ИК, ЯМР 1Н, ЯМР 13C спектроскопии, масс-спектрометрии. По данным ЯМР 13C спектроскопии для представителей 3ж,п, 5в в структурах полученных соединений присутствует карбонильная группа, а также кратная С=С связь, образующаяся при дегидроцианировании солей 2,4.
Отметим, что образование солей строения 2 на начальной стадии подразумевается во всех случаях взаимодействия ОТК с аммиаком и аминами, но в некоторых последующих разделах данная стадия опущена.
2. Синтез 5,6-диалкил-3,4-дицианопиридин-2-олятов аммония и их взаимодействие с кислотами
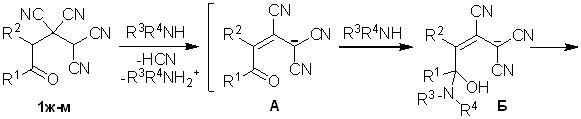
Для синтеза солей 3,5 были использованы 4-оксоалкан-1,1,2,2-тетракар-бонитрилы 1а-е, полученные на основе жироноароматических кетонов и кетонов со стерически затрудненной СО-группой. Было сделано предположение, что если в реакциях с аммиаком и аминами в безводной среде использовать ОТК на основе алифатических кетонов, в которых кетонная группа более активна по сравнению с карбонилом в тетрацианоалканонах 1а-е, то могут проходить дальнейшие превращения образующихся изначально солей ОТК.
Обнаружено, что взаимодействие тетранитрилов 1ж-м с аммиаком и аминами в безводном тетрагидрофуране или ацетонитриле при пониженной температуре приводит к 5,6-диалкил-3,4-дицианопиридин-2-олятам аммония 6а-к с выходами 50-79%.
Схема 3

Строение соединений 6 подтверждено с использованием методов ИК, ЯМР 1Н, ЯМР 13C спектроскопии, масс-спектрометрии, данными рентгеноструктурного анализа.
По-видимому, первоначально образуются соли А (схема 3), аналогичные по строению соединениям 3 на схеме 1. Так как, в случае ОТК 1ж-м карбонильная группа более активна, чем в представленных на схеме 1 тетрацианоалканонах, происходит присоединение нуклеофила по СО-группе, приводящее к аминоспиртам Б. Далее в результате внутримолекулярного взаимодействия по Пиннеру гидрокси- и цианогрупп формируются пираны В, которые рециклизуются в пиридины Г. Завершается процесс элиминированием и формированием конечных структур 6.
Нейтрализация полученных солей 6 минеральными кислотами приводит к 5,6-диалкил-2-оксо-1,2-дигидропиридин-3,4-дикарбонитрилам типа 7. Однако при взаимодействии соли 6ж с азотной кислотой обнаружено более глубокое превращение с гидролизом нитрильных функций. Данное взаимодействие приводит к образованию 2-гидрокси-3,8,8-тринитро-5,6,7,8-тетрагидрохинолин-4-карбоновой кислоты 8.
Схема 4 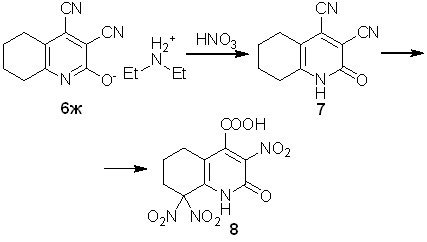
Строение тринитропроизводного 8 однозначно доказано данными рентгеноструктурного анализа монокристалла (рис. 1). На промежуточной стадии формирования кислоты 8 происходит образования пиридона 7, который при необходимости может быть выделен.
3. Взаимодействие тетрацианоэтилированных циклогексанонов с водным аммиаком
Описанные выше реакции 4-оксоалкан-1,1,2,2-тетракарбонитрилов с аммиаком и аминами проводили в безводной среде. Изучая влияние растворителя на ход взаимодействия между ОТК и аммиаком, продолжены исследования с использованием водных растворов аммиака различной концентрации.
Выяснено, что при взаимодействии тетрацианоэтилированных циклогексанонов 1к-о с 20-25% водным аммиаком происходит образование 9-амино-12-оксо-10,11-диазатрицикло[5.3.2.01,6]додек-8-ен-7,8-дикарбонитрилов 9а-д с выходами 72-85%.
Схема 5
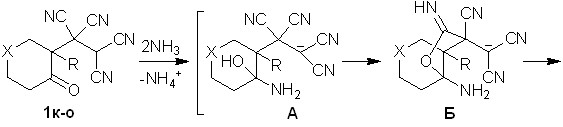
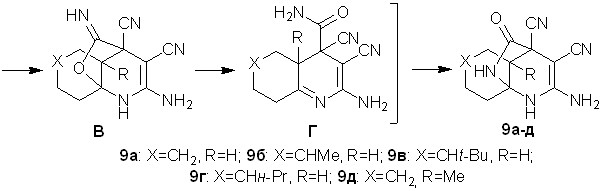
Строение диазатрициклов 9а-д установлено методами ИК, ЯМР 1Н, ЯМР 13С спектроскопии, масс-спекрометрии.
Вероятно, аммиак на первой стадии выступает в качестве основания и взаимодействует с CH-кислотным центром ОТК. В дальнейшем происходит нуклеофильное присоединение аммиака по СО-группе, что приводит к аминоспирту А. Очевидно, что в соли А происходит делокализация отрицательного заряда по дицианометиновому фрагменту, следствием чего является понижение электрофильных свойств терминальных цианогрупп. Далее за счет взаимодействия гидрокси- и -цианогруппы образуется иминофурановое производное Б, которое в результате последовательности процессов циклизации-дециклизации (схема 5) превращается в диазатрицикл 9.
4. Трансформации всех цианогрупп в 4-оксоалкан-1,1,2,2-тетракарбонитрилах под действием водного аммиака
Исходя из результатов предыдущих разделов, а также литературных данных известно, что на ход взаимодействия ОТК с различными реагентами значительное влияние оказывает структурный фактор. Продолжая исследования влияния строения ОТК на процесс взаимодействия с водным аммиаком, были использованы тетрацианоэтилированные циклоалканоны 1ж,з с размером цикла больше шести (циклогептанон и циклооктанон), а также ОТК на основе диалкилкетонов 1и,п,р.
Обнаружено, что взаимодействие тетрацианоалканонов 1ж,з с водным аммиаком, в аналогичных для синтеза веществ 9а-д условиях, приводит к образованию 4-амино-3-иминопирроло[3,4-d]пиридин-1-онов 10а,б с выходами 71-77% (путь I, схема 6). ОТК 1и,п,р в этих же условиях образуют 5,6-диалкил-2-амино-3-[амино(иминио)метил]-пиридин-4-карбоксилаты 11а-в с выходами 53-72% (путь II).
Схема 6
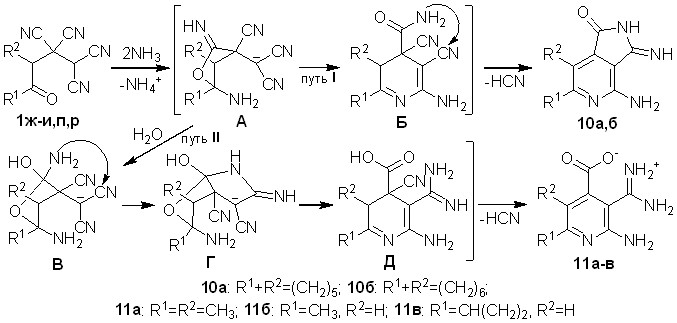
Строение соединений 10а,б и 11а-в установлено методами ИК, ЯМР 1Н, ЯМР 13С спектроскопии, масс-спекрометрии. Строение соединения 11а доказано рентгеноструктурным анализом (рис. 2).
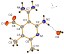
По-видимому, начальные этапы взаимодействия ОТК 1ж-и,п,р с аммиаком аналогичны тем, что описаны для тетрацианоэтилированных циклогексано-нов 1к-о (схема 5). В случае формирования пирролопиридинов 10 ключевой промежуточной структурой, определяющей отличный от показанного на схеме 5 результат взаимодействия, является интермедиат Б. По сравнению с интермедиатом Г схемы 5, в структуре Б схемы 6 не происходит циклизации амидной группы на C=N cвязь тетрагидропиридинового цикла, а осуществляется дегидроцианирование и гетероциклизация амидной группы на цианогруппу в положении 3 пиридинового кольца, в результате чего формируются пирролопиридины 10а,б. Такое направление трансформации интермедиата Б можно объяснить особенностями конформаций семи- и восьмичленных циклов, а именно, склонностью средних циклов к снятию трансаннулярного напряжения за счет образования кратной связи, из-за чего создаются благоприятные условия для дегидроцианирования. Кроме того, семи- и восьмичленные циклы могут вносить стерические затруднения для взаимодействия амидной группы с C=N-связью пиридинового цикла.
Формирование структур 11 (схема 6) можно объяснить отличной от вышеописанных случаев трансформацией промежуточного иминофурана А. Вероятно, он претерпевает превращения в результате атаки воды по иминогруппе, что приводит к аминоспирту В. Такой результат, возможно, связан с меньшими стерическими затруднениями для атаки воды по иминофрагменту по сравнению с реакциями ОТК на основе циклоалканонов. Далее, в аминоспирте В, в результате циклизации аминогруппы на цианогруппу, происходит образование структуры Г, в которой осуществляется раскрытие пиррольного фрагмента и формирование интермедиата Д. Завершается процесс элиминированием циановодорода, что приводит к производным изоникотиновых кислот 11а-в.
Описанное в данном разделе образование гетероциклов 10 и 11, примечательно одностадийным превращением всех цианогрупп исходных соединений в мягких условиях, что является редким случаем для достаточно широкого круга полицианосодержащих соединений.
5. Синтез 2,5-диамино-3-(2-оксоциклоалкил)-3H-пиррол-3,4-дикарбонитрилов
Согласно результатам, описанным в разделах 3 и 4, из тетрацианоэтилированных циклоалканонов и водного аммиака могут быть получены 9-амино-12-оксо-10,11-диазатрицикло[5.3.2.01,6]додек-8-ен-7,8-дикарбонитрилы 9 и 4-амино-3-иминопирроло[3,4-d]пиридин-1-оны 10. При этом на структуру образующегося соединения влияет только размер цикла в исходных тетрацианоалканонах 1. В тоже время, из-за наличия в составе ОТК нескольких конкурирующих электрофильных центров могут реализовываться и иные направления взаимодействия ОТК с водным аммиаком.
В связи с этим предприняты попытки изменения условий процессов для осуществления иных направлений превращений тетрацианоэтилированных циклоалканонов под действием аммиака. При этом обнаружено, что в ходе синтеза пирролопиридинов 10 при изменении концентрации аммиака в сторону уменьшения наблюдалось образования, в качестве примеси, соединений иного строения.
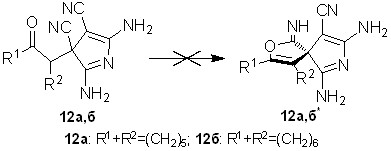
Подбирая оптимальные условия для их синтеза найдено, что тетрацианоэтилированные циклогептанон и циклооктанон 1ж,з в реакциях с водным аммиаком концентрации 10-15% при интенсивном перемешивании за 5-10 минут превращаются в представителей малоизученных азагетероциклов – 2,5-диамино-3-(2-оксоциклоалкил)-3H-пиррол-3,4-дикарбонитрилы 12а,б с выходами 55-61%.
Схема 7
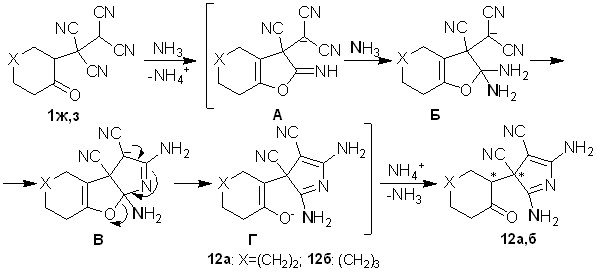
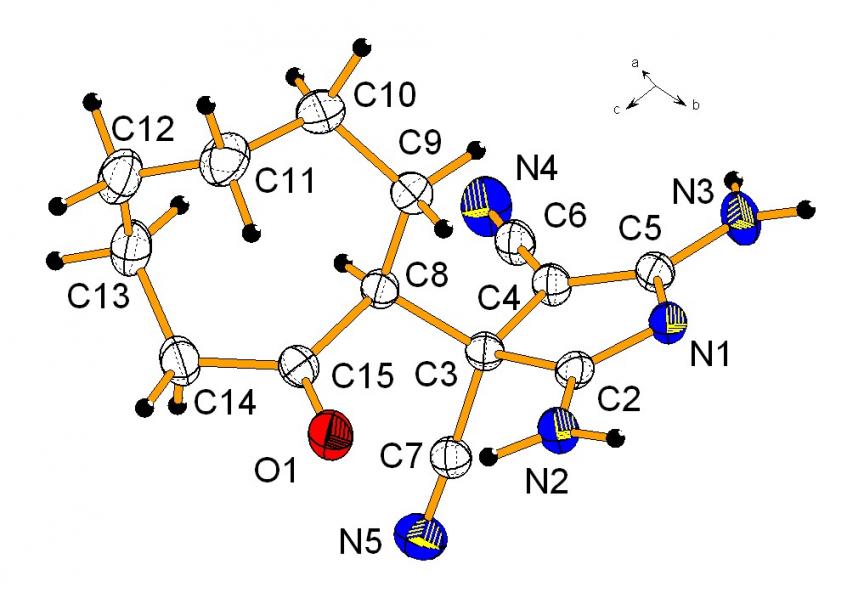
Строение 3Н-пирролов 12а,б доказано с использованием методом ЯМР 1Н, ЯМР 13С, ИК спектроскопии, масс-спектрометрии, рентгеноструктурным анализом. В ЯМР 1Н и ЯМР 13С спектрах сигналы протонов и углеродных атомов дублируются, что можно объяснить образованием смеси диастереомеров. Разделить диастереомеры не удалось из-за их взаимопревращения, которое вероятно происходит через енольную форму. По данным РСА для соединений 12б (рис. 3) в молекуле имеется внутримолекулярная водородная связь между кислородным атомом карбонильной группы и протоном N=CNH2-фрагмента (расстояние О…Н составляет 1.98 А).
В ходе образования 3Н-пирролов 12, вероятно, имеет место содействие карбонильной группы процессу превращения -CN-группы под действием N-нуклеофила. Аммиак изначально выполняет каталитическую функцию, способствуя енолизации карбонильной группы. Дальнейшая реакция енольного гидроксила с -CN-группой приводит к иминофурану А схемы 7. Взаимодействие енола именно с -CN-группой происходит из-за пониженной электрофильности -цианогрупп, обусловленной образованием солей на начальной стадии. Далее осуществляется нуклеофильное присоединение аммиака к иминофурановому фрагменту, что приводит к производному Б. В последнем амино- и цианогруппы сближены и их внутримолекулярная циклизация обуславливает образование пиррола В. Дальнейшее раскрытие фурановой составляющей в структуре В приводит к 3Н-пирролам 12. Образование смеси диастереомеров соединений 12а,б обусловлено неселективным задействованием диастереотопных -цианогрупп на промежуточной стадии процесса.
6. Направленные методы синтеза 2,3-дизамещенных 5-амино-3H-пиррол-3,4-дикарбонитрилов
В структурах, описанных в предыдущем разделе 2,5-диамино-3-(2-оксоциклоалкил)-3H-пиррол-3,4-дикарбонитрилов 12а,б, присутствуют две аминогруппы, поэтому нельзя однозначно утверждать в каком положении пиррольного цикла находится фрагмент аммиака. В связи с этим, была поставлена цель получить аналоги пирролов 12а,б, исходя из строения которых было бы понятно положение входящей группы. Это позволило бы однозначно судить о том, какая из цианогрупп (- или терминальная) подвергается начальному превращению. Для достижения поставленной цели были использованы амины.
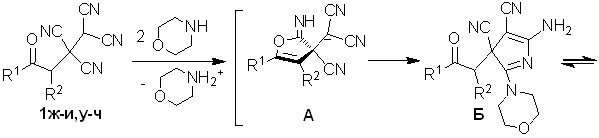
Найдено, что тетрацианоалканоны 1к-м взаимодействуют с морфолином в водной среде с образованием ранее неизвестных 5-амино-2-морфолин-4-ил-3-(2-оксоциклоалкил)-3H-пиррол-3,4-дикарбонитрилов 13а-в – структурных аналогов пирролов 11а,б. Выходы соединений 13а-в составляют 81-90%.
Схема 8
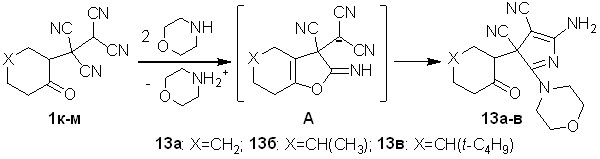
Строение 3Н-пирролов 13а-в доказано методами ЯМР 1Н, ЯМР 13С, ИК спектроскопии, масс-спектрометрии. Согласно ЯМР 1Н спектрам, 3H-пиррол-3,4-дикарбонитрилы 13а-в, так же как и соединения 12а,б, образуются в виде диастереомерных смесей. Последовательность образования пирролов 13а-в аналогична последовательности, представленной на схеме 7.
Для доказательства предложенных на схемах 7 и 8 путей формирования пирролов 12а,б и 13а-в через фурановое производное А были направленно использованы биологически активные 12-имино-9-фенил-10,11-диоксатрицик-ло[5.3.2.01,6]додекан-7,8,8-трикарбонитрилы 14а,б.
Как видно из строения веществ 14а,б (схема 9), в их структурах имеется 2-иминофурановый фрагмент, схожий с интермедиатами А схем 7 и 8 – в них при - и -углеродных атомах относительно иминогруппы имеются одна и две цианогруппы соответственно. В результате взаимодействия соединений 14а,б с морфолином также были получены 3Н-пирролы 13а,б. Выход соединений 13а,б, при использовании данного метода синтеза, составил 74-79%.
Схема 9
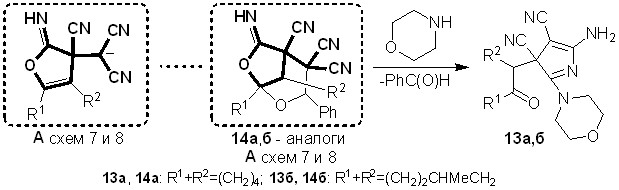
Таким образом, на основе реакций между диоксатрициклами 14а,б и морфолином был осуществлен встречный синтез соединений 13а,б. Данный результат частично подтверждает предложенную на схемах 7 и 8 последовательность превращений, включающую формирование иминофурана А на промежуточной стадии образования 3Н-пиррол-3,4-дикарбонитрилов 12а,б и 13а-в.
Для того чтобы избежать образования диастереомерных смесей пирролов типа 12 и 13, в реакциях с аминами были использованы тетрацианоэтилированные жирноароматические кетоны. Обнаружено, что взаимодействие тетрацианоалканонов 1а,б,с,т с аминами приводит к образованию 5-амино-3-(2-арил-2-оксоэтил)-3H-пиррол-3,4-дикарбонитрилов 15а-д с выходами 74-93%.
Схема 10
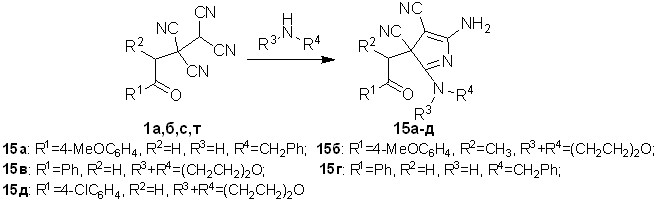
Важно отметить, что для полученных соединений 15а-д, в отличие от описанных выше пирролов 12а,б и 13а-в, образование смеси диастереомеров не происходит. Это обусловлено наличием в их структурах, за исключением соединения 15б, одного асимметрического атома углерода. В структуре 15б, также как и в соединениях 12а,б и 13а-в, присутствуют два асимметрических атома углерода. Образование одного диастереомера для пиррола 15б объясняется особенностями пространственного строения его молекулы.
Строение синтезированных 3Н-пирролов 15а-д предложено на основании данных ЯМР 1Н, ЯМР 13С, ИК спектроскопии, двумерных методов NOESY и HMBC, масс-спектрометрии. Совокупность полученных спектраль-ных данных, однако, не позволила однозначно определить положение аминного заместителя при пиррольном цикле. Окончательно вопрос о расположении аминного фрагмента был разрешен при помощи рентгено-структурного анализа монокристалла соединения 15в. На основании данных РСА можно утверждать, что в реакциях получения 3Н-пирролов 12а,б, 13а-в, 15а-д происходит начальное задействование -цианогруппы, о чем свидетельствует нахождение морфолинового фрагмента в структуре 15в в положении 2 пиррольного кольца (рис. 4).
7. Синтез и особенности строения 8-амино-1-имино-6-морфолин-4-ил-2-окса-7-азаспиро[4.4]нона-3,6,8-триен-9-карбонитрилов
Данные рентгеноструктурного анализа для соединения 15в показывают наличие несвязевого напряжения в молекуле, вызванного взаиморасположением протона NCH2-звена морфолинового кольца и водородным атомом метиленового звена при карбонильной группе, расстояние между которыми меньше суммы их Ван-дер-Ваальсовых радиусов (рис. 5).
Исходя из этих данных, было сделано предположение, что при замене одного водорода в CH2CO-фрагменте на алкильный заместитель в гипотетических морфолинзамещенных пирролах типа 12, 13 и 15, могут проходить дальнейшие превращения, так как в этом случае должно возрастать стерическое напряжение. При отсутствии морфолинового заместителя несвязевое напряжение должно быть менее значительным, что подтверждено данными РСА для 2,5-диаминозамещенного пиррола 12б (рис. 3).
Данное предположение подтверждается превращениями 2-морфолин-4-илзамещенных пирролов 13а, 15б в твердой фазе, тогда как для 2-аминозамещенных аналогов 12а,б этого не наблюдается (схема 11).
Схема 11
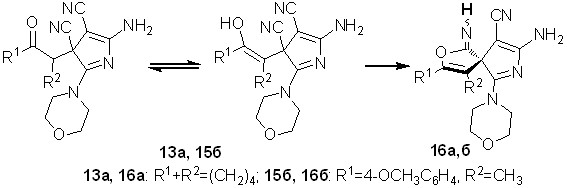
В результате твердофазного превращения соединения 13а, 15б количественно трансформировались в 8-амино-1-имино-6-морфолин-4-ил-2-окса-7-азаспиро[4.4]нона-3,6,8-триен-9-карбонитрилы 16а,б. Осуществление превращений соединений 13а, 15б в спираны 16а,б сопровождается енолизацией СО-группы, которая обусловлена частичным снятием напряжения, вызванного пространственной сближенностью морфолиного фрагмента с заместителем R2. В свою очередь, для 2-морфолин-4-илзамещенных соединений 15в,д, в структурах которых заместитель R2=Н, такого рода превращения не обнаружены.
Из этих данных следует, что для осуществления процесса формирования структур типа 16 необходимо наличие CHAlk-звена при карбонильной группе, а также присутствие морфолинового фрагмента во 2-м положении 3Н-пиррольного кольца. В связи с этим продолжено исследование взаимодействий тетрацианоалканонов 1, соответствующих выявленному структурному фактору, с морфолином. Для этого ОТК были подобраны таким образом, что в их составе присутствовало бы CHAlk-звено между карбонильной группой и тетрацианоэтильным фрагментом.
Было обнаружено, что взаимодействие тетрацианоалканонов 1ж-и,у-ч с морфолином происходит с образованием изомерных смесей 3,4-дизамещенных 8-амино-1-имино-6-морфолин-4-ил-2-окса-7-азаспиро[4.4]но-на-3,6,8-триен-9-карбонитрилов 17а-ж с выходами 71-86%, аналогичных по строению соединениям 16а,б.
Схема 12
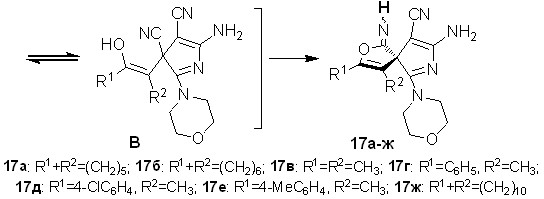
По-видимому, в ходе образования спиранов 17а-ж первоначально происходит енолизация карбонильной группы с дальнейшим взаимодействием енола с -CN-группой, что приводит к иминофурану А. Далее он переходит в пиррол Б согласно описанной на схеме 7 последовательности превращений. Затем в пирроле Б в результате енолизации СО-группы происходит внутримолекулярное присоединение гидроксигруппы к цианогруппе с образованием спиранов 17а-ж. Твердофазное превращение 3Н-пирролов 13а и 15б в спираны 16а,б доказывает предложенную схему превращения Б17а-ж.
Строение спиранов 16а,б и 17а-ж было доказано с использованием методом ЯМР 1Н, ЯМР 13С, ИК спектроскопии, масс-спектрометрии. По данным ЯМР 1Н, ЯМР 13С в ДМСО-d6, сигналы протонов и углеродных атомов дублируются, что свидетельствует об образовании диастереомерных смесей (рис. 6а). Возможно, это обусловлено различной E- и Z- конфигурацией C=NН связи иминного фрагмента, в котором протон при атоме азота может принимать различные положения.
Стоит отметить, что геометрическую изомерию, обусловленную различной конфигурацией незамещенной по атому азота иминогруппы, при нормальной температуре обычно фиксировать не удается, что связано с низким энергетическим барьером E/Z-изомеризации. В связи с этим было проведено дополнительное изучение особенностей строения спиранов 16 и 17. Так, изомерия по иминогруппе подтверждается данными ЯМР 1Н спектра соединения 17в при температуре 70°С, в котором сигналы протонов имино- и аминогрупп присутствуют в виде единичных пиков. Вероятно, это связано с увеличением скорости E/Z-изомеризации иминогруппы (рис. 6б).
В ходе дальнейшего исследования строения спиранов 16 и 17 обнаружено, что если спектры ЯМР 1Н для соединения 17в снимать в дейтерированном пиридине-d5, то спектральная картина меняется. В ЯМР 1Н спектре при 26°С, как и в спектре снятом в ДМСО-d6 при 26°С, наблюдаются сигналы протонов аминогруппы, морфолинового кольца, алкильных звеньев. Отличительной особенностью является то, что в пиридине-d5 отсутствуют сигналы протонов иминогруппы, а пики остальных протонов не дублируются (рис. 7б). Эти данные свидетельствуют об осуществлении процесса депротонирования иминогруппы пиридином (схема 13) и, как следствие, пропадает E/Z-изомерия.
Схема 13
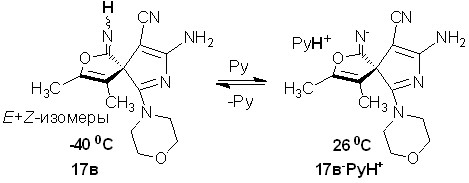
В ЯМР 1Н спектре соединения 17в, записанном в пиридине-d5 при -40°С, имеются сигналы протона иминогруппы, причем эти сигналы, как и в спектре 17в в ДМСО-d6 (26°С), представлены в виде двух пиков (рис. 7а). Дублиро-вание сигналов имеет место и для остальных протонов молекулы 17в, что свидетельствует о наличии смеси диастерео-меров при -40°С. Исходя из этих данных можно сделать вывод, что процесс депротонирования иминогруппы пиридином является термообратимым.
Выдвинутое предположение об образовании смеси изомеров из-за различной конфигурации C=NH-связи было подтверждено также химическими превращениями иминогруппы. При проведении кислотно-катализируемого гидролиза соединений 16а, 17а,в-д в водной среде были получены 3,4-дизамещенные 8-амино-6-морфолин-4-ил-1-оксо-2-окса-7-азаспиро[4.4]нона-3,6,8-триен-9-карбонитрилы 18а-д с выходами 78-94%.
Схема 14
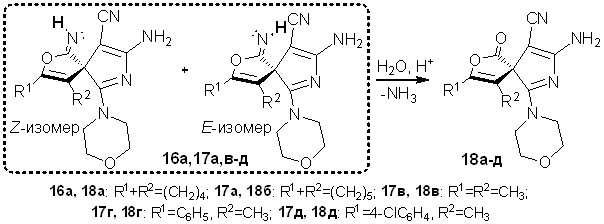
Строение спиранов 18а-д доказано с использованием методов ЯМР 1Н, ЯМР 13С, ИК спектроскопии, масс-спектрометрии. В спектрах ЯМР 1Н и ЯМР 13С (рисунок 9) соединения 18в в сравнении с ЯМР 1Н и ЯМР 13С (рисунок 8) для имина 17в сигналы водородных и углеродных атомов не дублируются, что свидетельствует об исчезновении E/Z-изомерии в результате превращения C=NHC=O путем гидролиза.
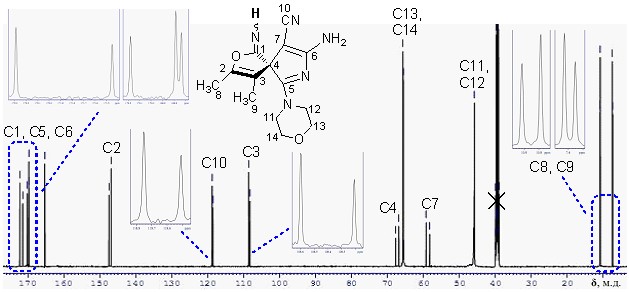
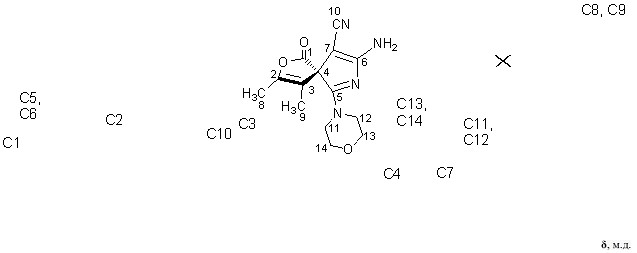
Так как химические сдвиги углеродных атомов исходного имина 17в и продукта его гидролиза 18в схожи, то можно утверждать о сохранении спиранового углеродного скелета в ходе данной реакции.
Возможность фиксирования при комнатной температуре методом ЯМР E/Z-изомеров по N-незамещенной иминогруппе для соединений 16 и 17 может быть обусловлена влиянием азадиенового 3Н-пиррольного кольца на кислый протон иминогруппы, в результате чего повышается энергетический барьер E/Z-изомеризации.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ И ВЫВОДЫ
- Выявлены основные пути превращения 4-оксоалкан-1,1,2,2-тетракар-бонитрилов под действием аммиака и аминов, которые реализованы путем варьирования строения тетрацианоалканонов, природы растворителя, температурного режима.
- Предложен метод синтеза солей тетрацианоалканонов – 4-оксо-1,1,2,2-тетрацианобутан-1-идов, базирующийся на взаимодействии 4-оксоалкан-1,1,2,2-тетракарбонитрилов, полученных на основе жирноароматических и пространственно затрудненных кетонов, с аммиаком и аминами. Продемонстрирована нестабильность солей тетрацианоалканонов, которые твердофазно превращаются в 4-оксо-1,1,2-трицианобут-2-ен-1-иды.
- Показано образование 5,6-диалкил-3,4-дицианопиридин-2-олятов аммония из 4-оксоалкан-1,1,2,2-тетракарбонитрилов на основе алифатических кетонов в неводной среде. Для 3,4-дициано-5,6,7,8-тетрагидрохинолин-2-олята диэтиламмония обнаружен необычный процесс взаимодействия с азотной кислотой с образованием 2-гидрокси-3,8,8-тринитро-5,6,7,8-тетрагидрохинолин-4-карбоновой кислоты.
- Выявлено влияние структурного фактора исходных 4-оксоалкан-1,1,2,2-тетракарбонитрилов на ход их взаимодействия с водным аммиаком. В зависимости от строения тетрацианоалканонов образуются 9-амино-12-оксо-10,11-диазатрицикло[5.3.2.01,6]додек-8-ен-7,8-дикарбонитрилы, 4-амино-3-имино-2,3-дигидро-1H-пирроло[3,4-c]пиридин-1-оны и 5,6-диалкил-2-амино-3-[амино(иминио)метил]пиридин-4-карбоксилаты.
- Показано, что образование 5-амино-3H-пиррол-3,4-дикарбонитрилов при взаимодействии 4-оксоалкан-1,1,2,2-тетракарбонитрилов с аммиаком и аминами осуществляется путем начального задействования -цианогрупп. Ход данного превращения, протекающего через промежуточное образование 2-иминофуранов, подтвержден встречным синтезом 5-амино-3H-пиррол-3,4-дикарбонитрилов из 12-имино-9-фенил-10,11-диоксатрицикло[5.3.2.01,6]доде-кан-7,8,8-трикарбонитрилов.
- Разработан подход к синтезу изомерных смесей 8-амино-1-имино-6-морфолин-4-ил-2-окса-7-азаспиро[4.4]нона-3,6,8-триен-9-карбонитрилов, заключающийся во взаимодействии 4-оксоалкан-1,1,2,2-тетракарбонитрилов, содержащих фрагмент C(O)СHAlk, с морфолином. Показано, что изомерия для данных соединений обусловлена E/Z-конфигурацией N-незамещенной иминогруппы, что доказано ее гидролизом, а также данными ЯМР при различной температуре в различных растворителях.
Основное содержание работы изложено в следующих публикациях
Публикации в изданиях, рекомендованных ВАК для размещения материалов диссертаций:
- Беликов, М.Ю. Получение нового органического аниона взаимодействием 4-арил(гетерил)-4-оксобутан-1,1,2,2-тетракарбонитрилов с аммиаком [Текст] / М.Ю. Беликов, О.В. Ершов, А.В. Еремкин, Я.С. Каюков, О.Е. Насакин // Журн. орг. химии. – 2010. – Т. 46. – № 4. – С. 604-605.
- Беликов, М.Ю. Получение 3,4-дициано-5,6,7,8-тетрагидрохинолин-2-олятов диэтиламмония [Текст] / М.Ю. Беликов, О.В. Ершов, А.В. Еремкин, Я.С. Каюков, О.Е. Насакин // Журн. орг. химии. – 2010. – Т. 46. – № 4. – С. 621-622.
- Беликов, М.Ю. Прегненолон и ацетат 16-дегидропрегненолона в реакциях с тетрацианоэтиленом [Текст] / М.Ю. Беликов, О.В. Ершов, А.В. Еремкин, Я.С. Каюков, О.Е. Насакин // Журн. орг. химии. – 2010. – Т. 46. – № 7. – С. 1090-1091.
- Беликов, М.Ю. Синтез и биологическая активность продуктов взаимодействия 4-оксоалкан-1,1,2,2-тетракарбонитрилов с аминами [Текст] / М.Ю. Беликов, О.В. Ершов, О.Е. Насакин, Б.П. Струнин, В.А. Антипов, Л.Ф. Саттарова, П.А. Гуревич // Вестник Казанского технол. ун-та. – 2010. – № 8. – С. 23-27.
- Беликов, М.Ю. Синтез пирроло[3,4-c]пирролов и хинолин-3,4-дикарбонитрилов на основе 4-оксоалкан-1,1,2,2-тетракарбонитрилов [Текст] / М.Ю. Беликов, О.В. Ершов, И.В. Липовская, О.Е. Насакин, Б.П. Струнин, В.А. Антипов, Л.Ф. Саттарова, П.А. Гуревич // Вестник Казанского технол. ун-та. – 2010. – № 9. – С. 112-115.
Материалы конференций:
- Беликов, М.Ю. Синтез 2-гидрокси-3,8,8-тринитро-5,6,7,8-тетрагидрохинолин-4-карбоновой кислоты [Текст] / М.Ю. Беликов, О.В. Ершов // Материалы Международной конференции «Новые направления в химии гетероциклических соединений». – Кисловодск. – 2009. – С. 266.
- Беликов, М.Ю. Новые направления превращений 4-оксоалкан-1,1,2,2-тетракарбонитрилов под действием аммиака [Электронный ресурс] / М.Ю. Беликов // Материалы XVII Международной конференции студентов, аспирантов и молодых учёных «Ломоносов 2010». – М.: МАКС Пресс. – 2010. – 1 электрон. опт. диск (CD-ROM); 12 см. ISBN 978-5-317-03197-8.
- Беликов, М.Ю. Тетрацианоэтилированные кетоны в реакциях с третичными аминами [Текст] / М.Ю. Беликов // Межвузовский сборник научных трудов VII Всероссийской интерактивной конференции молодых ученых с международным участием «Современные проблемы теоретической и экспериментальной химии». – Саратов. – 2010. – С. 149-150.
- Беликов, М.Ю. Синтез 4-арил-4-оксо-1,1,2-трицианобут-2-ен-1-идов [Текст] / М.Ю. Беликов // Сборник тезисов XIII Молодежной научной школы-конференции «Актуальные проблемы органической химии». – Новосибирск. – 2010. – С. 89.
- Беликов, М.Ю. Направленные превращения электрофильных центров в 4-оксоалкан-1,1,2,2-тетракарбонитрилах [Текст] / М.Ю. Беликов // Материалы Всероссийской научно-практической конференции «Современные проблемы в контексте естественно-научных исследований». – Чебоксары. – 2010. – С. 127.
- Беликов, М.Ю. Синтез 3Н-пирролов на основе 4-оксоалкан-1,1,2,2-тетракарбонитрилов [Текст] / М.Ю. Беликов, О.В. Ершов // Сборник тезисов III Международной конференции «Химия гетероциклических соединений», посвященной 95-летию со дня рождения проф. А.Н. Коста. – Москва. – 2010. – У 7.
- Беликов, М.Ю. Превращения 4-оксоалкан-1,1,2,2-тетракарбонитрилов под действием аминов [Текст] / М.Ю. Беликов, О.В. Ершов, А.В. Еремкин // Сборник материалов Всероссийской конференции с элементами научной школы для молодежи «Актуальные проблемы органической химии». – Казань. – 2010. – С. 84.
- Беликов, М.Ю. Синтез ионных производных пиридина на основе 4-оксоалкан-1,1,2,2-тетракарбонитрилов [Текст] / М.Ю. Беликов // Сборник тезисов докладов IV Молодежной конференции ИОХ РАН. – Москва. – 2010. – С. 44.
Подписано в печать 22.02.2011 Формат 6084/16.
Усл. печ. л. 1,0. Тираж 100 экз. Заказ № 68
Чувашский государственный университет
Типография университета
![]()
428015 Чебоксары, Московский просп., 15

