ров на дипреноидные спирты, альдегиды и имины в реакциях фосфорили рования
На правах рукописи
Большакова Ольга Владимировна
дипреноидные спирты, альдегиды и имины
в реакциях фосфорилирования
02.00.08 - химия элементоорганических соединений
А в т о р е ф е р а т
диссертации на соискание ученой степени
кандидата химических наук
Казань - 2010
Работа выполнена на кафедре химии ГОУ ВПО «Татарский государственный гуманитарно-педагогический университет» и кафедре высокомолекулярных и элементооорганических соединений ГОУ ВПО "Казанский государственный университет им. В.И. Ульянова-Ленина".
Научный руководитель: доктор химических наук Низамов Ильяс Саидович
Официальные оппоненты: доктор химических наук,
профессор Катаев Владимир Евгеньевич
доктор химических наук, профессор Никитина Лилия Евгеньевна
Ведущая организация: Казанский государственный технологический университет
Защита состоится 1 июля 2010 г. в 1200 ч на заседании диссертационного совета Д 212.081.03 по защите диссертаций на соискание ученой степени доктора и кандидата наук в Казанском государственном университете им. В.И. Ульянова-Ленина по адресу: 420008, г. Казань, ул. Кремлевская, 18, КГУ, Бутлеровская аудитория.
С диссертацией можно ознакомиться в научной библиотеке им. Н.И. Лобачевского Казанского государственного университета.
Электронный вариант автореферата размещен на сайте Казанского государственного университета www.ksu.ru
Отзывы на автореферат, заверенные печатью, просим направлять по адресу: 420008, г. Казань, ул. Кремлевская, 18, Казанский государственный университет, научная часть.
Автореферат разослан 25 мая 2010 г.
Ученый секретарь диссертационного
совета, кандидат химических наук, доцент Казымова М.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Одной из фундаментальных проблем химии природных соединений является создание новых типов фосформодифицированных производных изопреноидов. Эти соединения являются перспективными биорегуляторами, играющими важную роль в продуцировании живыми организмами углеводсодержащих биополимеров ряда (липо)полисахаридов, гликопротеинов и пептидогликанов. Между тем в настоящее время ветеринария и медицина испытывают потребность в новых лекарственных средствах биорегуляторного типа. Среди природных преноидов найдены вещества, проявляющие противоязвенную, ранозаживляющую, гипотензивную, антитромбозную, противоопухолевую, антигипертензивную, андренергическую, антиульцерогенную, гиперпротекторную и антигиперхолестеринемическую активность, а также участвующие в нормализации иммунной функции, в восстановлении функций печени, являющиеся растворителями желчных камней. В то же время недостаточное внимание уделено синтетическим фосфорилированным преноидам. Между тем введение фосфорсодержащих фрагментов в молекулу преноидов может привести к созданию биологически активных веществ различного действия, являющихся базой для получения лекарственных средств нового поколения, что составляет актуальную задачу.
Целью работы является синтез новых фосфорилированных производных дипреноидов путем введения фосфорсодержащих фрагментов в молекулы дипреноидных диенильных спиртов, альдегидов и иминов и выявление среди полученных продуктов соединений с биологической активностью.
Научная новизна работы. Синтезированы ранее неизвестные непредельные дипреноидные фосфиты, имеющие структурный фрагмент O-PO2, с различной геометрической конфигурацией диенильных фрагментов на основе нерола и гераниола (Е- и Z-изомеров 3,7-диметил-2,6-октадиен-1-ола) и (R,S)-линалоола. В отличие от известных ранее,-ненасыщенных фосфитов полученные в работе непредельные фосфиты и фосфиниты вторичных скелетных перегруппировок не претерпевают.
Впервые установлено региоспецифическое образование продуктов 1-алкиламиинофосфонатного строения в реакции диалкилфосфитов с E,Z-цитралем, (R,S)-цитронеллалем и (1R)-(–)-миртеналем в присутствии первичного алифатического амина с участием карбонильной группы непредельного дипреноидного альдегида по схеме реакции Кабачника-Филдса. При этом реакция Пудовика с присоединением фосфорсодержащих фрагментов по двойным связям непредельного дипреноидного альдегида в выбранных мягких условиях не реализуется.
Впервые получены непредельные дипреноидные имины с использованием E,Z-цитраля и (R,S)-цитронеллаля и первичных аминов, в том числе оптически активных, в качестве промежуточных продуктов получения конечных 1-аминофосфонатов в реакции Кабачника-Филдса. Найдено, что при образовании иминов из первичных аминов и E,Z-цитраля соотношение Z- и E-изомеров меняется от 1:1 в исходном цитрале до 1:2 для соответствующих иминов. При иминировании (R,S)-цитронеллаля алкиламинами образуется рацемическая смесь изомеров.
Реакция Пудовика иминов E,Z-цитраля с диалкилфосфитами протекает по схеме 1,2-присоединения с образованием 1-алкиламинофосфонатов. В этих реакциях в мягких условиях образования продуктов 1,4- и 3,4-присоединения по схеме реакции Пудовика не происходит.
В отличие от известных реакций,-ненасыщенных иминов с диалкилтриметилсилилфосфитами, приводящих после обработки водой к 1,3-дифосфонатам через тандемное двухкратное 1,4- и 1,2-присоединение, впервые установлено, что реакции иминов E,Z-цитраля с диалкилтриметилсилилфосфитами в присутствии воды или диэтиламина протекают региоспецифически с участием связи C=N и образованием 1-алкиламинофосфонатов.
Практическая значимость работы. Ряд новых фосформодифицированных непредельных дипреноидов с фрагментом C-O-P(III) получен на основе реакций дипреноидных диенильных спиртов с хлорфосфитами, хлорфосфинами и циклическими амидофосфитами, содержащими лабильные связи P-Cl и P-N. Модифицирован способ получения непредельных дипреноидных 1-гидроксифосфонатов с использованием реакции диалкилфосфитов с E,Z-цитралем в присутствии триэтиламина при большом разбавлении в соответствующих спиртах, что позволило повысить выходы и чистоту целевых продуктов. Неизвестные ранее непредельные дипреноидные 1-алкиламинофосфонаты синтезированы при введении E,Z-цитраля, (R,S)-цитронеллаля и (1R)-(–)-миртеналя) во взаимодействие с диалкилфосфитами в присутствии первичных алифатических аминов в мягких условиях.
Среди дипреноидных иминов и 1-алкиламинофосфонатов с дипреноидными заместителями найдены вещества, обладающие бактериостатической и фунгистатической активностью. Наиболее эффективно подавляют рост бактерий Staphylococcus aureus и Bacillus cereus оптически активные левовращающие непредельные дипреноидные имины, содержащие хиральные центры в алкиларильном фрагменте у атома азота. 1-Алкиламинофосфонаты оказались наиболее активными по отношению к Staphylococcus aureus и Bacillus cereus.
Апробация работы. Основные результаты работы докладывались и обсуждались на итоговых научных конференциях Казанского научного центра РАН (Казань, 2005-2008 гг.); XIV-ой и XV-ой международных конференциях по химии соединений фосфора (г. Казань, 2005 г., г. С.-Петербург, 2008 г.); VIII-ой молодежной научной школе-конференции по органической химии (г. Казань, 2005 г.); четвертой международной конференции молодых ученых “Современные тенденции в органическом синтезе и проблемы химического образования” (г. С.-Петербург, 2005 г.); IV-ой Всероссийской научной конференции “Химия и технология растительных веществ” (г. Сыктывкар, 2006 г.); V-ой и VI-ой научных конференциях молодых ученых, аспирантов и студентов научно-образовательного центра Казанского государственного университета "Материалы и технологии XXI века" (г. Казань, 2005 г., 2006 г.); IV-ой Всероссийской научной конференции “Химия и технология растительных веществ” (г. Сыктывкар, 2006 г.), XV-ой международной конференции по химии соединений фосфора (г. С.-Петербург, 2008 г.).
Публикации. Основное содержание диссертации изложено в 16 публикациях, в том числе в 5 статьях, тезисах 11 докладов на международных и Всероссийских конференций.
Объем и структура диссертации. Диссертация состоит из введения, трех глав, списка литературы и приложения; включает 2 таблицы, 26 рисунков и библиографию из 125 литературных ссылок. В первой главе приведен литературный обзор, посвященный синтетическим фосформодифицированным изопреноидам. Во второй главе обсуждаются результаты исследования автора. В третьей главе приводится описание экспериментов. В приложении содержатся рисунки спектров полученных продуктов.
Диссертационная работа поддержана грантами РФФИ-Татарстан № 03-03-96208, № 07-03-00617-а, академии наук Республики Татарстан № 07-7.2-182/2003(Ф) и молодежным грантом Reg. 007 научно-образовательного центра (CRDF) Казанского государственного университета (2004-2005 гг.) «Фосфорилирование 1,5-полиенов и их низкомолекулярных аналогов».
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Реакции дипреноидных диенильных спиртов с хлорфосфитами,
хлорфосфинами и амидофосфитами
Среди природных ациклических изопреноидов ряда дипреноидов с числом атомов углерода С10 в качестве субстратов для фосфорилирования нами выбраны доступные диенильные спирты такие, как гераниол (E-изомер 3,7-диметил-2,6-октадиен-1-ола) 1, нерол (Z-изомер 3,7-диметил-2,6-октадиен-1-ола) 2 и линалоол (рацемическая смесь (+)-кориандрола и (-)-ликареола) 3 под действием хлоридов и амидов трехкоординированного фосфора. Показано, что реакция диэтилхлорфосфита 4 с неролом 2 протекает в течение 1 ч в присутствии триэтиламина в бензоле с экзотермическим эффектом и образованием 1-(Z-3,7-диметил-2,6-октадиенил)диэтилфосфита 5 (реакция 1). Для синтеза E-изомера 6 использована реакция диэтилхлорфосфита 4 с гераниолом 1 в присутствии триэтиламина в растворе бензола (реакция 2).
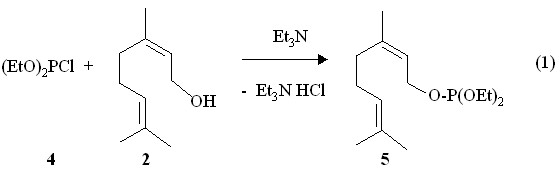
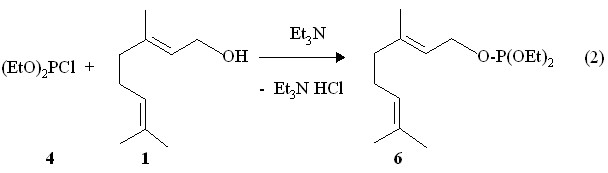
Продукты реакций (1) и (2) выделены с помощью прибора для молекулярно-пленочной перегонки. В спектрах ЯМР 31Р химический сдвиг ядра атома фосфора Z-изомера 5 расположен в более сильном поле (Р 138.3 м.д.) по сравнению с E-изомером 6 (Р 138.9 м.д.). Характерным структурным признаком полученных 3,7-диметил-2,6-октадиенил)диэтилфосфитов 5 и 6 является наличие фрагмента CH2OP по соседству с непредельным фрагментом С=CH. В спектре ЯМР 1Н в растворе СDCl3 исходного нерола 2 метиленовые протоны у атома кислорода CH2O проявляются в виде дублета при 4.0 м.д. В спектре ЯМР 1Н Z-изомерного фосфита 5 сигналы протонов метиленоксильной группы у атома фосфора С=CH-CH2OP принимают вид дублета дублетов при 4.45 м.д. (3JHH 6.9 Гц, 3JРH 9.0 Гц). В спектре ЯМР 1Н метиленовые протоны у атома кислорода CH2O исходного гераниола 1 дают дублет при 4.1 м.д. В спектре ЯМР 1Н E-изомерного фосфита 6 сигналы метиленовых протонов у атомов кислорода С=CH-CH2OP также смещены в сторону слабого поля (3JHH 7.5 Гц, 3JРH 9.0 Гц).
Нами показано, что реакция рацемического линалоола 3 с диэтилхлорфосфитом 4 в присутствии триэтиламина в растворе бензола сопровождается небольшим экзотермическим эффектом и завершается образованием 3-(3,7-диметил-1,6-октадиенил)диэтилфосфита 7 в виде смеси R,S-изомеров, выделеных на приборе для молекулярно-пленочной перегонки (реакция 3).
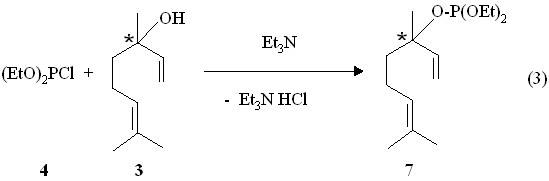
Сигнал ядра атома фосфора соединения 7 в спектре ЯМР 31Р в бензольном растворе находится в более высоком поле (Р 134.3 м.д.), чем Z- и E-изомеры 3,7-диметил-2,6-октадиенил)диэтилфосфита 5 и 6. Для соединения 7 характерно присутствие метильной группы у атома С3 (фрагмент СН3C=CH), протоны которых в спектре ЯМР 1Н проявляются в виде уширенного синглетного сигнала при 1.48 м.д. В масс-спектрах электронного удара непредельных дипреноидных фосфитов 5, 6 и 7 имеются массовые пики m/z 274 их молекулярных ионов [M]+. (вычислено М: 274.2).
Для получения преноидных производных, содержащих связи P-C, можно использовать диорганилхлорфосфины. Дифенилхлорфосфин 8 фосфорилирует с экзотермическим эффектом гераниол 1 в бензоле в присутствии триэтиламина при 20 оС (4 ч) с образованием О-(E-3,7-диметил-2,6-октадиен-1-ил)дифенилфосфинита 9 (реакция 4).
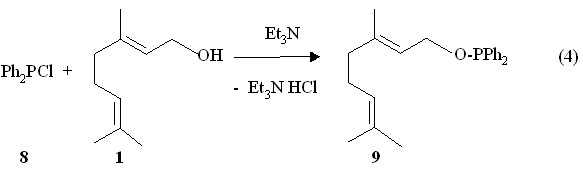
В спектре ЯМР 31Р О-геранилдифенилфосфинита 9 в растворе бензола содержится синглетный сигнал при Р 111.8 м.д., что согласуется с трехкоординированным атомом фосфора с окружением Ph2POR. В спектре ЯМР 1Н в растворе СDCl3 фосфинита 9 наряду с сигналами протонов геранильного заместителя содержатся два мультиплета при 7.28-7.58 и 7.67-7.70 м.д. протонов двух фенильных групп. В масс-спектре электронного удара фосфинита 9 присутствует массовый пик m/z 338, который соответствует его молекулярному иону [M]+. (вычислено М: 338.2).
Впервые установлено, что в отличие от,-ненасыщенных фосфитов полученные дипреноидные диенильные фосфиты вторичных скелетных перегруппировок не претерпевают (подобно [2,3]-сигматропной перегруппировки при кипячении в течение 5 ч толуольного раствора аллилдиэтилфосфита с образованием 2-пропенилдиэтилфосфоната (Христов В.Ч., 1998 г.).
Биологическая активность зачастую обусловлена фармакофорными циклическими структурами. В связи с этим в качестве фосфорилирующих агентов со связью P-N, нами использованы циклические амидофосфиты. Найдено, что при нагревании смеси нерола 2 и O,O-пропилен-N,N-диэтиламидофосфита 10 до 140 оС с отгонкой диэтиламина образуется О-1-(Z-3,7-диметилокта-2,6-диенил)-1,3,2-диоксафосфоринан 11, выделенный на приборе для молекулярно-пленочной перегонки (реакция 5).
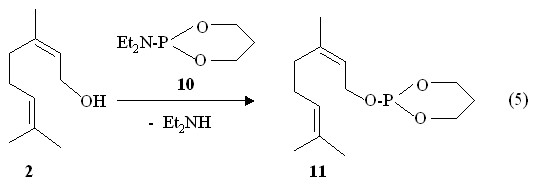
В спектре ЯМР 31Р 1,3,2-диоксафосфоринана 11 содержится синглетный сигнал при Р 129.4 м.д., в области, характерной для фосфитов, что отличается от сигнала исходного амидофосфита 10 (Р 145 м.д.). В спектре ЯМР 1Н 1,3,2-диоксафосфоринана 11 при 3.47 и 3.48 м.д. имеются два дублета метильных протонов фрагмента C=C-CH2OP (3JPH 9.5 Гц). Массовый пик m/z 259.2, обнаруженный в масс-спектре химической ионизации 1,3,2-диоксафосфоринана 11, соответствует его молекулярному иону [M + Н]+.
Таким образом, реакции дипреноидных диенильных спиртов с хлорфосфитами, хлорфосфинами и амидофосфитами, содержащими лабильные связи P-Cl и P-N, открывают доступные подходы к фосформодифицированным преноидам с фрагментом C-O-P(III).
1-Гидроксифосфонаты на основе E,Z-цитраля.
Модифицирование метода синтеза
Преноидные производные со связью C-P(IV), обладащие достаточно высокой гидролитической и термической стабильностью, могут быть получены на основе реакций эфиров кислот трехвалентного фосфора с дипреноидными альдегидами. В молекулах непредельных дипреноидных альдегидов содержится несколько реакционных центров (одна или две двойные связи и карбонильная группа). Поэтому структура продуктов их реакций с диалкилфосфитами не очевидна, поскольку возможно конкурентное присоединение фосфорильных фрагментов по карбонильной группе цитраля (реакция Абрамова), нуклеофильное присоединение по 2,3-двойной связи С=С по схеме реакции Пудовика и радикальное присоединение по 6,7-двойной связи С=С по реакции Пудовика в зависимости от выбранных условий реакции и строения реагентов.
В работах французских химиков (Kamal M., Montero J.-L. с сотр, 1999 г.) было показано, в условиях реакции Абрамова,-непредельные дипреноидные карбонильные соединения такие как цитраль и -ионон с диалкилфосфитом дают 1-гидроксифосфонаты. Отметим, что 1-гидроксифосфонатам особенно с хиральными центрами в последнее время уделяется большое внимание как биологически активным соединениям. В связи с умеренным выходом 1-гидроксифосфонатов на основе цитраля и их невысокой чистотой метод синтеза целевых продуктов модифицирован нами путем проведения реакции диалкилфосфитов 12а,б с E,Z-цитралем 13 в присутствии триэтиламина в молярном соотношении 2:1:4 при большом разбавлении в растворе соответствующих спиртов при 40-55 оС в течение 16-17.5 ч с образованием О,О-диалкил-E,Z-1-гидрокси-3,7-диметилокта-2,6-диенилфосфонатов 14а,б (выходы 87-88 %), выделенных с помощью прибора для молекулярно-пленочной перегонки (реакция 6).
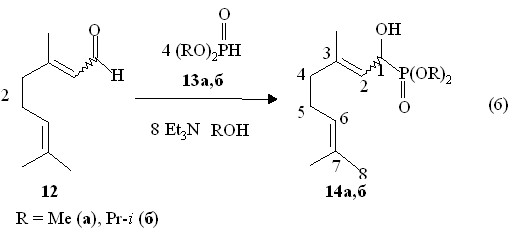
О,О-Ди-изо-пропил-E,Z-1-гидрокси-3,7-диметилокта-2,6-диенилфосфонаты 14б очищены колоночной хроматографией. Их чистота подтверждена данными ГЖХ, которые показывает присутствие двух изомеров соединения 14б. На хроматограмме имеются 2 пика с временами удерживания в толуоле 7.94 и 8.48 мин в соотношении 1:2. В спектре ЯМР 31Р смеси изомеров фосфонатов 14б присутствуют два синглетных сигнала при P 21.9 и 24.2 м.д. В спектре ЯМР 1Н О,О-диметил-E,Z-1-гидрокси-3,7-диметилокта-2,6-диенилфосфонатов 14а два мультиплета при 5.02 и 5.27 м.д. относятся к винильным протонам фрагментов Me2C=CH и C=CH-CP соответственно. В ИК спектре О,О-ди-изо-пропил-E,Z-1-гидрокси-3,7-диметилокта-2,6-диенилфосфонатов 14б содержатся полосы поглощения при 3330 и 1665 см-1 валентных колебаний связей ОН и С=С соответственно. Двойные связи С=С E,Z-цитраля в реакции с диалкилфосфитами, таким образом, не затрагиваются. В масс-спектре электронного удара О,О-диметил-E,Z-1-гидрокси-3,7-диметилокта-2,6-диенилфосфонатов 14а содержится массовый пик m/z 262 [М+.], соответствующий его молекулярному иону. О,О-Ди-изо-пропил-E,Z-1-гидрокси-3,7-диметилокта-2,6-диенилфосфонаты 14б в масс-спектре электронного удара дают массовый пик m/z 318 [M]+. их молекулярных ионов.
Следует отметить, что в отсутствие триэтиламина реакция (6) протекает медленно и с низким выходом продуктов 14а,б. Таким образом, нами модифицирован способ получения непредельных дипреноидных 1-гидроксифосфонатов на основе реакций E,Z-цитраля с диалкилфосфитами в основной среде путем большого разбавления соответствующими спиртами. Этот синтетический прием позволил повысить выходы и чистоту 1-гидроксифосфонатов. Присоединение диалкилфосфитов по связи С=О E,Z-цитраля происходит региоспецифически. Продуктов присоединения по двойным связям С=С не обнаружено.
Фосфорилирование дипреноидных альдегидов
в условиях реакции Кабачника-Филдса
Перспективным направлением синтеза фосфорилированнных дипреноидов с фрагментом C-P(IV) может служить реакция дипреноидных альдегидов с кислыми фосфитами в присутствии аминов со связями N-H (реакция Кабачника-Филдса). Нами найдено, что диэтилфосфит 13в реагирует с E,Z-цитралем 12 в присутствии эквимольного количества изо-бутиламина 15а при 10-15 оС с образованием О,О-диэтил-1-(N-изо-бутиламино)-3,7-диметилокта-2,6-диенилфосфонатов 16а в виде смеси E,Z-изомеров (выход 95 %), очищенных перегонкой в вакууме (реакция 7).
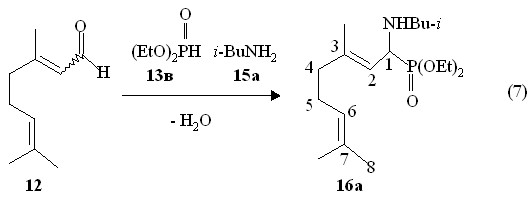
Спектр ЯМР 31Р продуктов 16а содержит уширенный сигнал при P 24.6 м.д., что соответствует фосфонатам. В ИК спектре соединений 16а имеются две полосы поглощения при 3430 и 3306 см-1, характерные для валентных колебаний связи N-H. Масс-спектр электронного удара фосфонатов 16а содержит массовый пик m/z 345.3, относящийся к их молекулярным ионам [М]+. . В спектре ЯМР 1Н двух изомерных продуктов 16а метиновые протоны у атома фосфора (фрагмент PCH) дают два дублета дублетов при 3.74 м.д. (3JHH 9.9 Гц, 3JРH 12.5 Гц, 3JHH 2.9 Гц). При 4.18 м.д. и 5.11 м.д. находятся сигналы винильных протонов фрагментов PCH-CH=C и (СН3)2C=CH, соответственно, что свидетельствует о сохранении двойных связей С=С в молекулах продуктов реакции (7). Таким образом, при взаимодействии диэтилфосфита с E,Z-цитралем в присутствии изо-бутиламина в мягких условиях происходит региоспецифическое присоединение по связи С=О с образованием продуктов 1-алкиламинофосфонатого строения. При этом реакция Пудовика с присоединением фосфорсодержащих фрагментов по двойным связям С=С непредельного дипреноидного альдегида в выбранных мягких условиях реакции (7) не реализуется.
В случае (R,S)-цитронеллаля, который можно представить в виде цитраля, гидрированного по 2,3-двойной связи, 6,7-двойная связь практически нереакционноспособна по отношению к присоединению фосфорильных фрагментов. Нами показано, что диэтилфосфит 13в в реакции с (R,S)-цитронеллалем 17 в присутствии изо-пропиламина 15б или изо-бутиламина 15а дает О,О-диэтил-1-(N-алкиламино)-3,7-диметилокта-6-енилфосфонаты 18а,б с высокими выходами (до 98 %), выделенные перегонками в вакууме (реакция 8). При использовании диэтилфосфита 13в реакция (8) сопровождается экзотермическим эффектом.
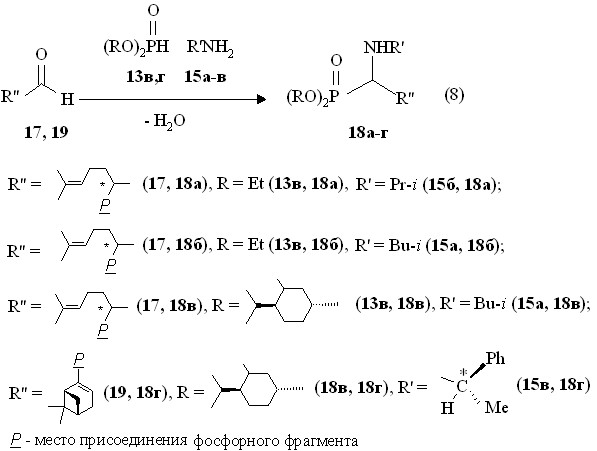
Предложенный подход к синтезу непредельных дипреноидных 1-аминофосфонатов (реакция 8) позволил ввести в эту реакцию ди[(–)-(1R,2S,5R)мент-2-ил]фосфит 13г с хиральным преноидными заместителями. Полученный на его основе О,О-ди[(–)-(1R,2S,5R)мент-2-ил]-1-(N-изо-бутиламино)-3,7-диметилокта-6-енилфосфонат 18в очищен хроматографированием на колонке. Масс-спектр электронного удара соединения 18в содержит массовый пик m/z 567.6, соответствующий его молекулярному иону [М]+.. Фосфонат 18в в спектре ЯМР 31Р имеет синглептный сигнал при р 26.4 м.д. Спектры ЯМР 31Р О,О-диэтил-1-(N-изо-пропиламино)-3,7-диметилокта-6-енил- фосфонатов 18а и О,О-диэтил-1-(N-изо-бутиламино)-3,7-диметилокта-6-енилфосфонатов 18б содержат по два сигнала при р 29.1 и 31.4 м.д. в соотношении 14:1 и р 29.0 и 29.2 м.д. в соотношении ~1:1 соответственно. Эти сигналы относятся к двум диастереомерам О,О-диэтил-1-(N-алкиламино)-3,7-диметилокта-6-енилфосфонатов благодаря наличию двух асимметрических центров - атомов углеродов C1 и С3. В спектре ЯМР 1Н О,О-диэтил-1-(N-изо-бутиламино)-3,7-диметилокта-6-енилфосфонатов 18б метиновые протоны фрагмента Р-СН-СН2 проявляются в виде двух дублетов триплетов при 3.72 и 3.90 м.д. (3JHH 7.0-7.3 Гц, 2JРH 15.4 Гц).
В развитие этого подхода представляет интерес получить хиральные 1-аминоалкилфосфонаты при введении в реакцию Кабачника-Филдса трех оптически активных реагентов. С этой целью нами изучена реакция ди[(–)-(1R,2S,5R)мент-2-ил]фосфита 13г со смесью (1R)-(–)-миртеналя 19 и L-(–)--фенилэтиламина 15в, которая при кипячении реагентов в течение 14 ч в растворе безводного бензола с использованием прибора Дина-Старка привела к образованию ди-O,O-(1R,2S,5R)-мент-2-ил[1-L-миртенил)-(N-1(L)-фенилэтиламино)метил]фосфоната 18г (реакция 8). Продукт 18г является оптически активным ([]D22 -40.3о, c 1.0, C6H6), что согласуется со знаком угла оптического вращения исходных L-(–)--фенилэтиламина 15в ([]D20 -39о) и (1R)-(–)-миртеналя 19 ([]D20 -15о). В спектре ЯМР 31Р фосфоната 18г имеется сигнал при р 22.1 м.д. В спектре ЯМР 1Н соединения 18г метиновый протон фрагмента PCH проявляется в виде дублета квартетов при 4.38 м.д. (3JHH 6.7 Гц, 3JРH 13.3 Гц). Соединение 18г в масс-спектре электронного удара дает молекулярный ион с массовым пиком m/z 611.8 [M]+.
Таким образом, реакция Кабачника-Филдса при использовании непредельных дипреноидных альдегидов позволяет получать 1-аминофосфонаты, в том числе оптически активные, в одну стадию.
Имины на основе дипреноидных альдегидов
Учитывая, что одним из направлений получения 1-аминофосфонатов в реакции Кабачника-Филдса является образование промежуточных иминов, нами изучены реакции непредельных дипреноидных альдегидов с первичными аминами, в том числе с хиральными. В этот вариант реакции Пудовика нами вовлечены те же E,Z-цитраль, (R,S)-цитронеллаль и (1R)-(–)-миртеналь, использованнные выше в реакции Кабачника-Филдса (см. реакции 9 и 11). Установлено, что реакция E,Z-цитраля с этиламином (15г) (в виде хлоргидрата), изо-пропил- (15б), изобутил- (15б) и н-бутиламинами (15д) в присутствии гидроксида калия при охлаждении до -20 оС приводит к 3,7-диметилокта-2,6-диенил-N-алкилиминам 20а-г в виде смеси E,Z-изомеров с высокими выходами (84-87 %), очищенные перегонками в вакууме. Алкиламины вводилсь в реакции в 1.2-кратном избытке.
В ИК спектрах E,Z-3,7-диметилокта-2,6-диенил-N-бутилиминов 20а-г имеется сильная полоса поглощения при 1651-1652 см-1 валентных колебаний связи С=N. В спектре ЯМР 1Н E,Z-3,7-диметилокта-2,6-диенил-N-диэтилиминов 20в соотношение между сигналами протона группы N=CH при 1 8.13 м.д. и 2 8.19 м.д. составляет 1:2 (3JHH 9.5 Гц и 3JHH 9.2 Гц, соответственно).
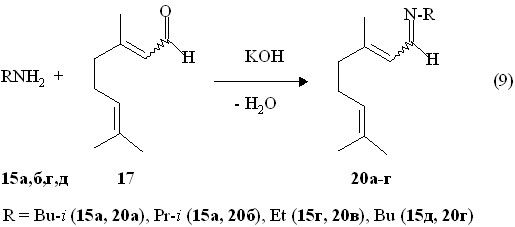
Таким образом, нами впервые установлено, что в процессе иминирования соотношение Z- и E-изомеров меняется от 1:1 в исходном цитрале до 1:2 для соответствующих иминов. Винильный протон (фрагмент C=CH-C=N) в спектре ЯМР 1Н E,Z-3,7-диметилокта-2,6-диенил-N-изо-бутилиминов 20а проявляется в виде двух дублетов при 1 5.77 м.д. (3JHH 9.2 Гц) и 2 6.04 м.д. (3JHH 9.5 Гц). Масс-спектр химической ионизации E,Z-3,7-диметилокта-2,6-диенил-N-изо-бутилиминов 20а дает массовый пик m/z 208.3 их молекулярных ионов [M + Н]+. В масс-спектре электронного удара E,Z-3,7-диметилокта-2,6-диенил-N-изо-пропилиминов 20б содержится массовый пик m/z 193.1, соответствующий их молекулярным ионам [M]+..
В реакции (R,S)-цитронеллаля 17 с изо-бутиламином 15а и изо-пропиламином 15б при охлаждении до -20 оС в присутствии КОН получены (R,S),E,Z-3,7-диметил-6-енил-N-алкилимины 21а,б, выделенные перегонками в вакууме (реакция 10).

В ИК спектрах (R,S),E,Z-3,7-диметилокта-6-енил-N-изо-бутилиминов 21а имеется характерный набор полос поглощения валентных колебаний связей С=N и C=С соответственно при 1669-1666 и 1637-1638 см-1. В спектре ЯМР 1Н (R,S),E,Z-3,7-диметил-6-енил-N-изо-пропилиминов 21б винильные протоны фрагмента N=CH дают два дублета при 1 7.64 и 2 7.65 м.д. (3JHH 5.1 Гц и 3JHH 5.2 Гц соответственно) в соотношении 1:1. В спектре ЯМР 1Н (R,S),E,Z-3,7-диметилокта-6-енил-N-изо-бутилиминов 21а соотношение дублетных сигналов протонов у связи N=CH при 1 7.59 м.д. (3JHH 5.0 Гц) и 2 7.61 м.д. (3JHH 5.1 Гц) также равно 1:1. Таким образом, в реакции (R,S)-цитронеллаля 17 с алкиламинами образуется смесь 1:1 изомеров.
При введении оптически активного L-(–)--фенил(этил)амина 15в во взаимодействие с (R,S)-цитронеллалем 17 (-20 оС, КОН) получен оптически активный 3,7-диметил-6-енил-N-1-L--фенил(этил)имин 21в ([]D22 -0.8 о, c 1.0, C6H6), выделенный перегонкой в вакууме (реакция 10). В спектре ЯМР 1Н имина 21в при 1 7.77 м.д. (3JHH 5.1 Гц) и 2 7.79 м.д. (3JHH 4.4 Гц) содержится два дублета винильного протона группы CH=N в соотношении 1:1
Представляет интерес ввести в реакцию иминирования оба реагента в оптически активной форме. Установлено, что в реакции L-(–)--фенил(этил)амина 15в с (1R)-(–)-миртеналем 19 в присутствии КОН при -20 оС образуется оптически активный (1R),E,Z-(–)-миртенил-N-1-L-(–)--фенил(этил)имин 21г ([]D22 -17.8 о, c 1.0, C6H6) (реакция 10). Масс-спектр электронного удара имина 21г содержит массовый пик m/z 253.2, соответствующий его молекулярному иону [M]+.. В спектре ЯМР 1Н соединения 21г синглетный сигнал при 7.92 м.д. отнесен к винильному протону связи N=CH. При этом второго сигнала протона группы N=CH от другого вероятного изомера в спектре ЯМР 1Н не наблюдается. Полученные имины могут служить в качестве исходных соединений реакциях фосфорилирования.
Реакции иминов дипреноидных альдегидов с диалкилфосфитами
В реакциях кислых фосфитов с непредельными иминами на основе E,Z-цитраля можно предположить следующие маршруты: 1) присоединение по связи C=N; 2) присоединение по 2,3-двойной связи); 1)+2) тандемное присоединение по связи C=N и 2,3-двойной связи С=С; 3) присоединение по 6,7-двойной связи. Направление 1 может служить модельной реакцией образования 1-аминофосфонатов по реакции Кабачника-Филдса E,Z-цитраля с диалкилфосфитами в присутствии первичных аминов. Нами установлено, что в реакции E,Z-3,7-диметилокта-2,6-диенил-N-изо-бутилимина 20а с диэтилфосфитом 13в при 20 оС образуются О,О-диэтил-E,Z-1-(N-изобутиламино)-3,7-диметилокта-2,6-диенилфосфонаты 16а (выход 90 %), выделенные перегонкой в вакууме (реакция 11).
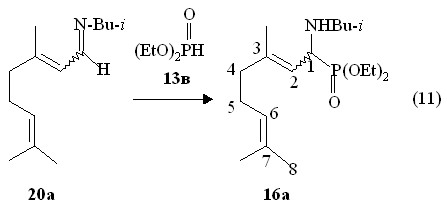
Параметры ИК спектров, спектров ЯМР 31Р и 1Н и масс-спектров О,О-диэтил-E,Z-1-(N-изобутиламино)-3,7-диметилокта-2,6-диенилфосфонатов 16а, полученных во встречных синтезах (реакции 7 и 11), идентичны. Таким образом, в реакции иминов E,Z-цитраля с диалкилфосфитами реализуется направление, связанное с образованием 1-аминофосфонатов. Двухкомпонентная реакция дипреноидных иминов с диалкилфосфитами дает возможность получать 1-алкиламинофосфонаты более чистыми по сравнению с продуктами реакции Кабачника-Филдса. В реакции Пудовика иминов цитраля с диалкилфосфитами образования продуктов с участием двойных связей С=С не происходит.
Реакции иминов E,Z-цитраля с диалкилcилилфосфитами
Известно, что при введении диалкилтриметилсилилфосфитов в реакции с,-ненасыщенными иминами происходит тандемное двухкратное 1,4- и 1,2-присоединение с последующим образованием 1,3-дифосфонатов после обработки водой промежуточных продуктов (Стивенс С.В. с сотр., 2005 г.). В отличие от этого нами найдено, что в реакции (12) E,Z-3,7-диметилокта-2,6-диенил-N-этилиминов 20в и E,Z-3,7-диметилокта-2,6-диенил-N-бутилимином 20г с диалкилтриметилсилилфосфитами 22а,б в присутствии контролируемых количеств воды или диэтиламина (20-70 оС, 1 ч) образуются О,О-диалкил-E,Z-1-(N-этил)-3,7-диметилокта-2,6-диенилфосфонаты 16в-г.
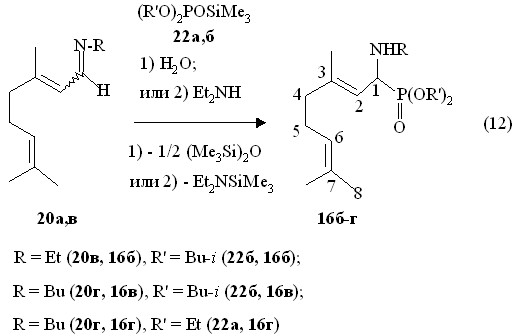
Соединения 16в-г имеют химические сдвиги в спектрах ЯМР 31Р при р 24.3-24.6 м.д., то есть в области, характерной для 1-алкиламинофосфонатов, полученных в реакциях (7) и (11). В спектре ЯМР 1Н О,О-ди-изо-бутил-E,Z-1-(N-этил)-3,7-диметилокта-2,6-диенилфосфонатов 16б дублет дублетов при 3.60 м.д. относится к метиновому протону у атома фосфора (фрагмент PCH, 3JHH 6.6 Гц, 3JРH 14.0 Гц). Сохранение двойных связей С=С в молекулах продуктов реакции (12) подтверждается также присутствием сигналов при 5.08 м.д. и 5.93 м.д. в виде узких мультиплетов, характерных для винильных протонов (фрагменты PCH-CH=C и (СН3)2C=CH, соответственно). В масс-спектре электронного удара О,О-ди-изо-бутил-E,Z-1-(N-этил)-3,7-диметилокта-2,6-диенилфосфонатов 16б имеется массовый пик m/z 373.4 их молекулярных ионов [М]+.. Массовый пик m/z 401.4, найденный в масс-спектре химической ионизации О,О-ди-изо-бутил-E,Z-1-(N-бутиламино)-3,7-диметилокта-2,6-диенилфосфонатов 16в, соответствует их молекулярным ионам [M + Н]+.
Таким образом, параметры спектров продуктов 16в-г свидетельствуют о протекании реакции (12) с участием связи C=N непредельных диреноидных иминов. При этом двойные связи С=С не затрагиваются. Реакция иминов E,Z-цитраля с диалкилcилилфосфитами представляет собой еще один подход к синтезу непредельных дипреноидных 1-алкиламинофосфонатов.
Бактериостатическая и фунгистатическая активность
иминов цитраля и дипреноидных 1-алкиламинофосфонатов
Разработанные нами методы синтеза иминов цитраля и 1-алкиламинофосфонатов, полученных на основе цитраля и цитронеллаля, предоставили возможность провести среди них поиск веществ, обладающих биологически активными свойствами. Среди пестицидов значительный практический интерес представляют бактерицидные и фунгицидные препараты. В этой связи исследования по разработке средств защиты продуктов питания, кормов от токсикогенных бактерий и микроскопических грибов, лечению болезней, связанных с грибной этиологией, являются актуальными. Препаратов отечественного производства для этих целей недостаточно. С целью поиска бактирицидов и фунгицидов полученные имины цитраля и 1-алкиламинофосфонаты прошли испытания по отношению к патогенным бактериям и грибам Staphylococcus aureus, Bacillus cereus, Escherichia coli и Aspergillus niger в лаборатории химико-биологических исследований Учреждения РАН ИОФХ им. А.Е. Арбузова КазНЦ РАН. Установлено, что наибольшую бактериостатическую активность по отношению к Staphylococcus aureus и Bacillus cereus проявляют (R,S),E,Z-3,7-диметил-6-енил-N-1-L--фенил(этил)имины (6.25 и 7.80 мг/л в ДМСО, соответственно). Им немного уступают (1R),E,Z-(–)-миртенил-N-1-L-(–)--фенил(этил)имины (125 и 250 мг/л, соответственно). Таким образом, наиболее эффективно подавляют рост грамположительных бактерий оптически активные левовращающие непредельные дипреноидные имины, содержащие хиральные центры в алкиларильном фрагменте у атома азота. 1-Алкиламинофосфонаты оказались наиболее активными по отношению к Staphylococcus aureus и Bacillus cereus и малоактивными в отношении Escherichia coli и Aspergillus niger. Среди испытанных бактерий наиболее эффективно задерживается рост колоний золотистого стафилококка (15.6-62.5 мг/л). По отношению Staphylococcus aureus E,Z-1-(N-изо-бутиламино)-3,7-диметилокта-2,6-диенил-О,О-диэтилфосфонаты, (R,S)-1-(N-изо-бутиламиино)-3,7-диметилокта-6-енил-О,О-диэтилфосфонаты и (R,S)-1-(N-изо-бутиламино)-3,7-диметилокта-6-енил-О,О-диэтилфосфонаты проявляют фунгистатичское действие в концентрации 15.6 мг/л. Полученные результаты представляют интерес для дальнейшего поиска биологически активных соединений в ряду фосфорилированных дипреноидов.
выводы
1. Впервые установлено, что в отличие от,-ненасыщенных фосфитов новые непредельные фосфиты и фосфиниты c различной геометрической конфигурацией диенильных фрагментов, полученные на основе реакций Е- и Z-изомеров 3,7-диметил-2,6-октадиен-1-ола и (R,S)-линалоола с хлорфосфитами, хлорфосфинами и циклическими амидофосфитами, вторичных скелетных перегруппировок не претерпевают.
2. Модифицированный способ получения непредельных дипреноидных 1-гидроксифосфонатов на основе реакции диалкилфосфитов с E,Z-цитралем в присутствии триэтиламина при большом разбавлении в соответствующих спиртах повышает чистоту целевых продуктов.
3. Реакции E,Z-цитраля, (R,S)-цитронеллаля и (1R)-(–)-миртеналя) с диалкилфосфитами в присутствии алкиламинов протекают региоспецифически с участием карбонильной группы по схеме реакции Кабачника-Филдса с образованием непредельных дипреноидных 1-алкиламинофосфонатов. Продуктов реакции Пудовика с участием двойных связей непредельных дипреноидных альдегидов не образуется.
4. В процессе образовании иминов из алкиламинов и E,Z-цитраля соотношение Z- и E-изомеров меняется от 1:1 в исходном цитрале до 1:2 для соответствующих иминов. При иминировании (R,S)-цитронеллаля алкиламинами образуется смесь 1:1 (R,S),E,Z-изомеров.
5. Реакция Пудовика иминов E,Z-цитраля с диалкилфосфитами протекают с участием связи C=N и образованием 1-алкиламинофосфонатов, при этом образования продуктов с участием двойных связей С=С не происходит.
6. Впервые установлено, что в отличие от,-ненасыщенных иминов реакции иминов E,Z-цитраля с диалкилтриметилсилилфосфитами в присутствии воды или диэтиламина протекают с участием связи C=N и образованием 1-алкиламинофосфонатов.
7. Синтезированные дипреноидные имины и 1-алкиламинофосфонаты с непредельными дипреноидными заместителями обладают бактериостатической и фунгистатической активностью.
Основные результаты работы изложены в следующих публикациях
Публикации в изданиях, рекомендованных ВАК РФ,
для размещения материалов кандидатских диссертаций:
1. Низамов И.С., Большакова О.В., Низамов И.Д., Сергеенко Г.Г., Ямбушев Ф.Д., Батыева Э.С. Нерил- и геранил(диэтил)фосфиты // Журн. oбщ. химии. 2006. Т. 76, № 12. С. 2055-2056.
2. Низамов И.С., Большакова О.В., Низамов И.Д., Ямбушев Ф.Д., Сергеенко Г.Г., Батыева Э.С. 1-Гидрокси-3,7-диметилокта-2,6-диенил-О,О-диметилфосфонат. Разработка методов синтеза // Журн. oрг. химии. 2005. Т. 41, № 3. С. 472-473.
Другие статьи по теме диссертации
3. Nizamov I.S., Bolshakova O.V., Nizamov I.D., Sergeenko G.G., Mironov V.F., Yambushev F.D., Batyeva E.S., Alfonsov V.A. Development of methods of phosphorylation of citral by medial and acidic phosphites // Res. J. Chem. Envir. 2007. V. 11, N 3. P. 36-41.
4. Низамов И.С., Большакова О.В., Низамов И.Д., Ямбушев Ф.Д. Фосфорилирование диенильных спиртов // Вест. Казанск. гос. педагог. ун-та. 2005. № 4. С. 172-176.
5. Низамов И.С., Ямбушев Ф.Д. Низамов И.Д., Большакова О.В. Диенильные 1-гидроксифосфонаты // Вест. Казанск. гос. педагог. ун-та. 2005. № 4. С. 176-181.
Тезисы докладов
6. Низамов И.С., Большакова О.В., Низамов И.Д., Батыева Э.С., Миронов В.Ф. Фосформодифицирование низкомолекулярных аналогов полипреноидов // IV Всеросс. науч. конф. “Химия и технология растительных веществ”: Тез. докл. Сыктывкар, 2006. С. 140.
7. Большакова О.В., Низамов И.С., Сергеенко Г.Г., Низамов И.Д., Василенко Г.И., Ямбушев Ф.Д., Батыева Э.С. Фосфорилирование диенильных кислот и спиртов // VI науч. конф. молодых ученых, аспирантов и студентов научно-образовательного центра Казанского госун-та “Материалы и технологии XXI века”: Тез. докл. Казань, 2006. С. 19.
8. Nizamov I.D., Nizamov I.S., Bolshakova O.V., Popovich Ya.E., Sergeenko G.G., Mironov V.F., Yambushev F.D., Batyeva E.S. Higher dienyl alcohols in phosphorylation reactions // XIV Intern. conf. on the chemistry of phosphorus compounds: Book of abstracts. Kazan, Russia, 2005. P103.
9. Nizamov I.S., Bolshakova O.V., Nizamov I.D., Mironov V.F., Batyeva E.S. Phosphorylated low-molecular weight analogues of native polyprenoides // XIV Intern. conf. on the chemistry of phosphorus compounds: Book of abstracts. Kazan, Russia, 2005. OP29.
10. Большакова О.В., Ахметзянова Л.Р., Низамов И.Д., Низамов И.С. Реакции фосфорилирования диенильных спиртов // VIII Молод. науч. школа-конф. по органической химии: Тез. докл. Казань, 2005. С. 103 (С1-60).
11. Ахметзянова Л.Р., Большакова О.В., Низамов И.С., Низамов И.Д. Цитраль в реакциях с фосфорорганическими соединениями // VIII Молод. науч. школа-конф. по органической химии: Тез. докл. Казань, 2005. С. 99 (С1-56).
12. Низамов И.Д., Большакова О.В., Ахметзянова Л.Р., Сергеенко Г.Г., Низамов И.С. Фосформодифицирование низкомолекулярных аналогов 1,5-полиенов // VIII Молод. науч. школа-конф. по органической химии: Тез. докл. Казань, 2005. С. 71 (С1-28).
13. Ахметзянова Л.Р., Низамов И.С., Большакова О.В., Низамов И.Д., Ермолаев Е.С., Попович Я.Е., Миронов В.Ф., Батыева Э.С. Фосфорилированные низкомолекулярные аналоги полипреноидов // Четвертая междунар. конф. молод. ученых “Современные тенденции в органическом синтезе и проблемы химического образования”: Тез. докл. С.-Петербург, 2005. С. 267-268.
14. Низамов И.Д., Большакова О.В., Ахметзянова Л.Р., Хайбуллин Р.Н., Низамов И.С., Миронов В.Ф. Моделирование процессов фосфорилирования полиизопренилальдегидов // V Науч. конф. молодых ученых, аспирантов и студентов научно-образовательного центра Казанского госун-та "Материалы и технологии XXI века": Тез. докл. Казань: Казанский госун-т, 2005. С. 66.
15. Большакова О.В., Низамов И.Д., Попович Я.Е., Хайбуллин Р.Н., Ахметзянова Л.Р., Низамов И.С. Диенильные спирты в реакциях фосфорилирования // V Науч. конф. молодых ученых, аспирантов и студентов научно-образовательного центра Казанского госун-та "Материалы и технологии XXI века": Тез. докл. Казань: Казанский госун-т, 2005. С. 17.
16. Bolshakova O.V., Nizamov I.D., Sergeenko G.G., Nizamov I.S., Batyeva E.S., Alfonsov V.A. Phosphorylation of citral, citronellal and (-)-myrtenal imines // XV-th Intern. conf. on the chemistry of phosphorus compounds: Book of abstracts. Saint-Petersburg, Russia, 2008. P. 117. (P-23).

