Гомогенный катализ окисления соединений фенольного ряда в щелочных водно-этанольных средах
На правах рукописи
Кошелева Анна Евгеньевна
ГОМОГЕННЫЙ КАТАЛИЗ ОКИСЛЕНИЯ
СОЕДИНЕНИЙ ФЕНОЛЬНОГО РЯДА
В ЩЕЛОЧНЫХ ВОДНО-ЭТАНОЛЬНЫХ СРЕДАХ
05.21.03 – технология и оборудование химической переработки
биомассы дерева; химия древесины
02.00.04 – физическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Архангельск
2006
Работа выполнена на кафедре теоретической и прикладной химии
Архангельского государственного технического университета
| Научные руководители: | заслуженный деятель науки РФ, доктор химических наук, профессор Боголицын К.Г. |
| кандидат химических наук, доцент Попова Н.Р. | |
| Официальные оппоненты: | доктор химических наук, профессор Хабаров Ю.Г. доктор химических наук, профессор Новоселов Н.П. |
Ведущая организация: Московский государственный университет, химический факультет
Защита диссертации состоится « 7 » декабря 2006 г. в 13 часов на заседании диссертационного совета Д.212.008.02 в Архангельском государственном техническом университете (163002, г. Архангельск, Набережная Северной Двины, 17)
С диссертацией можно ознакомиться в библиотеке Архангельского государственного технического университета.
Автореферат разослан «31» октября 2006 г.
Ученый секретарь диссертационного
совета, кандидат химических наук, доцент Т.Э. Скребец
Общая характеристика работы
Актуальность темы
В соответствии с современными тенденциями приоритетные технологии должны базироваться на основных принципах «зеленой химии», предусматривающих создание оригинальных безотходных производств, минимально воздействующих на окружающую среду, работающих, в основном, на возобновляемом сырье при максимально комплексном его использовании с применением эффективных селективных гомогенных каталитических систем.
C этой точки зрения актуальной задачей является разработка теоретических основ и создание принципиально новых способов химической переработки растительной биомассы и лигносодержащих материалов, включающих каталитическую окислительную деструкцию лигнина с целью получения органических веществ с заданными потребительскими свойствами, биологический синтез целлюлозы, ферментативную и органосольвентную делигнификации древесины. В качестве среды для проведения таких процессов используют различные протолитические и апротонные растворители, а также их смеси с водой. При этом окислителем является молекулярный кислород, озон, пероксид водорода, катализаторами – органические соединения, неорганические и органические кислоты, ферменты, металлы переменной валентности, их комплексы, причем комплексные соединения металлов переменной валентности считаются наиболее перспективными.
Цель диссертационной работы – установление основных закономерностей гомогенного катализа комплексными соединениями марганца(II) процессов окисления лигнинных соединений фенольного ряда растворенным молекулярным кислородом в щелочных водных и водно-этанольных средах.
Для достижения этой цели необходимо решить следующие задачи:
1.Разработать жидкофазный катализатор процессов окисления соединений фенольного ряда;
2.Исследовать основные закономерности протекания процесса каталитического окисления родственных лигнину фенольных соединений гваяцильного ряда растворенным кислородом в водно-щелочных и этанольно-водно-щелочных средах;
3.Определить оптимальные условия проведения процесса каталитического окисления модельных соединений структурного звена лигнина растворенным кислородом в щелочных водных и водно-этанольных средах;
4.Исследовать процесс каталитического окисления диоксанлигнина кислородом в водно-щелочных и этанольно-водно-щелочных средах.
5.Разработать механизм и кинетическую модель процесса каталитического окисления соединений фенольного ряда растворенным молекулярным кислородом.
Работа выполнена в рамках гранта Министерства промышленности, науки и технологий РФ (Государственный контракт № 43.044.1 1.2626) и гранта поддержки научно-исследовательской работы аспирантов государственных образовательных учреждений высшего профессионального образования, находящихся в ведении Федерального агентства по образованию РФ (Шифр гранта А04-3.21-686).
Научная новизна
Выполнены комплексные физико-химические исследования и установлены основные закономерности процессов каталитического окисления родственных лигнину фенольных соединений гваяцильного ряда и препаратов лигнина в щелочных водных и водно-этанольных средах.
Изучена кинетика, разработаны механизм и кинетическая модель каталитического окисления соединений фенольного ряда в щелочных водно-этанольных средах, экспериментально доказана их адекватность. Установлено, что механизм каталитического окисления носит активационный характер, связанный с образованием промежуточного комплекса металл – фенольное соединение – кислород, в котором реализуется взаимная активация, как окисляемого вещества, так и кислорода.
Обоснована активная форма катализатора, полученная на основе комплексных соединений марганца (II).
Практическая ценность
Разработан и запатентован гомогенный катализатор (Патент на изобретение №2239494) на основе комплексного соединения марганца (II) с хелатообразующими лигандами (предпочтительно ацетилацетон, N-фенил-антраниловая кислота).
Разработана спектрофотометрическая методика оценки каталитической активности комплексных соединений марганца (II) в процессах окисления соединений фенольного ряда.
Определены и обоснованы оптимальные условия каталитического окисления соединений фенольного ряда молекулярным кислородом в щелочных водных и водно-этанольных средах.
На защиту выносятся
- Характеристика основных закономерностей каталитического окисления соединений фенольного ряда молекулярным кислородом в щелочных водных и водно-этанольных средах на основе результатов исследования влияния рН раствора, концентрации окисляемого вещества, окислителя, катализатора, состава растворителя, температуры на кинетику процесса.
- Механизм и кинетическая модель процесса каталитического окисления соединений фенольного ряда молекулярным кислородом в щелочных водно-этанольных средах.
- Обоснование каталитически активной формы комплексного соединения марганца (II).
- Спектрофотометрическая методика оценки каталитической активности комплексных соединений марганца (II) в процессах окисления соединений фенольного ряда.
Апробация работы
Основные положения диссертационной работы докладывались и получили положительную оценку на международных конференциях «12th International Symposium on Wood and Pulping Chemistry» (Madison, Wisconsin USA, 2003 г.); «Ломоносов – 2003» (Москва, 2003 г.); «11th Nordic Symposium on Catalysis» (Оулу, Финляндия, 2004 г.); «Eighth European Workshop on Lignocellulosics and Pulp» (Рига, Латвия, 2004 г.); «Проблемы сольватации и комплексообразования в растворах» (Плес, 2004 г.); «Современная наука и образование в решении проблем экономики Европейского Севера» (Архангельск, 2004 г.); «Физикохимия лигнина» (Архангельск, 2005 г.); «Ninth European Workshop on Lignocellulosics and Pulp» (Вена, Австрия, 2006 г.); на всероссийском симпозиуме «Эффекты среды и комплексообразования в растворах» (Красноярск, 2006 г.), а также на ежегодных научно-технических конференциях Архангельского государственного технического университета.
Публикации По теме диссертации опубликовано 14 работ.
Структура и объем диссертации
Диссертация состоит из введения; обзора литературы; методической части; экспериментальной части, включающей 4 раздела; выводов; списка литературы. Содержание работы изложено на 130 страницах, из них 107 страниц основного текста, включая 32 рисунка, 11 таблиц и 7 схем, библиография содержит 130 наименований.
Краткое содержание работы
В обзоре литературы проанализированы результаты работ по катализу процессов делигнификации (варка, отбелка), окислительных превращений лигнина и лигносодержащих материалов с целью получения целевых продуктов с заданными потребительскими свойствами. Показано, что комплексные соединения металлов переменной валентности обладают большей каталитической активностью, чем ионы металлов.
Рассмотрены механизмы, лежащие в основе процессов каталитического окисления органических веществ. Выявлено, что окислительно-восстановительный катализ в процессах окисления лигносодержащих материалов принципиально может быть реализован по индуцированному, циклическому и активационному механизму.
На основе анализа литературных данных сформулированы цели и задачи исследования.
В методической части диссертационной работы приведена характеристика используемых модельных соединений структурного звена лигнина, а также функциональный состав полученного по методике Пеппера диоксанлигнина ели (Табл. 1); приведена методика синтеза жидкофазных катализаторов окисления.
Таблица 1 – Функциональный состав диоксанлигнина ели
| СООН, % | ОНобщ, %. | ОНфен., % | ОСН3, % | СО, % |
| 0,89 | 2,61 | 1,72 | 15,51 | 7,00 |
Исследование кинетики каталитического окисления фенолсодержащих соединений растворенным кислородом проводилось спектрофотометрическим методом, путем измерения значений оптической плотности во времени относительно растворителя по характеристическим полосам поглощения ионизированных форм ванилина, феруловой кислоты и изоэвгенола (347, 343 и 280 нм соответственно) в течение двух с половиной часов с временным интервалом 10 минут. Измерения проводили в псевдо-условиях по кислороду, концентрация которого в реакционной среде соответствовала растворимости кислорода воздуха (в водной среде –2,58·10-4 моль/л; в водно-этанольной среде (содержание спирта –50 об.%) –3,03·10-4 моль/л) и превышала концентрацию окисляемого вещества в 10 раз.
В качестве кинетических параметров определялись: начальная скорость реакции, псевдо-константа скорости реакции, порядок реакции. При статистической обработке экспериментальных данных рассчитана относительная погрешность результатов исследований, которая составила 4 % для начальной скорости реакции, 5 % для псевдо-константы скорости реакции.
Процесс окисления диоксанлигнина осуществлялся при непрерывной подаче кислорода через анализируемый раствор и контролировался в течение 6 часов с временным интервалом – 2 часа по изменению массовой доли карбоксильных групп в препарате, которую определяли методом кондуктометрического титрования. По данным статистической обработки экспериментальных результатов исследований абсолютная погрешность определения содержания карбоксильных групп не превышала ± 0,10 масс. %.
Экспериментальная часть
- Поиск и характеристика каталитических систем
на основе марганца (II)
Одним из свойств соединения, предполагаемого на роль катализатора процессов химической переработки лигносодержащего сырья, является его способность избирательно воздействать на лигнинную составляющую. Анализ литературных данных показал, что такими селективными свойствами обладают соединения марганца (II).
С целью выявления наиболее эффективной каталитической системы на основе Mn (II) исследовано влияние концентрации и природы лигандов на кинетику процесса окисления модельных соединений структурного звена лигнина – ванилина, изоэвгенола, феруловой кислоты растворенным кислородом в щелочных водной и водно-этанольной (содержание этанола – 50 об. %) средах.
Полученные зависимости имеют экстремальный характер (Рис. 1, 2), при этом природа окисляемого вещества и среда, в которой осуществляется процесс каталитического окисления, не влияют на вид данных зависимостей.
 |  |
| Рисунок 1 – Зависимость псевдо-констан-ты скорости реакции окисления ванилина от концентрации лиганда (L) в водно-этанольно-щелочной среде (содержание спирта – 50 об. %): 1– 1-(2-пиридил-азо)-нафтол-2, 2– изофталевая кислота, 3– 8-оксихинолин, 4– ацетилацетон, 5 –1,10-фенантролин. | Рисунок 2 – Зависимость псевдо-константы скорости реакции окисления фенольных соединений (1 – изоэвгенол, 2,4 – ванилин, 3,5 – феруловая кислота) от концентрации ацетилацетона в водно-щелочной (1,2,3) и этанольно-водно-щелочной (содержание спирта – 50 об.%) (4,5) средах. |
Максимум каталитической активности катализатора наблюдается при соотношении катализатор : лиганд (L) равном 1:1, что соответствует составу каталитически активной формы катализатора – [Mn2+L]. При образовании данного координационно-ненасыщенного комплекса создаются благоприятные условия для вхождения в координационную сферу иона металла молекул окисляемого вещества и кислорода, между которыми в дальнейшем и происходит взаимодействие.
Исследованные лиганды по своей эффективности воздействия на кинетику процесса располагаются в следующий ряд: 1-(2-пиридил-азо)-нафтол-2 < изофталевая кислота щавелевая кислота < 8-оксихинолин ацетилацетон < 1,10-фенантролин < дифенилкарбазон < N-фенилантрани-ловая кислота (Табл. 2).
Таблица 2 Влияние природы органического лиганда в составе
комплекса [Mn2+L] на псевдо-константу скорости реакции окисления ванилина
в этанольно-водно-щелочной (содержание спирта – 50 об. %) среде
| Лиганд | kobs103, мин-1 |
| 1-(2-пиридил-азо)-нафтол-2 | 3,60±0,03 |
| щавелевая кислота | 3,72±0,05 |
| изофталевая кислота | 3,73±0,05 |
| 8-оксихинолин | 3,76±0,04 |
| ацетилацетон | 3,82±0,03 |
| 1,10-фенантролин | 4,05±0,06 |
| дифенилкарбазон | 4,11±0,06 |
| N–фенилантраниловая кислота | 4,20±0,04 |
Различие в их действии заключается в отличительной способности данных органических соединений увеличивать эффективный заряд центрального иона за счет образования координационной связи, что приводит к увеличению электрофильности металла и, в свою очередь, способствует ускорению передачи электрона от окисляемого вещества к молекулярному кислороду, в результате чего скорость реакции возрастает (Схема 1).
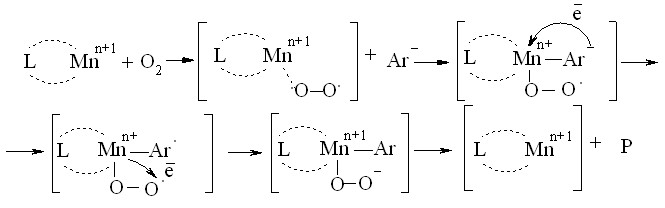
Схема 1–Механизм действия катализатора: L – лиганд, Mnn+ – марганец, Аr– – ионизированная форма окисляемого вещества, Р – продукты реакции окисления.
На основании проведенных исследований разработан и запатентован катализатор окисления (Патент на изобретение № 2239494) на основе комплексного соединения Mn (II) с органическими соединениями (предпочтительно ацетилацетон, N-фенилантраниловая кислота) состава [Mn2+L].
При исследовании каталитической активности комплексных соединений марганца (II) установлена корреляционная зависимость между наблюдаемым в области 970-1020 нм максимумом поглощения (max) в спектрах комплексных ионов [Mn2+L] (Рис. 3), обусловленным d-d-электронным переходом металла-катализатора, и псевдо-константой скорости реакции (Рис. 4):
| (1) |
где а=-2,714, b=-2,816 – параметры, зависящие от химической природы лиганда.
 |  |
| I | II |
 |  |
| III | IV |
Рисунок 3 – Спектр комплексов марганца (II) с органическими лигандами: I– с сульфосалициловой кислотой; II– с изофталевой кислотой; III– с ацетилацетоном; IV– с N–фенилантраниловой кислотой: 1– спектр комплекса (с =510-2 моль/л), 2– спектр органического лиганда (с=510-2 моль/л), 3– спектр MnCl2 (с=510-2 моль/л).
Полученная зависимость может быть использована для предварительной оценки каталитической активности комплексных соединений марганца (II) с органическими лигандами в процессах окисления соединений фенольного ряда.
2. Изучение кинетики каталитического окисления родственных лигнину фенольных соединений гваяцильного ряда растворенным кислородом
С целью определения оптимальных условий проведения каталитического процесса; установления основных закономерностей превращений лигнинных веществ в процессе гомогенного каталитического окисления; разработки кинетической модели процесса окисления исследовано влияние рН раствора, концентрации катализатора, окисляемого вещества, окислителя, состава растворителя (концентрации этанола), температуры на кинетику процесса окисления модельных соединений структурного звена лигнина растворенным кислородом в щелочных водной и в водно-этанольной средах.
В качестве объектов исследований использованы ванилин, феруловая кислота и изоэвгенол, моделирующие структурные фрагменты хвойных лигнинов, содержащие различные заместители в пара-положении к фенольному гидроксилу:
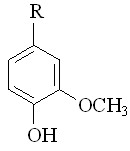 | где R – СОН – ванилин; – СН=СН–СООН – феруловая кислота; –СН =СН-СН3 – изоэвгенол |
Катализаторами процесса служили хлорид марганца (II) и полученное на его основе комплексное соединение марганца с ацетилацетоном – [Mn2+Acac].
Результаты исследования влияния рН среды показали, что максимальная скорость реакции достигается при рН раствора близком значению рKа+1, (Ka– константа ионизации окисляемого вещества), что соответствует образованию 99% ионизированной формы фенольного соединения, которая в основном и подвергается окислению (Рис. 5, 6, табл. 3).
В случае присутствия катализатора дальнейшее увеличение рН раствора приводит к избыточному содержанию ОН––ионов, которые в свою очередь взаимодействуют с катализатором с образованием гидроксокомплексов, при этом доля каталитически активной формы катализатора в растворе снижается, что приводит к уменьшению скорости реакции (Рис. 6). Введение органической составляющей в растворитель не влияет на вид зависимостей начальной скорости реакции от рН раствора.
 |  |
| Рисунок 5 – Зависимость начальной скорости реакции окисления ванилина (А), феруловой кислоты (Б) и изоэвгенола (В) от рН раствора в отсутствие катализатора в водно-щелочной среде при cок.в.=5·10-5моль/л, cкат.= 5·10-6моль/л, I = 0,01 моль/л, Т=298 К. | Рисунок 6 – Зависимость начальной скорости реакции окисления ванилина (А), феруловой кислоты (Б) и изоэвгенола (В) от рН раствора в водно-щелочной среде при cок.в.=5·10-5 моль/л, I=0,01моль/л, Т=298 К в присутствии катализатора: 1– MnCl2, 2– [Mn2+Acac], cкат.= 5·10-6 моль/л. |
Таблица 3 – Начальная скорость окисления фенольных соединений
молекулярным кислородом при оптимальных значениях рН раствора.
| Соединение | рKa* | рНопт. | v010 9, мольл-1 с-1 | ||
| В отсутствие катализатора | В присутствии катализатора MnCl2 | В присутствии катализатора [Mn2+Acac] | |||
| Водно-щелочная среда | |||||
| Ванилин | 7,38±0,05 | 8,5 | 1,47±0,10 | 1,81±0,08 | 2,10±0,11 |
| Феруловая кислота | 9,31±0,16 | 10,3 | 1,59±0,05 | – | 2,63±0,13 |
| Изоэвгенол | 9,81±0,08 | 10,5 | 0,99±0,11 | 1,76±0,12 | 1,91±0,09 |
| Этанольно-водно-щелочная среда (содержание спирта – 50 об. %) | |||||
| Ванилин | 8,50 | 9,5 | 1,91±0,19 | 2,50±0,08 | 2,95±0,11 |
| Феруловая кислота | 10,20 | 11,5 | 2,40±0,05 | – | 3,49±0,15 |
Условия исследований: сок.в.=5·10-5 моль/л, скат.=5·10-6 моль/л, I=0,01 моль/л, Т=298 K. Примечание: *- рKa фенольных соединений приведены согласно литературным данным /Ермакова М.И., Кирюшина М.Ф., Зарубин М.Я.//Химия древесины.-1984.-№5.-С. 23-29, Мелькис А.А., Закис Г.Ф., Мекша М.В. // Химия древесины.-1983.-№ 1.-С. 106-112/
На основе полученных результатов исследования влияния концентрации катализатора на процесс окисления фенолсодержащих соединений в
водно-щелочной и этанольно-водно-щелочной (содержание спирта – 50 об. %) средах (Рис. 7, 8) определена оптимальная его концентрация, которая соответствует 10 масс. % от концентрации окисляемого вещества.
Для определения порядка реакции по окисляемому веществу был использован метод начальных скоростей Вант-Гоффа. Параметры полученных линейных зависимостей lgv0 = nlgcок.в+a (где n порядок реакции) и соответствующие коэффициенты корреляции представлены в таблице 4. Параметр n указывает на первый порядок по окисляемому веществу.
Определение порядка реакции по окислителю осуществляли графическим методом. Лучшая корреляционная зависимость экспериментальных данных была найдена для зависимости ![]() , как в отсутствии катализатора (R2=0,997), так и в его присутствии (R2=0,998), что указывает на первый порядок по окислителю.
, как в отсутствии катализатора (R2=0,997), так и в его присутствии (R2=0,998), что указывает на первый порядок по окислителю.
 |  |
| Рисунок 7– Зависимость начальной скорости реакции окисления фенольных соединений от концентрации MnCl2 (1,3) и [Mn2+Acac] (2,4,5) в водно-щелочной среде при cок.в.=5·10-5 моль/л, I =0,01 моль/л, Т = 298 К: 1,2– изоэвгенол (рН 10,5); 3,4– ванилин (рН 8,5); 5– феруловая кислота (рН 10,3). | Рисунок 8– Зависимость начальной скорости реакции окисления фенольных соединений от концентрации MnCl2 (1) и [Mn2+Acac] (2,3) в этанольно-водно-щелочной среде (содержание спирта–50 об.%) при I=0,01моль/л, cок.в. = 5·10-5 моль/л, Т = 298 К: 1,2– ванилин (рН 9,5);3– феруловая кислота (рН 11,5). |
Таблица 4 – Параметры зависимости lgv0 =f(lgcок.в) и значения коэффициентов корреляции (R2) при окислении фенольных соединений молекулярным кислородом
| Соединение | В отсутствие катализатора | В присутствии катализатора MnCl2 | В присутствии катализатора [Mn2+Acac] | ||||||
| n | a | R2 | n | a | R2 | n | a | R2 | |
| Водно-щелочная среда | |||||||||
| Ванилин | 0,70 | -5,78 | 0,990 | 0,77 | -5,41 | 0,990 | 0,71 | -5,62 | 0,997 |
| Феруловая кислота | 0,82 | -5,32 | 0,990 | 0,82 | -5,30 | 0,994 | 0,78 | -5,35 | 0,990 |
| Изоэвгенол | 1,07 | -4,44 | 0,991 | 0,94 | -4,75 | 0,997 | 0,82 | -5,22 | 0,996 |
| Этанольно-водно-щелочная среда (содержание спирта – 50 об. %) | |||||||||
| Ванилин | 1,10 | -4,05 | 0,996 | 1,02 | -4,24 | 0,998 | 0,92 | -4,61 | 0,997 |
| Феруловая кислота | 0,98 | -4,45 | 0,992 | 0,89 | -4,64 | 0,991 | |||
Условия исследований: скат.=5·10-6 моль/л, рН=рНопт.(Табл. 1), I=0,01 моль/л, Т=298 K.
При исследовании влияния состава растворителя (Рис. 9) установлено, что введение органической составляющей в растворитель увеличивает скорость реакции окисления, что обусловлено воздействием эффектов сольватации на реакционную способность окисляемого вещества.
Варьирование температуры в интервале 288…303 K позволило определить термодинамические параметры процесса (Табл. 5), которые показали, что введение в систему катализатора [Mn2+Acac] снижает энергию активации процесса.
Таблица 5 – Значения Еа (кДж/моль) и S (Дж/(мольK)) для реакции окисления
фенолсодержащих соединений в водно-щелочной среде.
| Соединение | В отсутствие катализатора | В присутствии катализатора MnCl2 | В присутствии катализатора [Mn2+Acac] | |||
| Еа | S | Еа | S | Еа | S | |
| Ванилин (рН 8,5) | 25,8±1,1 | -569±10 | 19,8±0,9 | -587±5 | 17,6±1,3 | -593±9 |
| Феруловая кислота (рН 10,3) | 24,8±1,5 | -571±11 | – | – | 16,3±1,9 | -596±10 |
| Изоэвгенол (рН 10,5) | 27,0±1,2 | -565±9 | 20,8±1,3 | -583±7 | 19,3±1,2 | -588±4 |
Условия исследований:сок.в.=510-5моль/л;скат.=510-6моль/л,рН=рНопт.(Табл.1),I=0,01моль/л.
- Исследование каталитического окисления диоксанлигнина
растворенным кислородом
Лигнин представляет собой композиционно неоднородный полифункциональный полимер, отличительное свойство которого – хорошо выраженная способность к окислению. В зависимости от условий проведения реакции окисление может приводить к деструкции макромолекулы лигнина до низкомолекулярных продуктов, к окислению отдельных функциональных групп, к конденсации образующихся продуктов. Простой механический перенос результатов, полученных при изучении модельных соединений, на лигнины (как технические, так и нативные) всегда сопряжен со значительными упущениями, связанными с многофункциональностью макромолекулы лигнина, ее структурными и конформационными особенностями. В связи с этим с целью проверки соблюдения при окислении лигнина закономерностей, установленных для ряда модельных соединений его структурного звена исследовано влияние рН раствора, концентрации катализатора, состава растворителя, температуры на процесс окисления диоксанлигнина ели растворенным кислородом в присутствии комплекса [Mn2+Acac] в качестве катализатора.
При исследовании влияния рН раствора на процесс каталитического окисления диоксанлигнина установлено оптимальное значение рН раствора, равное 12,0, что соответствует величине рKa+1 (рKa диоксанлигнина ели составляет 10,9) и согласуется с определением оптимального значения рН при окислении фенолсодержащих соединений. Сравнение результатов эксперимента, проведенного в отсутствие и в присутствии катализатора (Рис. 10), указывает на то, что введение в реакционную среду [Mn2+Acac] интенсифицирует процессы окисления на 62 % по истечении шести часов от начала эксперимента.
Экспериментальные данные исследования влияния температуры показали, что с ростом температуры увеличивается содержание массовой доли карбоксильных групп в лигнине (Рис. 11). Анализ результатов эксперимента, проведенного при температуре 353 K (Рис. 12) показал, что введение в раствор ацетилацетонатного комплекса марганца (II) интенсифицирует процесс окисления лигнина на 50 % по истечении шести часов от начала эксперимента.
 Рисунок 11 – Зависимость приращения массовой доли карбоксильных групп в лигнине в присутствии [Mn2+Acac]–катализатора от времени при сДЛ=1 г/л, скат=10-4моль/л, рН 12,0 при температуре: 1– 298 K; 2– 328 K; 3– 343 K; 4– 353 K. Рисунок 11 – Зависимость приращения массовой доли карбоксильных групп в лигнине в присутствии [Mn2+Acac]–катализатора от времени при сДЛ=1 г/л, скат=10-4моль/л, рН 12,0 при температуре: 1– 298 K; 2– 328 K; 3– 343 K; 4– 353 K. |  Рисунок 12 – Зависимость приращения массовой доли карбоксильных групп в лигнине от времени при сДЛ=1г/л рН 12, Т=353 K:1–в отсутствие катализатора; 2– в присутствии [Mn2+Acac]–катализатора, скат=10-4моль/л. Рисунок 12 – Зависимость приращения массовой доли карбоксильных групп в лигнине от времени при сДЛ=1г/л рН 12, Т=353 K:1–в отсутствие катализатора; 2– в присутствии [Mn2+Acac]–катализатора, скат=10-4моль/л. | |
 |  | |
| Рисунок 13– Зависимость приращения массовой доли карбоксильных групп в лигнине от концентрации катализатора при сДЛ=1г/л, рН 12, Т=298 K через три часа от начала эксперимента. | Рисунок 14– Зависимость приращения массовой доли карбоксильных групп в лигнине от концентрации этанола при сДЛ=1 г/л, рН 12,5, Т=353 K через шесть часов от начала эксперимента:1– в отсутствие катализатора; 2– в присутствии катализатора [Mn2+Acac],скат = 2·10-4 моль/л. | |
В результате исследования влияния концентрации катализатора определена оптимальная его концентрация – 210-4 моль/л, что соответствует 4 масс.% от навески лигнина (Рис. 13).
Исследование влияния состава растворителя на процесс каталитического окисления диоксанлигнина (Рис. 14) указывает на то, что при концентрации спирта 50 об. % наблюдается наибольшее содержание карбоксильных групп, причем введение [Mn2+Acac]-комплекса в реакционную среду интенсифицирует процесс окисления на 100 % по истечении шести часов от начала эксперимента.
На основании приведенных выше экспериментов, можно сделать вывод о том, что при исследовании процесса каталитического окисления нативных препаратов лигнина можно использовать те же подходы, что и при изучении процесса окисления модельных соединений структурного звена лигнина. Использованный [Mn2+Acac] – катализатор проявляет каталитическую активность, как при окислении модельных соединений структурного звена лигнина, так и при окислении диоксанлигнина. Анализ литературных данных и полученные экспериментальные данные позволяют предположить, что механизм каталитического окисления, при этом носит активационный характер, связанный с образованием промежуточного комплекса металл-фенольное соединение-кислород, в котором реализуются взаимная активация, как окисляемого вещества, так и кислорода.
4 Разработка кинетической модели механизма каталитического окисления соединений фенольного ряда растворенным кислородом
Проведенные исследования свидетельствуют о тождественности основных закономерностей и факторов, влияющих на процесс каталитического окисления соединений фенольного ряда и диоксанлигнина, вследствие этого разработана единая кинетическая модель механизма гомогенного каталитического окисления фенольных структур лигнина.
При окислении фенольных соединений растворенным кислородом в отсутствие катализатора полученные экспериментальные данные позволяют представить процесс в виде следующей кинетической схемы:
| Kа АrН | (2) (3) |
где P1 – продукты окисления.
Применяя к реакции (2) метод квазиравновесных концентраций, получаем следующее выражение для скорости реакции:
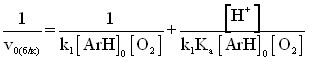 , , | (4) |
где v0(б/к) – начальная скорость реакции окисления фенольных соединений кислородом без катализатора;
Kа – константа равновесия реакции (2);
k1 – константа скорости реакции (3);
[ArH]0 – общая исходная концентрация окисляемого вещества;
[O2] – начальная концентрация кислорода в растворе.
[H+] – начальная концентрация ионов водорода в растворе.
С целью определения значений констант ионизации Kа и скорости реакции окисления k1 с помощью программы Curve Expert 1.3 построены линейные зависимости 1/v0=f([H+]) и определены параметры уравнения, которые позволили рассчитать константы Kа и k1.
Расчетные значения констант ионизации совпадают со значениями Ka, приведенными в литературе и определенными независимыми методами (потенциометрическое, кондуктометрическое, спектрофотометрическое титрование) (Табл. 6). Это является дополнительным подтверждением адекватности кинетической схемы (2)–(3).
Таблица 6 – Значения констант ионизации фенольных соединений Кa и скорости
реакции окисления k1 фенолсодержащих соединений в отсутствии катализатора.
| Соединение | k1, М-1с-1 | Kа109 | pKа | |
| I | II | |||
| Водно-щелочная среда | ||||
| Ванилин | 0,11 | 24,00±0,12 | 7,61 ±0,01 | 7,38±0,05 |
| Феруловая кислота | 0,13 | 0,80±0,04 | 9,10±0,02 | 9,31±0,16 |
| Изоэвгенол | 0,09 | 0,30±0,02 | 9,52±0,03 | 9,81±0,08 |
| Этанольно-водно-щелочная среда (содержание спирта – 50 об. %) | ||||
| Ванилин | 0,10 | 2,14±0,11 | 8,67±0,02 | 8,50 |
| Феруловая кислота | 0,16 | 0,04±0,01 | 10,40±0,09 | 10,20 |
Примечание: I – рассчитанное по экспериментальным данным значение рKа; II – значение рKа согласно литературным данным /Ермакова М.И., Кирюшина М.Ф., Зарубин М.Я.//Химия древесины.-1984.-№5.-С. 23-29, Мелькис А.А., Закис Г.Ф., Мекша М.В. // Химия древесины.-1983.- № 1.- С. 106-112/
В случае окисления фенольных соединений растворенным кислородом в присутствии катализатора было установлено, что основную роль в каталитическом цикле играет ион металла (Mn2+), роль органического лиганда (L) сводится к увеличению активности катализатора и не отражается
на кинетической схеме процесса. Поэтому кинетическая схема в данном случае состоит из уравнений (2)(3) и уравнений, следующего вида:
| KI Mn2+ + O2 | (5) (6) (7) (8) (9) (10) (11) (12) |
где Р2, P3, P4 – продукты окисления.
Применяя метод квазистационарных концентраций и предполагая, что [Mn2+]0<<[Ar]0; KI[O2]<<1; KIV·KIII·KII[OH-]2[Ar-]<<1; KV·KII[OH–][Ar–]<<1 получим следующее уравнение для скорости реакции:
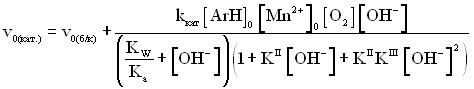 , , | (13) |
где v0(кат) – начальная скорость реакции в присутствии катализатора;
KW –константа ионизации воды, KW =10-14;
KII–константа равновесия реакции (7);
KIII – константа равновесия реакции (8);
| kкат = k/кат + k//кат [OH-] + k///кат[OH-]2, где k/кат = k2KI k//кат = k4KVKII k///кат = k3KIVKIIIKII | (14) |
С целью проверки адекватности модели проведена обработка экспериментальных данных в области оптимальных значений рН раствора (рKa …рKa+1), в результате чего получена зависимость (15) и рассчитано значение константы k/кат (Табл. 7).
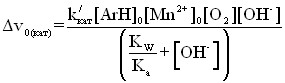 , , | (15) |
где v0(кат)= v0(кат)– v0(б/к)
Таблица 7 – Значения константы k/кат, полученные расчетным методом.
| Модель | k/кат·10-3 | ||||
| В присутствии MnCl2 | В присутствии [Mn2+Acac] | ||||
| Водно-щелочная среда | |||||
| Ванилин | 5,44 | 14,50 | |||
| Феруловая кислота | – | 18,90 | |||
| Изоэвгенол | 10,60 | 11,20 | |||
| Этанольно-водно-щелочная среда (содержание спирта – 50 % об.) | |||||
| Ванилин | 8,25 | 15,70 | |||
| Феруловая кислота | – | 26,70 | |||
 | |||||
| I | II | ||||
| Рисунок 14 – Зависимость v0(кат) от концентрации OH–-ионов при окислении ванилина в присутствии MnCl2 в водно-щелочной среде (I), и в этанольно-водно-щелочной среде (содержание спирта – 50 об.%) (II): 1 – кривая, полученная расчетным методом; 2 – кривая, полученная по экспериментальным данным. | |||||
 |  | ||||
| I | II | ||||
| Рисунок 15 – Зависимость v0(кат) от концентрации OH–-ионов при окислении ванилина в присутствии [Mn2+Асас]–катализатора в водно-щелочной среде (I) и в этанольно-водно-щелочной среде (содержание спирта – 50 об. %) (II): 1– кривая, полученная расчетным методом; 2 – кривая, полученная по экспериментальным данным. | |||||
Сопоставление зависимостей v0(кат)=f([OH-]), полученных по экспериментальным и расчетным данным (Рис. 14, 15) указывает на адекватность предложенной кинетической схемы.
Выводы
- Выполнены комплексные физико-химические исследования и установлены основные закономерности процессов каталитического окисления родственных лигнину фенольных соединений гваяцильного ряда и препаратов лигнина в щелочных водных и водно-этанольных средах и определены оптимальные условия проведения процесса: рН раствора соответствует pKa+1, концентрация катализатора составляет до 10 % от концентрации окисляемого вещества.
- Изучена кинетика, разработаны механизм и кинетическая модель процесса каталитического окисления соединений фенольного ряда в щелочных водно-этанольных средах. Установлено, что механизм каталитического окисления носит активационный характер, связанный с образованием промежуточного комплекса металл – фенольное соединение – кислород, в котором реализуется взаимная активация, как окисляемого вещества, так и кислорода.
- Исследован процесс каталитического окисления диоксанлигнина и экспериментально показано соблюдение основных закономерностей, установленных для каталитического окисления ряда модельных соединений.
- Разработана спектрофотометрическая методика и получено уравнение вида: ln kobs= b – a/max для оценки каталитической активности комплексных соединений марганца (II) в процессах окисления соединений фенольного ряда.
- Разработан, обоснован и запатентован гомогенный катализатор окисления соединений фенольного ряда (Патент на изобретение №2239494) на основе комплексного соединения марганца (II) с органическими соединениями (предпочтительно ацетилацетон, N-фенилантрани-ловая кислота).
Список публикаций по теме диссертации
- Боголицын, К.Г. Делигнификация древесины, катализируемая соединениями металлов переменной валентности [Текст] / К.Г. Боголицын, Н.Р. Попова, Т.Э. Скребец, А.Е. Кошелева // Лесной журнал.–2002.– № 6.– C. 67-84.– (Изв. высш. учеб. заведений).– ISSN 0536–1036.
- Popova, N. The Catalytic Oxidation of the Lignin Model Compounds [Text] / N. Popova, K. Bogolitsyn, A. Kosheleva, E. Shulgina // 12th International Symposium on Wood and Pulping Chemistry.– Proceedings.– Madison.–Wisconsin USA.– 2003 г.– P. 47-48.
- Кошелева, А.Е. Кинетика и механизм каталитического окисления ванилина в водно-щелочных растворах [Текст] / А.Е. Кошелева // Ломоносов–2003: материалы Международной конференции студентов и аспирантов по фундаментальным наукам.– Москва: Изд-во МГУ.– 2003 г.– Т. 2.– С. 280.– ISBN 5–261–00043–6.
- Кошелева, А.Е. Гомогенный катализ окислительных превращений ванилина в водно-щелочной среде [Текст] / А.Е. Кошелева // Охрана окружающей среды и рациональное использование природных ресурсов: сборник научных трудов.– Архангельск: Изд-во АГТУ.– Выпуск IX.–2004.– С. 131-135.– ISBN 5–261–00067–X.
- Kosheleva, A. Activation cataiytic oxidation of vanillin in water-ethanol medium [Text] / A. Kosheleva, K. Bogolitsyn, N. Popova, E. Kotlova // 11th Nordic Symposium on Catalysis.– Proceedings.– Oulu.– Finland.–2004.– P. 129-130.– ISBN 951–9223–47–9.
- Bogolitsyn, K. The Oxidation of Lignin Model Compounds in Homogeneous Catalysis [Text] / K. Bogolitsyn, A. Kosheleva, N. Popova // Eighth European Workshop on Lignocellulosics and Pulp.– Proceedings.– Riga.– Latvia.– 2004.– P. 313-316.– ISBN 9984–19–611–9.
- Кошелева, А.Е. Влияние состава растворителя на каталитическое окисление фенолсодержащих соединений [Текст] / А.Е. Кошелева, К.Г. Боголицын, Н.Р. Попова, А.В. Антрушин // Проблемы сольватации и комплексообразования в растворах: IX Международная конференция: тезисы докладов.– Плес: Изд-во ИХР РАН.– 2004 г.– С. 92.ISBN 5–201–10436–3.
- Кошелева, А.Е. Гомогенный катализ процессов окисления модельных соединений лигнина в водно-щелочной этанольной среде [Текст] / А.Е. Кошелева, К.Г. Боголицын, Н.Р. Попова // Современная наука и образование в решении проблем экономики Европейского Севера: материалы Международной научно-технической конференции, посвященной 75-летию АЛТИ-АГТУ.– Архангельск: Изд-во АГТУ.– 2004.– С. 233–235.– ISBN 5–261–00167–6:100:00р ГРНТИ 14.35.
- Пат. 2239494 Российская Федерация, МПК7 С 07 С 37/58, С 02 F 1/72. Катализатор окисления соединений фенольного ряда/ Боголицын К.Г., Попова Н.Р., Скребец Т.Э., Кошелева А.Е.; заявитель и патентообладатель Архан. гос. техн. ун-т.- № 2003117507; заявл. 17.06.04; опубл. 10.11.04, Бюл. № 31- 6 с.
- Боголицын, К.Г. Гомогенное каталитическое окисление ванилина в этанольно-водно-щелочных средах [Текст] / К.Г. Боголицын, Н.Р. Попова, А.Н. Пряхин, В.В. Лунин, А.Е. Кошелева // Журнал физической химии.– Том 79.– № 3.–2005.–С. 469-474.– ISSN 0044–4537.
- Кошелева, А.Е. Термодинамика каталитического окисления соединений фенольного ряда [Текст] / А.Е. Кошелева, К.Г. Боголицын, Н.Р. Попова, И.А. Шестакова // Физикохимия лигнина: материалы Международной конференции.– Архангельск: Изд-во АГТУ.– 2005.– С.209-212. ISBN 5–261–00121–6.
- Кошелева, А.Е. Металлокатализ процессов окисления соединений фенольного ряда в водно-этанольных средах [Текст] / А.Е. Кошелева, Н.Р. Попова, К.Г. Боголицын, И.А. Шестакова // Наука – Северному региону: Сборник научных трудов.– Вып. 62.– Архангельск: Изд-во АГТУ.–2005.– С. 109-111.
- Bogolitsyn, K. Homogeneous Catalytic Oxidation of Lignin Model Compounds in Water-Ethanol Medium [Text] / K. Bogolitsyn, A. Kosheleva, N. Popova // Ninth European Workshop on Lignocellulosics and Pulp.–Proceedings.–Vena.– Austria.– 2006.– P. 178-180.
- Боголицын, К.Г. Исследование механизма каталитического окисления фенолов в присутствии комплексных соединений марганца (II) [Текст] / К.Г. Боголицын, А.Е. Кошелева, Н.Р. Попова, А.В. Котлова // Эффекты среды и комплексообразования в растворах: Всероссийский Симпозиум: тезисы докладов.– Красноярск: Изд-во Сиб. ГТУ.– 2006.– С.144-145.
Отзывы на автореферат в 2-х экземплярах с заверенными гербовой печатью подписями просим направлять по адресу:
163002, г. Архангельск, Набережная Северной Двины, 17, АГТУ, диссертационный совет Д.212.008.02.

