Взаимодействие метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1 н -пиррол-2-карбоксилатов c сн,nн-бинуклеофильными реагентами
На правах рукописи
Банникова Юлия Николаевна
ВЗАИМОДЕЙСТВИЕ МЕТИЛ 1-АРИЛ-3-АРОИЛ-4,5-ДИОКСО-4,5-ДИГИДРО-1Н-ПИРРОЛ-2-КАРБОКСИЛАТОВ C СН,NН-БИНУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
Специальность 02.00.03 – Органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Пермь – 2006
Работа выполнена на кафедре органической химии Пермского государственного университета.
| Научный руководитель: | доктор химических наук, профессор Масливец Андрей Николаевич |
| Официальные оппоненты: | доктор химических наук, профессор Залесов Владимир Васильевич кандидат химических наук, доцент Пименова Елена Валентиновна |
| Ведущая организация: | Уральский государственный технический университет (УГТУ – УПИ, г. Екатеринбург) |
Защита состоится «15» ноября 2006 г. в 1515 часов на заседании диссертационного совета Д 212.189.04 в Пермском государственном университете по адресу: 614990, г. Пермь, ГСП, ул. Букирева, 15, ПермГУ, в зале заседаний Ученого совета.
С диссертацией можно ознакомиться в библиотеке Пермского государственного университета.
Автореферат разослан « » октября 2006 г.
| Ученый секретарь диссертационного совета | И.В. Петухов |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Одним из важнейших направлений развития современной органической химии является изучение химических свойств различных карбонильных производных гетероциклов, на основе которых возможно получение новых классов гетероциклических соединений. Моноциклические 1Н-пиррол-2,3-дионы, в особенности содержащие различные функциональные группы в нескольких положениях пирролдионового цикла, проявляют уникальные свойства в этом отношении и представляют собой интересные объекты исследования.
Метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилаты являются полифункциональными соединениями, содержащими несколько карбонильных групп в гетероядре и в заместителях, что наряду с напряженностью неароматичного пирролдионового цикла придает им высокую реакционную способность, в особенности по отношению к нуклеофильным реагентам. В результате нуклеофильных превращений метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов, а именно их реакций с ОН- и NH-мононуклеофильными реагентами и NH,NH-, NH,OH-, NH,SH-бинуклеофильными реагентами получены карбонильные производные пяти-, шести-, семичленных азагетероциклов и конденсированных гетероциклических систем, в том числе обладающих полезными свойствами.
Представлялось перспективным исследовать реакции метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с 1,3- и 1,4-СН,NH-бинуклеофильными реагентами – енаминами и енгидразинами циклической и ациклической структуры, в том числе включающими фрагмент гетероцикла, направление первоначального присоединения и последующих гетероциклизаций.
Цель работы. Исследование взаимодействия метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с новыми классами бинуклеофильных реагентов – 1,3- и 1,4-СН,NН-бинуклеофилами – ациклическими, циклическими и гетероциклическими енаминами, енаминокетонами, енаминоэфирами и енгидразинами.
Научная новизна. Впервые изучены нуклеофильные превращения метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов под действием 1,3- и 1,4-СН,NН-бинуклеофильных реагентов {N-незамещенных, N-алкил и N-арил 3-амино-5,5-диметилциклогекс-2-ен-1-онов, 1,2-ди(5,5-диметил-3-оксоциклогекс-1-енамино)этана, 3-анилино-1Н-инден-1-онов, 4-анилинопент-3-ен-2-онов, 3-анилино-1,3-дифенилпроп-2-ен-1-онов, этил 3-анилинобут-2-еноатов, 3-[2-(диарилметилен)гидразино]-5,5-диметилциклогекс-2-ен-1-онов, 3-(2-ацилгидразино)-5,5-диметилциклогекс-2-ен-1-онов, замещенных 1-метил-3,4-дигидроизохинолинов, 2,2,4-триметил-1,2-дигидробензо[f]изохинолина, 6-амино-1,3-диметилпиримидин-2,4(1Н,3Н)-диона, 3-анилино-1,5-диарил-1,5-дигидро-2Н-пиррол-2-онов}.
Установлено, что взаимодействие метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с различными СН,NН-бинуклеофилами приводит к образованию оксопроизводных гетероциклических спиро-систем индол-3-спиро-2'-пиррола, индено[1,2-b]пиррол-3-спиро-2'-пиррола, индол-3-спиро-2'-фурана, пиррол-2-спиро-3'-пиррола, пирроло[2,1-а]изохинолин-2-спиро-2'-пиррола, бензо[f]пирроло[2,1-a]изохинолин-9-спиро-2'-пиррола, пирроло[2,3-d]пиримидин-5-спиро-2'-пиррола, мостиковых гетероциклических систем 8,11-диазатрицикло[7.2.1.02,7]додек-2(7)-ена, 4,6,8,11-тетраазатрицикло[7.2.1.02,7]додек-2(7)-ена, системы 2-(1Н-пиррол-3-ил)-2,5-дигидро-1Н-пиррола.
Практическая ценность. Разработаны препаративные методы синтеза неописанных ранее оксопроизводных замещенных 2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2'-(2,5-дигидро-1Н-пирролов), 1,2-бис(2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2'-(2,5-дигидро-1Н-пиррол-1-ил)этанов, 1,2,3,4-тетрагидроиндено[1,2-b]пиррол-3-спиро-2'-(2,5-дигидро-1Н-пирролов), метил 8,11-диазатрицикло[7.2.1.02,7]додек-2(7)-ен-1-карбоксилатов, 2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2'-(2,5-дигидрофуранов), 2,5-дигидро-1Н-пиррол-2-спиро-3'-(2,5-дигидро-1Н-пирролов), этил 2,5-дигидро-1Н-пиррол-2-спиро-3'-(2,5-дигидро-1Н-пиррол-4-карбоксилатов), 2,3,5,6-тетрагидропирроло[2,1-а]изохинолин-2-спиро-2'-(2,5-дигидро-1Н-пирролов), 5,6,8,9-тетрагидробензо[f]пирроло[2,1-a]изохинолин-9-спиро-2'-(2,5-дигидро-1Н-пирролов), метил 4,6,8,11-тетраазатрицикло[7.2.1.02,7]додек-2(7)-ен-1-карбоксилатов, 2,3,4,5,6,7-гексагидро-1Н-пирроло[2,3-d]пиримидин-5-спиро-2'-(2,5-дигидро-1Н-пирролов), метил 2-(2,5-дигидро-1Н-пиррол-3-ил)-2,5-дигидро-1Н-пиррол-2-карбоксилатов.
Предлагаемые методы просты по выполнению, позволяют получать соединения с заданной комбинацией заместителей и могут быть использованы как препаративные в синтетической органической химии.
Публикации. По материалам диссертации опубликовано 5 статей в центральной печати, 2 патента РФ, 5 тезисов докладов конференций и статей в сборниках научных трудов.
Апробация. Результаты работы доложены на Областной научной конференции молодых ученых, студентов и аспирантов «Молодежная наука Прикамья» (Пермь 2002), на Отчетной научной конференции студентов и аспирантов Пермского государственного университета (Пермь 2003), на VII и VIII Молодежной научной школе-конференции по органической химии (Екатеринбург 2004, Казань 2005), на 5-й Международной конференции молодых ученых и студентов (Самара 2004), на IV Международной конференции молодых ученых по органической химии «Современные тенденции в органическом синтезе и проблемы химического образования» (Санкт-Петербург 2005), на Международной конференции по химии гетероциклических соединений (Москва 2005), на Всероссийской конференции «Техническая химия. Достижения и перспективы» (Пермь 2006).
Структура и объем диссертации. Диссертационная работа общим числом 132 страниц машинописного текста состоит из введения, обзора литературы, обсуждения результатов собственных исследований, экспериментальной части, приложения и выводов, содержит 4 рисунка, 1 таблицу. Список литературы включает 105 наименований работ отечественных и зарубежных авторов.
Благодарность. Автор выражает глубокую благодарность Алиеву Зайнутдину Гасановичу за проведение рентгеноструктурных исследований (Институт проблем химической физики РАН, г. Черноголовка Московской обл.), Кодессу Михаилу Исааковичу за проведение исследований спектроскопии ЯМР (Институт органического синтеза, ЦКП «Урал-ЯМР», г. Екатеринбург).
Работа выполнена при финансовой поддержке РФФИ (проекты № № 04-03-96033, 04-03-33024) и Федерального агентства по образованию (А 04-2.11-491).
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
В первой главе приводятся литературные данные по взаимодействию моноциклических 1Н-пиррол-2,3-дионов с различными моно- и бинуклеофилами, на основании которых сделан выбор объекта исследований.
Во второй главе описаны результаты проведенных исследований.
2.1. Получение метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов
При взаимодействии метиловых эфиров 4-арил-2-ариламино-4-оксо-2-бутеновых кислот (1а-ж), полученных реакцией метиловых эфиров ароилпировиноградных кислот с замещенными анилинами, с оксалилхлоридом получены метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилаты (2а-ж).

1, 2: Ar1 = Ar2 = Ph (а), Ar1 = Ph, Ar2 = C6H4Me-4 (б), Ar1 = Ph, Ar2 = C6H4Cl-4 (в), Ar1 = C6H4NO2-4, Ar2 = Ph (г), Ar1 = C6H4OEt-4, Ar2 = C6H4Me-4 (д), Ar1 = C6H4Cl-4, Ar2 = C6H4Me-4 (е), Ar1 = C6H4Br-4, Ar2 = C6H4Me-4 (ж).
2.2. Взаимодействие метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с СН,NН-бинуклеофилами
2.2.1. Взаимодействие метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с циклическими енаминокетонами
N-Замещенные имины димедона, существующие в енаминокетонной форме, а именно в форме N-замещенных 3-амино-5,5-диметилциклогекс-2-ен-1-онов (3а-е), были выбраны к качестве CH,NH-бинуклеофилов вследствие препаративной доступности и легкости варьирования заместителей у атома азота. Эти циклические енаминокетоны (3а-е) существуют в форме (Е)-изомеров с расположением группы -СН и группы NH енаминофрагмента по одну сторону от двойной связи, что благоприятствует их участию в реакциях в качестве бинуклеофилов. Широкий ряд электронодонорных и электроноакцепторных заместителей у атома азота енаминокетонов (3а-е) использован с целью оценки их влияния на ход реакции.
Пирролдионы (2а-е) взаимодействуют с N-замещенными 3-амино-5,5-диметилциклогекс-2-ен-1-онами (3а-е) с образованием 1-замещенных 6,6-диметил-2,4-диоксо-2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2'-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пирролов) (4а-т), структура которых подтверждена РСА [геометрия молекулы соединения (4ж) представлена на рис. 1].
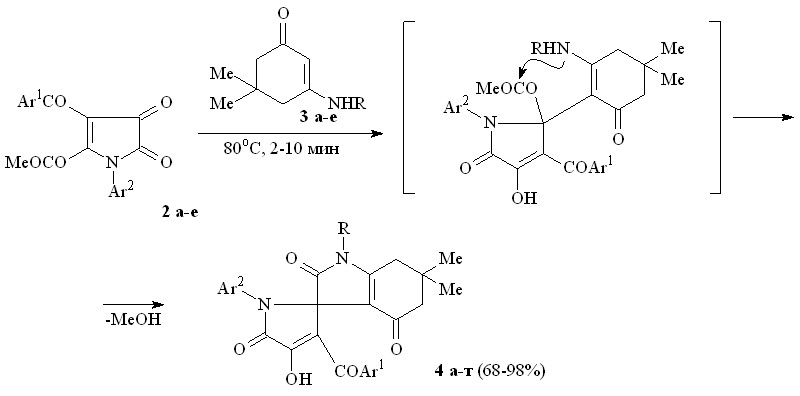
3: R = CH2Ph (а), C6H11-с (б), CH2CH=CH2 (в), Ph (г), C6H4OMe–4 (д), C6H4Cl-4 (е);
4: Ar1 = Ar2 = Ph, R = CH2Ph (а), Ar1 = Ph, Ar2 = С6Н4Me-4, R = CH2Ph (б), Ar1 = Ph, Ar2 = С6Н4Cl-4, R = CH2Ph (в), Ar1 = С6Н4NO2-4, Ar2 = Ph, R = CH2Ph (г), Ar1 = С6H4OEt-4, Ar2 = С6Н4Me-4, R = CH2Ph (д), Ar1 = С6Н4Cl-4, Ar2 = С6Н4Me-4, R = CH2Ph (е), Ar1 = Ar2 = Ph, R = C6H11-c (ж), Ar1 = Ph, Ar2 = С6Н4Me-4, R = C6H11-c (з), Ar1 = Ph, Ar2 = С6Н4Cl-4, R = C6H11-c (и), Ar1 = С6Н4NO2-4, Ar2 = Ph, R = C6H11-c (к), Ar1 = С6Н4Cl-4, Ar2 = С6Н4Me-4, R = C6H11-c (л), Ar1 = Ar2 = Ph, R = CH2CH=CH2 (м), Ar1 = Ph, Ar2 = С6Н4Me-4, R = CH2CH=CH2 (н), Ar1 = Ph, Ar2 = С6Н4Me-4, R = Ph (о), Ar1 = Ph, Ar2 = С6Н4Cl-4, R = Ph (п), Ar1 = Ph, Ar2 = С6Н4Me-4, R = C6H4OMe-4 (р), Ar1 = С6Н4NO2-4, Ar2 = Ph, R = C6H4OMe-4 (с), Ar1 = Ph, Ar2 = С6Н4Me-4, R = C6H4Cl-4 (т).
По-видимому, на первой стадии взаимодействия происходит присоединение группы -CH енаминокетонов (3а-е) к атому С2 пирролдионов (2а-е) с последующим замыканием пиррольного цикла путем внутримолекулярной атаки аминогруппой енаминокетонов (3а-е) сложноэфирной карбонильной группы – заместителя при атоме С2 пирролдионов (2а-е) и отщеплением метанола.
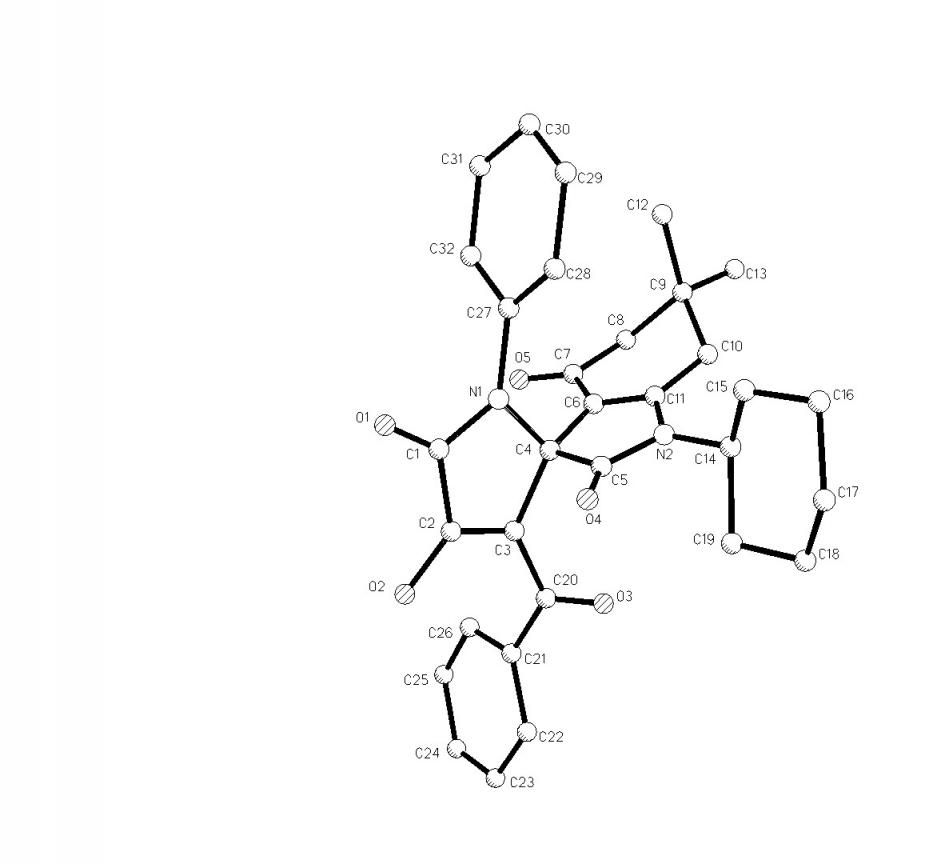 Рис. 1. Молекулярная структура соединения (4ж). Рис. 1. Молекулярная структура соединения (4ж). |
При взаимодействии пирролдионов (2в,д) с N-незамещенным 3-амино-5,5-диметилциклогекс-2-ен-1-оном (3ж), проводимом при температуре 80-840С в течение 2-10 мин, образуются 6,6-диметил-2,4-диоксо-2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2'-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пирролы) (4у,ф). При уменьшении времени реакции пирролдионов (2а-в) и енаминокетона (3ж) до 0.5-1 мин образуются метил 11-арил-12-ароил-9-гидрокси-5,5-диметил-3,10-диоксо-8,11-диазатрицикло[7.2.1.02,7]додек-2(7)-ен-1-карбоксилаты (5а-в). Кипячение соединения (5в) в бензоле в течение 10 мин приводит к образованию соединения (4у).
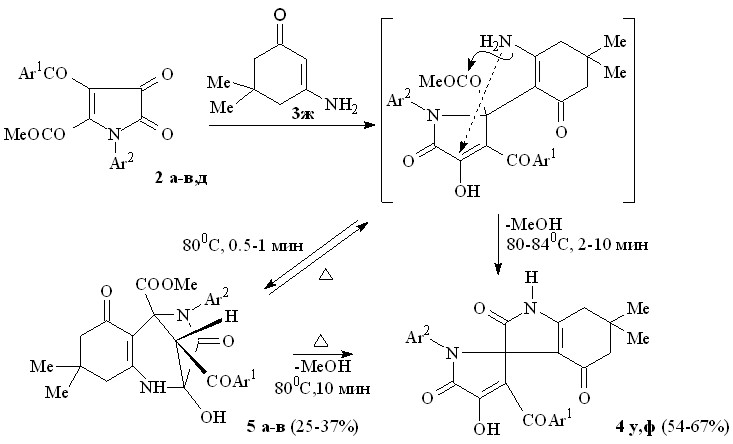
4: Ar1 = Ph, Ar2 = С6Н4Cl-4 (у), Ar1 = С6H4OEt-4, Ar2 = С6Н4Me-4 (ф);
5: Ar1 = Ar2 = Ph (а), Ar1 = Ph, Ar2 = С6Н4Me-4 (б), Ar1 = Ph, Ar2 = С6Н4Cl-4 (в).
По-видимому, на первой стадии взаимодействия происходит присоединение группы -CH енаминокетона (3ж) к атому С2 пирролдионов (2а-в) с последующим присоединением первичной аминогруппы енаминокетона (3ж) к атому углерода в положении 4 пирролдионов (2а-в) с образованием соединений (5а-в). Это присоединение обратимо и при нагревании соединения (5в) происходит расщепление связи NH–C(OH) и замыкание пиррольного цикла путем внутримолекулярной атаки первичной аминогруппой сложноэфирной карбонильной группы – заместителя при атоме С2 пирролдиона (2в).
Образование соединений, аналогичных соединениям (5а-в), в случае енаминокетонов (3а-е) не происходит, вероятно, вследствие увеличения стерических препятствий у аминогруппы енаминокетонов (3а-е) из-за наличия заместителей у атома азота.
При взаимодействии пирролдионов (2а,в) с 3-анилино-5,5-диметилциклогекс-2-ен-1-онами (3д,е) кроме ожидаемых 1-арил-6,6-диметил-2,4-диоксо-2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2'-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1H-пирролов) (4х-ч) в качестве минорных продуктов образуются 1-арил-6,6-диметил-2,4-диоксо-2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2'-(4-ариламино-3-ароил-5-оксо-2,5-дигидрофураны) (6а-в), структура которых подтверждена РСА [геометрия молекулы соединения (6а) представлена на рис. 2].

4: Ar1 = Ar2 = Ph, R = C6H4OMe-4 (х), Ar1 = Ph, Ar2 = С6Н4Cl-4, R = C6H4OMe-4 (ц), Ar1 = Ph, Ar2 = С6Н4Cl-4, R = C6H4Cl-4 (ч);
6: Ar1 = Ar2 = Ph, R = C6H4OMe-4 (а), Ar1 = Ph, Ar2 = C6H4Cl-4, R = C6H4OMe-4 (б),Ar1 = Ph, Ar2 = C6H4Cl-4, R = C6H4Cl-4 (в).
По-видимому, образование соединений (6а-в) происходит вследствие первоначального присоединения группы NH енаминокетонов (3д,е) к атому углерода в положении 5 пирролдионов (2а,в), расщепления пирролдионового цикла по связи N1-С5 и последующего замыкания «нового» пиррольного цикла вследствие внутримолекулярного нуклеофильного присоединения группы -CH енаминокетонов к кетонной карбонильной группе с образованием полуацетальной гидроксильной группы, в свою очередь атакующей сложноэфирную карбонильную группу и отщепления метанола.
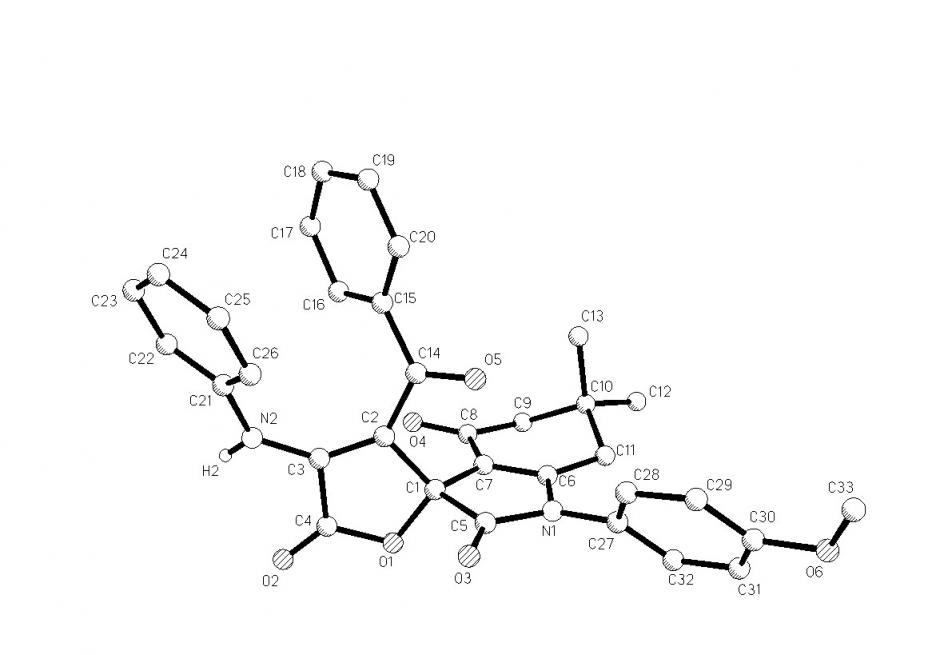
Рис. 2. Молекулярная структура соединения (6а).
Вероятно, введение арильных заместителей к атому азота енаминокетонов (3д,е) уменьшает нуклеофильность аминогруппы и препятствует вышеописанной спиро-гетероциклизации, что приводит к реализации второго направления первоначального присоединения с последующей рециклизацией.
Использование в качестве бинуклеофила «бис-енаминокетона» позволило синтезировать «бис-спиро-соединения». При взаимодействии пирролдионов (2а-в) с 1,2-ди(5,5-диметил-3-оксоциклогекс-1-енамино)этаном (7) по схеме последовательной атаки -CH и NН группами енаминокетона (7) атома углерода в положении 2 и карбонильной группы метоксикарбонильного заместителя в положении 2 пирролдионового цикла образуются 1,2-бис(6,6-диметил-2,4-диоксо-2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2'-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пиррол-1-ил)этаны (8а-в).
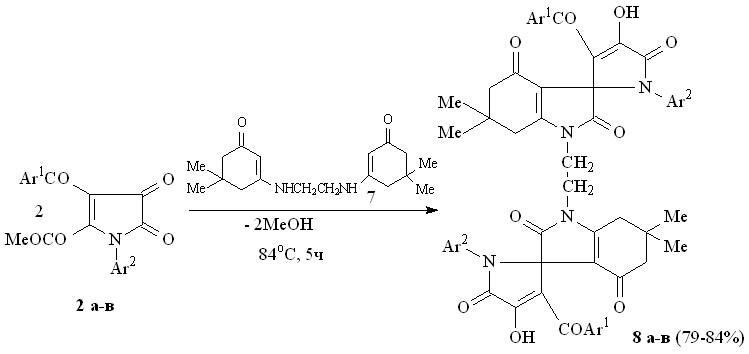
8: Ar1 = Ar2 = Ph (а), Ar1 = Ph, Ar2 = C6H4Me-4 (б), Ar1 = Ph, Ar2 = C6H4Cl-4 (в).
При взаимодействии пирролдионов (2б,в) с 3-анилино-1Н-инден-1-онами (9а,б) по схеме близкой к вышеописанной образуются 1-арил-2,4-диоксо-1,2,3,4-тетрагидроиндено[1,2-b]пиррол-3-спиро-2'-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пирролы) (10а-в).
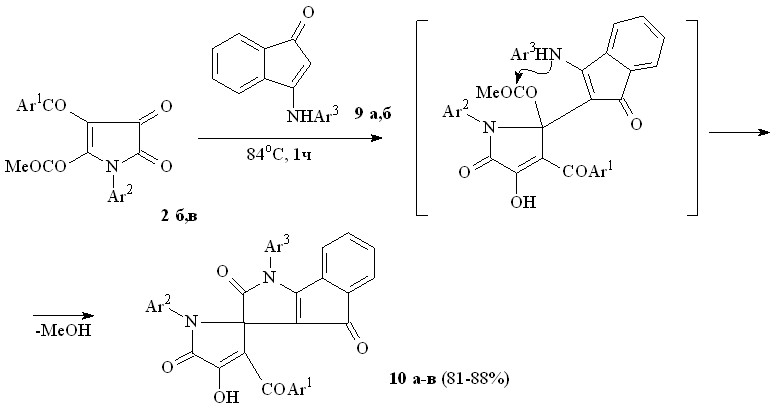
9: Ar3 = Ph (а),C6H4Cl-4 (б);
10: Ar1 = Ar3 = Ph, Ar2 = C6H4Cl-4 (а), Ar1 = Ar3 = Ph, Ar2 = C6H4Me-4 (б), Ar1 = Ph, Ar2 = C6H4Me-4,
Ar3 = C6H4Cl-4 (в).
2.2.2. Взаимодействие метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с ациклическими енаминокетонами
Ациклические енаминокетоны (11а-в, 13а-г), в отличие от циклических енаминокетонов, существуют в форме (Z)-изомеров с внутримолекулярной водородной связью между группой NH и кетонной карбонильной группой и расположением группы -СН и группы NH енаминофрагмента по разные стороны от двойной связи, что может препятствовать их участию в реакциях в качестве бинуклеофилов. Тем не менее, при взаимодействии пирролдионов (2а-в) с 4-анилинопент-3-ен-2-онами (11а-в) по схеме близкой к вышеописанной образуются 1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пиррол-2-спиро-3'-(1-арил-4-ацетил-5-метил-2-оксо-2,5-дигидро-1Н-пирролы) (12а-е).
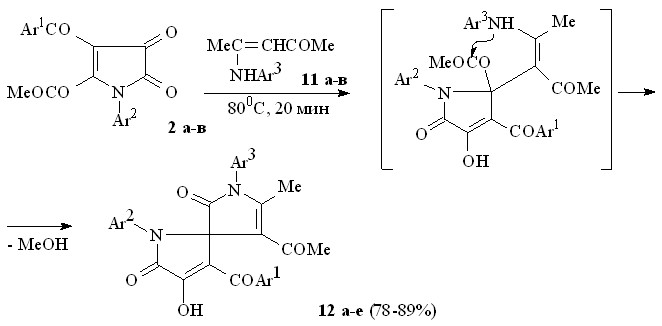
11: Ar3 = Ph (а), C6H4Cl-4 (б), C6H4ОMe-4 (в); 12: Ar1 = Ar2 = Ar3 = Ph (а), Ar1 = Ar2 = Ph, Ar3 = C6H4Cl-4 (б), Ar1 = Ph, Ar2 = C6H4Me-4, Ar3 = C6H4Cl-4 (в), Ar1 = Ph, Ar2 = C6H4Me-4, Ar3 = C6H4ОMe-4 (г), Ar1 = Ar3 = Ph, Ar2 = C6H4Cl-4 (д), Ar1 = Ph, Ar2 = C6H4Cl-4, Ar3 = C6H4ОMe-4 (е).
При взаимодействии пирролдионов (2а-в,д) с 3-анилино-1,3-дифенилпроп-2-ен-1-онами (13а-г) по схеме последовательной атаки -CH и NН группами енаминокетона атома углерода в положении 2 и карбонильной группы метоксикарбонильного заместителя при атоме С2 образуются 1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пиррол-2-спиро-3'-(1-арил-4-бензоил-2-оксо-5-фенил-2,5-дигидро-1Н-пирролы) (14а-к).
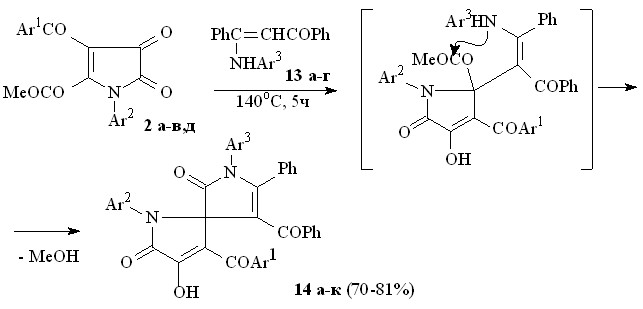
13: Ar3 = Ph (а), C6H4Me-4 (б), C6H4Cl-4 (в), C6H4ОMe-4 (г); 14: Ar1 = Ar2 = Ar3 = Ph (а), Ar1 = Ar3 = Ph, Ar2 = C6H4Me-4 (б), Ar1 = Ar3 = Ph, Ar2 = C6H4Cl-4 (в), Ar1 = Ar2 = Ph, Ar3 = C6H4Me-4 (г), Ar1 = Ph, Ar2 = Ar3 = C6H4Me-4 (д), Ar1 = Ph, Ar2 = C6H4Cl-4, Ar3 = C6H4Me-4 (е), Ar1 = Ar2 = Ph, Ar3 = C6H4Me-4 (ж), Ar1 = Ph, Ar2 = C6H4Me-4, Ar3 = C6H4Cl-4 (з), Ar1 = Ph, Ar2 = Ar3 = C6H4Cl-4 (и), Ar1 = С6H4OEt-4, Ar2 = C6H4Me-4, Ar3 = C6H4ОMe-4 (к).
Таким образом, иное, чем у циклических енаминокетонов, геометрическое строение молекул ациклических енаминокетонов не меняет направление их взаимодействия с пирролдионами (2а-в,д), а лишь несколько увеличивает его продолжительность.
2.2.3. Взаимодействие метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с ациклическими енаминоэфирами
Пирролдионы (2а-в,д) взаимодействуют с этил 3-анилинобут-2-еноатами (15а-г) по схеме близкой к вышеописанной с образованием этил 1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пиррол-2-спиро-3'-(1-арил-5-метил-2-оксо-2,5-дигидро-1Н-пиррол-4-карбоксилатов) (16а-о).
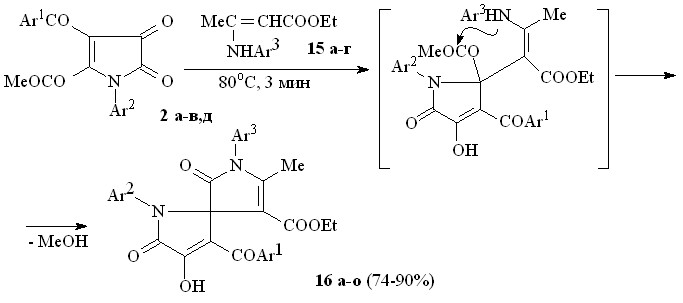
15: Ar3 = Ph (а), C6H4Me-4 (б), C6H4OMe-4 (в), C6H4Cl-4 (г); 16: Ar1 = Ar2 = Ar3 = Ph (a), Ar1 = Ar2 = Ph, Ar3 = С6Н4Me-4 (б), Ar1 = Ar2 = Ph, Ar3 = C6H4OMe-4 (в), Ar1 = Ar2 = Ph, Ar3 = С6Н4Cl-4 (г), Ar1 = Ar3 = Ph, Ar2 = С6Н4Me-4 (д), Ar1 = Ph, Ar2 = Ar3 = С6Н4Me-4 (е), Ar1 = Ph, Ar2 = С6Н4Me-4, Ar3 = C6H4OMe-4 (ж), Ar1 = Ph, Ar2 = С6Н4Me-4, Ar3 = С6Н4Cl-4 (з), Ar1 = Ar3 = Ph, Ar2 = С6Н4Cl-4 (и), Ar1 = Ph, Ar2 = С6Н4Cl-4, Ar3 = С6Н4Me-4 (к), Ar1 = Ph, Ar2 = Ar3 = С6Н4Cl-4 (л), Ar1 = С6H4OEt-4, Ar2 = С6Н4Me-4, Ar3 = Ph (м), Ar1 = С6H4OEt-4, Ar2 = С6Н4Me-4, Ar3 = C6H4OMe-4 (н), Ar1 = С6H4OEt-4, Ar2 = С6Н4Me-4, Ar3 = С6H4OEt-4 (о).
2.2.4. Взаимодействие метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с циклическими енгидразинами
Пирролдионы (2а-в,д,ж) взаимодействуют с 3-[2-(диарилметилен)гидразино]-5,5-диметилциклогекс-2-ен-1-онами (17а,б) по схеме последовательной атаки -CH и NН группами енгидразинов атома углерода в положении 2 и карбонильной группы метоксикарбонильного заместителя в положении 2 пирролдионового цикла с образованием 1-диарилметиленамино-6,6-диметил-2,4-диоксо-2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2'-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пирролов) (18а-ж).
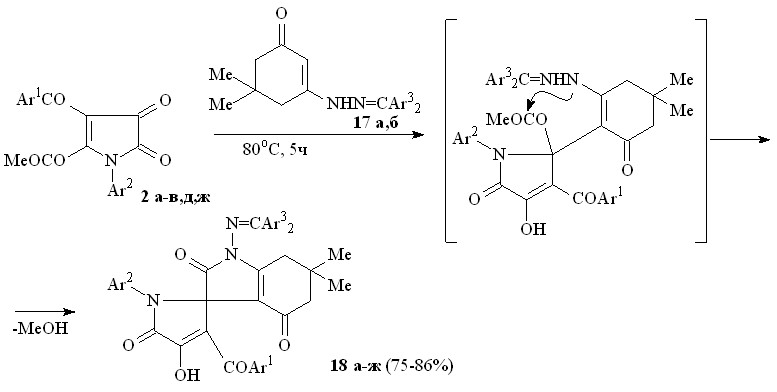
17: Ar3 = Ph (а), C6H4Me-4 (б); 18: Ar1 = Ar2 = Ar3 = Ph (а), Ar1 = Ar3 = Ph, Ar2 = C6H4Me-4 (б), Ar1 = Ar3 = Ph, Ar2 = С6Н4Cl-4 (в), Ar1 = C6H4Br-4, Ar2 = C6H4Me-4, Ar3 = Ph (г), Ar1 = C6H4Br-4, Ar2 = Ar3 = C6H4Me-4 (д), Ar1 = С6H4OEt-4, Ar2 = C6H4Me-4, Ar3 = Ph (е), Ar1 = С6H4OEt-4, Ar2 = C6H4Me-4, Ar3 = C6H4Me-4 (ж).
При взаимодействии пирролдионов (2а-в) с 3-(2-ацилгидразино)-5,5-диметилциклогекс-2-ен-1-онами (19а-г) по схеме близкой к вышеописанной образуются 1-ациламино-6,6-диметил-2,4-диоксо-2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2'-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пирролы) (20а-м), структура которых подтверждена РСА [геометрия молекулы соединения (20в) представлена на рис. 3]. Ожидаемого нами замыкания пиридазинонового цикла вследствие внутримолекулярной атаки группой NH амидного фрагмента NHCOR сложноэфирного карбонила не происходит, по-видимому, вследствие ее меньшей нуклеофильности по сравнению с группой NH енаминофрагмента.
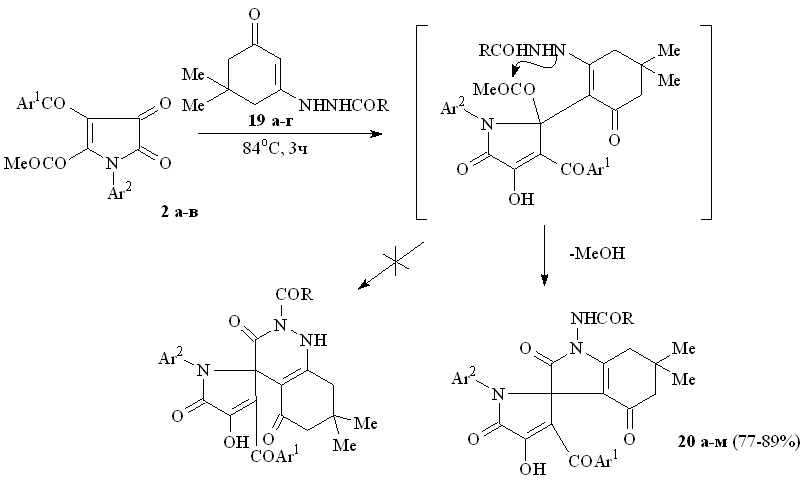
19: R = Ph (а), CHPh2 (б), C6H4NO2-3 (в), C6H4NO2-4 (г); 20: Ar1 = Ar2 = R = Ph (а), Ar1 = R = Ph, Ar2 = С6Н4Me-4 (б), Ar1 = R = Ph, Ar2 = С6Н4Cl-4 (в), Ar1 = Ar2 = Ph, R = CHPh2 (г), Ar1 = Ph, Ar2 = С6Н4Me-4, R = CHPh2 (д), Ar1 = Ph, Ar2 = С6Н4Cl-4, R = CHPh2 (е), Ar1 = Ar2 = Ph, R = C6H4NO2-3 (ж), Ar1 = Ph, Ar2 = С6Н4Me-4, R = C6H4NO2-3 (з), Ar1 = Ph, Ar2 = С6Н4Cl-4, R = C6H4NO2-3 (и), Ar1 = Ar2 = Ph, R = C6H4NO2-4 (к), Ar1 = Ph, Ar2 = С6Н4Me-4, R = C6H4NO2-4 (л), Ar1 = Ph, Ar2 = С6Н4Cl-4, R = C6H4NO2-4 (м).

Рис. 3. Молекулярная структура соединения (20в).
2.2.5. Взаимодействие метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с гетероциклическими енаминами
2.2.5.1. Взаимодействие метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с енаминами ряда изохинолинов
1-Метил-3,4-дигидроизохинолины в таутомерной форме 1-метилен-1,2,3,4-тетрагидроизохинолинов содержат енаминофрагмент с двумя примерно равноценными нуклеофильными центрами и образуют продукты нуклеофильной атаки высокоэлектрофильных 2,3-диоксогетероциклов как группой NH-, так и группой -СН- этого фрагмента.
При взаимодействии пирролдионов (2а-г) с замещенными 1-метил-3,4-дигидроизохинолинами (21а,б) по схеме последовательной атаки -CH и NН группами таутомерной енаминоформы изохинолинов атома углерода в положении 2 и сложноэфирной карбонильной группы метоксикарбонильного заместителя в положении 2 пирролдионового цикла образуются 5,5-диметил-3-оксо-2,3,5,6-тетрагидропирроло[2,1-а]изохинолин-2-спиро-2'-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пирролы) (22а-е).
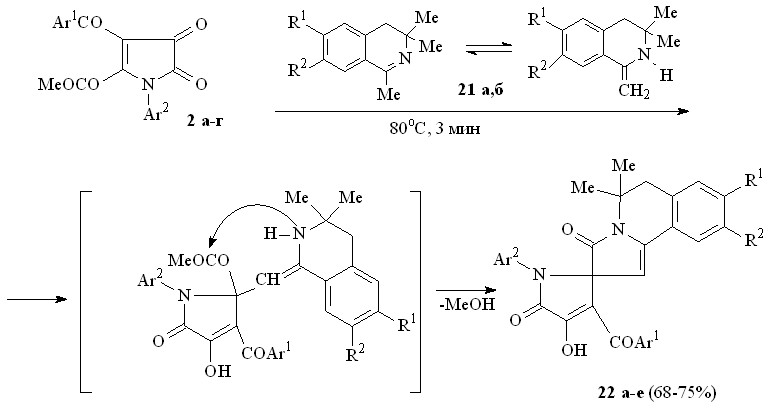
21: R1 = R2 = H (а), OMe (б);
22: Ar1 = Ar2 = Ph, R1 = R2 = OMe (а), Ar1 = С6Н4NO2-4, Ar2 = Ph, R1 = R2 = OMe (б), Ar1 = Ph, Ar2 = C6H4Me-4, R1 = R2 = H (в), Ar1 = Ph, Ar2 = C6H4Me-4, R1 = R2 = OMe (г), Ar1 = Ph, Ar2 = C6H4Cl-4, R1 = R2 = H (д), Ar1 = Ph, Ar2 = C6H4Cl-4, R1 = R2 = OMe (е).
При взаимодействии пирролдионов (2а-в,д,е) с 2,2,4-триметил-1,2-дигидробензо[f]изохинолином (23) по аналогичной схеме образуются 6,6-диметил-8-оксо-5,6,8,9-тетрагидробензо[f]пирроло[2,1-a]изохинолин-9-спиро-2'-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пирролы) (24а-д), структура которых подтверждена РСА [геометрия молекулы соединения (24а) представлена на рис. 4].
24: Ar1 = Ar2 = Ph (а), Ar1 = Ph, Ar2 = С6Н4Me-4 (б), Ar1 = Ph, Ar2 = C6H4Cl-4 (в), Ar1 = С6H4OEt-4, Ar2 = С6Н4Me-4 (г), Ar1 = C6H4Cl-4, Ar2 = С6Н4Me-4 (д).
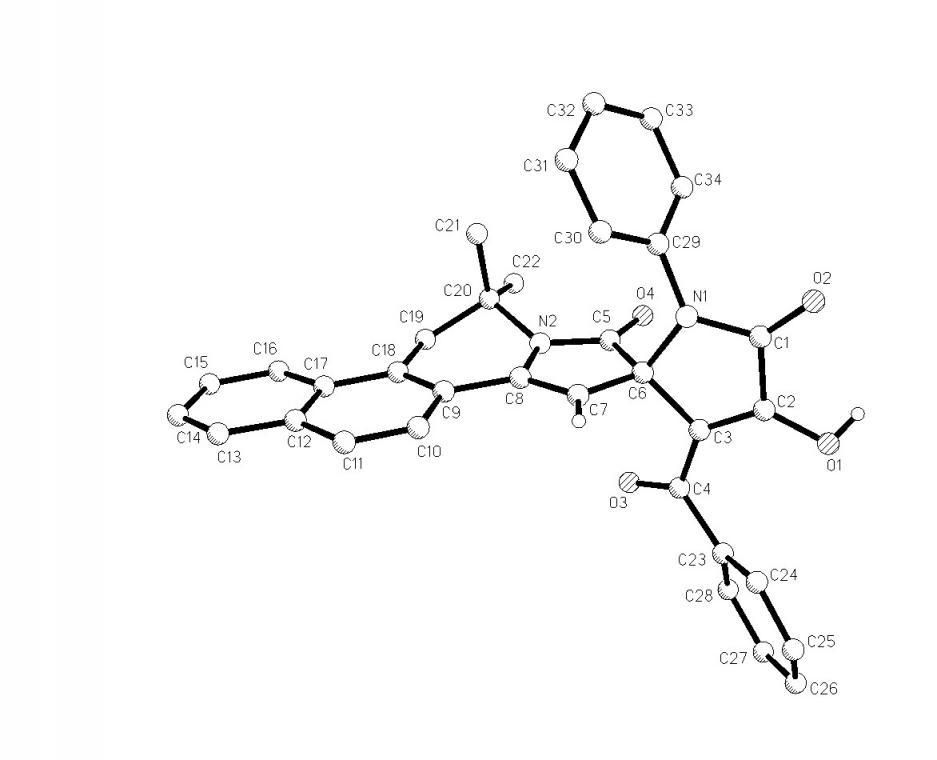
Рис. 4. Молекулярная структура соединения (24а).
Соединения (24а-д) являются 13-азагонанами – гетероциклическими аналогами стероидов, содержащими спиро-гетероциклический заместитель в положении 16 тетрациклической системы, а приведенная реакция – новый подход к их синтезу.
2.2.5.2. Взаимодействие метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с 6-амино-1,3-диметилпиримидин-2,4(1Н,3Н)-дионом
При взаимодействии пирролдионов (2а-в,ж) с 6-амино-1,3-диметилпиримидин-2,4(1Н,3Н)-дионом (6-амино-1,3-диметилурацилом), проводимом при температуре 84С в течение 8-9 ч происходит образование метил 11-арил-12-ароил-9-гидрокси-4,6-диметил-3,5,10-триоксо-4,6,8,11-тетраазатрицикло[7.2.1.02,7]додек-2(7)-ен-1-карбокси-латов (25а-г). Кипячение соединений (25а,в) при температуре 140С в течение 14-18 ч приводит к образованию 1,3-диметил-2,4,6-триоксо-2,3,4,5,6,7-гексагидро-1Н-пирроло[2,3-d]пиримидин-5-спиро-2'-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пирролов) (26а,б).
25: Ar1 = Ar2 = Ph (а), Ar1 = Ph, Ar2 = С6Н4Me-4 (б), Ar1 = Ph, Ar2 = C6H4Cl-4 (в), Ar1 = С6Н4Br-4, Ar2 = С6Н4Me-4 (г); 26: Ar1 = Ar2 = Ph (а), Ar1 = Ph, Ar2 = C6H4Cl-4 (б).
По-видимому, образование соединений (25а-г) происходит вследствие присоединения группы -CH енаминофрагмента аминоурацила к атому С2 пирролдионов (2а-в,ж) и аминогруппы енаминофрагмента аминоурацила к атому С4 пирролдионов (2а-в,ж). При нагревании соединений (25а,в) происходит расщепление связи NH–C(OH) и замыкание пиррольного цикла путем внутримолекулярной атаки аминогруппой аминоурацила сложноэфирной карбонильной группы – заместителя в положении 2 пирролдионов (2а,в) и отщепления метанола.
2.2.5.3. Взаимодействие метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатов с 3-анилино-1,5-диарил-1,5-дигидро-2Н-пиррол-2-онами
Пирролдионы (2а-в) взаимодействуют с 3-анилино-1,5-диарил-1,5-дигидро-2Н-пиррол-2-онами (27а,б) с образованием метил 2-(4-анилино-1,2-диарил-5-оксо-2,5-дигидро-1Н-пиррол-3-ил)-1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидро-1Н-пиррол-2-карбоксилатов (28а-д).
27: Ar3 = Ph, Ar4 = Ar5 = С6Н4Me-4 (а), Ar3 = С6Н4F-4, Ar4 = Ar5 = Ph (б); 28: Ar1 = Ar2 = Ar3 = Ph, Ar4 = Ar5 = С6Н4Me-4 (а), Ar1 = Ar2 = Ar4 = Ar5 = Ph, Ar3 = С6Н4F-4 (б), Ar1 = Ar4 = Ar5 = Ph, Ar2 = С6Н4Me-4, Ar3 = С6Н4F-4 (в), Ar1 = Ar3 = Ph, Ar2 = C6H4Cl-4, Ar4 = Ar5 = С6Н4Me-4 (г), Ar1 = Ar4 = Ar5 = Ph, Ar2 = C6H4Cl-4, Ar3 = С6Н4F -4 (д).
Образование соединений (28а-д) происходит вследствие присоединения группы -CH гетероциклических енаминов (27а,б) к атому С2 пирролдионов (2а-в). Ожидаемого нами замыкания пиррольного цикла вследствие внутримолекулярной атаки группой NH N-арилзамещенного енаминофрагмента сложноэфирного карбонила не происходит, вероятно, вследствие ее низкой нуклеофильности.
В третьей главе приведены методики синтеза и физико-химические характеристики полученных соединений.
В приложении приведены данные о биологической активности синтезированных соединений.
Представители некоторых рядов синтезированных соединений (всего 23 соединения) были исследованы на наличие у них антимикробной активности. Проведенные исследования показали, что данные соединения проявляют ингибирующее действие относительно грамположительных микроорганизмов Staphylococcus aureus (МИК в интервале 7,8-1000,0 мкг/мл, МБК в интервале 31,2-2000,0 мкг/мл).
Лучшее по противомикробным показателям соединение (24в) (МИК <31,2 мкг/мл, МБК >31,2 <62,5 мкг/мл) является умеренно токсичным (ЛД50 >150 мг/кг).
ВЫВОДЫ
- Установлено, что N-незамещенные циклические и гетероциклические енаминокетоны (3-амино-5,5-диметилциклогекс-2-ен-1-он и 6-амино-1,3-диметилпиримидин-2,4(1Н,3Н)-дион) взаимодействуют с метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатами по схеме последовательного присоединения группы -CH и аминогруппы енаминофрагмента енаминокетонов к атомам С2 и С4 пирролдионов.
- Найдено, что продукты последовательной атаки -CH и NH группами N-незамещенных циклических и гетероциклических енаминокетонов при нагревании претерпевают рециклизацию вследствие расщепления связи NH–C(OH) и внутримолекулярной атаки аминогруппы сложноэфирной карбонильной группы с отщеплением метанола.
- Установлено, что N-замещенные циклические, ациклические и гетероциклические енаминокетоны, енаминоэфиры, енамины и енгидразины (3-алкиламино- и 3-анилино-5,5-диметилциклогекс-2-ен-1-оны 1,2-ди(5,5-диметил-3-оксоциклогекс-1-енамино)этан, 3-анилино-1Н-инден-1-оны, 4-анилинопент-3-ен-2-оны, 3-анилино-1,3-дифенилпроп-2-ен-1-оны, этил 3-анилинобут-2-еноаты, 3-[2-(диарилметилен)гидразино]-5,5-диметилциклогекс-2-ен-1-оны, 3-(2-ацилгидразино)-5,5-диметилциклогекс-2-ен-1-оны, замещенные 1-метил-3,4-дигидроизохинолины и 2,2,4-триметил-1,2-дигидробензо[f]изохинолин) взаимодействуют с метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатами по схеме последовательной атаки -CH и NН группами енаминов атома С2 и карбонильной группы метоксикарбонильного заместителя в положении 2 пирролдионового цикла.
- Показано, что при взаимодействии N-арилзамещенных циклических енаминокетонов (3-анилино-5,5-диметилциклогекс-2-ен-1-онов) с метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатами в качестве второго, минорного направления реализуется схема атаки группой NH енаминокетонов атома С5, расщепления пирролдионового цикла по связи N1-С5 и последующего внутримолекулярного замыкания «нового» пиррольного цикла вследствие присоединения группы -CH енаминокетонов к кетонной карбонильной группе с образованием полуацетальной гидроксильной группы, в свою очередь атакующей сложноэфирную карбонильную группу.
- Обнаружено, что N-арилзамещенные гетероциклические енамины (3-анилино-1,5-диарил-1,5-дигидро-2Н-пиррол-2-оны) взаимодействуют с метил 1-арил-3-ароил-4,5-диоксо-4,5-дигидро-1Н-пиррол-2-карбоксилатами по схеме присоединения группы -CH гетероциклических енаминов к атому С2 пирролдионов без последующей внутримолекулярной циклизации.
Основное содержание диссертации изложено в работах:
- Банникова Ю.Н., Масливец А.Н. Спиро-бисгетероциклизация 5-метоксикарбонил-2,3-дигидро-2,3-пирролдионов под действием активированных енаминов // ХГС. 2004. №1. С.124-126.
- Банникова Ю.Н., Масливец А.Н., Алиев З.Г. Пятичленные 2,3-диоксогетероциклы XLIX. Взаимодействие 1-арил-4-ароил-5-метоксикарбонил-2,3-дигидро-2,3-пирролдионов с замещенными 3-амино-5,5-диметил-2-циклогексен-1-онами // ЖОрХ. 2004.Т 40. Вып. 12. C. 1840-1845.
- Банникова Ю.Н., Масливец А.Н. Способ получения 1-алкил-6,6-диметил-2,4-диоксо-2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидропирролов) // Патент РФ на изобретение № 2238272 (2004).
- Bannikova Yu.N., Vereshchagina N.L., Maslivets A.N. 1-Benzyl-6,6-dimethyl-2,4-dioxo-2,3,4,5,6,7-hexahydro-1H-indole-3-spiro-[2-(4-hydroxy-1-o-hydroxyphenyl-3-p-methoxybenzoyl-5-oxo-2,5-dihydropyrrole)] and 6,6-dimethyl-2,4-dioxo-1-cyclohexyl-2,3,4,5,6,7-hexahydro-1H-indole-3-spiro-2-(4-hydroxy-1-phenyl-3-p-nitroxybenzoyl-5-oxo-2,5-dihydropyrrole) // Selected methods for synthesis and modification of heterocycles. Kartsev V.G. Ed., Moscow: IBS Press. 2004. Vol. 1. P. 484.
- Банникова Ю.Н., Рачева Н.Л., Масливец А.Н. Рециклизация моноциклических 2,3-дигидро-2,3-пирролдионов и пирролбензоксазинтрионов под действием активированных енаминов // Труды 5-й Международной конференции молодых ученых и студентов. Самара, 2004. С. 13-15.
- Bannikova Yu.N., Maslivets A.N., RozkovaYu.S., Shklyaev Yu.V. and Aliev Z.G. Spiro heterocyclization of 5-methoxycarbonyl-2,3-dihydro-2,3-pyrrolediones by reaction with 1-methyl-3,4-dihydroisoquinoline // Mend. Commun. 2005. P. 158-159.
- Банникова Ю.Н., Масливец А.Н. Спиро-бис-гетероциклизация моноциклических 2,3-дигидро-2,3-пирролдионов под действием енаминов // Тезисы докладов IV Международной конференции молодых ученых по органической химии «Современные тенденции в органическом синтезе и проблемы химического образования». Санкт-Петербург, 2005. С. 105.
- Банникова Ю.Н., Масливец А. Н. Взаимодействие моноциклических 2,3-дигидро-2,3-пирролдионов с СН,NН-бинуклеофилами // Сборник тезисов Международной конференции по химии гетероциклических соединений. Москва, 2005. С. 118.
- Банникова Ю.Н., Масливец А.Н. Спиро-бис-гетероциклизация 5-метоксикарбонил-2,3-дигидро-2,3-пирролдионов под действием ациклических енаминов // ЖОрХ. 2005. Т 41. Вып. 11. C. 1748-1749.
- Масливец А.Н., Банникова Ю.Н., шкляев Ю.В., рожкова ю.с., Смирнова А.С., Александрова Г.А. 11,11-Диметил-1-оксо-1,2,10,11-тетрагидробензо[h]пирро-ло[2,1-а]изохинолин-2-спиро-2'-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигид-ропирролы), проявляющие антимикробную активность относительно грамположительной микрофлоры // Патент РФ на изобретение № 2281286 (2006).
- Банникова Ю.Н., Масливец А.Н. Взаимодействие 5-метокси-карбонилзамещенных 1Н-пиррол-2,3-дионов с СН,NН-бинуклеофильными реагентами // Сборник тезисов Всероссийской конференции «Техническая химия. Достижения и перспективы». Пермь, 2006. С.41.
- Банникова Ю.Н., Масливец А.Н. Двойная спиро-бис-гетероциклизация 5-метоксикарбонил-2,3-дигидро-2,3-пирролдиона под действием N-арилзамещенного имина димедона // ЖОрХ. 2006. Т 42. Вып. 5. C. 787-788.

