Изменения комплекса рибосомных генов человека в процессе естественного и репликативного старения
На правах рукописи
УДК 575.224
Малиновская Елена Михайловна
ИЗМЕНЕНИЯ КОМПЛЕКСА РИБОСОМНЫХ ГЕНОВ ЧЕЛОВЕКА
В ПРОЦЕССЕ ЕСТЕСТВЕННОГО И РЕПЛИКАТИВНОГО
СТАРЕНИЯ
03.00.15 – Генетика
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2008
Работа выполнена в лаборатории молекулярной биологии ГУ Медико-генетического научного центра РАМН
| Научные руководители: | доктор биологических наук, Вейко Наталья Николаевна |
| Официальные оппоненты: | доктор биологических наук, профессор Ревазова Юлия Анатольевна |
| кандидат биологических наук Захарова Екатерина Юрьевна |
Ведущая организация: Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов (ФГУП «ГосНИИгенетика»)
Защита состоится 2 февраля 2009 г. в 12 часов на заседании диссертационного совета Д 001.016.01 в ГУ Медико-генетический научный центр РАМН по адресу: 115478, город Москва, улица Москворечье, дом 1.
С диссертацией можно ознакомиться в библиотеке ГУ Медико-генетического научного центра РАМН
Автореферат разослан ________________ 200 г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук, Зинченко Р.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Рибосомные гены (РГ), кодирующие рибосомные РНК (28S, 18S, 5.8S рРНК), имеют принципиальное значение для функционирования эукариотической клетки. Для обеспечения синтеза большого количества молекул рРНК, в геноме человека содержится от 250 до 700 копий РГ. В соматической клетке человека транскрибируется 30-50% копий РГ, которые называют активными копиями (АкРГ). К варьирующим признакам генома также относят количество метилированных копий РГ.
В литературе уже давно дискутируется вопрос о возможной связи характеристик комплекса РГ генома млекопитающих и старения. В нескольких работах сообщалось об уменьшение числа копий РГ при старении тканей человека и животных (Strehler B.L. et al., 1979; Johnson L.K. et al., 1975; Gaubatz J. et al., 1976). В более поздних работах было показано, что при старении клеток организма мышей (Ono T. et al., 1985; Peterson C.R. et al., 1984), крыс (Halle J.P. et al., 1997) и человека (Peterson C.R. et al., 1984) не происходит существенного изменения числа копий РГ в геноме. Столь же противоречивые данные получены при исследовании изменения метилирования РГ при старении. Сообщалось об увеличении метилирования при старении культивируемых фибробластов кожи человека (Machwe A. et al., 2000), клеток крысы (Oakes C.C. et al., 2003) и мыши (Swisshelm K. et al., 1990). По данным других авторов, при старении млекопитающих уровень метилирования РГ не изменяется или снижается (de Carvalho C.V. et al., 2000). Практически нет работ, в которых одновременно оценивали бы изменения нескольких характеристик РГ при старении, а также изучали бы взаимосвязь между свойствами РГ и уровнем окислительного стресса, который рассматриваются в настоящее время в качестве основной причины старения.
Цель и задачи исследования. Изучение изменений комплекса РГ человека в процессе старения и установление возможной связи между этим процессом и продолжительностью жизни, а также анализ изменения свойств комплекса РГ при старении культивируемых клеток человека (репликативное старение). Были сформулированы следующие экспериментальные задачи:
- сравнить свойства комплекса РГ (число копий, количество АкРГ и уровень метилирования) в выборке людей 80 лет и старше и в выборке лиц молодого и среднего возраста;
- исследовать изменение свойств комплекса РГ при репликативном старении 5 штаммов фибробластов кожи доноров различного возраста, геномы которых значительно различаются по свойствам комплекса РГ;
- исследовать взаимосвязь свойств комплекса РГ и маркеров старения (содержание теломерного повтора, уровень апоптоза, максимальное число пассажей) для 5 штаммов фибробластов кожи человека;
- изучить влияние свойств комплекса РГ культивируемых фибробластов на устойчивость клеток к апоптозу, индуцируемому окислительным стрессом.
Научная новизна. Впервые показано, что количество АкРГ у людей, достигших 80-летнего возраста, варьирует в пределах достаточно узкой «адаптивной» нормы. Впервые найдено объяснение противоречивым результатам относительно снижения числа копий и изменения уровня метилирования РГ при старении: обнаружено, что при старении происходит потеря высокометилированных кластеров неактивных РГ, если таковые присутствовали в геноме. Впервые показано, что свойства комплекса РГ не влияют на нормальное репликативное старение культивируемых фибробластов, но влияют на устойчивость клеток к апоптозу, который индуцируется факторами внешней среды (в данном случае хроматом калия). Впервые обнаружено, что клетки с большим количеством АкРГ характеризуются значительно более высоким уровнем эндонуклеазной активности, чем в контроле.
Научно-практическая значимость работы. Данные о количестве АкРГ в геномах людей старческого возраста могут быть полезным при составлении прогнозов длительности жизни и риска развития патологии, индуцируемой окислительным стрессом, у различных возрастных групп населения. Данные о влиянии количества АкРГ в геноме клетки на изменения уровня апоптоза при действии повреждающих факторов внешней среды могут оказаться полезными при разработке схем клеточной терапии. Описана схема анализа ряда маркеров, которые позволяют прогнозировать различия в длительности пролиферативного периода и в уровне спонтанного апоптоза в культурах клеток уже на ранних пассажах, что также может иметь значение для клеточных технологий.
Положения, выносимые на защиту.
- В выборке людей старческого возраста по сравнению с людьми среднего возраста значительно сужены интервалы варьирования общего числа копий РГ в геноме и количества активных копий РГ. Комплекс РГ старых людей практически не содержит высокометилированных кластеров «молчащих» рибосомных копий.
- При репликативном старении культивируемых фибробластов кожи человека геном теряет высокометилированные кластеры копий РГ. При репликативном старении происходит значительное повреждение первичной структуры рДНК, что проявляется в значительном занижении данных real-time ПЦР.
- Скорость репликативного старения фибробластов кожи и маркеры старения (содержание теломерного повтора и уровень спонтанного апоптоза) не зависят от свойств комплекса РГ и от возраста доноров кожи.
- При действии хромата калия, индуцирующего дополнительный окислительный стресс, относительные изменения в уровне апоптоза клеток отрицательно коррелируют с количеством активных копий РГ в геноме.
- Уровень эндонуклеазной активности в лизатах (и степень фрагментации внеклеточной ДНК) при нормальном культивировании и в условиях индуцированного окислительного стресса положительно коррелируют с количеством активных копий РГ в геноме клеток.
Личный вклад автора. Основные результаты исследования получены и оформлены лично автором в лаборатории молекулярной биологии ГУ МГНЦ РАМН.
Публикации. По материалам диссертации опубликовано 9 работ, из них 4 в изданиях, рекомендованных ВАК МОН РФ.
Структура и объем диссертации. Диссертация состоит из введения, 6 глав, выводов и списка использованной литературы. Список литературы содержит 148 источников, из них 15 отечественных и 133 зарубежных авторов. Работа изложена на 116 страницах машинописи. Текст содержит 38 рисунков и 6 таблиц.
Апробация работы. Работа прошла апробацию на семинаре ГУ Медико-генетического центра РАМН 15 октября 2008г. Результаты были представлены на 70-й Республиканской научной конференции студентов и молодых ученых с международным участием «Вопросы теоретической и практической медицины» (Уфа, 2005); на международной конференции «Новые направления в радиобиологии» (Москва, 2007); на 6 европейском конгрессе «Healthy and active ageing for all Europeans» (Санкт-Петербург, 2007); на V конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины» (Москва, 2008).
МАТЕРИАЛЫ И МЕТОДЫ
Анализируемая выборка. Образцы периферической крови у людей старческого возраста (100 доноров в возрасте от 80 до 100 лет, средний возраст 83 ± 3, мужчины и женщины) собраны сотрудниками госпиталя №1 ветеранов войны (г. Москва, главврач Местергази Г.М.) и предоставлены нам сотрудниками лаборатории общей цитогенетики МГНЦ РАМН (рук.проф. Ляпунова Н.А.). Сбор образцов периферической крови у контрольной группы проводился сотрудниками Медико-генетического научного центра РАМН (г. Москва). Обследовано 336 доноров в возрасте от 19 до 70 лет (средний возраст 46 ± 15 лет). У пяти из этих доноров были получены биопаты кожи для исследования репликативного старения.
ДНК выделяли из 0,5 мл периферической крови, суспензии клеток или среды культивирования фибробластов методом экстракции органическими растворителями. Концентрацию ДНК определяли флуориметрически на спектрофлуориметре «LS 55» («PerkinElmer», Англия) c использованием красителя, малозависимого от длины ДНК (RiboGreen®, возб =487нм, флу=525нм) и зависимого (Hoechst 33528, возб =350 нм, флу=450 нм).
Концентрацию выделенной РНК определяли флуориметрически с использованием РНК-связывающегося красителя Quant-iTTM RiboGreen RNA reagent (MoBiTec), возб=487 нм, флу=524 нм.
Содержание повторяющихся последовательностей генома определяли с помощью метода количественной дот-гибридизации с фотобиотинированными зондами, который подробно описан ранее (Вейко Н.Н. и соавт., 2003). Для определения количества рДНК использовали зонд pHRGВВ-28S (порядковый номер нуклеотидов 9346-10783, HSU 13369, GeneBank), описанный ранее (Вейко Н.Н. и соавт., 1996).
Приготовление препаратов метафазных хромосом, окраску ядрышка лимфоцитов серебром, определение количества АкРГ и анализ активных РГ в интерфазных ядрах лимфоцитов проводили сотрудники лаборатории Общей цитогенетики ГУ МГНЦ РАМН Косяковой Н.В., Мандрон И.А., Еголиной Н.А., Мхитаровой Е.В., Цветковой Т.Г. (рук. проф. Н.А.Ляпунова), применяя вариант метода Ag - окраски, разработанный в лаборатории (Ляпунова Н.А. и соавтр., 2001). Для анализа мы использовали микроскоп Axioplan и цифровую камеру RETIGA 2000R («IMAGING», Канада). Изображения анализировали с использованием компьютерной программы анализа изображений («ИнтерЭВМ», Москва). Для оценки изменения активности ядрышка определяли число гранул серебра и их суммарную площадь не менее чем в 150 интерфазных ядрах.
Культивируемые линии фибробластов были получены из образцов кожи доноров сотрудниками лаборатории Молекулярной биологии ГУ МГНЦ РАМН Т.Д. Смирновой и Л.А. Каменевой. Клетки культивировали в среде Игла с добавлением 10% эмбриональной телячьей сыворотки при 370С в условиях насыщающей влажности в атмосфере 3-5% СО2. Клетки (1/3 от общего количества) пересевали примерно 1 раз в три дня, далее культивировали до субконфлуентного состояния и вновь пересевали.
Схема эксперимента по исследованию действия хромата калия. В лунки 24-луночного планшета («Nunc») вносили 30-50 тыс. клеток, культивировали 3 суток до образования монослоя (100-200 тыс. клеток). Добавляли в среду 4 или 6 мкМ K2CrO4 и инкубировали 4 часа («ранний» ответ на стресс) и 24 часа. Заменяли среду и культивировали клетки в течение 72 часов («поздний» ответ). Для каждой концентрации K2CrO4 и в контрольных вариантах через определенные интервалы времени анализировали клетки с трех-шести лунок планшета.
Ферментативную активность каспазы 3 определяли в белковых лизатах клеток с использованием субстрата QAc-DEVD-AFC, возб=400 нм, флу=490 нм. Реакцию проводили при 33оС в течение 1 часа. Активность каспазы 3 выражали в расчете на единицу ДНК.
Нуклеазную активность определяли методом, разработанным в лаборатории Молекулярной биологии ГУ МГНЦ РАМН, с использованием модельного субстрата – комплекса однонитевой ДНК с 30-звенным олигонуклеотидом, содержащим на 5-конце флуоресцентную группу, а на 3-конце тушитель флуоресценции. При гидролизе эндонуклеазами целостность молекулы олигонуклеотида нарушается, что приводит к разгоранию флуоресценции R6G (возб=524 нм, флу=558 нм). Для калибровки использовали стандартный раствор ДНКазы 1.
Для количественной оценки содержания гена 18S рРНК в геномной ДНК применили метод ПЦР по принципу «TaqMan». Использовали модифицированные олигонуклеотиды («Синтол», Москва), которые на 5-конце содержали карбоксиметилфлуоресцеин (R6G) или флуоресцеин (FAM), на 3-конце – тушитель флуоресценции BQH1. Реакцию ПЦР проводили в приборе Rotor Gene 300 (Сorbett, Австралия).
Статистическую обработку результатов проводили с использованием стандартного пакета программ Statgraphics, Statistica 6.0 и StatPlus. Распределения анализировали по методу Колмогорова-Смирнова. Средние значения величин сравнивали с использованием t-критерия. На всех графиках, если не оговорено особо, приводится стандартная ошибка (SE).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Число копий РГ и относительное количество АкРГ в геномах людей старческого возраста (СВ) и группы сравнения (ГС)
В табл. 1 и на рис. 1 приведены данные об общем числе копий РГ и об относительном количестве АкРГ в геномах людей СВ и ГС. Наблюдается значительное сужение распределения числа копий РГ в группе СВ по сравнению с ГС: уменьшается интервал варьирования и снижается величина дисперсии. По критерию Фишера дисперсии для выборок СВ и ГС различаются.
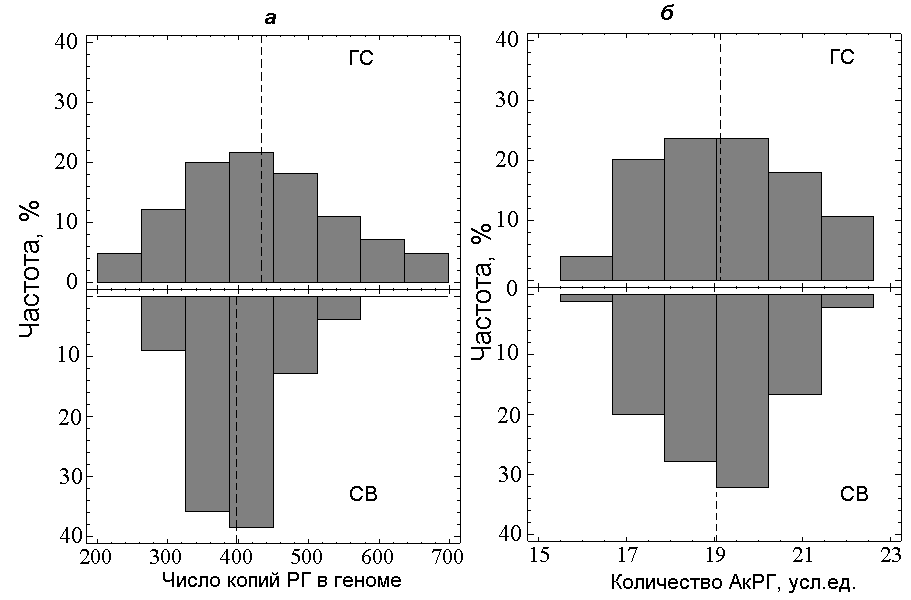
Рис. 1. Частотное распределения общего числа копий РГ (а) и относительного количества АкРГ (б) в геномах людей СВ и ГС.
Таблица 1.
Общее число копий и относительное количество АкРГ в геномах ГС и СВ
| Анализируемые группы | Общее число копий РГ (К) | Кол-во АкРГ (А), усл.ед. | ||||||
| Интервал значений | Среднее | SD | n | Интервал значений | Среднее | SD | n | |
| Группа ГС | 205-699 | 431 | 112 | 336 | 15,5-22,6 | 19,2 | 1,7 | 219 |
| Группа СВ | 272-568 | 397 | 57 | 78 | 16,3-22,1 | 19,1 | 1,2 | 90 |
Средние значения АкРГ в лимфоцитах людей СВ и ГС не различаются, при этом, как и в случае общего числа копий, наблюдается уменьшение интервала варьирования и величины дисперсии для СВ в сравнении с ГС.
Оценка количества метилированных копий РГ в геномах людей старческого и среднего возраста
На наличие в геноме кластеров «молчащих» рибосомных генов (КМРГ) указывает величина отношения общего числа копий РГ (К) к числу активных копий РГ (А), К/А> 26±1 (Вейко Н.Н., 2001). КМРГ не транскрибируются и, как правило, высокометилированы. На рис. 2а приведены распределения величины К/А в геномах группы СВ и ГС. В отличие от ГС, в группе СВ редко встречаются индивиды, у которых в геноме есть небольшие КМРГ.
Поскольку КМРГ высокометилированы, их отсутствие в геноме должно коррелировать со сниженным уровнем метилирования РГ. Мы провели сравнительный анализ метилирования РГ в геномах ГС и СВ. Для этого определили показатель М, равный отношению гибридизационных сигналов НрaII- и Msp1- гидролизатов геномной ДНК (Вейко Н.Н., Ляпунова Н.А. и соавтр., 2008), полученных при гибридизации с зондом на рДНК. Последовательность РГ содержит много сайтов Msp1НрaII. Фрагменты, получающиеся при гидролизе неметилированных копий РГ, имеют малую длину, что препятствует их эффективной иммобилизации на нитроцеллюлозной мембране. Чем больше метилированных копий РГ в геноме, тем выше показатель М.
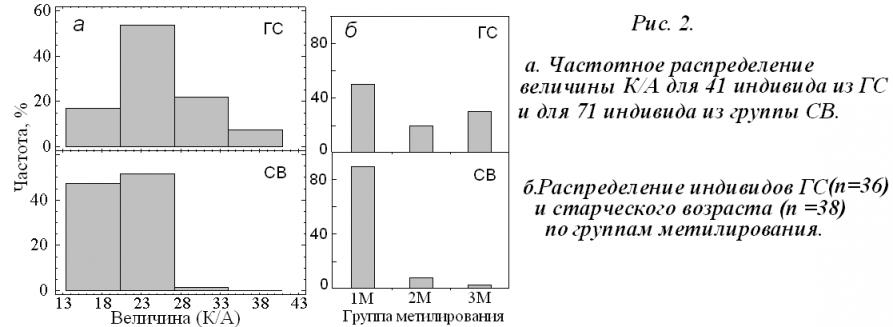
Мы выделили три группы, различающиеся по показателю М. Для доноров группы 1М значения М варьируют от 1,1 до 1,7, для группы 2М показатель метилирования изменяется от 1,7 до 2,5 и для группы 3М – от 2,5 до 3, 1. Более 80% анализируемых образцов ДНК группы СВ были отнесены к группе 1М (мало метилированных копий РГ). Таким образом, в геномах людей СВ снижено содержание КМРГ и это коррелирует со сниженным уровнем метилирования РГ.
Возникает вопрос: теряются ли КМРГ при старении организма или до старости доживают преимущественно те индивиды, у которых в геноме изначально нет копий КМРГ? В последнем случае отсутствие КМРГ в геноме можно было бы рассматривать как прогностический маркер долголетия.
Поскольку мы не располагаем возможностью проследить изменение количества КМРГ в геноме на протяжении всей жизни одних и тех же индивидов, для ответа на поставленный вопрос мы обратились к модельной системе – репликативному старению культивируемых фибробластов кожи человека, которое многими авторами рассматривается как адекватная модель изучения механизмов старения млекопитающих.
Анализ влияния свойств комплекса РГ на скорость репликативного старения фибробластов кожи человека
Для отбора доноров кожи применили два критерия – возраст донора и количество АкРГ в геноме, определенных ранее в культивируемых лимфоцитах. Основные характеристики штаммов приведены в таблице 2.
Таблица 2.
Характеристики анализируемых в работе штаммов фибробластов
| № | Основные характеристики | Порядковый номер штамма фибробластов кожи | ||||
| 2206 | 2207 | 2208 | 2211 | 2212 | ||
| 1 | Возраст донора (год) | 21 | 35 | 52 | 52 | 35 |
| 2 | Максимальное число пассажей (МЧП) | 60 | 66 | 62 | 56 | 47 |
| 3* | Число клеток в субконфлуентной культуре, млн | 3,0 ± 0,3 | 2,7 ± 0,2 | 1,5 ± 0,1 | 1,7 ± 0,1 | 1,9 ± 0,1 |
| 4 | Число клеток (40 пас.) в субконфлуентной культуре, млн | 1,4 ± 0,2 | 2,3 ± 0,2 | 1,7 ± 0,2 | 1,0 ± 0,1 | 0,5 ± 0,1 |
| 5* | Содержание ТП, пг/нгДНК | 0,59± 0,05 | 1,06± 0,04 | 0,74± 0,01 | 0,40± 0,03 | 0,35 ± 0,03 |
| 6* | Количество АкРГ, (усл.ед) | 17,7 ± 0,1 | 17,1 ± 0,1 | 21,5 ± 0,1 | 16,7 ± 0,1 | 20,0 ± 0,2 |
| 7* | Число копий РП | 590 ± 40 | 670 ± 70 | 470 ± 60 | 370 ± 20 | 470 ± 40 |
| 8* | Показатель К/А | 35 | 39 | 22 | 21 | 22 |
| 9* | Степень метилирования РГ, показатель М | 1,7 ± 0,2 | 1,9 ± 0,2 | 1,12± 0,03 | - | - |
| 10* | РНК, мкг/мкг ДНКклетки | 1,6 ± 0,2 | 1,7 ± 0,2 | 3,3 ± 0,3 | 1,4 ± 0,1 | 2,4 ± 0,2 |
| 11* | вкДНК, (% от totДНК) | 3,3 ± 0,5 | 2,2 ± 0,3 | 2,9 ± 0,4 | 3,0 ± 0,5 | 7,4 ± 1,1 |
| 12* | Фрагментация вкДНК | 2,7 ± 0,4 | 2,1 ± 0,2 | 5,2 ± 0,4 | 2,1 ± 0,7 | 3,0 ± 0,9 |
| 13* | Активность каспазы 3,ед.фл./ 1мкг ДНК | 33 ± 2 | 26 ± 3 | 29 ± 2 | 35 ± 3 | 45 ± 5 |
| 14* | Активность нуклеаз, ед.фл./ 1мкг ДНК | 42 ± 4 | 40 ± 4 | 58 ± 3 | 48 ± 4 | 90 ± 4 |
*) характеристики определены для субконфлуентных клеток на 5-м пассаже
Свойства комплекса РГ. Число копий РГ в геномах клеток 5-го пассажа варьировало от 370 до 670, относительное количество АкРГ – от 16,7 до 21,5 усл.ед. Для клеток штаммов 2206 и 2207 значения показателя К/А оказались выше порогового значения 26, что позволяет предположить присутствие в геноме КМРГ. Для остальных штаммов величины К/А находились в интервале значений, характерных для геномов, в которых КМРГ отсутствуют. Для трех штаммов с разными значениями отношения К/А (2206, 2207 и 2208) был определен показатель метилирования. Сравнение значений К/А и М выявило высокую положительную корреляцию между этими параметрами (k = 0,997; р = 0,05; N = 3), что подтверждает предположение о наличии в геномах штаммов 2207 и 2206 высокометилированных кластеров РГ, которые составляют соответственно примерно 33 % и 26 % всех копий РГ. Количество РНК, определенное в расчете на 1 мкг клеточной ДНК (табл.2, строка 9), отражает, прежде всего, количество рРНК, т.к. рРНК составляет от 80 до 90% клеточной РНК. Мы наблюдали положительную зависимость количества РНК от количества АкРГ в геноме клеток (рис. 3).
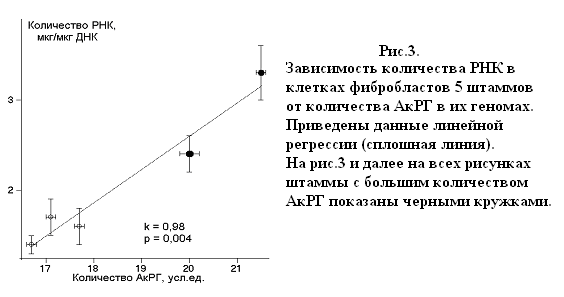
Маркеры репликативного старения
(1) Максимальное число пассажей (МЧП). Скорость репликативного старения характеризуется величиной МЧП клеток культуры (строка 2, табл. 2). Показатель МЧП изменялся от 47 (штамм 2212) до 66 (штамм 2207). Для определения МЧП необходимы длительные эксперименты по культивированию клеток. Мы определили, что можно прогнозировать скорость старения, определяя некоторые параметры культуры, коррелирующие с МЧП, задолго до того, как клетки перестанут делиться.
(2) Число клеток на фиксированной площади на 40-м пассаже (строка 4) коррелирует с МЧП (показатели линейной регрессии, k = 0,99; p < 0,01; n = 5) и также отражает старение культуры – «старые», неделящиеся клетки занимают большую площадь, чем «молодые» и пролиферирующие.
(3) Содержание теломерного повтора в клетках 5-го пассажа. В последние годы получены доказательства того, что уменьшение содержания в геноме ТП – это следствие (маркер), но не причина старения (Оловников А.М., 2003). Содержание ТП в геномах клеток 5-го пассажа (строка 5, табл.2) коррелирует с МЧП (k = 0,99; p < 0,01; n = 5) и может рассматриваться как прогностический маркер старения. Содержание ТП на 5-м пассаже и число клеток на 40-м пассаже также связаны линейной зависимостью (k = 0,97; p = 0,005; n = 5).
Уровень спонтанного апоптоза в клетках 5-го пассажа оценивали по двум показателям: активность в клеточных лизатах одного из ключевых ферментов апоптоза – каспазы 3 (табл. 2, строка 13) и количество внеклеточной ДНК (вкДНК) по отношению к общему количеству ДНК в лунке планшета (строка 11). Значения этих маркеров апоптоза (рис. 4) отрицательно коррелируют с МЧП (и с содержанием ТП).
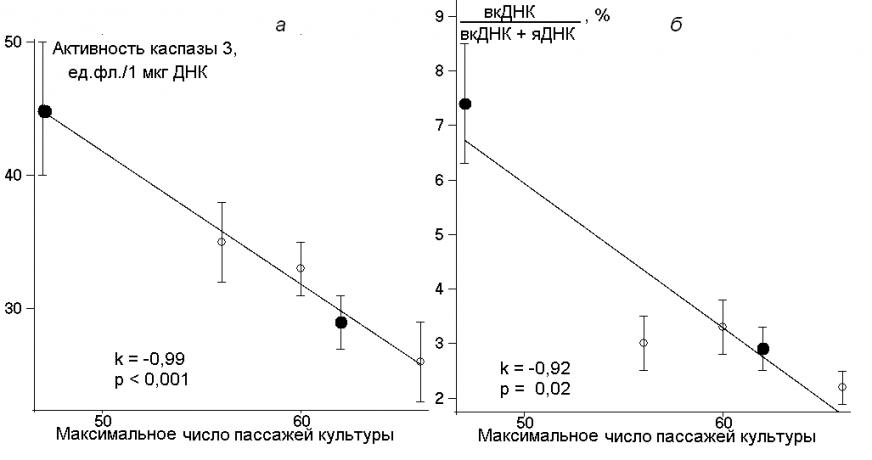
Рис. 4. Зависимость активности каспазы 3 (а) и количества вкДНК (б) в культуре клеток 5-го пассажа от МЧП.
Таким образом, культуры клеток с относительно низкой скоростью репликативного старения на ранних пассажах характеризуются высоким содержанием в геноме ТП и низким уровнем спонтанного апоптоза
Сопоставление свойств комплекса РГ и маркеров старения. Методом линейной регрессии мы проанализировали зависимость свойств комплекса РГ клеток 5-го пассажа (число копий, количество АкРГ, показатели К/А и М) от маркеров старения (МЧП, содержание ТП, спонтанный апоптоз). Характеристики комплекса РГ клеток практически не влияли на скорость пролиферативного старения. К моменту начала культивирования вне организма клетки находятся в определенном состоянии, которое характеризуется уровнем спонтанного апоптоза и содержанием ТП и не зависит от свойств комплекса РГ. Это состояние определяет длительность пролиферативного периода клеток в условиях нормального культивирования при отсутствии внешних воздействий, которые могут индуцировать дополнительный окислительный стресс.
Изменения некоторых свойств генома при репликативном старении
Изменение содержания контрольной последовательности (ТП). На рис. 5 показано содержание ТП в геномной ДНК, выделенной из клеток различных пассажей.
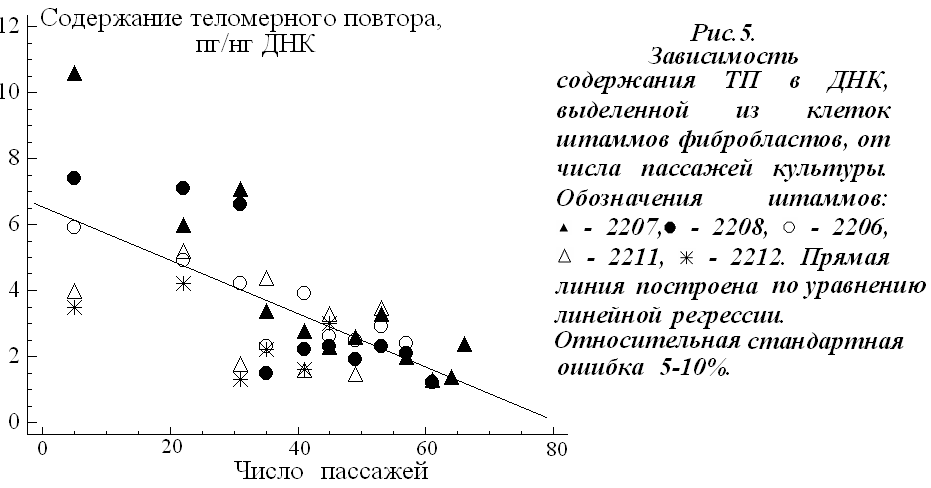
В содержании ТП в ДНК клеток 5-го пассажа наблюдается вариабельность и отрицательная зависимость между содержанием ТП и числом пассажей культуры (k = - 0,7; р < 0,0001; N = 45). Весь период культивирования клеток можно условно разбить на два отрезка: «ранние пассажи» (5-31), когда наблюдается выраженное снижение содержания ТП в ДНК при делении клеток (k= - 0,53; р = 0,01; N = 20) и «поздние пассажи», когда содержание ТП в ДНК клеток незначительно изменяется в последующих генерациях клеток (k = - 0,33; р = 0,1; N = 25). На рис. 6а приведены данные по среднему содержанию ТП в ДНК клеток «ранних» и «поздних» пассажей. Для всех штаммов выявлено достоверное снижение содержания ТП в ДНК клеток «поздних» пассажей.
Изменение содержания РГ и уровня метилирования РГ. Сравнение среднего содержания РГ в ДНК клеток «ранних» и «поздних» пассажей демонстрирует тенденцию к уменьшению общего числа копий РГ в геномах фибробластов при репликативном старении (рис. 6б). В случае штаммов 2207 и 2206, которые содержат КМРГ, уменьшение статистически значимо. Геномы этих штаммов теряют соответственно примерно 36 % и 26 % всех копий РГ. Естественно предположить, что теряются, прежде всего, метилированные КМРГ, содержание которых в геномах клеток «ранних» пассажей близко к количеству теряемых на «поздних» пассажах копий РГ.
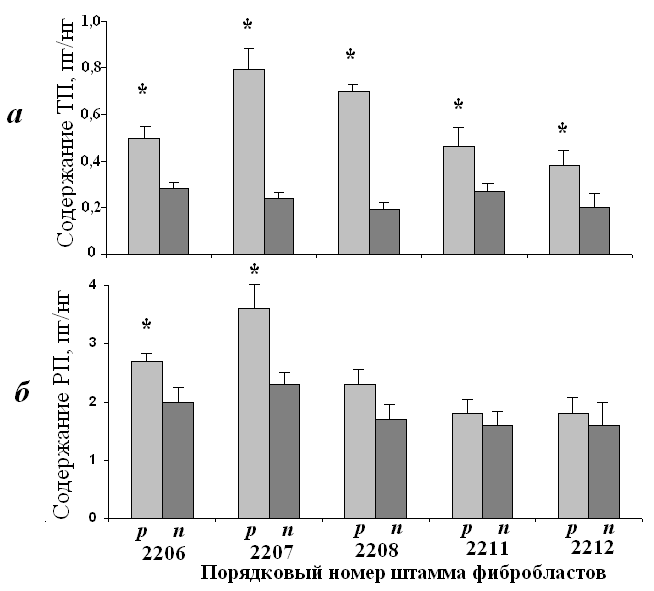
Рис. 6. Средние значения содержания ТП (а) и РП (б) в ДНК культивируемых фибробластов «ранних» (светлые столбики) и «поздних» (темные столбики) пассажей. * - различия в содержании РГ на «ранних» и «поздних» пассажах достоверны (р < 0,001).
Для того чтобы подтвердить это предположение, мы сравнили показатели метилирования РГ для штаммов 2206, 2207 и 2208 на пятом и последнем пассажах (соответственно 57-, 66- и 62-ом). Результаты представлены на рис. 7. На последних пассажах штаммов 2206 и 2207 наблюдается значительное снижение показателя М, в геноме практически не остается высокометилированных копий РГ.
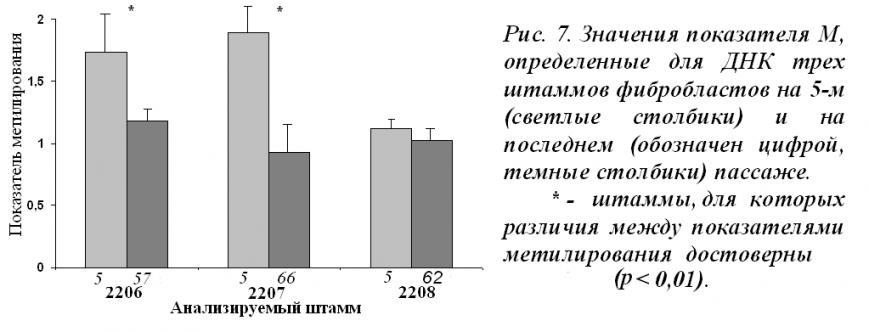
Приведенные данные позволяют сделать вывод: при репликативном старении фибробластов кожи человека из генома удаляются неактивные кластеры высокометилированных РГ.
Повреждение рибосомных генов при репликативном старении
Мы сочли целесообразным подтвердить данные об изменении числа копий РГ при старении фибробластов, полученные с помощью метода дот-гибридизации, методом «real-time» ПЦР (рис. 8).
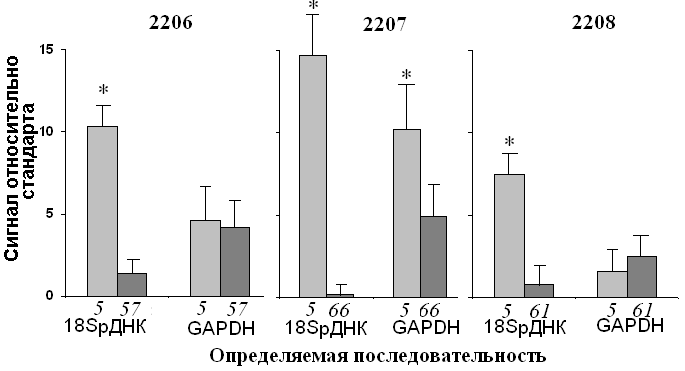
Рис. 8. Относительное содержание гена 18S рРНК и гена GAPDH в ДНК фибробластов 5-го (светлые столбики) и одного из последних (темные столбики) пассажей. Цифры под столбиками – номер пассажа. * - различия в содержании анализируемых генов в ДНК достоверны (р < 0,001).
Анализ содержания фрагмента 18SрДНК длиной 269 п.н. в варианте «ТagMаn» ПЦР был проведен для ДНК штаммов 2206, 2207 и 2208, для которых мы наблюдали наибольшие изменения количества РГ при старении клеток. Для сравнения в тех же образцах ДНК анализировали содержание уникального гена GAPDH. В качестве внутреннего стандарта использовали ген Myd88. Содержание 18SрДНК в ДНК клеток «поздних» пассажей снижалось значительно сильнее, чем можно было ожидать, ориентируясь на данные количественной дот-гибридизации. Изменения в содержании гена GAPDH при старении были разнонаправленными, поэтому низкую эффективность ПЦР в случае рДНК клеток последних пассажей нельзя объяснить ингибиторами, которые могли бы содержаться в образцах ДНК клеток поздних пассажей. Трудно допустить, что на самом деле содержание РГ в геноме при старении снижается на порядок, тем более что по данным количественной дот-гибридизации потери не превышают 40 %. Низкую эффективность ПЦР в этом случае можно объяснить модификацией последовательности РГ в «старых» фибробластах. Известно, что при старении снижается эффективность ответа клеток на повреждающие воздействия. Некоторые виды повреждений в РГ репарируются с гораздо меньшей скоростью, чем аналогичные повреждения последовательностей генома, транскрибируемых РНК полимеразой II (Stevnsner T. et al., 1993). Однонитевые разрывы и модификация оснований приводят к тому, что, во-первых, снижается эффективность комплексообразования используемых в ПЦР праймеров с ДНК-мишенью, и, во-вторых, полимераза Taq1 не способна «прочитать» весь анализируемый фрагмент. Модификация последовательности РГ в клетке, по-видимому, должна сопровождаться снижением количества транскрибируемых копий РГ, поскольку повреждение ДНК является препятствием для работы РНК полимеразы 1. Таким образом, мы можем высказать предположение, что, несмотря на относительно небольшое снижение общего числа копий РГ при репликативном старении, количество неповрежденных копий, которое потенциально способно транскрибироваться, снижается в несколько раз. Это может являться одной из причин (возможно, решающей) блокирования пролиферации.
Влияние свойств комплекса РГ на функционирование культивируемых фибробластов кожи в условиях окислительного стресса, вызываемого хроматом калия
Репликативное старение, равно как и естественное старение организма, зависит от двух основных факторов – свойств генома и свойств среды культивирования (обитания). Действие неблагоприятных факторов среды может значительно ускорять старение и сокращает продолжительность пролиферативного периода культивируемых клеток. В англоязычной литературе введен специальный термин – стресс-индуцированное преждевременное старение (SIPS) (Toussaint O. et all., 2000). Стресс-индуцированное старение сопровождается значительным снижением длины теломеры уже на ранних пассажах культивируемых клеток (Toussaint O. et all., 2000). В нашей работе мы исследовали действие K2CrO4 на культивируемые фибробласты кожи здоровых людей, чтобы оценить, могут ли свойства комплекса РГ влиять на последствия действия на клетки неблагоприятных факторов среды, которые индуцируют сильный окислительный стресс и ускоряют процесс старения. Исследование влияния K2CrO4 на штаммы фибробластов 5-го пассажа, включало 2 этапа, которые были спланированы на основании проведенных ранее исследований кинетики действия K2CrO4 на фибробласты здорового донора (Вейко Н.Н., Терехов С.М. и соавтр., 2005):
- «Ранний» ответ на стресс, который мы тестировали после действия «малых» доз K2CrO4 (4 часа культивирования в присутствии 4 и 6 мкМ K2CrO4 );
- «Поздний» ответ, индуцированный заменой среды культивирования, после действия 4 и 6 мкМ K2CrO4 хромата в течение суток. Анализ проводили через 72 часа после смены среды.
«Ранний» ответ фибробластов на действие «малых» доз K2CrO4
Изменение количества клеточной РНК. Действие малых доз K2CrO4 вызывает увеличение количества РНК в культивируемых фибробластах 4-го пассажа здорового молодого донора (Вейко Н.Н., Терехов С.М. и соавтр., 2005). Анализ изменения количества РНК при действии малых доз хромата в клетках пяти штаммов в связи с параметрами, приведенными в таблице 2 (маркеры старения, свойства комплекса РГ, возраст), выявил только одну зависимость – от возраста донора (рис. 9). Очевидно, что в фибробластах, полученных от доноров 52 лет, наблюдается снижение количества РНК в присутствии хромата, в отличие от клеток молодых доноров, для которых количество РНК при действии K2CrO4 увеличивается на 40-70 %.
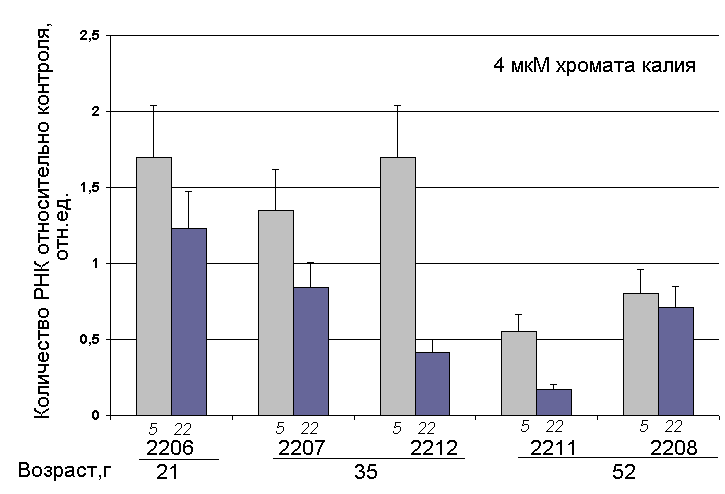
Рис. 9. Изменение количества РНК в клетках 5 (светлые столбики) и 22 (темные столбики) пассажей относительно контроля (5 и 22 пассаж без K2CrO4) при действии 4 мкМ K2CrO4 (4 часа).
Ранее было обнаружено, что эффект изменения количества РНК при действии 4 мкМ K2CrO4 снижается по мере увеличения числа пассажей, т.е. по мере старения культуры. Мы дополнили эти данные, сравнив изменения количества клеточной РНК при действии 4 мкМ K2CrO4 для пяти культур на 5 и 22 пассажах (рис. 9). Для всех штаммов на 22-м пассаже («постаревшие» клетки), за исключением 2206 (донору 21 год), наблюдается достоверное снижение количества РНК при действии 4мкМ хромата, т.е. тот же эффект, что и для фибробластов 5-го пассажа для 52-летних доноров. Полученный результат достаточно интересен. Наши данные и данные других авторов показали, что репликативное старение фибробластов не зависит от возраста донора кожи. Однако изменения количества РНК при действии окислителя указывают на то, что «молодые» клетки доноров старше 50 лет по некоторым свойствам похожи на «состарившиеся» клетки доноров младшего возраста. Возможно, эти особенности клеток «старых» доноров, не влияя на репликативное старение в нормальных условиях, будут влиять на скорость старения, обусловленного дополнительным стрессом.
Изменения уровня апоптоза. На рис. 10 приведены данные относительного изменения величин, характеризующих апоптоз, при действии на фибробласты малых (4*4 и 6*4 мкМ*ч) доз K2CrO4. Активность каспазы 3 имеет тенденцию к снижению при действии меньшей дозы окислителя (эффект достоверен только для штамма 2208) и немного возрастает при действии большей дозы. Ранее было показано, что количество клеток с признаками апоптоза при раннем ответе на действие 4мкМ хромата не увеличено по сравнению с контролем (Вейко Н.Н., Терехов С.М. и соавтр., 2005).

Рис. 10. Изменения активности каспазы 3 (темные столбики) и количества вкДНК (светлые) клеток 5-го пассажа в присутствии малых доз K2CrO4. За единицу приняты значения соответствующих параметров клеток в отсутствие K2CrO4.
На фоне незначительных изменений активности каспазы 3 при действии 6 мкМ K2CrO4 возрастает количество вкДНК. Исключение составляет штамм 2212, для которого наблюдается значительное снижение количества вкДНК по отношению к контролю при обеих дозах хромата. Одной из причин увеличения количества вкДНК может быть ускорение процесса деградации уже апоптотических клеток при действии окислительного стресса. Нельзя также исключить, что при действии малых доз окислителя в ответ на дополнительный стресс происходит синтез новых последовательностей генома (Gahan C.G. et al., 2008). Изменения количества вкДНК при действии K2CrO4 коррелируют с маркерами репликативного старения (МЧП и содержанием ТП в геноме (k = 0,85, р = 0,05, N=5)). Максимальное увеличение количества вкДНК при действии 4мкМ хромата наблюдается у клеток штаммов с высоким содержанием ТП, т.е. у штаммов с замедленным репликативным старением. Мы не обнаружили какой-либо зависимости между изменениями параметров, характеризующих апоптоз относительно контроля, и свойствами комплекса РГ.
«Поздний» ответ фибробластов на действие хромата калия
Известно, что смена среды культивирования индуцирует пролиферацию в контрольных субконфлуентных клетках и арест клеточного цикла и апоптоз в экспонированных клетках (Pritchard D.E., 2001). Исследование кинетики изменения маркеров апоптоза, проведенное ранее на фибробластах здорового молодого донора, показало, что максимальные изменения наблюдаются на 72 часу культивирования после смены среды, в которой клетки инкубировали 24 часа (4 и 6 мкМ K2CrO4) (Вейко Н.Н., Терехов С.М. и соавтр., 2005). В нашей работе мы воспроизвели эти условия.
Уровень апоптоза клеток через 72 часа после стимуляции апоптоза путем смены среды мы оценили по активности каспазы 3 и количеству фрагментов вкДНК в среде культивирования. Абсолютные значения активности каспазы 3 в клеточных лизатах экспонированных клеток зависят от маркеров старения (рис. 11): чем выше содержание ТП в геноме штамма (МЧП), тем меньшее число клеток подвергается апоптозу при действии окислительного стресса. Свойства комплекса РГ не влияют на абсолютные значения активности каспазы 3.
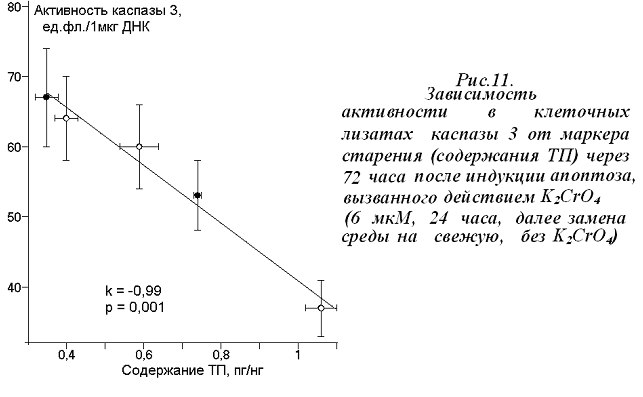
Однако относительные изменения активности каспазы 3 при действии K2CrO4 меньше в клетках, геном которых содержит большие количества АкРГ (рис. 12а) и не зависят от маркеров старения. Аналогичную зависимость мы наблюдали для другого маркера апоптоза – вкДНК (рис. 12б).
Относительные изменения количества вкДНК при действии 6 мкМ хромата по сравнению с контролем (клетки без хромата) тем больше, чем меньше активных копий РГ содержит геном.
Таким образом, интенсивность апоптоза клеток, вызванного окислителем, определяется маркерами старения (содержанием ТП, МЧП), которые отражают способность клетки противостоять окислительному стрессу (Fuster J.J. et al., 2006; Duan J. et al., 2005; Houben J.M. et al., 2008). Относительные изменения уровня апоптоза в культуре клеток при действии окислителя зависят от количества активных копий РГ в геноме. Можно ожидать, что из двух штаммов клеток, которые характеризуются одинаковыми маркерами старения, более устойчивой к индуцируемому внешним воздействием апоптозу будет культура с большим количеством активных копий РГ в геноме.
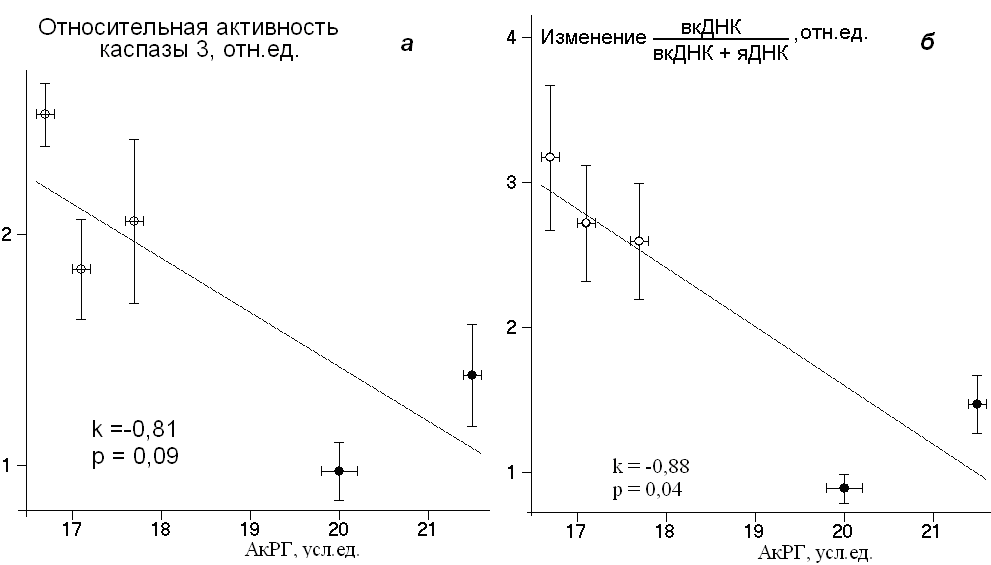
Рис. 12. Зависимость изменения активности каспазы 3 (а) и количества вкДНК (б) в экспонированных клетках относительно контроля от количества АкРГ в геноме штамма. Условия: а – приводятся средние значения для двух концентраций хромата; б – клетки инкубировали в присутствии 6мкМ хромата.
Количество АкРГ и активность нуклеаз в лизатах клеток
Исследования нуклеазной активности (НА) имеют прямое отношение к проблеме старения. С возрастом увеличивается уровень апоптоза клеток, возрастает количество вкДНК. В составе вкДНК накапливаются неметилированные CpG-богатые фрагменты, в том числе и рибосомные гены, которые могут выступать в роли лигандов для рецепторов TLR9, стимулируя синтез цитокинов и вызывая дополнительный окислительный стресс. С возрастом концентрация РГ в сыворотке крови возрастает, особенно при заболеваниях, связанных с увеличением гибели клеток (Вейко Н.Н. и соавтр., 2007, 2008). Поскольку количество неметилированных копий РГ пропорционально количеству активных копий, то чем больше количество АкРГ, тем большее количество фрагментов РГ – лигандов TLR9 будут переходить в состав вкДНК при апоптозе одной клетки. Для «нейтрализации» (путем гидролиза) этих фрагментов необходима повышенная НА. Анализируемые штаммы фибробластов представляют удобную модель для проверки предположения о влиянии количества АкРГ на уровень НА клеток.
Мы охарактеризовали НА клеточных лизатов интактных клеток и показатель, отражающий степень фрагментации вкДНК (табл. 2). Основным ферментом, обуславливающим тестируемую в наших условиях Mg2+-зависимую эндонуклеазную активность, является ДНКаза1 (Campbell V.W., Jackson D.A., 1980). Экспрессия этого фермента увеличивается при гипоксии клеток (Kominato Y. et all., 2007). Известно, что ДНКаза 1 играет существенную роль в процессе элиминации фрагментов вкДНК из организма (среды культивирования).
Уровень НА в клетках при различных условиях культивирования
5 штаммов клеток 5-го пассажа мы разделили на две группы – с малым количеством АкРГ (2207, 2207 и 2211) и большим (2208 и 2212).
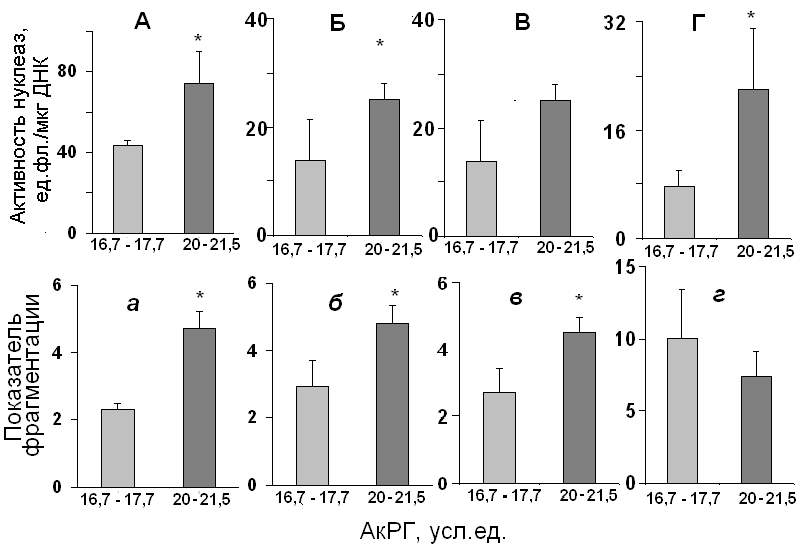
Рис. 13. Средние значения НА (А-Г) и показателя фрагментации (а-г) в группе клеток с относительно малыми (светлые столбики) и большими (темные) количествами АкРГ (усл.ед.) в геноме. Варианты: А,а – стандартное культивирование; Б,б – действие малых доз (приводятся средние значения для двух доз) K2CrO4; В,в и Г,г – апоптоз, вызванный соответственно действием 4 мкМ или 6 мкМ K2CrO4 («поздний ответ»). (*) -отмечены значения, которые различаются с вероятность p < 0,05.
Для этих групп были определены средние значения показателя фрагментации и НА (рис. 13). При стандартных условиях культивирования значения НА (рис. 13А) и уровень фрагментации ДНК (рис. 13а) в клетках с большим количеством АкРГ примерно в 2 раза выше, чем в клетках с низким количеством АкРГ. «Ранний» ответ на действие хромата калия (4 часа, 4 или 6 мкМ) сопровождается значительным снижением НА клеток (рис. 13Б). Вероятно, окислительный стресс уменьшает возможности клеток эффективно деградировать вкДНК. Значения НА и степени фрагментации (рис. 13б), как и в случае спонтанного апоптоза клеток, зависят от количества АкРГ в геноме. Уровень НА клеток, в которых протекает процесс апоптоза («поздний» ответ), индуцированный 4мкМ (рис. 13В) или 6 мкМ (рис. 13Г) K2CrO4 также положительно коррелирует с количеством в геномах штаммов АкРГ. Таким образом, для трех состояний клеток (стандартное культивирование, «ранний» и «поздний» ответ на окислительный стресс) мы обнаружили одни и те же закономерности: уровень Mg2+-зависимой нуклеазной активности клеток в штаммах с высоким относительным количеством АкРГ значительно выше, чем в клетках с низким количеством АкРГ. В большинстве случаев это соответствует более высокой степени фрагментации вкДНК.
ЗАКЛЮЧЕНИЕ
В основе большинства теорий старения лежит предположение об определяющей роли окислительного стресса, который вызывается как эндогенными причинами (функционирование митохондрий), так и экзогенными (действие окружающей среды и образа жизни). Устойчивость организма (клетки) к действию свободных радикалов и, следовательно, скорость старения, ассоциированные со старением заболевания и продолжительность жизни – это производная функционирования большого числа генов, среди которых весьма трудно выделить определяющие процесс естественного старения. Свойства комплекса РГ индивида (клетки) – это фон, на котором развивается клеточный ответ на окислительный стресс. Для эффективного ответа на стресс клетке необходимо достаточное количество рибосом, которые обеспечат синтез нужного количества белков, участвующих в процессах детоксикации, репарации и апоптоза поврежденных клеток. Именно поэтому рибосомные гены давно привлекают внимание исследователей процесса старения.
Количество активных копий РГ в геноме – определяющая характеристика РГ, напрямую связанная с количеством клеточной РНК. Мы обнаружили, что для группы СВ по сравнению с ГС наблюдается сужение распределения по количеству АкРГ (рис. 14). Данные многолетних наблюдений сотрудников лаборатории Общей цитогенетики ГУ МГНЦ РАМН, а также данные литературных источников говорят о том, что относительное количество АкРГ (количество копий РГ в потенциально-активной фракции РГ (Conconi A., 1992)) в геноме клеток – врожденная характеристика организма, не изменяющаяся с возрастом.
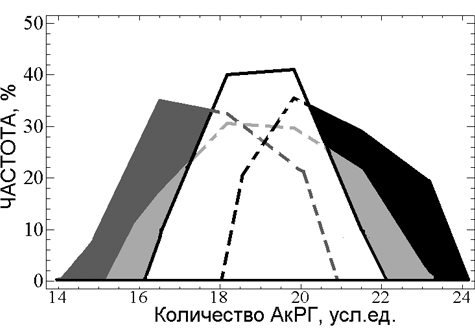
Рис. 14. Сравнение распределений по количеству АкРГ для выборки СВ (белое поле), группы среднего возраста (светло-серый цвет), группы больных ревматоидным артритом ((Шубаева Н.О., 2003), темно-серый цвет) и больных шизофренией ((Вейко Н.Н., Еголина Н.А. и соавтр., 2003), черный цвет).
Таким образом, сужение распределения по количеству АкРГ в группе СВ говорит о том, что до 80 лет не дожили индивиды с минимальными и с максимальными количествами АкРГ в геноме. Мы предположили, что индивиды с малым количеством АкРГ (менее 16,5 усл.ед.) не доживают до старческого возраста, в том числе и потому, что их клетки обладают сниженной устойчивостью к окислительному стрессу. Относительно небольшие повреждения клеток сопровождаются индукцией апоптоза, что приводит к более раннему старению органов и тканей. Это предположение подтвердилось при исследовании действия окислительного стресса, вызываемого малыми дозами хромата калия, на 5 линий фибробластов кожи доноров с различным количеством АкРГ в геноме. Относительные изменения в уровне показателей апоптоза при действии на клетки с низкими количествами АкРГ были в несколько раз больше, чем в клетках с большими количествами АкРГ. Аналогичные данные были получены ранее для фибробластов кожи больных ревматоидным артритом (РА) (Шубаева Н.О., 2003). В этой связи интересно отметить, что у большей части больных РА, который является социально значимым заболеванием, сокращающим продолжительность жизни на 10-15 лет, ранее наблюдали более низкие, чем у возрастной нормы, количества АкРГ в геноме (см. рис. 14). Больные РА составляют подгруппу людей с низкими количествами АкРГ среди людей среднего и молодого возраста, которые, при прочих равных условиях, имеют вероятность не дожить до 80 лет.
Индивиды с большим количеством АкРГ (более 22 усл.ед.) также не представлены в выборке СВ. Мы объясняем это двумя причинами. Как показали данные модельного исследования действия K2CrO4 на культивируемые фибробласты, клетки с большим количеством АкРГ повышенно устойчивы к апоптозу, индуцируемому генотоксическим агентом. Благодаря более высокой активности синтеза белка (большего количества рРНК, а значит и рибосом) клетки с поврежденной ДНК могут выжить и не подвергнуться апоптозу. Но при этом возрастет вероятность мутаций в ДНК, что может привести к возникновению опухоли или других заболеваний, сокращающих продолжительность жизни.
Вторая возможная причина – это наличие в популяции генетической патологии, для которой характерно увеличение количества АкРГ и не высокая продолжительность жизни. Из литературы известно пока только одно заболевание (исключая синдром Дауна с трисомией по 21 хромосоме), при котором было обнаружено для части больных значительное увеличение количества АкРГ в геноме – это шизофрения (Вейко Н.Н., Еголина Н.А. и соавтр., 2003) (рис. 14). Авторами этих работ высказано предположение, что увеличение активности РГ связано с наличием врожденной генетической патологии, для компенсации которой необходим интенсивный синтез белка и, следовательно, большое количество АкРГ в геноме.
Общее число копий РГ зависит от количества АкРГ в геноме и от количества метилированных КМРГ. Результаты, полученные в нашем исследовании, позволяют сделать вывод, что при старении геном, с большой вероятностью, теряет высокометилированные КМРГ. Эти данные могут отчасти объяснить противоречивость полученных ранее разными авторами результатов об изменении количества и метилирования РГ при старении клеток и тканей животных. В зависимости от наличия или отсутствия КМРГ в геноме исследуемых клеток можно обнаружить или не обнаружить статистически значимое снижение содержания РГ в геноме. КМРГ не транскрибируются, являясь своеобразным «балластом» генома. Потеря этих последовательностей при старении не должна сказываться на количестве синтезируемой РНК- полимеразой 1 рРНК. Также важен обнаруженный нами факт, что в состарившихся клетках, имеет место повреждение цепи рДНК в значительном числе копий рДНК. Эти нарушения могут приводить как к блокированию клеточного цикла, так и к низкой устойчивости к стрессу. Оба этих события сопутствуют старению и смерти организма.
Наши данные показали, что распределение по числу копий РГ в геноме для людей старше 80 лет значительно сужено по сравнению с выборкой здоровых людей среднего возраста (см. рис. 15). По-видимому, значительное уменьшение доли высокопийных по рДНК геномов в группе СВ происходит вследствие трех причин: (1) потеря в течение жизни КМРГ, которые встречаются только в геномах с большим числом копий (Вейко Н.Н., 2001), (2) снижение числа людей с большим количеством АкРГ, которым соответствуют большое число копий РГ и (3) наличие в популяции генетической патологии, для которой характерно увеличение общего числа копий РГ и не высокая продолжительность жизни. Увеличение общего числа копий РГ, также как и количества АкРГ, ранее наблюдали для геномов больных шизофренией (см. рис. 15). Небольшое уменьшение доли низкокопийных по рДНК геномов в выборке СВ связано, по-видимому, с уменьшением в выборке СВ людей с низкими количествами АкРГ, геномы которых содержат мало КМРГ.
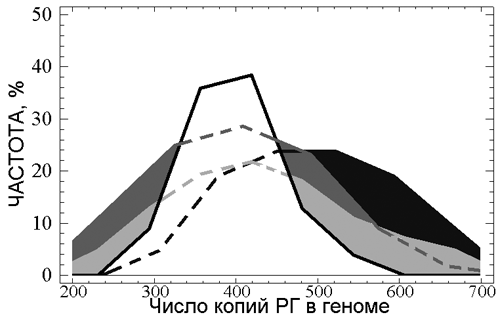
Рис. 15. Сравнение распределений по числу копий РГ для выборки СВ (белое поле), группы среднего возраста (светло серый цвет), группы больных ревматоидным артритом ((Вейко Н.Н., Шубаева Н.О. и соавтр., 2006), темно-серый цвет) и больных шизофренией ((Вейко Н.Н., Еголина Н.А. и соавтр., 2003), черный цвет).
Исследование репликативного старения показало, что длительность пролиферативного периода культур с количеством АкРГ в геномах от 16,7 до 21,5 усл.ед. не зависит от свойств комплекса РГ и диктуется определенным состоянием клетки к началу культивирования вне организма. Это состояние может быть охарактеризовано не зависящими от свойств комплекса РГ, но коррелирующими между собой параметрами – содержанием теломерного повтора в геноме, показателями спонтанного апоптоза клеток (активность каспазы 3 и количество вкДНК). Штаммы с максимальными содержаниями ТП в геноме имеют минимальные показатели уровня апоптоза на раннем пассаже и переживают максимальное число пассажей. Однако интенсивность ответа клеток ранних пассажей на экзогенное повреждающее воздействие напрямую зависит от количества АкРГ: чем больше АкРГ в геноме, тем меньше относительное увеличение активности каспазы 3 и количества вкДНК в культуре.
При изучении репликативного старения и ответа клеток на окислительный стресс обнаружен новый факт, имеющий принципиальное значение для развития дальнейших исследований роли РГ в процессах старения. Оказалось, что от количества АкРГ в геноме фибробластов напрямую зависит эндонуклеазная активность клеток, которую мы тестировали в клеточных лизатах. Положительную корреляцию между НА и количеством АкРГ в геноме мы обнаружили в интактной субконфлуентной культуре клеток, при действии на клетки малых доз хромата калия и при индукции апоптоза клеток. Повышенную НА в клетках с большим количеством АкРГ нельзя объяснить увеличением общего уровня синтеза белка в клетках с более активным синтезом рРНК. При действии малых доз хромата калия в одном из штаммов с большим количеством АкРГ наблюдалось снижение количества клеточной РНК, но уровень НА оставался высоким. Для клеток с большим количеством АкРГ и соответственно более высоким уровнем НА, мы наблюдали, как правило, значительно более сильную фрагментацию внеклеточной ДНК.
В работе мы высказали предположение, что повышенная НА клеток с большим количеством АкРГ в геноме – это возможная компенсаторная реакция клетки на более высокие концентрации CpG-богатых фрагментов РГ в внеклеточной среде, которые могут нанести вред, индуцируя дополнительный окислительный стресс путем взаимодействия с рецепторами TLR9. Очевидно, для окончательного вывода о роли высоких значений НА в функционировании клеток с большим количеством АкРГ требуются дальнейшие исследования.
ВЫВОДЫ
- В выборке людей старческого возраста по сравнению с людьми среднего возраста значительно сужены интервалы варьирования общего числа копий РГ в геноме и количества активных копий РГ.
- У людей старческого возраста снижено содержание в геноме высокометилированных кластеров молчащих рибосомных генов. При репликативном старении геном человека теряет высокометилированные кластеры неактивных копий РГ.
- При репликативном старении культивируемых фибробластов кожи человека происходит значительное повреждение первичной структуры рДНК, что проявляется в значительном занижении показателей real-time ПЦР.
- Скорость репликативного старения фибробластов кожи и маркеры старения не зависят от геномной дозы РГ и от возраста доноров кожи.
- При действии хромата калия, индуцирующего дополнительный окислительный стресс, относительные изменения в уровне апоптоза клеток отрицательно коррелируют с количеством активных копий РГ в геноме клетки: минимальные изменения в уровне апоптоза демонстрируют штаммы с большим количеством РГ.
- Уровень эндонуклеазной активности фибробластов (и степень фрагментации внеклеточной ДНК) при нормальном культивировании и в условиях окислительного стресса положительно коррелирует с количеством активных копий РГ в геноме штамма.
Список работ, опубликованных по теме диссертации
- Малиновская Е.М. Изменения комплекса рибосомных генов человека при старении./ Малиновская Е.М., Смирнова Т.Д., Еголина Н.А., Цветкова Т.Г., Косякова Н.В., Мандрон И.А., Мхитарова Е.В., Костюк С.В., Терехов С.М., Местергази Г.М., Вейко Н.Н., Ляпунова Н.А. // Медицинская генетика. – 2008. – Т.7, №2., С.10-16.
- Ермаков А.В. Фрагменты ДНК, обнаруживаемые в среде после воздействия ионизирующей радиации в адаптирующих дозах, являются фактором стресс-сигнализации между лимфоцитами и клетками-свидетелями. / Ермаков А.В., Костюк С.В., Еголина Н.А., Малиновская Е.М., Вейко Н.Н., Спитковский Д.М. // Рад.биология. Радиоэкология. – 2007. – Т.47, №2. – С.133-140.
- Ермаков А.В. Сигнализация между лимфоцитами человека после индукции эффекта свидетеля ионизирующей радиацией в адаптирующих дозах. / Ермаков А.В., Костюк С.В., Еголина Н.А., Калашникова Е.А., Кокаровцева С.Н., Малиновская Е.М., Вейко Н.Н. // Рад.биология. Радиоэкология. – 2007. – Т.47, №6, С.650-657.
- Ermakov A.V. Factors of stress signaling X-irradiatid and noniradiated human lymphocytes. / Ermakov A.V., Kostyuk S.V., Konkova M.S., Egolina N.A., Malinovskaya E.M., Veiko N.N. // Ann N Y Acad Sci. – 2008 –V.1137. – P.41-46.
- Малиновская Е.М. Количественные характеристики комплекса рибосомных генов у индивидов старческого возраста. / Малиновская Е.М. // Материалы 70-й юбилейной итоговой Республиканской научной конференции студентов и молодых ученых с международным участием «Вопросы теоретической и практической медицины». I часть. – Уфа. 2005. – С.15-16.
- Вейко Н.Н. Фрагменты внеклеточной ДНК – факторы клеточной стресс-сигнализации при действии ионизирующей радиации. / Вейко Н.Н., Ермаков А.В., Костюк С.В., Малиновская Е.М., Еголина Н.А., Замулаева И.А., Саенко А.С. // Тез. Докл. Международной конференции “Новые направления в радиобиологии” – Москва, 2007. – С.10-13.
- Konkova M.S. The cell-free DNA fragments are factors of stress-signaling from irradiated to non-irradiated human lymphocytes after exposure by low doses of the X-radiation. / Konkova M.S., Ermakov A.V., Kostyuk S.V., Egolina N.A., Malinovskaya E.M., Veiko N.N. // CNAPS-V (“Circulating Nucleic Acids in Plasma/ Serum”): Abstracts. – Moscow, 2007. – P.16.
- Egolina N.A. Human ageing is not accompanied by decreasing of genomic dosage of ribosomal genes. Тез. 6-го европейского конгресса «Healthy and active ageing for all Europeans». / Egolina N.A., Lyapunova N.A., Veiko N.N., Mkhitarova E.V., Tsvetkova T.G., Mandron I.A., Kosyakova N.V., Malinovskaya E.M., Agapova R.K., Porokhovnik L.N., Mestergazi G.M. // Успехи геронтологии. – 2007. – Т.20, №3. – С.30.
- Малиновская Е.М. Изменения комплекса рибосомных генов при репликативном старении фибробластов кожи человека. / Малиновская Е.М., Вейко Н.Н. // Тезисы V конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины». – Москва. 2008. – С.261-262.
Список используемых сокращений
АкРГ – активные копии рибосомных генов;
вкДНК – внеклеточная ДНК;
ГС – группа сравнения;
КМРГ – кластеры «молчащих» (т.е. неактивных) генов;
МЧП – максимальное число пассажей;
НА – нуклеазная активность;
РА – ревматоидный артрит;
РГ – рибосомные гены;
РП – рибосомный повтор;
СВ – люди старческого возраста;
ТП – теломерный повтор;
MyD88 –миелоидный фактор дифференцировки;
TLR – «Toll-like»-рецепторы.

