Биохимические особенности свободнорадикальн ого окисления в ротовой жидкости и крови при ишемической болезн и сердца и сахарно м диабет е 2 типа
- На правах рукописи
- Литвинова Марина Георгиевна
БИОХИМИЧЕСКИЕ особенности свободнорадикального окисления в Ротовой жидкости и крови при ИШЕМИЧЕСКОЙ БОЛЕЗНи СЕРДЦА
И САХАРНоМ ДИАБЕТе 2 ТИПА
03.01.04 - биохимия
- Автореферат диссертации
- на соискание ученой степени
кандидата медицинских наук
Краснодар – 2012
Работа выполнена в государственном бюджетном образовательном учреждении высшего профессионального образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ГБОУ ВПО КубГМУ Минздрава России).
Научный руководитель: доктор медицинских наук, профессор
Быков Илья Михайлович.
Официальные оппоненты:
Курзанов Анатолий Николаевич, доктор медицинских наук, профессор,
ГБОУ ВПО КубГМУ Минздрава России, кафедра клинической фармакологии и функциональной диагностики ФПК и ППС, профессор кафедры;
Никулина Дина Максимовна, доктор медицинских наук, профессор,
государственное бюджетное образовательное учреждение высшего профессионального образования «Астраханская государственная медицинская академия» Министерства здравоохранения Российской Федерации (ГБОУ ВПО АГМА Минздрава России), кафедра биологической химии с курсом клинической лабораторной диагностики, заведующая кафедрой.
Ведущая организация – государственное бюджетное образовательное учреждение высшего профессионального образования «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ГБОУ ВПО РостГМУ Минздрава России).
Защита состоится «____» декабря 2012 года в ____ час. на заседании диссертационного совета Д208.038.02 на базе ГБОУ ВПО КубГМУ Минздрава России (350063, Краснодар, ул. Седина, 4, тел. (861) 2627375, ГБОУ ВПО КубГМУ Минздрава России).
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО КубГМУ Минздрава России.
Автореферат разослан «____» ____________ 2012 г.

Учёный секретарь
диссертационного совета
Д208.038.02 профессор Л.А. Скорикова
Общая характеристика работы
Актуальность исследования. Среди заболеваний, существенно ухудшающих прогноз для жизни и здоровья населения, а, следовательно, имеющих важное социальное значение, особое место занимает патология сердечно-сосудистой системы (ССС) - ишемическая болезнь сердца (ИБС), инфаркт миокарда, сосудистые нарушения при сахарном диабете (СД) 2 типа, которые в последнее время нередко встречаются сочетано и характеризуются высоким уровнем инвалидности и смертности. Патология ССС практически на всех этапах ее развития сопровождается в той или иной мере выраженным окислительным стрессом (ОС) (J.M. Stratton et al., 2000; Е. Stoupel, М. Jottrand, 2001; М.И.Балаболкин и соавт., 2005; И.Н. Ступаков, Р.Г. Гудкова, 2008; Л.Л. Берштейн, 2007; Л.Б. Лазебник и соавт., 2009; О.В. Зайратьянц, Л.В. Кактурский, 2009; Н.Ф. Измеров, Г.И. Тихонова, 2010; В.В. Кухарчук, Э.М. Тарарак, 2010; M. Garcia-Caballero et al., 2010; И.И. Дедов, М.В. Шестакова, 2011). Известно, что в основе ведущих механизмов развития сосудистых осложнений у больных с ИБС и СД 2 типа лежат многогранные патобиохимические изменения, появляющиеся в результате усиления свободнорадикального окисления (СРО) и сопровождающиеся избыточным образованием активных форм кислорода (АФК), свободных радикалов и реактивных молекул (липидов, нуклеиновых кислот, белков и других соединений), которые наряду с дислипидемией, дефицитом инсулина или инсулинорезистентностью, и, как следствие, гипергликемией при СД являются одним из основных компонентов патогенеза (B. Halliwell, J.M.C. Gutteridge, 1999; А.И. Карпищенко, 2001; В.В. Зинчук и соавт., 2003; М.И. Балаболкин и соавт.,, 2005; М.В. Кудряшова и соавт., 2010).
Необходимость своевременной диагностики и лечения болезней системы кровообращения определяется еще и тем, что в 2008 году летальность населения от этих заболеваний в России составила 57,1%, что значительно превышает показатели в развитых европейских странах (Ощепкова Е.В., 2009), причем большая часть ее приходится на смертельный исход по причине ИБС. Известно, что АФК приводят к повышению уровня окисленных липопротеинов низкой плотности (ЛПНП), которые играют особую патогенетическую роль в формировании осложнений при патологии ССС. Окисленные ЛПНП увеличивают проницаемость эндотелия, усиливают адгезию лейкоцитов на его поверхности эндотелия, миграцию лейкоцитов и макрофагов в субэндотелиальное пространство, что сопровождается нарушением равновесия в прооксидантно-антиоксидантной системе и является ведущим механизмом повреждения миокарда и сосудов (J.A. Schaar et al., 2004; А.В. Болтач, 2009; С.А. Румянцева и соавт., 2010). Изучение взаимоотношений в ферментной антиоксидантной системе (АОС) эритроцитов показало, что она является чувствительным индикатором для оценки функционального состояния ССС (С.А. Чепурненко, 2010) и тяжести заболевания (А.А. Хозин и соавт., 1999). Учитывая увеличение распространенности СД 2 типа среди населения, в настоящее время нередко можно наблюдать сочетанное течение у пациентов ИБС и СД 2 типа. Все это характеризуется неблагоприятным прогнозом и является основополагающим при оценке степени тяжести состояния пациентов и мониторинге у них эффективности комплексной терапии.
Одной из современных проблем лабораторной диагностики остается поиск удобного биологического материала, позволяющего осуществлять не только диагностику ОС, но и проводить систематический мониторинг и скрининг состояния АОС и уровня СРО в организме (Л.М. Пустовалова, О.В. Борисенко, 2006). В качестве альтернативного крови биосубстрата, отвечающего требованиям: неинвазивности, безопасности, возможности многократного забора в практически неограниченном количестве в физиологических условиях, может быть использована ротовая жидкость (РЖ), что было продемонстрировано в ряде исследований (A. Jurjus et al., 1999; А.И. Воложин и соавт., 2001; А.С. Григорьян и соавт., 2001; Э.М. Гильмияров, 2002; Л.Г. Комарова, Л.В. Коркоташвили, 2003; А.Б. Денисов, 2003; Г.Ф. Коротько, 2006; М.Ф. Борисенков и соавт., 2007; И.М. Быков и соавт., 2008). Авторами получены данные о закономерностях функционировании слюнных желез, об изменении состава и физико-химических свойств смешанной слюны при стоматологической (А.И. Воложин и соавт., 2001; А.М. Соловьева, 2000; В.П. Бережной и соавт., 1999, 2003; Э.М. Гильмияров, 2003; И.А. Омаров и соавт., 2011) и нестоматологической патологии (A.G. Herzog et al., 2001; Л.Г. Комарова, Л.В. Коркоташвили, 2003; В.Д. Трифонов и соавт., 2003; Е.П. Просвирова и соавт., 2004). Исследованиями последнего десятилетия выявлен параллелизм изменений параметров метаболизма в крови и РЖ при ряде заболеваний (Григорьев И.В., 2000). Однако в настоящее время имеется ограниченное число исследований, посвященных изучению взаимосвязи внутренних органов с полостью рта, а также возможности диагностики и прогнозирования соматической патологии с использованием биохимического исследования РЖ (Ф.Н. Гильмиярова, 2006). Несмотря на определенные достижения в области биохимии РЖ, остается ряд нерешенных вопросов по диагностике и мониторингу ОС при свободнорадикальных патологиях и оценке состояния АОС.
Таким образом, изучение показателей СРО и АОС в крови и РЖ, а также показателей липидного и углеводного обмена крови совместно с данными клинических исследований, позволит индивидуализировать подбор медикаментозных препаратов с учетом конкретной клинической ситуации в зависимости от выраженности метаболических нарушений, а, следовательно, повысить эффективность проводимой терапии при ИБС и СД 2 типа, что снизит риск неблагоприятных прогнозов у таких категорий пациентов.
Цель исследования: установить биохимические особенности течения процессов свободнорадикального окисления в ротовой жидкости, выявить ведущие патогенетические механизмы, приводящие к метаболическим нарушениям углеводного и липидного обменов, и установить дополнительные лабораторные критерии для неинвазивной оценки степени декомпенсации при ишемической болезни сердца и сахарном диабете 2 типа.
В связи с поставленной целью необходимо решить следующие задачи:
- Определить ключевые биохимические показатели, характеризующие состояние процессов СРО и антиоксидантный потенциал в крови и РЖ у пациентов ИБС и СД 2 типа, в том числе при сочетанном течении этих заболеваний;
- Изучить функциональное состояние ферментного звена антиоксидантной защиты (АОЗ) в крови и РЖ пациентов с ИБС и СД 2 типа, в том числе при сочетанном течении этих заболеваний;
- Оценить изменения показателей липидного и углеводного обменов, и частоты клинических осложнений, в зависимости от состояния показателей АОС крови пациентов с ИБС и СД 2 типа, в том числе при сочетанном течении этих заболеваний;
- Выявить характерные взаимоотношения между показателями СРО и АОС в крови и РЖ пациентов с ИБС и СД 2 типа, в том числе при сочетанном течении этих заболеваний;
- Разработать на основании полученных данных комплекс дополнительных лабораторных критериев для неинвазивной оценки эффективности проводимой терапии при ИБС и СД 2 типа, в том числе при сочетанном течении этих заболеваний.
Научная новизна. В работе впервые выполнено комплексное изучение показателей СРО, ферментного и неферментного звеньев АОС в крови и РЖ при ИБС и СД 2 типа (в том числе при сочетанном течении этих заболеваний), характеризующих интенсивность свободнорадикальных процессов, а также исследовано состояние углеводного и липидного обменов, на основании чего были отобраны дополнительные лабораторные критерии для определения степени декомпенсации этих патологических состояний и оценки эффективности проводимой терапии.
Впервые в выполненной работе показано, что в прооксидантно-антиоксидантной системе в РЖ пациентов при ИБС и СД 2 типа наблюдаются существенные сдвиги биохимических показателей СРО (ТБК-реактивные продукты (ТБК-РП)) и АОС (глутатион (GSH)), что сопровождается выраженными нарушениями гомеостаза ротовой полости и может быть использовано для лабораторного неинзвазивного мониторинга за данными категориями пациентов.
Впервые установлено, что у пациентов с СД 2 типа, а также при сочетанном течение ИБС и СД 2 типа, изменения в РЖ носят более выраженный характер, чем аналогичные изменения в крови, что может быть использовано при лабораторном определении степени декомпенсации данных патологических состояний.
Впервые показано, что выраженность нарушений липидного и углеводного обменов в крови имеют корреляционные взаимоотношения с показателями СРО и АОС в РЖ пациентов с ИБС и СД 2 типа, в том числе при сочетанном течении этих заболеваний, а также, что они коррелируют с частотой осложнений при ИБС (инфаркт миокарда, артериальная гипертония) и СД 2 типа (ангиопатии, полинейропатии, энцефалопатия). Это позволяет разработать новые методы лабораторного неинвазивного мониторинга течения данных патологических состояний и оценки эффективности проводимой терапии.
Впервые выявлена общая закономерность изменения активности ферментного звена АОЗ (каталазы (КАТ), супероксиддисмутазы (СОД), глутатионредуктазы (ГР), глутатионпероксидазы (ГПО)) в РЖ при ИБС и СД 2 типа, в том числе при сочетанном течении этих заболеваний, что позволит индивидуализировать выбор корригирующих мероприятий с учетом особенностей патологических сдвигов во взаимоотношениях ферментов антирадикальной защиты (АРЗ).
Научно-практическая значимость работы. Выявленные различия молекулярных механизмов, обеспечивающих метаболическую защиту клеточных структур в крови и биомолекул РЖ при ОС у пациентов с патологией ССС, существенно расширяют представление о патогенезе ИБС и СД 2 типа, в том числе аддитивных и синергических патогенетических взаимодействий при сочетанном течении этих заболеваний. Изучение корреляционных взаимоотношений показателей углеводного и липидного обменов, а также показателей СРО и АОС в крови и РЖ позволило предложить дополнительные (ферментные – активность КАТ, СОД, ГПО, ГР – и неферментные – содержание ТБК-РП, уровень GSH) показатели для оценки степени декомпенсации метаболического статуса при ИБС и СД 2 типа, в том числе при сочетанном течении этих заболеваний, что позволит своевременно проводить комплексные корригирующие мероприятия для предупреждения развития поздних осложнений ИБС (инфаркт миокарда, гипертония) и СД 2 типа (ангиопатии, полинейропатии, ожирение). На основании анализа результатов исследования были отобраны дополнительные лабораторные критерии, позволяющие в качестве неинвазивных методов оценивать эффективность проводимого лечения и своевременно проводить корригирующее мероприятия, направленные на предупреждение развития осложнений.
Внедрение в практику результатов исследования. Результаты исследования используются в учебном процессе кафедры фундаментальной и клинической биохимии, кафедры общей и клинической патофизиологии, ГБОУ ВПО КубГМУ Минздрава России (г. Краснодар), внедрены в практику отделения кардиологии 3 ГБУЗ «Клинический госпиталь для ветеранов войн» (г. Краснодар), отделения эндокринологии КБУЗ «Краевая клиническая больница №1 имени профессора С.В.Очаповского» департамента здравоохранения Краснодарского края (г. Краснодар), КБУЗ «Краевая консультативная поликлиника» (г. Краснодар), МБУЗ «Городская поликлиника №7» (г. Краснодар).
Основные положения, выносимые на защиту:
- Установлено, что изменения показателей СРО и АОС в крови и РЖ при ИБС и СД 2 типа имеют существенные отличия по уровню значений и направленности сдвигов лабораторных показателей, которые наиболее выражены при сочетанном течении этих патологических состояний.
- Выявлены корреляционные взаимоотношения между показателями углеводного и липидного обменов в крови и уровнем СРО и АОЗ в РЖ при ИБС и СД 2 типа, в том числе при сочетанном течении этих заболеваний. Совместное их использование в комплексном обследовании пациентов с ИБС и СД 2 типа повышает значимость диагностической оценки нарушений гомеостаза и позволяет своевременно проводить корригирующие мероприятия при данных патологических состояниях.
- Полученные результаты исследований доказывают, что изменения низкомолекулярных показателей прооксидантно-антиоксидантной системы (ТБК-РП, GSH) и ферментного звена АОЗ (КАТ, СОД, ГР, ГПО) в РЖ имеют специфические особенности при ИБС и СД 2 типа, а также при сочетанном течении этих заболеваний, что позволяет использовать эти показатели для неинвазивной оценки устойчивости липопротеинов крови к пероксидации, определения степени декомпенсации СРО при данных патологических состояниях и оценки эффективности проводимой патогенетической терапии.
Апробация результатов исследования. Материалы диссертационной работы были представлены и обсуждались на IV Всемирном форуме по астме и респираторной аллергии (г.Париж, Франция, 2011), Общероссийской научно-практической конференции стоматологических кафедр ГБОУ ВПО Минздравсоцразвития России (Москва, Краснодар, 2012), IІІ Международной научно-практической интернет-конференции «Проблемы и перспективы развития науки в начале третьего тысячелетия в странах СНГ» (г. Переяслав-Хмельницкий, Украина 2012), на конференции кафедры фундаментальной и клинической биохимии ГБОУ ВПО КубГМУ Минздравсоцразвития России (г.Краснодар, 2012).
Публикации. По материалам диссертации опубликовано 8 научных работ, в том числе 4 статьи в центральной медицинской печати, рекомендованной Высшей аттестационной комиссией при Министерстве образования и науки Российской Федерации.
Объем и структура работы. Диссертация изложена на 132 страницах компьютерного текста, состоит из введения, обзора литературы, 3 глав собственных исследований, заключения, выводов, библиографического указателя, содержащего 158 отечественных и 103 зарубежных источников, иллюстрирована 16 рисунками и содержит 11 таблиц.
Материалы и методы исследования
Для решения поставленных задач было обследовано 80 человек в возрасте от 48 до 88 лет. Исследования проводились у пациентов, страдающих ИБС, СД 2 типа и при сочетанном течении этих заболеваний. Первую группу составили 30 пациентов, страдающих ИБС (мужчин 22 человека (73,3%), женщин 8 человек (26,7%), средний возраст (M±m) – 77,4±2,0 года). Вторую группу составили 20 пациентов c СД 2 типа (мужчин 10 человек (50,0%), женщин 10 человек (50,0%), средний возраст (M±m) –60,3±2,9 года). Третью группу составили 30 пациентов c ИБС в сочетании с СД 2 типа (мужчин 23 человека (76,7%), женщин 7 человек (23,3%), средний возраст (M±m) –65,9±2,1 года). Контрольную группу составили 20 человек без клиники ИБС и СД 2 типа, соизмеримых по полу и возрасту (мужчин 13 человек (65,0%), женщин 7 человек (35,0%), средний возраст (M±m) – 64,7±11,5 года).
Работа была выполнена в соответствии с дизайном исследования:
1. Клинико-лабораторный этап – отбор пациентов в соответствии с критериями по нозологическим формам, оценка состояния углеводного и липидного обменов.
2. Аналитический этап – исследование показателей СРО и состояния эндогенной АОС в крови и РЖ.
3. Анализ корреляционных взаимосвязей и разработка алгоритмов ранней неинвазивной диагностики и мониторинга ОС при ИБС и СД 2 типа.
Критерии отбора пациентов. Отбор и обследование пациентов осуществлялись на базе отделения кардиологии №3 ГБУЗ «Клинический госпиталь для ветеранов войн» (г. Краснодар), отделения эндокринологии ГБУЗ «Краевая клиническая больница №1 имени профессора С.В. Очаповского» департамента здравоохранения Краснодарского края (г. Краснодар), ГБУЗ «Краевая консультативная поликлиника» (г. Краснодар), МБУЗ «Городская поликлиника №7» (г. Краснодар).
Средняя длительность заболевания составляла от 5 до 20 лет. Распространенность осложнений оценивали, исходя из поставленных в лечебных учреждениях клинических диагнозов (табл. 1).
Пациентам проводились лабораторные исследования (определение уровня глюкозы крови натощак, общего холестерина (ХС), ХС липопротеинов низкой плотности (ЛПНП), ХС липопротеинов высокой плотности (ЛПВП), триглицеридов (ТрГ), гликозилированного гемоглобина (HbA1c)) по стандартным методикам с помощью автоматического биохимического анализатора и наборов реактивов (фирма «Sigma»).
Таблица 1
Клиническая характеристика обследованных категорий пациентов
| Показатель распространенности осложнений, в % | Контроль | ИБС (группа 1) | СД 2 типа (группа 2) | ИБС+СД 2 типа (группа 3) |
| Длительность заболевания, лет (M±m) | - | 9,31±0,87 | 8,89±1,06 | 14,10±1,29 |
| Ретинопатия | 0,0 | 0,0 | 40,0 | 40,0 |
| Ангиопатия нижних конечностей | 0,0 | 6,7 | 100,0 | 80,0 |
| Полинейропатия | 0,0 | 3,3 | 100,0 | 83,3 |
| Нефропатия | 0,0 | 0,0 | 70,0 | 50,0 |
| ИБС | 0,0 | 100,0 | 0,0 | 100,0 |
| Стенокардия | 0,0 | 100,0 | 0,0 | 100,0 |
| Постинфарктный кардиосклероз | 0,0 | 20,0 | 0,0 | 20,0 |
| Артериальная гипертония | 0,0 | 100,0 | 50,0 | 100,0 |
| Нарушение мозгового кровообращения | 0,0 | 16,7 | 10,0 | 13,3 |
| Дисциркуляторная энцефалопатия | 0,0 | 100,0 | 30,0 | 73,3 |
| Ожирение | 0,0 | 3,3 | 40,0 | 53,3 |
Состояние липидного обмена определяли по уровню ХС, ТрГ, ХС ЛПНП, ХС ЛПВП; состояние углеводного обмена оценивали по уровню глюкозы и содержанию HbA1c (табл. 2).
Таблица 2
Показатели углеводного и липидного обменов в крови
у обследованных групп пациентов (M±m)
| Показатель | Контроль | ИБС (группа 1) | СД 2 типа (группа 2) | ИБС+СД 2 типа (группа 3) |
| Холестерин, ммоль/л | 4,82±0,34 | 6,24±0,17* | 5,44±0,30 | 5,63±0,19* |
| ЛПНП, ед | 2,87±0,26 | 2,98±0,18 | 3,04±0,21 | 3,71±0,18* |
| ЛПВП, ед. | 1,97±0,15 | 1,39±0,10* | 1,98±0,22 | 1,47±0,09* |
| Триглицериды, моль/л | 1,30±0,33 | 2,48±0,14* | 1,71±0,19 | 2,43±0,21* |
| Глюкоза, ммоль/л | 4,51±0,67 | 4,98±0,07 | 11,43±1,04* | 9,73±0,65* |
| Гликозилированный Hb, % | 4,09±0,78 | 5,10±0,25 | 7,32±0,36* | 7,50±0,47* |
Примечание. * - р<0,05 в сравнении с показателями контрольной группы.
Биохимические методы исследования. Определение активности ферментов АРЗ и содержание биосубстратов проводили одновременно в крови и РЖ у всех обследованных категорий пациентов.
Активность СОД в РЖ и гемолизате эритроцитов определяли по методу (В.А. Костюк и соавт., 1990), который основан на способности СОД тормозить реакцию аутоокисления кверцетина за счет дисмутации супероксидного анион-радикала, образующегося при окислении кверцетина в присутствии N,N,N1,N1-тетраметилэтилендиамина в аэробных условиях. Удельную активность СОД выражали в условных единицах, отнесенных к 1г белка РЖ или гемоглобина в крови.
Определение активности КАТ в РЖ и гемолизате эритроцитов проводили колориметрическим методом (М.А. Королюк и соавт, 1988), принцип которого основан на способности пероксида водорода давать с солями молибдена стойкий окрашенный комплекс. Об активности КАТ судили по количеству перекиси водорода не разрушенной ферментом. Активность КАТ выражали в мкмоль/ (мин • г белка) в РЖ или мкмоль / (мин • г Hb) в крови.
Содержание базальных ТБК-РП и Fe2+-индуцированных (ТБК-РП (Fe2+)) в РЖ и плазме крови определяли на основании окрашенного комплекса, образующегося при взаимодействии вторичных продуктов липопероксидации – преимущественно малонового диальдегида (МДА), содержащихся в РЖ и плазме крови, с тиобарбитуровой кислотой (ТБК). ТБК-РП (Fe2+) определяли в присутствии ионов Fe2+ для оценки устойчивости липопротеинов к пероксидации. Интенсивность окраски образующегося комплекса, измеряемая фотометрически при = 540 нм, прямо пропорциональна концентрации вторичных продуктов перекисного окисления биомолекул. Полученные результаты выражали в микромолях МДА на 1 л РЖ или плазмы крови (И.Д. Стальная, 1977; В.С. Камышников, 2004).
Принцип метода определения содержания восстановленного глутатиона в РЖ и гемолизате эритроцитов основан на способности восстановленного GSH при взаимодействии с 5,5'-дитио-бис-(2-нитробензойной) кислотой образовывать окрашенное соединение – тио-2-нитробензойную кислоту, водный раствор которого имеет максимум поглощения при = 412 нм. Полученные результаты выражали в мкмоль/л или мкмоль/г общего белка РЖ и мкмоль/г гемоглобина (Hb), содержащегося в гемолизате эритроцитов (G.L. Ellman, 1959; А.В. Арутюнян, Е.Е. Дубинина, Н.Н. Зыбина, 2000).
Определение активности ГПО в РЖ и гемолизате эритроцитов проводили с использованием гидроперекиси третичного бутила. ГПО катализирует расщепление гидроперекиси третбутила, используя в качестве субстрата восстановленный GSH. С помощью 5,5'-дитиобис(2-нитробензойной) кислоты (реактив Эллмана), определяли концентрацию оставшегося после реакции GSH. Об активности ГПО судили по уровню израсходованного в результате реакции восстановленного GSH. Активность ГПО выражали в мкмоль / (мин • г белка) в РЖ или мкмоль / (мин • г Hb) в крови (А.В. Гаврилова, Н.Ф. Хмара, 1986; Арутюнян А.В., Дубинина Е.Е., Зыбина Н.Н., 2000).
Определение активности ГР в РЖ и гемолизате эритроцитов проводили на основании реакции восстановления окисленного GSH при участии окисления восстановленного никотинамидадениндинуклеотидфосфата (НАДФН+Н+) в качестве донора протонов и электронов. Активность фермента измеряли по степени (НАДФН+Н+) при длине волны 340 нм. Активность ГР выражали в мкмоль / (мин • г белка) в РЖ или мкмоль / (мин • г Hb) в крови (Л.Б. Юсупова, 1989; А.В. Арутюнян, Е.Е. Дубинина, Н.Н. Зыбина, 2000).
Статистическую обработку экспериментальных данных проводили в соответствии с методами, принятыми в вариационной статистике (А.Н.Герасимов, 2007), с использованием программы STATISTICA версия 6.0. О достоверности отличий средних величин изучаемых показателей сравниваемых групп судили по величине t-критерия Стьюдента после проверки распределения на нормальность. Для оценки корреляционных взаимосвязей отдельных изучаемых параметров использовали коэффициент Пирсона (r). Статистически достоверными считали отличия, соответствующие оценке ошибки вероятности р<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В ходе проведенных исследований было установлено, что у всех категорий обследованных наблюдалось развитие ОС, которое сопровождалось повышением у них в крови ТБК-реактивных продуктов: у больных с ИБС – на 114,1% (p<0,05), у больных с СД 2 типа – на 182,4% (p<0,05), а при сочетании ИБС и СД 2 типа количество ТБК-РП возрастало на 285,5% (p<0,05), что свидетельствует об усилении процессов СРО, особенно у больных с патологией сердечно-сосудистой системы на фоне нарушений углеводного обмена (табл. 3). Одновременно при исследовании РЖ также было выявлено увеличение продуктов окислительной модификации – уровень ТБК-РП повышался (табл. 4): при ИБС на 105,3% (p<0,05), при СД 2 типа – на 226,3% (p<0,05), при сочетании ИБС и СД 2 типа – на 343,9% (p<0,05), следует отметить, что в большей степени уровень ОС возрастал при СД 2 типа и его сочетании с ИБС, это указывает на ведущую роль эндокринной патологии в развитии нарушений гомеостаза в ротовой полости, что может быть связано как с рекреторной функцией слюнных желез и накоплением в РЖ моносахаридов при декомпенсации СД, так и выраженными нарушениями функционирования гематосаливарного барьера при диабете в условиях формирования макро- и микроангиопатий (табл. 1).
Таблица 3
Показатели уровня СРО и состояния эндогенной АОС в крови
пациентов при ИБС и СД 2 типа
| Показатель | Контроль (M±m) | ИБС (M±m) | СД 2 типа (M±m) | ИБС+СД 2 типа (M±m) |
| ТБК-РП, мкмоль/л | 2,55±0,1 | 5,46±0,11* | 7,20±0,1* | 9,83±0,14* |
| ТБК-РП (Fе2+), мкмоль/л | 21,36±0,38 | 50,98±1,1* | 64,17±0,26* | 92,49±0,96* |
| Каталаза, мкмоль/(мин*г) | 69,39±0,93 | 50,31±0,49* | 42,30±0,44* | 34,63±0,41* |
| СОД, ед./г | 23,58±0,51 | 15,88±0,24* | 12,76±0,21* | 10,47±0,15* |
| Каталаза/СОД, усл.ед. | 3,0±0,1 | 3,2±0,1 | 3,3±0,1* | 3,3±0,1* |
| GSH, мкмоль/г | 6,61±0,29 | 6,01±0,03* | 5,46±0,07* | 4,66±0,04* |
| ГПО, мкмоль/(г*мин) | 0,63±0,08 | 0,49±0,01 | 0,38±0,01* | 0,30±0,01* |
| ГР, мкмоль/(г*с) | 22,29±0,41 | 19,24±0,25* | 14,70±0,62* | 11,88±0,49* |
Примечание. * - р<0,05 в сравнении с показателями контрольной группы.
При изучении состояния ферментного звена АОС было установлено, что в крови у обследованных категорий больных наблюдается снижение активности двух основных ферментов 1 и 2 линий АРЗ (табл. 3). Так, активность КАТ была снижена при ИБС на 27,5% (p<0,05), при СД 2 типа – на 39,0% (p<0,05), при сочетании ИБС и СД 2 типа – на 50,1% (p<0,05), в то время как активность СОД уменьшалась еще в большей степени при ИБС на 32,7% (p<0,05), при СД 2 типа – на 45,9% (p<0,05), при сочетании ИБС и СД 2 типа – на 55,6% (p<0,05), что свидетельствует у таких больных о выраженных нарушениях обезвреживания не только свободных радикалов, но и реактивных молекул (пероксидов), которые могут значительно утяжелять течение ОС, образуя в результате своего неферментативного распада токсичные вторичные радикалы, запускающие каскадные цепные реакции перекисного окисления биологических субстратов в организме. При изучении показателей ферментного звена в РЖ также было выявлено снижение активности КАТ и СОД, но в меньшей степени, чем в крови обследованных больных (табл. 4).
Таблица 4
Показатели уровня СРО и состояния эндогенной АОС в ротовой
жидкости пациентов при ИБС и СД 2 типа
| Показатель | Контроль (M±m) | ИБС (M±m) | СД 2 типа (M±m) | ИБС+СД 2 типа (M±m) |
| ТБК-РП, мкмоль/л | 0,57±0,05 | 1,17±0,03* | 1,86±0,04* | 2,53±0,05* |
| ТБК-РП (Fе2+), мкмоль/л | 4,90±0,13 | 9,73±0,16* | 12,95±0,36* | 17,12±0,36* |
| КАТ, мкмоль/(мин*г) | 63,10±1,48 | 49,63±0,77* | 39,31±0,45* | 31,37±0,71* |
| СОД, ед./г | 22,95±0,93 | 15,13±0,29* | 12,60±0,25* | 11,72±0,23* |
| Каталаза/СОД, усл.ед. | 2,8±0,1 | 3,3±0,1* | 3,1±0,1* | 2,7±0,1 |
| GSH, мкмоль/г | 70,38±1,64 | 61,45±0,91* | 53,73±0,48* | 47,56±0,46* |
| ГПО, мкмоль/(г*мин) | 50,96±1,90 | 46,74±0,39* | 39,66±0,66* | 31,94±0,31* |
| ГР, мкмоль/(г*с) | 32,49±0,85 | 29,81±0,36* | 24,94±0,65* | 20,05±0,18* |
Примечание. * - р<0,05 в сравнении с показателями контрольной группы.
При ИБС активность КАТ в РЖ снижалась на 21,3% (p<0,05), активность СОД – на 34,1% (p<0,05), при СД 2 типа активность КАТ снижалась на 37,7% (p<0,05), активность СОД – на 45,1% (p<0,05), при сочетании ИБС и СД 2 типа активность КАТ снижалась на 50,3% (p<0,05), тогда как активность СОД уменьшалась не так значительно в сравнении с показателями в крови – на 48,9% (p<0,05), что может говорить о преобладании в ротовой полости местной регуляции процессов СРО и активации в РЖ локальной АОС в условиях усиливающегося ОС на системном уровне. При оценке состояния АОС установлено, что уровень GSH в крови больных с ИБС снижался на 9,1% (p<0,05), у больных с СД 2 типа содержание GSH было снижено на 17,4% (p<0,05), при сочетании ИБС и СД 2 типа уровень GSH уменьшался на 29,5% (p<0,05). Такие изменения отражают нарушения в работе эндогенной АОС, которые в целом соответствуют степени тяжести патологического процесса, что требует применения в комплексной терапии данных заболеваний тиолсодержащих препаратов с антиоксидантными свойствами (И.А. Трегубова и соавт., 2012). При изучении состояния антиоксидантного потенциала РЖ установлено, что уровень GSH также снижался у всех категорий больных: при ИБС – на 12,7% (p<0,05), при СД 2 типа – на 23,7% (p<0,05), при сочетании ИБС и СД 2 типа – на 32,4% (p<0,05), причем данные изменения были выражены даже в большей степени, чем в крови таких больных, что говорит о потенциальной возможности использования неинвазивных методов диагностики ОС при ИБС и СД 2 типа, основанных на изучении показателей РЖ. Подобный подход позволит более рационально проводить мониторинг их состояния в амбулаторных условиях.
При изучении причин, вызывающих нарушения в работе низкомолекулярного звена АОС, было установлено, что одной из главных причин недостатка восстановленных тиолов в организме является дисбаланс в работе ГПО и ГР – вспомогательных ферментов АРЗ. Так в крови больных с ИБС активность ГПО достоверно не отличалась от показателей контрольной группы (p>0,05), в то время как активность ГР была снижена на 13,7% (p<0,05). У больных с СД 2 типа активность ГПО была снижена на 39,7% (p<0,05), активность ГР – на 34,1%. При сочетании ИБС и СД 2 типа активность ГПО и ГР были снижены достоверно (p<0,05) на 52,4% и 46,7% соответственно, что говорит о невозможности рециркуляции у таких больных не только тиоловых эндогенных антиоксидантов, но также и возможно нарушенной регенерации других классов низкомолекулярных субстратов с антиоксидантной активностью (фенольные, первичные амины, полиолы и др.), что, безусловно, является неблагоприятным фактором для таких категорий больных. При исследовании показателей активности этих ферментов в РЖ были выявлены аналогичные изменения. Следует отметить, что активность ГПО в РЖ была снижена достоверно и у пациентов при ИБС (табл. 4), что позволяет рекомендовать РЖ как биоматериал для ранней неинвазивной оценки уровня СРО при заболеваниях, сопровождающихся развитием ОС.
Принимая во внимание полученные на аналитическом этапе исследования результаты, характеризующие уровень СРО и состояние АОС, для разработки оптимального алгоритма диагностики и мониторинга ОС при ИБС и СД 2 типа, был проведен корреляционный анализ между ними и имеющимися клиническими и лабораторными (показатели липидного и углеводного обменов) данными. Установлено, что коэффициент корреляции ТБК-РП, отражающего базальный уровень СРО составил для крови: rТБК-РП/ХС = +0,43 (p<0,05), rТБК-РП/ЛПНП= +0,88 (p<0,05), rТБК-РП/ЛПВП = -0,45 (p<0,05), rТБК-РП/ТрГ = +0,66 (p<0,05), rТБК-РП/глюкоза = +0,78 (p<0,05), rТБК-РП/HbA1c = +0,94 (p<0,05), что подтверждает существенную роль неконтролируемых свободнорадикальных процессов в развитии нарушений липидного и углеводного обменов. При оценке диагностической значимости неинвазивных методов обследования с помощью корреляционного анализа уровня СРО в РЖ и показателей липидного и углеводного обменов крови было установлено, что коэффициенты корреляции ТБК-РП и показателей липидного обмена статистически значимо не отличаются от аналогичных данных в крови, хотя и несколько меньше их в абсолютных значениях: rТБК-РП/ХС = +0,33 (p>0,05), rТБК-РП/ЛПНП = +0,88 (p<0,05), rТБК-РП/ЛПВП = -0,35 (p>0,05), rТБК-РП/ТрГ)= +0,57 (p<0,05), в то время как корреляции ТБК-РП и показателей углеводного обмена даже превышают аналогичные данные по крови: rТБК-РП/глюкоза = +0,83 (p<0,05), rТБК-РП/HbA1c = +0,96 (p<0,05), что позволяет использовать РЖ в лабораторном алгоритме оценки тяжести метаболических нарушений у данных категорий пациентов. Особого внимания заслуживает тот факт, что наибольших значений достигает коэффициент корреляции ТБК-РП и HbA1c, так как последний отражает состояние углеводного обмена за последние 3-4 месяца, то есть сам является одним из наиболее объективных критериев при оценке состояния углеводного обмена. Такие данные показывают, что более значимую роль в инициации и поддержании повышенного уровня СРО у пациентов играют именно нарушения углеводного обмена, особенно при декомпенсации СД они могут иметь решающее значение при формировании поздних осложнений (микроангиопатия, полинейропатия). Среди показателей липидного обмена следует указать, что содержание общего ХС умеренно коррелирует с показателями СРО, в то время как уровень ЛПНП, являющихся атерогенной фракций липидного спектра, коррелирует с ТБК-РП значительно сильнее (r=+0,88, p<0,05), что указывает на большую диагностическую информативность для клиники именно определения показателей липидного спектра (ЛПНП, ЛПВП) крови совместно с ТБК-РП и ТБК-РП (Fe2+) в крови и РЖ, нежели традиционного общего ХС в крови. При анализе состояния эндогенной АОС и показателей углеводного и липидного обменов установлено, что наибольшая обратная корреляционная взаимосвязь наблюдается также между содержанием GSH в крови и уровнем ЛПНП (r= -0,91, p<0,05 в крови, r= -0,84, p<0,05 в РЖ), в то время как коэффициенты корреляции GSH с другими фракциями липидного спектра существенно ниже: rGSH/ХС = -0,35 (p>0,05), rGSH/ЛПВП = +0,41 (p>0,05), rGSH/ТрГ = +0,61 (p<0,05), что показывает большую уязвимость фракции ЛПНП для СРО в условиях истощения ключевых тиоловых компонентов эндогенной АОС и может вести к формированию макрососудистых осложнений у таких пациентов. Содержание GSH в крови также имело обратную корреляционную взаимосвязь и с показателями углеводного обмена, причем наибольшее значение было у коэффициента для GSH/HbA1с (r= -0,93, p<0,05), в то время как rGSH/глюкоза = -0,79 (p<0,05). При анализе взаимосвязей между показателями АОС в РЖ и состоянием липидного и углеводного обменов в крови установлено: rGSH/ХС = -0,40 (p>0,05), rGSH/ЛПНП = -0,84 (p<0,05), rGSH/ЛПВП = +0,37 (p>0,05), rGSH/ТрГ = -0,60 (p<0,05), rGSH/глюкоза = -0,84 (p<0,05), rGSH/HbA1c = -0,97 (p<0,05), что они статистически значимо не отличаются от аналогичных коэффициентов корреляции в крови, а, следовательно, могут быть использованы как неинвазивные лабораторные тесты для оценки метаболического статуса в условиях ОС (рис. 1). Более выраженная корреляционная взаимосвязь между GSH и показателями углеводного обмена в сравнении с липидным спектром указывает на большее влияние углеводов на состояния гомеостаза в ротовой полости, что может быть связано с повышенной проницаемостью гематосаливарного барьера для них при развитии микрососудистых осложнений, а также большей способностью слюнных желез к рекреции моносахаридов.
.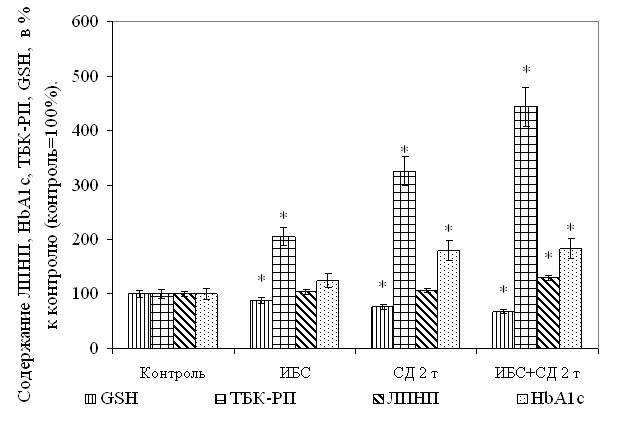 Рис. 1. Взаимосвязь уровня СРО и состояния АОС в РЖ и ряда показателей липидного спектра и углеводного обмена в крови. Примечание. *-p<0,05 в сравнении с контрольной группой.
Рис. 1. Взаимосвязь уровня СРО и состояния АОС в РЖ и ряда показателей липидного спектра и углеводного обмена в крови. Примечание. *-p<0,05 в сравнении с контрольной группой.
С целью дополнительного подтверждения данных, полученных при корреляцинном анализе лабораторных показателей, у обследованных категорий пациентов был также проведен анализ взаимосвязи уровня биохимических показателей ферментного звена АРЗ и частоты поздних осложнений (макро- и микрососудистых), в результате которого установлено, что активность КАТ и СОД в крови статистически значимо коррелирует с суммарной частотой микроангиопатий (ангиоретинопатия, нефропатия, ангиопатия нижних конечностей, полинейропатия: rКАТ/микроангиопатии = -0,81 (p<0,05), rСОД/микроангиопатии = -0,80 (p<0,05), и в меньшей степени с суммарной частотой макрососудистых осложнений (ИБС, стенокардия, постинфарктный кардиосклероз, нарушения мозгового кровообращения, дисциркуляторная энцефалопатия: rКАТ/макроангиопатии = -0,55 (p<0,05), rСОД/макроангиопатии = -0,54 (p<0,05), в то время как корреляция осложнений с КАТ/СОД – интегральным показателем функционирования ферментов АРЗ – еще более значима при оценке ее взаимосвязи с распространенностью микроангиопатий: r(КАТ/СОД)/микроангиопатии = +0,82 (p<0,05), r(КАТ/СОД)/микроангиопатии = +0,46 (p>0,05) что позволяет использовать показатели активности ферментного звена АОС в клинической практике для прогнозирования развития неблагоприятных исходов и поздних осложнений при ИБС и СД 2 типа.
При анализе данных, полученных при изучении РЖ коэффициенты корреляции существенно не отличались от аналогичных показателей в крови: rКАТ/микроангиопатии = -0,85 (p<0,05), rСОД/микроангиопатии = -0,77 (p<0,05), rКАТ/макроангиопатии = -0,47 (p>0,05), rСОД/макроангиопатии = -0,55 (p<0,05), что можно применять в клинической практике для неинвазивного мониторинга состояния пациентов с ИБС и СД 2 типа, особенно при анализе риска развития микрососудистых осложнений на амбулаторном этапе (рис. 2).
На основании выполненных исследований был разработан следующий алгоритм для лабораторного мониторинга процессов СРО у пациентов при ИБС и СД 2 типа:
1. На первом этапе выполняется исследование липидного спектра и определение гликозилированного гемоглобина в крови с одновременной оценкой содержания ТБК-РП и GSH в РЖ. При повышении уровня липидов и HbA1c проводится коррекция метаболических нарушений с помощью гиполипидемических средств и сахароснижающей терапии, дополнительно при повышении уровня ТБК-РП целесообразна коррекция с помощью антиоксидантов прямого действия (липофильной и гидрофильной природы), при снижении уровня GSH обосновано назначение тиолсодержащих препаратов (липоевая кислота, глутатион).
2. На втором этапе после достижения показателей адекватного контроля углеводного и липидного обменов продолжается мониторинг состояния СРО и АОС путем определения ТБК-РП и GSH в РЖ с целью своевременной коррекции процессов СРО, а также дополнительно оценивается в РЖ активность ферментного звена АОС (СОД и КАТ) с целью своевременного прогнозирования возможного развития микро- и макрососудистых осложнений, с дальнейшим назначением профилактических мероприятий и ангиопротекторов пациентам с пониженной активностью ферментов антирадикальной защиты.
. 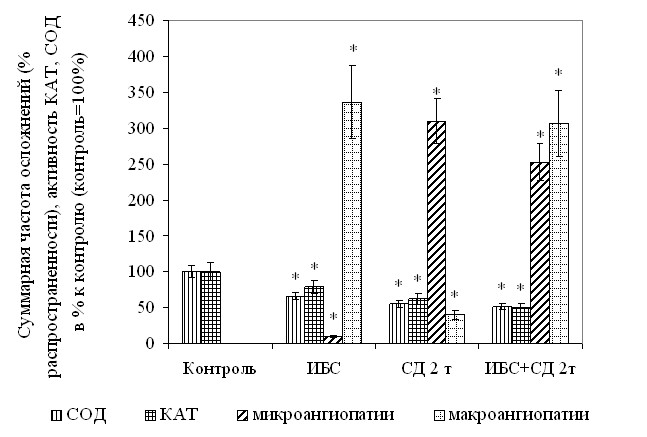 Рис. 2. Взаимосвязь показателей ферментного звена АРЗ в РЖ и распространенности осложнений при ИБС и СД 2 типа.
Рис. 2. Взаимосвязь показателей ферментного звена АРЗ в РЖ и распространенности осложнений при ИБС и СД 2 типа.
Примечание. *-p<0,05 в сравнении с контрольной группой.
Таким образом, на основании проведенных исследований показана значительная роль оценки метаболического статуса при ИБС и СД 2 типа с помощью неинвазивной диагностики по уровню СРО и показателям АОС в РЖ, в том числе и для подбора мероприятий, корригирующих ОС, и мониторинга проводимой антиоксидантной терапии, направленной на предупреждение развития макро- и микрососудистых осложнений.
ВЫВОДЫ
- При ИБС и СД 2 типа выявлены стойкие нарушения процессов СРО и механизмов АОС в крови и ротовой жидкости, особенно при сочетанном течении этих заболеваний (повышение ТБК-РП, ТБК-РП (Fe2+), снижение GSH), что необходимо учитывать для оценки степени декомпенсации при данных патологических состояниях.
- Формирование ОС при ИБС и СД 2 типа характеризуется существенными нарушениями функционирования ферментного звена АОС крови и ротовой жидкости, которые наиболее выражены при сочетанном течении этих заболеваний: в ротовой жидкости наблюдается снижение КАТ на 50,1%, СОД - на 55,6%, ГР – на 46,7%, ГПО – на 52,4%, что указывает на необходимость проведения мероприятий, направленных на купирование ОС на доклиническом этапе развития осложнений при данных патологических состояниях.
- Нарушения липидного (ЛПНП, ЛПОНП, ХС, ТрГ) и углеводного (глюкоза, HbA1c) обменов в крови при ИБС и СД 2 типа носят выраженный характер и коррелируют с изменениями показателей СРО и АОС в ротовой жидкости при данных патологических состояниях. Это дает основания считать возможным использовать показатели СРО и АОС в ротовой жидкости для комплексной оценки степени их декомпенсации.
- Характер изменений лабораторных показателей в ротовой жидкости отличается существенными нарушениями процессов СРО и состояния АОС, особенно при сочетанном течении этих заболеваний, так что ряд таких показателей (содержание ТБК-РП, GSH, активность КАТ, СОД), целесообразно, использовать при индивидуализированном подходе к выбору корригирующих мероприятий у данных категорий пациентов.
- Выявленные нарушения процессов СРО и состояния АОС в ротовой жидкости при ИБС и СД 2 типа, а особенно при сочетанном течении этих заболеваний, позволяют рекомендовать ротовую жидкость у таких групп пациентов в качестве дополнительного биосубстрата для проведения в амбулаторных условиях неинвазивной лабораторной диагностики и оценки степени декомпенсации этих патологических состояний, а также для мониторинга эффективности проводимой терапии.
Предложения для внедрения в практику
- Для оценки степени декомпенсации в прооксидантно-антиоксидантной системе при ИБС и СД 2 типа, а также при сочетанном течении этих заболеваний, рекомендовано в качестве дополнительных показателей исследовать: ферментное звено АОЗ (активность КАТ, СОД, интегральный показатель соотношения КАТ/СОД), а также низкомолекулярные субстраты прооксидантно-антиоксидантной системы (содержания ТБК-РП, GSH), что повысит эффективность диагностики при данных патологических состояниях, а также позволит своевременно назначать корригирующие мероприятия и контролировать эффективность проводимой терапии.
- Для индивидуализации корригирующих мероприятий при ИБС и СД 2 типа, а также при сочетанном течении этих заболеваний, в соответствии с предложенным алгоритмом лабораторной диагностики необходимо использовать не только комплексные антиоксидантные средства, но и такие группы препаратов, как имитаторы ферментов антирадикальной защиты (при снижении активности КАТ, СОД и/или интегрального показателя соотношения КАТ/СОД), а также тиолсодержащие антиоксиданты (например, препараты липоевой кислоты) при снижении уровня GSH в крови или РЖ у данных категорий пациентов.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
*1. Гаспарян, А.Ф. Интенсивность протекания процессов свободнорадикального окисления биомолекул и состояния ферментов антирадикальной защиты ротовой жидкости при неполных зубных рядах, замещенных протезами /А.Ф. Гаспарян, Т.С. Кочконян, А.А. Ладутько, И.М. Быков, В.В. Еричев, М.Г. Литвинова //Кубанский научный медицинский вестник. – 2010. - № 1 (115). – С.22-27.
2. Кочконян, Т.С. Интенсивность протекания процессов перекисного окисления липидов и состояние антиоксидантной системы крови при различных степенях вторичной адентии /Т.С. Кочконян, А.Ф. Гаспарян, А.А. Ладутько, И.М. Быков, Н.И. Быкова, А.В. Митина, Е.В. Гизей, М.Г. Литвинова //Астраханский медицинский журнал. – 2010. – Т.5, № 1. – С113-115.
*3. Митина, А.В. Роль аскорбатной окислительно-восстановительной системы в патогенезе вторичной адентии /А.В. Митина, А.А. Ладутько, Н.И. Быкова, В.А. Акопова, Е.В. Гизей, М.Г. Литвинова, И.М. Быков //Аллергология и иммунология. – 2010. – Т.12, № 1. – С.132-133.
4. Ладутько, А.А. Активность Cu/Zn-зависимой супероксиддисмутазы и содержание ионов меди в ротовой жидкости больных с различными степенями вторичной адентии /А.А. Ладутько, А.В. Митина, Н.И. Быкова, М.Г. Литвинова, Е.В. Гизей, В.А. Акопова //Состояние стоматологической службы и актуальные вопросы в теории и практике: сб. науч. тр. – Воронеж; Ставрополь; Краснодар, 2011. – С.130-132.
5. Литвинова, М.Г. Изменение показателей перекисного окисления липидов и антиоксидантной системы ротовой жидкости при ишемической болезни сердца /М.Г. Литвинова, В.А. Акопова, И.М. Быков //Реализация программ профилактики стоматологических заболеваний. Актуальные вопросы стоматологии: науч. тр. – Москва; Краснодар, 2012. – С.185-187.
6. Литвинова, М.Г. Особенности процессов липопероксидации у больных с ишемической болезнью сердца в сочетании с сахарным диабетом /М.Г. Литвинова, А.А. Басов, И.М. Быков // Проблемы и перспективы развития науки в начале третьего тысячелетия в странах СНГ : сб. научн. работ. III Международной научн.-практ. интенет-конференции. - Переяслав-Хмельницкий, Украина, 2012. – С.12-14.
*7. Литвинова, М.Г. Показатели свободнорадикального окисления в крови и ротовой жидкости у больных при ишемической болезни сердца и сахарном диабете 2 типа /М.Г. Литвинова, А.А. Басов, И.М. Быков // Кубанский научный медицинский вестник. – 2012. - № 3 (132). – С.94-98.
*8. Литвинова М.Г., Басов А.А., Акопова В.А. Лабораторная диагностика биохимических нарушений перекисного окисления в организме при ишемической болезни сердца и сахарном диабете // Современные проблемы науки и образования. – 2012. – № 5; URL: http://www.science-education.ru/105-7297.
* - работа опубликована в журнале, включенном Высшей аттестационной комиссией при Министерстве образования и науки Российской Федерации в Перечень ведущих рецензируемых научных журналов и изданий.
СПИСОК СОКРАЩЕНИЙ
АОС – антиоксидантная система
АРЗ – антирадикальная защита
5,5-ДТНБК - 5,5-дитиобис(2-нитробензойная) кислота
ГПО – глутатионпероксидаза
ГР – глутатионредуктаза
- ИБС – ишемическая болезнь сердца
- КАТ – каталаза
ЛПВП – липопротеины высокой плотности
ЛПНП – липопротеины низкой плотности
ЛПОНП – липопротеины очень низкой плотности
МДА – малоновый диальдегид
ОС – окислительный стресс
- РЖ - ротовая жидкость
- СД – сахарный диабет
- СОД – супероксиддисмутаза
- СРО – свободнорадикальное окисление
- ССС – сердечно-сосудистая система
- ТБК – тиобарбитуровая кислота
- ТБК-РП – базальные ТБК-реактивные продукты
- ТБК-РП(Fe2+) – Fe2+ -индуцированные ТБК-реактивные продукты
- ХС - холестерин
GSH – восстановленный глутатион
HbA1c – гликозилированный гемоглобин
Литвинова Марина Георгиевна
БИОХИМИЧЕСКИЕ особенности свободнорадикального окисления в Ротовой жидкости и крови при ИШЕМИЧЕСКОЙ БОЛЕЗНи СЕРДЦА
И САХАРНоМ ДИАБЕТе 2 ТИПА
03.01.04 – биохимия
- Автореферат
- диссертации на соискание ученой степени
кандидата медицинских наук
Подписано в печать 15.11.2012г.
Набор компьютерный. Гарнитура Times. Усл. П.л. 1,0
Тираж 100 экз.
Отпечатано на копировально-множительной технике
Типография ООО « редакция газеты «Всякая Всячина».
350020, г.Краснодар, ул.Бабушкина, 252, т. 259-41-59.

