Механизмы совместного действия гипоксического стимула и повышенного давления азота на животных
На правах рукописи
АЛЕКСЕЕВА ОЛЬГА СЕРГЕЕВНА
МЕХАНИЗМЫ СОВМЕСТНОГО ДЕЙСТВИЯ ГИПОКСИЧЕСКОГО
СТИМУЛА И ПОВЫШЕННОГО ДАВЛЕНИЯ АЗОТА
НА ЖИВОТНЫХ
03.00.13 – Физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Санкт-Петербург - 2008
Работа выполнена в Институте эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Научный руководитель: доктор биологических наук
Ветош Александр Николаевич
Официальные оппоненты: доктор биологических наук, профессор,
заслуженный деятель науки РФ
Сотников Олег Семенович
(Институт физиологии им. И.П. Павлова РАН)
доктор биологических наук
Тараканов Игорь Анатольевич
(Научно-исследовательский институт
общей патологии и патофизиологии РАМН)
Ведущее научное учреждение: Военно-Медицинская Академия им. С.М.Кирова,
Санкт-Петербург.
Защита состоится «____» _______________2008 г. в ____ часов на заседании Диссертационного совета по защите докторских и кандидатских диссертаций
(Д 002.020.01) при Институте физиологии им. И.П.Павлова Российской Академии Наук по адресу: 199034, Санкт-Петербург, наб. Макарова, 6.
С диссертацией можно ознакомиться в библиотеке Института физиологии им. И.П.Павлова Российской Академии Наук.
Автореферат разослан «____» _______________ 2008 г.
Ученый секретарь Диссертационного совета,
доктор биологических наук Н.Э.ОРДЯН
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Изучение физиологического действия основных компонентов воздуха – азота и кислорода – актуально в исследовательской и клинической практике в связи с тем, что недостаток кислорода в тканях является основным симптомом большинства патологических состояний, а повышенное давление азота приводит к нарушению состояния людей, работающих под водой – азотному наркозу. Кроме того, влияние на организм сочетанного действия этих газов при одновременном или последовательном изменении их парциального давления в дыхательной газовой среде практически не исследовано и является перспективным направлением развития подводной физиологии и медицины (Fenn, 1969; Зальцман с соавт., 1979; Bennett et al., 1982; Thom, 1992; Самойлов, 1999; Лукьянова, 2004; Буравкова с соавт., 2006).
Нарастание интенсивности дозированного гипоксического стимула приводит к изменениям функционального состояния животных, которые выражаются в потере рефлексов позы, активизации резервов систем дыхания и кровообращения, изменении потребления кислорода (Волохов, Образцова, 1950; Иванов, 1968). Эти изменения могут быть оценены количественно.
Наркотическое действие повышенного давления азота вызывает у человека обратимые эмоциональные, когнитивные, двигательные и сенсорные изменения (Bennett, Eliott, 1993). Аналогичные изменения регистрируются в организме млекопитающих (Ветош, 2003). Однако у животных в этих условиях имеет место преобладание нарушений двигательной активности и рефлексов позы. Количественное описание двигательных изменений в ходе развития азотного наркоза предполагает разработку специальной измерительной шкалы.
Исследование сочетанного действия гипоксического и гипербарического азотного стимулов на организм млекопитающих нуждается в поиске клеточного метаболического критерия оценки степени стрессорного воздействия. Одним из таких критериев является содержание в клетках головного мозга белков семейства HSP70, играющих ключевую роль в защите клеток организма от поражающего действия экстремальных факторов, в том числе гипоксии. Их можно отнести к универсальным эндогенным адаптогенам молекулярной природы, ответственным за восстановление третичной структуры продуцируемых клеткой белков de novo и после их частичной денатурации. Наиболее изучены в этом отношении белки семейства HSP70 (Schlesinger, Ashburner, 1982; Меерсон, Малышев, 1993; Маргулис, Гужова, 2000; Morimoto, Nollen, 2004; Пастухов, Екимова, 2005). Для анализа содержания белков семейства HSP70 в отдельных структурах и клеточных элементах головного мозга может быть применен иммуноцитохимический метод исследования, который позволяет количественно оценить топику распределения стресс-белков (Коржевский, 2005).
Цель работы: изучение совместного действия повышенного парциального давления азота и пониженного парциального давления кислорода на физиологические и биохимические характеристики организма крыс породы Wistar.
Задачи исследования:
1. Исследовать действие повышенного давления азота на динамику напряжения кислорода в моторной коре мозга крыс.
2. Изучить влияние параметров гипоксического прекондиционирования на чувствительность и устойчивость млекопитающих к действию гипербарического азота.
3. Оценить динамику чувствительности и устойчивости крыс к действию повышенного давления азота на фоне нарастающего гипоксического стимула.
4. Количественно описать изменения двигательной активности, рефлексов позы и характеристик кардиореспираторной системы крыс породы Wistar на фоне стабильно нарастающего гипоксического стимула в пределах 0,021-0,002 МПа кислорода в дыхательной газовой среде.
5. Определить содержание стресс-белков семейства HSP70 в клетках мозга крыс на фоне действия нормобарической гипоксии.
6. Провести исследование содержания белков семейства HSP70 в головном мозгу крыс при действии повышенного давления азота.
Научная новизна исследований.
Впервые показано, что напряжение кислорода в моторной коре мозга крыс в ходе компрессии азотом выходит за пределы значений, полученных при нормальном давлении этого газа, начиная с 7,1 МПа. Впервые установлено, что прекондиционирующее действие гипоксии (6 % кислорода в дыхательной газовой среде) приводит к уменьшению чувствительности и увеличению устойчивости крыс к действию повышенного давления азота. Впервые при совместном действии повышенного давления азота и пониженного давления кислорода выявлено увеличение чувствительности и уменьшение устойчивости крыс к азотному наркозу. Впервые удалось продемонстрировать увеличение содержания стресс-белков семейства HSP70 в клетках коры мозга крыс под влиянием повышенного давления азота.
Теоретическая и практическая значимость работы.
Результаты работы расширяют теоретические представления о влиянии сочетанного действия азота и кислорода на метаболические процессы в нейронах мозга млекопитающих. Подтверждается предположение о том, что повышенное давление азота приводит к увеличению содержания стресс-белков семейства HSP70 в клетках мозга животных. Удалось показать участие HSP70 в механизме увеличения резистентности организма к действию повышенного давления азота в результате предварительных гипоксических тренировок. Экспериментальное использование измененной дыхательной газовой среды (повышенное парциальное давление азота в сочетании с пониженным парциальным давлением кислорода) позволило выявить снижение устойчивости к азотному наркозу, что свидетельствует о синергическом действии гипоксии и азота под давлением. Полученные в работе данные могут быть использованы при планировании экспериментов по исследованию процессов нейродегенерации, нейропротекции и нейрорепарации для широкого класса экспериментальных моделей.
Данные проведённых экспериментов могут способствовать дальнейшему поиску конкретных режимов гипоксической терапии и ставить вопрос о возможном терапевтическом использовании повышенных парциальных давлений индифферентных газов. Выявленное увеличение содержания стресс-белков семейства HSP70 в клетках мозга при гипоксии позволяет объяснить молекулярный механизм эффекта тренирующего действия гипербарического азота, используемого в водолазной практике, полученного еще в 50-е годы прошлого века. Обнаруженная в работе динамика HSP70 в клетках мозга при действии гипоксии и азота под давлением, даёт возможность обосновать и найти новые подходы к разработке методов диагностики и профилактики нарушений, связанных с воздействием на организм экстремальных факторов среды. Результаты исследования и вытекающие из них выводы могут быть использованы в лекциях по гипербарической физиологии и медицине в ВУЗах и организациях дополнительного последипломного образования.
Основные положения, выносимые на защиту.
1. В ходе компрессии азотом вплоть до 7,1 МПа в условиях нормоксической, нормокапнической и нормотермической ДГС у крыс породы Wistar отсутствуют признаки вентиляторной, циркуляторной и гемической гипоксии клеток мозга.
2. Уменьшение парциального давления кислорода в ДГС приводит к двухфазному увеличению чувствительности и уменьшению устойчивости животных к действию
повышенного давления азота.
3. Содержание стресс-белков семейства HSP70 в клетках коры мозга крыс под влиянием повышенного парциального давления азота, пониженного парциального давления кислорода и их сочетанного действия увеличивается.
Апробация работы.
Основные результаты работы были представлены на международном симпозиуме по гипербарической и подводной медицине (Италия, Милан, 1996); на XXXIII международном конгрессе физиологических наук (Санкт-Петербург, 1997); на международной конференции, посвященной 150-летию акад. И.П.Павлова «Механизмы функционирования висцеральных систем» (Санкт-Петербург, 1999); на XI-XIII международных совещаниях по эволюционной физиологии (Санкт-Петербург, 1996, 2001, 2006); на Всероссийской конференции «Индифферентные газы в водолазной практике, биологии и медицине» (Москва, 2000); на Российской конференции «Проблемы обитаемости в гермообъектах» (Москва, 2001); на VIII международном симпозиуме по биологии высоких давлений (Москва, 2003); на четвертой Российской конференции (с международным участием) «Гипоксия: механизмы, адаптация, коррекция» (Москва, 2005); на 4-6-й Всеармейских научно-практических конференциях «Баротерапия в комплексном лечении и реабилитации раненых, больных и пораженных» (Санкт-Петербург, 2000, 2003, 2006); на конференции «Гипербарическая физиология и водолазная медицина» (Москва, 2005); на VII международном конгрессе “International society for adaptive medicine (ISAM)” (Москва, 2006); на международном симпозиуме «Актуальные проблемы биофизической медицины» (Украина, Киев, 2007); на XХ съезде физиологического общества им. И.П.Павлова (Москва, 2007); на Пятой Российской конференции «Гипоксия: механизмы, адаптация, коррекция» (Москва, 2008); на Всероссийской конференции «Научное наследие академика Л.А. Орбели. Структурные и функциональные основы эволюции функций, физиология экстремальных состояний» (Санкт-Петербург, 2008).
Публикации. По материалам диссертации опубликовано 28 печатных работ, включая 6 статей и 22 тезиса.
Структура о объем диссертации.
Диссертация состоит из введения, обзора литературы, описания методики исследования, 4 глав экспериментальных данных, обсуждения полученных результатов, выводов и списка литературы, содержащего 341 источник. Работа изложена на 161 странице машинописного текста, иллюстрирована 39 рисунками и содержит 12 таблиц.
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальные исследования проводились на 307 крысах-самцах породы Wistar (Рапполово), весом 205-247 г. Все опыты поставлены в барокамере объёмом 107 дм3. Максимальное давление, использовавшееся в опытах, составляло 11,6 МПа, а скорость компрессии равнялась 0,1 МПа в минуту. Все эксперименты производились с соблюдением «Правил проведения работ с использованием экспериментальных животных».
Исследуемые показатели:
Регистрация динамики поведенческих реакций. Двигательную активность и рефлексы позы животных регистрировали как при гипоксии, так и в условиях действия повышенного давления азота на основе классификации, предложенной Шеном, с нашими дополнениями и изменениями (Schoen, 1926; Вётош с соавт., 2000). Для побуждения к проявлению двигательной активности использовалось мягкое электрокожное воздействие (30 V, 1 mA, 1 сек).
Регистрация спонтанной биоэлектрической активности головного мозга крыс в условиях гипербарии проводилась у предварительно оперированных под нембуталовым наркозом животных, которым устанавливали стереотаксически платиновые электроды диаметром 200 мкм в головку хвостатого ядра, чёрную субстанцию, ретикулярную формацию среднего мозга, а также лобную и моторную зоны коры правого полушария. Спонтанная биоэлектрическая активность мозга животного в ходе компрессии азотом обрабатывалась по специально разработанной программе, позволяющей рассчитывать когерентные отношения между парами электрических сигналов, отводимых из различных точек мозга. Расчеты проводились для участков спектра шириной 0,3 – 0,4 гц.
Измерение напряжения кислорода в мозгу осуществляли полярографическим методом по методике И.Т.Демченко (Демченко, 1976) с незначительной модификацией, посредством платиновых электродов диаметром 200 мкм. Трепанационные отверстия для последующей установки электродов выполняли под нембуталовым наркозом (40 мг/кг) над поверхностью моторной коры мозга и в затылочной области коры. Электроды устанав-ливали в верхний слой коры мозга на глубину 0,5-1 мм перед началом эксперимента.
Измерение параметров температурного гомеостаза животных. Для изучения температурного гомеостаза у животных определяли ректальную температуру, температуру поверхности тела и головного мозга. Температуру поверхности коры мозга животных определяли с помощью терморезисторов типа МТ-54, которые имплантировали животным эпидурально под нембуталовым наркозом (в дозе 40 мг/кг) за 5-7 дней до опыта. Для измерения ректальной температуры использовали специальные датчики электротермометра типа ТПЭМ-1, которые вводили в прямую кишку животного на глубину 6 – 8 см. Температуру на поверхности тела измеряли терморезисторами типа МТ-54, которые приклеивались на выбритую поверхность кожи.
Определение потребления кислорода осуществляли общепринятым способом (Бреслав, 1970) по формуле
рО2 • Vсистемы
Q = ---------------------
М • t
где: Q - потребление кислорода животными, л/кг в час
pО2 = pО2 начальное – рО2 конечное
рО2 начальное - содержание кислорода в камере в начале измерения, %
рО2 конечное - содержание кислорода в камере в конце измерения, %
Vсистемы - объем камеры, л
М - масса животных, кг
t = tконечное - tначальное (в нашем случае t =0,5-1 час)
Морфологические методы исследования. Иммуноцитохимически на парафиновых срезах толщиной 10 мкм определяли в моторной коре крыс HSP70 и ядерный белок нервных клеток (NeuN). Мозг животных быстро (1-1,5 мин) выделяли, фиксировали цинк-этанол-формальдегидом и заливали в парафин. После депарафинирования на срезах мозга выявляли HSP70 с помощью первичных моноклональных антител (NovoCastra, Великобритания, разведение 1:90) и вторичных антител, конъюгированных с полимером и пероксидазой (набор LSAB2/HRP, Dako, Дания). Для определения NeuN применяли первичные моноклональные антитела (Chemicon, США, разведение 1:400) и вторичные антитела (набор LSAB2/HRP, Dako, Дания). Визуализацию прореагировавших первичных антител производили при помощи диаминобензидинового хромогена DAB+ (Dako, Дания). Светооптически на срезах выделяли нейроны, прореагировавшие с антителами на HSP70 и NeuN, и подсчитывали количество клеток с определенной интенсивностью иммуноцитохимической реакции. При постановке этих реакций пользовались опубликованными протоколами (Коржевский, 2005).
Тренировочные режимы гипоксии. Интервальная гипоксия была использована в качестве метода увеличения резистентности животных к действию повышенного давления азота. Тренировочные экспозиции проводились ежесуточно. И использовались 6-ти процентная кислородно-азотная смесь. Сеанс гипоксии выполнялся в соответствии с протоколом: 20 минут гипоксии + 5 минут нормоксии + 20 минут гипоксии + 5 минут нормоксии + 20 минут гипоксии + завершение сеанса гипоксии переходом к дыханию воздухом. После сеансов гипоксии для иммуноцитохимического анализа крыс брали на 1-е, 4-е и 8-е сутки. После 8-ми суток гипоксии часть предварительно кондиционированных животных подвергалась азотному наркозу.
Статистическая обработка результатов исследований. Первичные данные обрабатывались стандартными статистическими методами (Ашмарин с соавт., 1975; Елисеева, 1982), используя программы Microsoft Office, Microcal Origin, Diastat. Выяснение характера распределения данных, показало, что они подчиняются закону Гаусса. В связи с тем, что число измеренных значений в большинстве случаев было меньше 50, в дальнейших расчётах мы переходили от нормального распределения данных к распределению Стьюдента. Уровень значимости выбрали равным 0,05.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
- Действие повышенного давления азота на организм млекопитающих.
В ходе компрессии азотом у млекопитающих наблюдаются изменения в когнитивной, двигательной, эмоциональной и сенсорной сферах. В исследованиях на животных, проводившихся в нормоксических и нормокапнических условиях, доминируют изменения двигательной активности и рефлексов позы.
Двигательная активность и рефлексы позы крыс при различных значениях давления азота. В начале компрессии крысы, впервые подвергавшиеся действию повышенного давления азота, проявляли беспокойство. После достижения давления 1,3 МПа появлялись первые признаки атаксии задних конечностей при перемещении животных по камере. Эти признаки усиливались в диапазоне давлений 1,3 – 2,1 МПа. При давлении 2,1 МПа появлялась атаксия передних конечностей. При достижении давления 2,7 МПа, на фоне развивающейся атаксии задних и передних конечностей, у крыс появлялся новый поведенческий признак – падения на бок. К тому моменту, когда давление азота в барокамере достигало величины 3,9-4,0 МПа, перманентные падения превращались в боковое положение животного. При этом их конечности были напряжены и вытянуты, пальцы растопырены и напряжены. При достижении давления 4,1 МПа у крыс проявлялись признаки потери выпрямительных рефлексов.
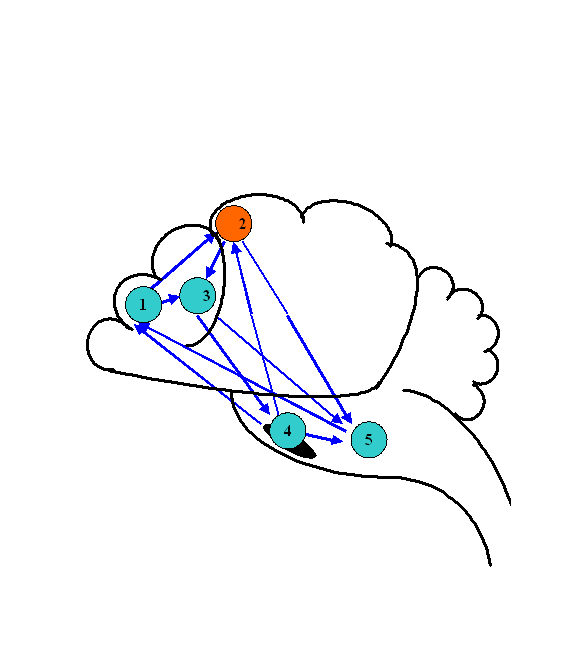
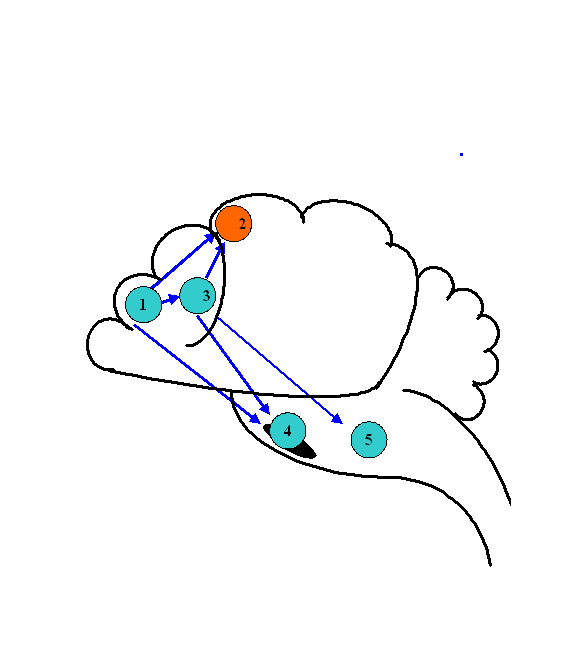
Динамика биоэлектрической активности мозга крыс в ходе компрессии азотом. Для анализа биоэлектрической активности мозга животных применялась мультиэлектродная система отведения биотоков мозга. Анализ когерентных отношений осуществлялся между потоками биоэлектрической активности из лобной (1) и моторной коры (2), головки хвостатого ядра (3), черной субстанции (4) и ретикулярной формации среднего мозга (5) крыс (рис.1).
 0,1 МПа 0,1 МПа | 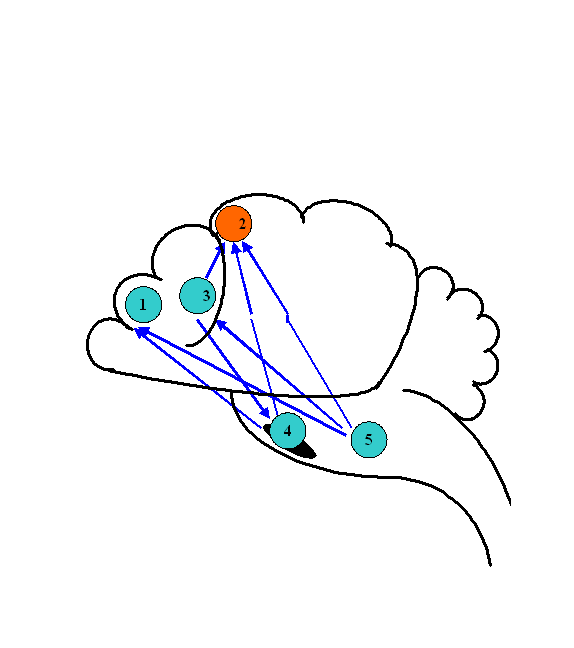 1,1 МПа 1,1 МПа |
 2,1 МПа 2,1 МПа | 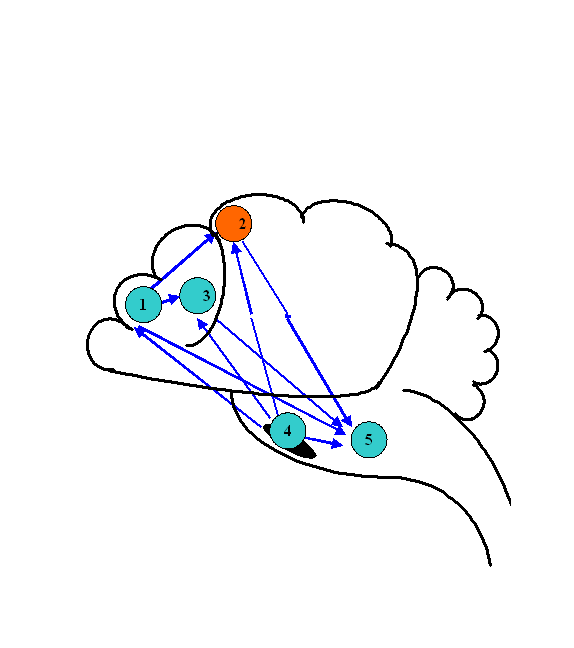 4,1 МПа 4,1 МПа |
Рис. 1. Паттерн когерентных отношений биоэлектрической активности структур ЦНС крысы в начале компрессии азотом. 1 – лобная кора, 2 - моторная кора, 3 - хвостатое ядро, 4 – черная субстанция, 5 - ретикулярная формация среднего мозга.
При нормальном давлении (0,1 МПа) нормоксической кислородно-азотной ДГС указанные центры мозга функционировали в условиях полного набора взаимных когерентных отношений. По мере компрессии паттерн этих отношений изменялся. При 1,1 МПа появились первые признаки редукции исходных взаимоотношений, как среди корковых, так и среди подкорковых структур. При 2,1 МПа отношения когерентности изменялись в сторону большего рассогласования исходных взаимосвязей. Дальнейшая компрессия до 4,1 МПа не приводила к полному восстановлению паттерна, так как когерентные связи между отдельными структурами по-прежнему отсутствовали.
Результаты исследования двигательной активности и электрографических коррелятов азотного наркоза позволяют предложить шкалу изменения состояния организма крыс в ходе компрессии, которая содержит пять важных точек: 0,7 МПа (торможение двигательной активности); 1,2 МПа (атаксия задних конечностей); 2,1 МПа (атаксия передних конечностей); 2,7 МПа (падения на бок); 3,9-4,0 МПа (боковое положение), равномерно перекрывающих диапазон давлений азота 0,1–4,1 МПа.
Изменение напряжения кислорода в коре мозга крыс при компрессии азотом. В ходе компрессии до 7,1 МПа среднее значение рО2 в моторной коре мозга крыс колебалось в пределах нормы от 26 до 33 мм.рт.ст. Это означает, что даже сорокакратное увеличение плотности ДГС не приводит к нарушению снабжения кислородом коры мозга экспериментальных животных. Результаты измерения представлены на рис. 2. Следовательно, в диапазоне повышенных давлений азота 0,1-4,1 МПа, применяемом нами в исследовании сочетанного действия гипоксии и азотного наркоза, при использовании нормоксических ДГС кислородный гомеостаз моторной коры мозга крыс не был нарушен.
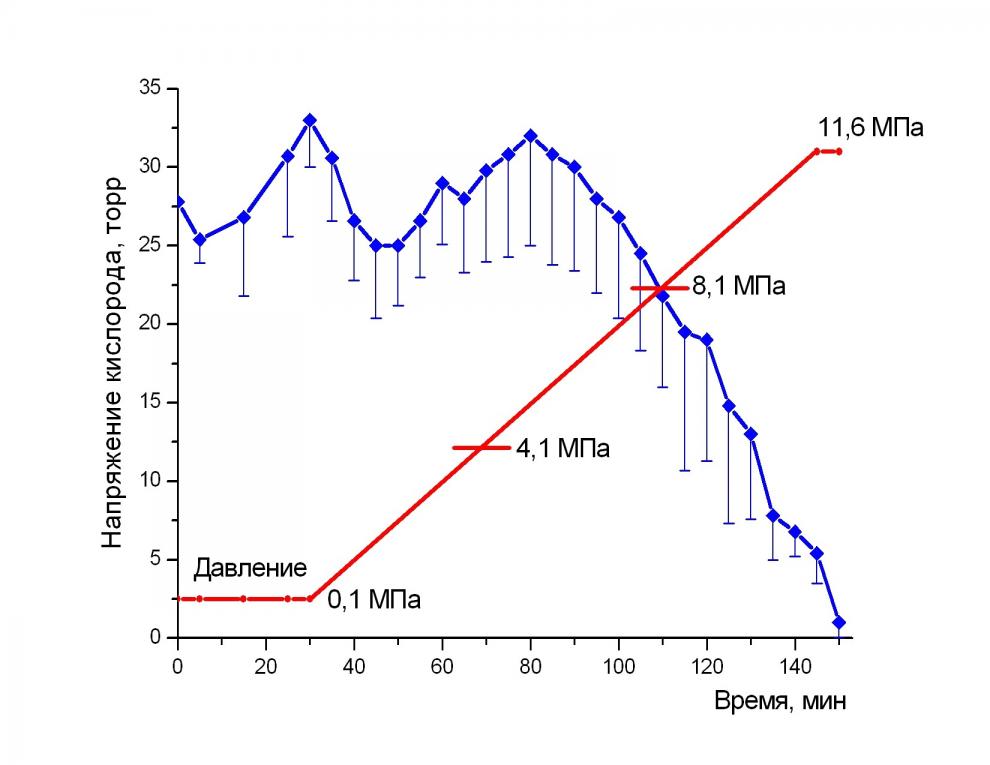
Рис. 2. Изменение напряжения кислорода в мозгу крыс в ходе компрессии азотом. Доверительные интервалы указаны для Р = 0,95.
Анализ динамики напряжения кислорода в мозгу крыс в ходе развития азотного наркоза дал возможность провести дополнительную коррекцию ранее полученных поведенческих и электрографических данных, позволившую получить тщательно выверенную шкалу ключевых изменений состояния нескольких функциональных систем экспериментальных животных при компрессии азотом. Ее можно рассматривать как физиологический портрет азотного наркоза. Ключевыми точками этой шкалы следует считать: атаксию задних конечностей при 1,7 МПа; атаксию передних конечностей при 2,6 МПа; состояние бокового положения, в котором животное оказывается при давлении азота 4,1 МПа.
- Действие пониженного парциального давления кислорода на организм млекопитающих. При уменьшении парциального давления кислорода в пределах 0,018 – 0,010 МПа организм включает физиологические резервы, нивелирующие недостаток кислорода в ДГС. Это - этап компенсируемой гипоксии. Последующее снижение количества кислорода в дыхательной смеси уже не восполняется мобилизацией физиологических и биохимических резервов организма. В большей части экспериментов мы выбирали содержание кислорода в ДГС в начале зоны некомпенсируемой гипоксии (0,006 МПа). При этом, содержание углекислого газа не превышало 0,0004 МПа, что характеризует наши экспериментальные ДГС как нормокапнические. Температура дыхательной газовой среды при этом поддерживалась в диапазоне 24-28 0 С.
Двигательная активность и рефлексы позы крыс при дыхании гипоксическими кислородно-азотными смесями. Поведенческий репертуар животных в условиях нарастающей гипоксии выглядит беднее, чем двигательные изменения в ходе компрессии азотом. При уменьшении парциального давления кислорода в ДГС с 0,021 до 0,009 МПа крысы сохраняли обычную позу покоя. В диапазоне парциальных давлений кислорода 0,009 – 0,007 МПа отмечалось усиление двигательной активности животных. Возрастало количество очистительных рефлексов. При давлении кислорода в ДГС ниже 0,007 МПа развивалась потеря выпрямительных рефлексов. Это был единственный общий признак, объединяющий кислородное голодание и азотный наркоз. Таким образом, шкала количественной оценки динамики двигательной активности и рефлексов позы крыс на фоне нарастающей гипоксической гипоксии имеет только две отчетливо выраженные фокальные точки на оси парциальных давлений кислорода. Это момент появления первых признаков двигательного возбуждения при 0,009 МПа кислорода и сформировавшееся состояние потери животным выпрямительных рефлексов при 0,005 МПа.
Динамика потребления кислорода крысами при гипоксии. При уменьшении концентрации кислорода вплоть до критической зоны 0,012-0,009 МПа потребление кислорода крысами оставалось практически неизменным и близким к значениям нормы (Трахтенберг с соавт., 1978) (рис. 3). При концентрации кислорода ниже 0,009 МПа, потребление кислорода увеличивалось. Это увеличение можно объяснить как увеличением работы мышц дыхания и миокарда в условиях нарастающей плотности, так и увеличением двигательной активности животных из-за развития атаксии конечностей.
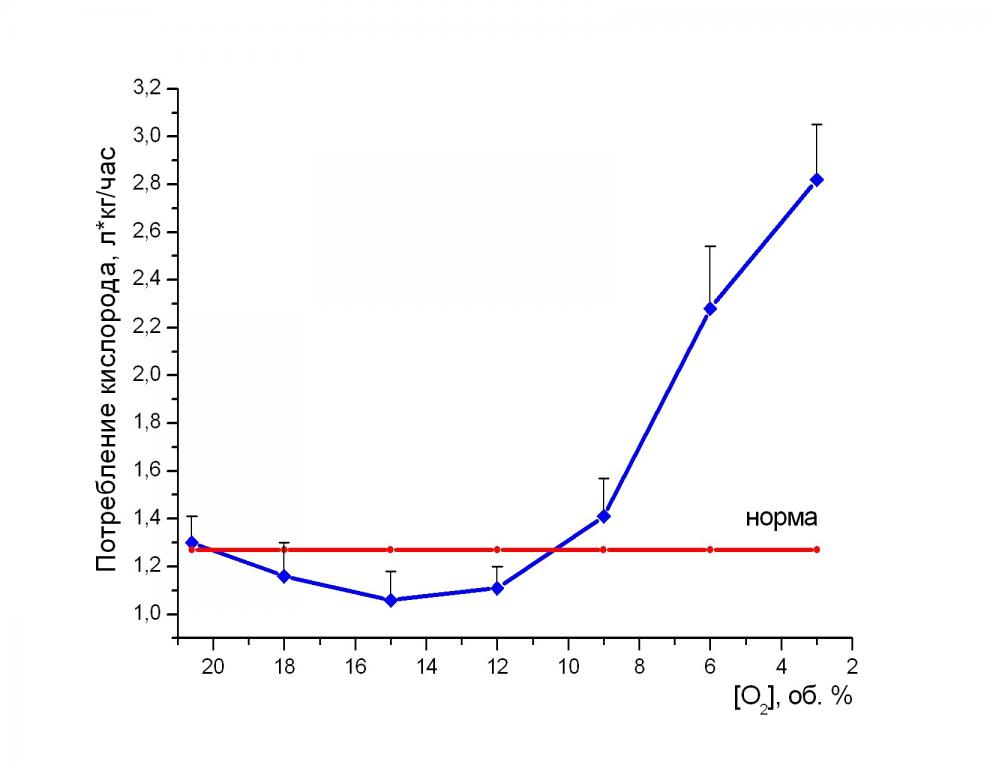
Рис. 3. Динамика потребления кислорода крысами при различном содержании кислорода в ДГС. По оси абсцисс – концентрация кислорода в ДГС (объемные проценты). Доверительные интервалы указаны для Р = 0,95
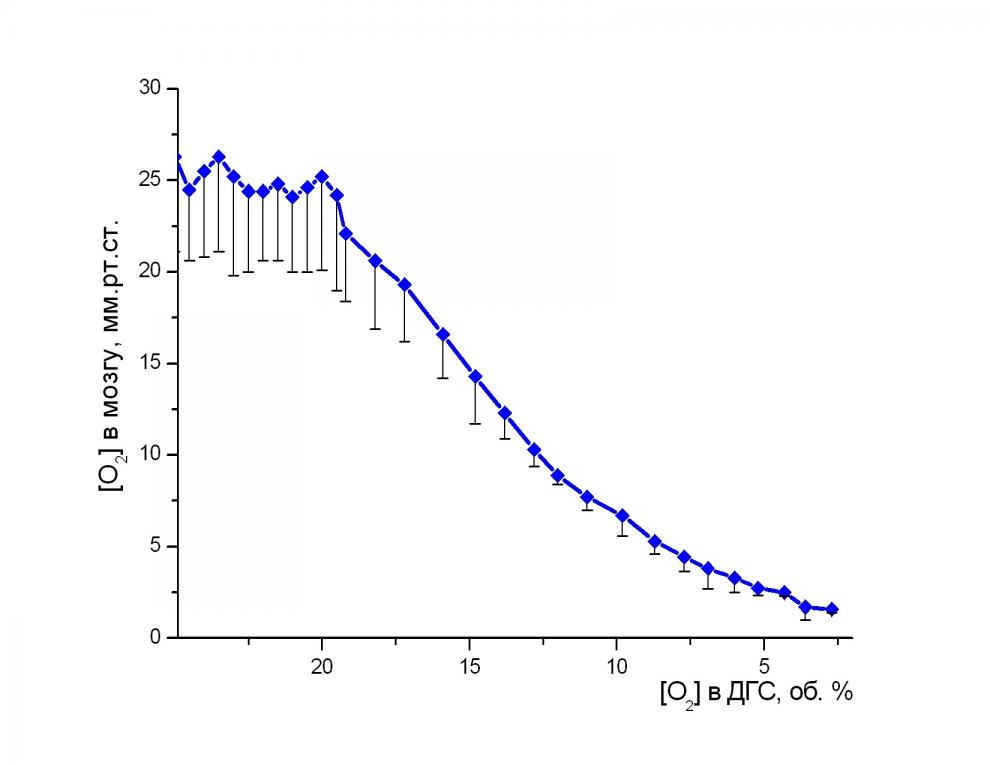
Изменение напряжения кислорода в коре мозга крыс при гипоксии. В нормоксических условиях среднее значение напряжения кислорода в моторной коре мозга крыс составляло 25 мм.рт.ст. (рис. 4). При уменьшении парциального давления кислорода в дыхательной газовой среде со скоростью 0,001 МПа в мин на этапе компенсируемой гипоксии напряжение кислорода в коре мозга снижалось градуально со скоростью 1,7 мм.рт.ст. в мин. В диапазоне 0,010-0,003 МПа кислорода в ДГС эта скорость уменьшилась до 0,5 мм.рт.ст. в мин. Наиболее вероятной причиной появления новой тенденции сохранения кислородного гомеостаза мозга может быть регионарное перераспределение кровотока в организме крысы в пользу преимущественного кровоснабжения ЦНС.
Рис. 4. Напряжение кислорода в коре головного мозга крысы при различном содержании кислорода в ДГС. По оси ординат – напряжение кислорода в мозгу, мм.рт.ст. По оси абсцисс – концентрация кислорода в ДГС (объемные проценты). Доверительные интервалы указаны для Р = 0,95
В условиях действия нарастающего гипоксического стимула изменения двигательной активности и рефлексов позы крыс коррелируют прежде всего с динамикой вегетативных показателей функциональных систем, обеспечивающих транспорт кислорода в организме.
На этапе компенсируемой гипоксии наблюдалось торможение двигательной активности животных, сопровождающееся умеренной активизацией деятельности кардиореспираторной системы. При этом потребление кислорода оставалось практически в пределах нормы, а напряжение кислорода в коре мозга градуально уменьшалось. На этапе некомпенсируемой гипоксии, начинающемся для различных функциональных систем в диапазоне 0,012-0,009 МПа кислорода в ДГС, происходила активизация вентиляторного и циркуляторного звеньев доставки кислорода к клеткам организма, что выражалось в увеличении ЧД и ЧСС. Таким образом, шкала изменения состояния крыс на фоне действия нарастающего гипоксического стимула, построенная на основе изменений двигательной активности и рефлексов позы животных и откорректированная по данным динамики вегетативных показателей, имеет три критические точки – 0,009 МПа кислорода (увеличение двигательной активности); 0,006 МПа (первые признаки потери выпрямительных рефлексов); 0,003 МПа (потеря выпрямительных рефлексов).
- Сочетанное действие повышенного парциального давления азота и пониженного парциального давления кислорода на организм млекопитающих.
Исследование влияния двух факторов на организм осуществлялось при их одновременном предъявлении в рамках экспериментальной модели и при последовательном их действии. Во втором случае фактор, предъявляемый отсроченно, оказывает свое действие на фоне «метаболического хвоста», вызванного действием первого фактора.
Развитие азотного наркоза у крыс на фоне гипоксической гипоксии. Исследование процесса развития азотного наркоза на фоне гипоксии производилось при парциальном давлении кислорода в ДГС, равном 0,021; 0,012; 0,008; 0,006 и 0,004 МПа. В качестве основных поведенческих признаков наркотического действия азота использовались: атаксия задних конечностей, атаксия передних конечностей и потеря выпрямительных рефлексов (см. рис. 5). В условиях нормоксии основные признаки наркотического действия азота впервые проявлялись соответственно при давлениях 1,7 МПа, 2,6 МПа и 4,1 МПа. Появление самого раннего признака азотного наркоза – атаксии задних конечностей при давлении азота 1,7 МПа мы рассматривали как количественную меру чувствительности организма крыс к наркотическому действию азота. Разницу давлений азота между появлением самого раннего и самого позднего признаков азотного наркоза мы рассматривали как количественную меру устойчивости к наркотическому действию азота. В условиях нормоксии она составляла 4,1 – 1,7 = 2,4 МПа. При компенсируемой гипоксии (0,012 и 0,008 МПа кислорода в ДГС) все основные поведенческие признаки впервые проявлялись при меньших давлениях. При этом повышалась чувствительность и
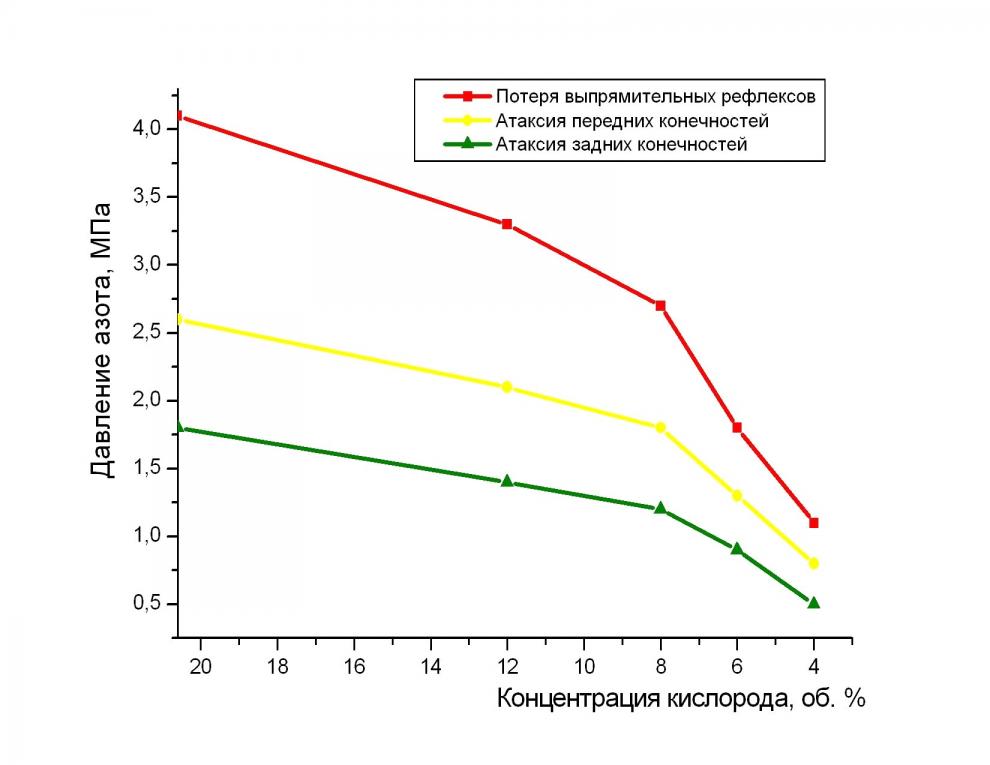
уменьшалась устойчивость животных к действию гипербарического азота.
Рис. 5. Изменение двигательной активности и рефлексов позы крыс в ходе развития азотного наркоза на фоне нарастающего гипоксического стимула.
В условиях жесткой, некомпенсируемой гипоксии (ниже 0,006 МПа О2) быстрее росла чувствительность и падала устойчивость крыс к наркотическому действию азота. При 0,004 МПа кислорода в ДГС весь спектр поведенческого репертуара укладывался в диапазон давлений азота 1,1 МПа. Полученные данные убедительно свидетельствуют о том, что процесс развития азотного наркоза является кислородозависимым в диапазоне концентраций кислорода в ДГС 0,021 – 0,004 МПа. При этом двухфазно увеличивалась чувствительность и уменьшалась устойчивость организма млекопитающих к наркотическому действию азота.
Развитие азотного наркоза у крыс на фоне гипоксического прекондиционирования.
На основании полученных данных для крыс породы Wistar нами было обосновано эффективное значение парциального давления кислорода в ДГС, соответствующее 0,006 МПа, приводящее к формированию метаболического гипоксического следа (Журавин, 2003). Основываясь на этом, курсовое прекондиционирующее гипоксическое воздействие на крыс производили один раз в сутки в одно и то же время в первой половине дня. Максимальная длительность гипоксического курса составляла 16 дней. Эффективность гипоксического прекондиционирования количественно оценивали на модели азотного наркоза (табл. 1). На основании проведенных исследований с 10, 12 и 16-дневными прекондиционирующими воздействиями была получена максимальная степень устойчивости, асимптотически приближающаяся к 50%, но длительность курсового воздействия при 60-ти минутной непрерывной гипоксии чрезвычайно велика. Для увеличения эффективности воздействий нами была выбрана интервальная гипоксическая тренировка. В результате 4-х дневной интервальной гипоксической тренировки устойчивость животных к действию повышенного давления азота возросла до 67,2%.
Таблица 1
Повышение резистентности крыс к действию повышенного давления азота после 8-и сеансов 60-минутного непрерывного гипоксического воздействия.
| Поведенческий признак азотного наркоза | Давление азота, при котором наступает признак | Разница (в %) между наступлением признака азотного наркоза при тренировочной гипоксии и без нее | |
| при компрессии азотом | при компрессии азотом после 8 сеансов гипоксии | ||
| Атаксия задних конечностей | 1,7 | 2,6 | 52,9 |
| Атаксия передних конечностей | 2,6 | 3,4 | 30,7 |
| Потеря выпрямительных рефлексов | 4,1 | 5,4 | 31,7 |
| Средняя величина устойчивости | 38,4 | ||
- HSP-статус нейронов моторной коры мозга крыс при действии повышенного парциального давления азота, пониженного парциального давления кислорода и их сочетания.
В ходе компрессии азотом концентрация этого газа возрастает в каждой клетке организма экспериментального животного. Однако, клетками-мишенями для гипербарического азота являются, прежде всего, активно работающие клетки мозга. Нарушение двигательной активности и рефлексов позы в ходе развития азотного наркоза и на терминальных стадиях гипоксии может быть обусловлено дефицитом функциональной активности нейронов пирамидной и экстрапирамидной систем мозга. Нисходящие пути пирамидной системы начинаются в моторных зонах коры больших полушарий головного мозга. Иммуноцитохимическое исследование HSP-статуса этих нейронных структур составило основную задачу заключительной стадии нашего исследования.
Динамика HSP70 в моторной коре мозга крыс при азотном наркозе. У крыс контрольной группы клетки моторной коры головного мозга, дающие иммуноцитохимическую реакцию на HSP70, были разделены на три типа: клетки с сильной, умеренной и слабой реакцией (рис. 6). В клетках всех трех типов реакция носила гранулярный характер. В клетках с сильной реакцией гранулы располагались по всей цитоплазме, в клетках с умеренной – в основном на одном полюсе цитоплазмы и в клетках со слабой реакцией – гранулы в очень небольшом количестве могли располагаться по всей цитоплазме, но, в основном, наблюдались на одном полюсе.

Рис. 6. Нейроны моторной коры головного мозга крыс с различной интенсивностью иммуноцитохимической реакции на HSP70. 1 – сильная реакция, 2 – умеренная реакция, 3 – слабая реакция. Увеличение х 400.
Действие повышенного давления азота на крыс (один час при 4,1 МПа) приводило к увеличению по отношению к контролю количества клеток с сильной реакцией на HSP70 и уменьшению количества клеток со слабой реакцией (табл. 2). Сильная реакция была характерна для нейронов всех слоев моторной коры мозга.
Таблица 2
Среднее количество нейронов с различной интенсивностью иммуноцитохимической реакции на HSP70 в моторной коре мозга крыс при компрессии азотом до 4,1 МПа.
| Воздействие | Среднее количество (%) нейронов | ||
| Сильная реакция | Умеренная реакция | Слабая реакция | |
| Интактный контроль | 2,5 | 36,9 | 60,6 |
| Компрессия азотом до 4,1 МПа | 6,7 | 42,1 | 47,6 |
| Изменение реакции, % | +168 | +14,1 | -27,3 |
Динамика HSP70 в моторной коре мозга крыс при курсовой интервальной гипоксии. Реакция нейронов моторной коры мозга крыс на интервальное гипоксическое воздействие подчинялась тем же закономерностям, что и реакция на действие повышенного давления азота (табл. 3).
Таблица 3
Среднее количество нейронов с различной интенсивностью иммуноцитохимической реакции на HSP70 в моторной коре мозга крыс при различной длительности курса интервальных гипоксических тренировок.
| Воздействие | Среднее количество (%) нейронов | ||
| Сильная реакция | Умеренная реакция | Слабая реакция | |
| Интактный контроль | 2,5 | 36,9 | 60,6 |
| 6 % гипоксия 1 сеанс | 1,9 | 56,7 | 41,4 |
| 6 % гипоксия 4 сеанса | 5,9 | 54,7 | 39,4 |
| 6 % гипоксия 8 сеансов | 5,8 | 59,9 | 34,3 |
| Изменение реакции после 8 сеансов гипоксии, % | +132 | +62,3 | -56,6 |
Динамика HSP70 в моторной коре мозга крыс при действии повышенного давления азота после курсовой интервальной гипоксии. После ежедневной 8-суточной интервальной гипоксии крыс подвергали компрессии азотом до 4,1 МПа. При этом в моторной коре крыс еще больше увеличивалось количество клеток с умеренной реакцией и резко снижалось количество клеток со слабой реакцией. Количество клеток с сильной реакцией было на том же уровне, что и при компрессии азотом без прекондиционирования гипоксией (табл. 4).
Таблица 4
Среднее количество нейронов с различной интенсивностью иммуноцитохимической реакции на HSP70 в моторной коре мозга крыс при компрессии азотом до 4,1 МПа после курса интервальных гипоксических тренировок.
| Воздействие | Среднее количество (%) нейронов | ||
| Сильная реакция | Умеренная реакция | Слабая реакция | |
| Интактный контроль | 2,5 | 36,9 | 60,6 |
| Компрессия азотом до 4,1 МПа | 6,7 | 42,1 | 47,6 |
| 8 сеансов гипоксии + компрессия азотом до 4,1 МПа | 6,0 | 66,9 | 27,1 |
Таким образом, HSP-статус нейронов моторной коры мозга крыс после компрессии азотом, следующей за курсом восьмисуточного гипоксического прекондиционирования, изменялся в сторону увеличения количества клеток с сильной и умеренной реакцией и снижения количества клеток со слабой реакцией.
- Обсуждение результатов экспериментальных исследований.
Прямое экспериментальное измерение напряжения кислорода в моторной коре мозга линейных крыс в ходе развития азотного наркоза в нормотермических, нормоксических и нормокапнических условиях показало, что колебания регистрируемого параметра происходили в пределах 25-33 мм.рт.ст. вплоть до величины давления азота 7,1 МПа. Это означает, что гипоксической, вентиляторной, циркуляторной и гемической гипоксии в коре мозга животных в этом диапазоне давления азота не было.
Сравнение шкал изменения функционального состояния крыс при действии повышенного давления азота или нарастающей гипоксической гипоксии показало существенную разницу их функциональных проявлений. Это позволило количественно исследовать симптоматику азотного наркоза на фоне гипоксического стимула.
Если гипоксическое воздействие на крыс в экспериментах предшествовало компрессии азотом, то это приводило к уменьшению чувствительности животных к азотному наркозу. Чувствительность биологической системы к действию того или иного фактора окружающей среды определяется моментом появления самой ранней реакции на данный стимул. Первые признаки азотного наркоза после гипоксического прекондиционирования появлялись при давлении на 47,1 % превышающем давление азота, при котором признаки имели место у животных, не получивших прекондиционирующего воздействия. При этом увеличивался показатель устойчивости крыс к действию повышенного давления азота. Устойчивость биологической системы определяется разницей между моментами появления самой ранней реакции на предъявленный стимул и самой поздней. Потеря выпрямительных рефлексов у животных, получивших предварительное гипоксическое воздействие, происходила при давлениях, превышающих 4,1 МПа.
В свою очередь, экспозиция животных в условиях повышенного давления азота на фоне нарастающего гипоксического стимула приводила к прямо противоположным результатам. На стадии компенсируемой гипоксии (0,018-0,008 МПа кислорода в ДГС) чувствительность крыс к действию повышенного давления азота увеличивалась с 1,7 до 1,2 МПа азота. На стадии некомпенсируемой гипоксии (0,008-0,004 МПа кислорода в ДГС) чувствительность к действию азота возрастала более быстрыми темпами. Эти результаты хорошо согласуются с данными И.С.Бреслава (Бреслав, Ноздрачев, 2005). Одновременно двухфазно уменьшалась устойчивость животных к действию повышенного давления азота, которая, в конечном счете, изменилась с 4,1-1,7=2,4 МПа до 1,1-0,4=0,7 МПа, то есть снизилась в 3,5 раза.
Таким образом, гипоксическое воздействие на животных давало прямо противоположный результат при предварительном и одновременном действии с повышенным давлением азота. В поисках непротиворечивого объяснения полученного парадоксального результата и для выявления общих механизмов устойчивости клеток мы исследовали содержание стресс-белков HSP70 в нейронах моторной коры мозга крыс при обоих воздействиях.
У интактных животных две трети нейронов моторной коры мозга содержали HSP70 в незначительном количестве, около трети нервных клеток имели умеренное количество тех же белков. Значительное количество HSP70 наблюдалось только у 2,3 % нейронов. Компрессия животных азотом вплоть до 4,1 МПа в полтора раза увеличивала число нейронов с умеренным содержанием HSP70 и в 2,68 раза увеличивала число нейронов со значительным количеством тех же белков. Это означает, что экстремальное воздействие повышенного давления азота приводило к повреждениям внутриклеточных молекулярных агрегатов. Эти повреждения вызывали активизацию сначала конститутивных, а затем, возможно, и синтез индуцибельных белков HSP70 в нейронах.
Однократное интервальное гипоксическое воздействие (0,006 МПа кислорода в ДГС) увеличивало число нейронов моторной коры, содержащих умеренное количество HSP70, в 1,67 раза. Четырехкратное интервальное гипоксическое воздействие увеличивало число нейронов моторной коры, содержащих значительное количество HSP70, в 2,6 раза. Из этого следует, что экстремальное гипоксическое воздействие также приводит к многочисленным повреждениям внутриклеточных молекулярных агрегатов, причем данные о динамике HSP70 в нейронах свидетельствуют о том, что в рамках нашей экспериментальной модели оптимальная гипоксическая нагрузка на животных находилась в пределах между 4 и 8 сутками курсовой интервальной гипоксии.
Таким образом, стресс-белки семейства HSP70, бесспорно, принимают участие в процессах адаптации нейронов мозга, как к действию повышенного давления азота, так и к пониженному парциальному давлению кислорода. Нами также получены экспериментальные данные об участии этих белков в процессах адаптации к сочетанному действию вышеуказанных экстремальных факторов.
В ходе нормального функционирования клетки возникают периоды повышения метаболической нагрузки и кратковременного нарушения баланса между возросшей потребностью в кислороде и поступлением молекул этого газа. Чаще всего это происходит в активно работающих клетках, например, в нейронах и кардиомиоцитах. При этом развивается оксидативный стресс, который приводит к увеличению концентрации активных форм кислорода (АФК) в митохондриях и пероксисомах (Саприн, Калинина, 1999). Одна из активных форм кислорода - супероксид анион радикал, вступая в реакцию с молекулами оксида азота, порождает высокореакционноспособную молекулу пероксинитрита (Lipton, 1999; Malyshev, Zenina, Golubeva, 1999). Этот продукт метаболизма повреждает -S-S- связи в молекулах окрестных белков, тем самым, нарушая их нативную конформационную структуру (Зенков с соавт., 1999). Постоянно присутствующие в активно работающих клетках конститутивные стресс-белки способны быстро восстановить исходную конформацию повреждённых клеточных молекулярных агрегатов (Welch, 1992; Меерсон, Малышев, 1993; Ветош, 2003). В случае недостаточности репарационной потенции конститутивных стресс-белков, клетка способна быстро синтезировать дополнительные индуцибельные HSP (Sharp, Massa, Swanson, 1999). Репарационная активность стресс-белков требует затраты энергии молекул АТФ (Lipton, 1999; Morimoto, Nollen, 2004).
В ходе компрессии азотом количество пероксинитрита в клетках увеличивается (Thom, Fisher, 1998). Следовательно, усиливается интенсивность повреждения белков и возрастает репарационный ответ активно работающих клеток.
В условиях гипоксии количество АФК в клетках возрастает (Lipton, 1999; Саприн, Калинина, 1999). Это также приводит к увеличению концентрации пероксинитрита и увеличению количества частично повреждённых белков (Lipton, 1999; Malyshev et al., 1999; Зенков с соавт., 1999). Однако процессы репарации в гипоксических условиях затруднены, так как при недостатке кислорода уменьшается синтез АТФ (Дудченко, Белоусова, Лукьянова, 1994; Lipton, 1999).
И, наконец, в условиях сочетанного действия повышенного давления азота и гипоксии количество молекул пероксинитрита должно возрастать суммативно. В то же время на фоне гипоксии в клетках уменьшается количество АТФ и, следовательно, понижается репаративный потенциал конститутивных стресс-белков. Совокупность этих двух обстоятельств должна вызывать возрастание чувствительности организма крыс к действию повышенного давления азота и уменьшение устойчивости животных к влиянию этого газа под давлением. Выявленное нами усугубление процесса азотного наркоза в условиях гипоксии может быть объяснено вовлечением стресс-белков семейства HSP70 в механизмы наркотического действия азота, развития гипоксии и их сочетания.
ВЫВОДЫ
1. Напряжение кислорода в моторной зоне коры мозга крыс породы Wistar остается в пределах нормы в ходе компрессии азотом вплоть до 4,1 МПа, т.е. гипоксической, вентиляторной, циркуляторной и гемической гипоксии у животных в этих условиях нет.
2. Прекондиционирование крыс при 6 % кислорода в ДГС уменьшает чувствительность и увеличивает устойчивость к действию повышенного давления азота пропорционально количеству сеансов гипоксии.
3. В ходе развития азотного наркоза на фоне нарастающего гипоксического стимула устойчивость крыс к действию повышенного давления азота уменьшается начиная с парциального давления кислорода в ДГС 0,009 МПа.
4. Шкала количественной оценки изменения состояния двигательной активности и рефлексов позы крыс на фоне нарастающего со скоростью 0,001 МПа в мин гипоксического стимула имеет три критические точки: 0,009; 0,006 и 0,003 МПа кислорода в ДГС.
5. В ходе курсового интервального гипоксического воздействия в нейронах моторной коры мозга крыс, начиная с первого сеанса, до 60 % увеличивается количество HSP70. При этом, количество нейронов, имеющих высокое содержание HSP70, увеличивается в 3 раза, начиная с 4 сеанса курсовой гипоксии.
6. В ходе компрессии азотом до 4,1 МПа количество нейронов моторной коры мозга крыс, имеющих высокое содержание HSP70, увеличивается в 2,68 раза.
СПИСОК ОСНОВНЫХ ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ
- Vjotosh A., Sharapov O., Alekseeva O. Central nervous system sensitivity to high nitrogen pressure in various mammalian species // Proceeding of International Joint Meeting on Hiperbaric and Underwater Medicine. - Milano, Italy, 1996. - Р. 451-454.
- Ветош А.Н., Шарапов О.И., Алексеева О.С. Сравнительно-физиологическое исследование чувствительности ЦНС млекопитающих к действию повышенного давления азота // Сб. «Тезисы докладов I(XI) Международного совещания по эволюционной физиологии». - С-Пб, 1996. - С.34-35.
- Ветош А.Н., Алексеева О.С., Попов А.А. Динамика температуры тела млекопитающих в ходе компрессии азотом // Гипербарическая физиология и медицина. - 1996. - № 4. - С.8
- Ветош А.Н., Алексеева О.С. Развитие гипотермии под действием повышенного давления азота // Доклады академии наук. - 1997. - Т.355. - № 2. - С.276-278.
- Ветош А.Н., Алексеева О.С., Попов А.А. Гипотермическое действие повышенного давления индифферентных и наркотических газов на организм млекопитающих животных // Тезисы докладов 3-й Всеармейской научно-практической конференции «Баротерапия в комплексном лечении и реабилитации раненых, больных и пораженных». - С-Пб, 1997. - С.73-74.
- Vjotosh A., Alekseeva O., Sharapov O., Popov A. Sensory support of the rat brain supraspinal motor control under nitrogen high pressure // Proceeding of XXXIII Int. Congress of Physiological Sciences. - 1997. - Р.41-63
- Vjotosh A., Alekseeva O., Sharapov O., Popov A. Hypothermia component of animal nitrogen narcosis // High pressure biology and medicine. University of Rochester press. - 1998. - Р.262-268.
- Vjotosh A., Alekseeva O., Popov A., Boso A., Demchenko I. Role of nitric oxide in the mechanism of nitrogen narcosis // Undersea and Hyperbaric Medicine. - 1999. - V.26., suppl - Р.81.
- Ветош А.Н., Попов А.А., Алексеева О.С., Пожидаев В.А. Действие на организм животных экстремальных значений плотности азотно-кислородной дыхательной газовой среды // Доклады академии наук. - 1999. - Т.365. - № 2. - С.276-278.
- Ветош А.Н., Попов А.А., Алексеева О.С., Пожидаев В.А. Снабжение мозга кислородом в условиях экстремально высокой плотности дыхательной газовой среды. // Международная конференция, посвященная 150-летию акад.И.П.Павлова «Механизмы функционирования висцеральных систем». - С-Пб, 1999. - С.72-73.
- Ветош А.Н., Попов А.А., Алексеева О.С., Пожидаев В.А. Действие азота под давлением 12,1 МПа на млекопитающих животных // Материалы Всероссийской конференции «Индифферентные газы в водолазной практике, биологии и медицине». - Москва, 2000. - С.26-30.
- Ветош А.Н., Алексеева О.С., Попов А.А. Использование феномена перекрестной адаптации для увеличения резистентности животных к действию повышенного давления азота // Материалы Российской конференции «Проблемы обитаемости в гермообъектах». - Москва, 2001. - С.27-28.
- Алексеева О.С., Попов А.А. Диссолюция функций нервно-мышечного аппарата млекопитающих под влиянием действия повышенного давления азота и введения кверцетина // XII Международное совещание и V школа по эволюционной физиологии. Тезисы докладов. - С-Пб, 2001. - С.7-8.
- Ветош А.Н., Лучаков Ю.И., Попов А.А., Алексеева О.С., Морозов Г.А. Терморегуляторные реакции млекопитающих в условиях действия повышенного давления азота // Физиол.ж. - 2003. - Т.89. - № 2. - С.139-145.
- Алексеева О.С., Ветош А.Н. Динамика процессов потребления кислорода млекопитающими животными при длительном пребывании в гипербарической кислородно-азотной и кислородно-гелиево-азотной средах // Баротерапия в комплексном лечении и реабилитации раненых, больных и пораженных. – СПб, 2003. - С. 29.
- Vetosh A., Alexeeva O., Popov A. Mammalian nitrogen narcosis and possible role of high shock proteins // 8th International Meeting on biological high pressure. - Moskow, 2003. - Р.74-75.
- Ветош А.Н., Алексеева О.С., Горелов А.М. Пульсоксиметрический мониторинг состояния испытуемых в ходе предъявления стабильного гипоксического стимула // Материалы Четвертой Российской конференции (с международным участием) «Гипоксия: механизмы, адаптация, коррекция». - Москва, 2005. - С.21.
- Ветош А.Н., Алексеева О.С. Азотный наркоз у млекопитающих животных. Оптимизация экспериментальной модели // Материалы конференции «Гипербарическая физиология и водолазная медицина». - Москва, 2005. - С.9-11.
- Алексеева О.С., Ветош А.Н. Предварительные гипоксические тренировки – способ коррекции состояния организма при азотном наркозе // Тезисы докладов и лекций XIII международного совещания и VI школы по эволюционной физиологии. - СПб, 2006. - С. 12-13.
- Алексеева О.С., Ветош А.Н. Азотный наркоз у млекопитающих на фоне дозированной гипоксии // Тезисы докладов 6-й Всеармейской научно-практической конференции «Баротерапия в комплексном лечении и реабилитации раненых, больных и пораженных». - СПб, 2006. - С.63.
- Vjotosh A.N., Alekseeva O.S., Popov A.A. High nitrogen pressure influence on adaptive physiological mechanisms of mammalian // VII World congress “International society for adaptive medicine (ISAM)”. - Moscow, 2006. - Р.105-106.
- Отеллин В.А., Григорьев И.П., Забелинский С.А., Чеботарева М.А., Кривченко А.И., Алексеева О.С., Косткин В.Б. Жирные кислоты фосфолипидов клеточных ядер головного мозга после гипоксии в различные периоды онтогенеза крыс // Доклады академии наук. - 2006. - Т.410. - № 2. - С.275-277.
- Ветош А.Н., Алексеева О.С. Влияние модулятора синтеза HSP – кверцитина на процессы развития азотного наркоза у животных // Тезисы докладов XХ съезда физиологического общества им. И.П.Павлова. - Москва, 2007. - С.24.
- Ветош А.Н., Алексеева О.С. Изменение характера наркотического действия гипербарического азота под влиянием нарастающего гипоксического стимула // Материалы международного симпозиума «Актуальные проблемы биофизической медицины». - Киев, 2007. - С.37.
- Ветош А.Н., Косткин В.Б., Алексеева О.С., Коржевский Д.Э. Роль стресс-белков семейства HSP70 в изменении характера наркотического действия гипербарического азота под влиянием нарастающего гипоксического стимула // Фiзiол. журн. - 2008. - Т.54. - № 2. - С.33-40.
- Ветош А.Н., Алексеева О.С., Косткин В.Б., Коржевский Д.Э. Динамика активности стресс-белков семейства HSP70 в нейронах моторной коры мозга крыс на фоне дозированного гипоксического стимула и в условиях азотного наркоза // Пятая Российская конференция «Гипоксия: механизмы, адаптация, коррекция». - Москва. - 2008.

