Мелкие млекопитающие южных курильских островов
На правах рукописи
ГРИГОРЬЕВ ЕВГЕНИЙ МИХАЙЛОВИЧ
МЕЛКИЕ МЛЕКОПИТАЮЩИЕ ЮЖНЫХ КУРИЛЬСКИХ ОСТРОВОВ
03.00.08 – зоология
03.00.16 – экология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук

Владивосток – 2008
Работа выполнена в лаборатории териологии Биолого-почвенного института ДВО РАН и в Государственном природном заповеднике «Курильский»
Научный руководитель: доктор биологических наук,
профессор
Костенко Виктор Александрович
Официальные оппоненты: старщий научный сотрудник,
доктор биологических наук,
Картавцева Ирина Васильевна
кандидат биологических наук
Бурковский Олег Александрович
Ведущее учреждение: Институт биологических проблем
Севера ДВО РАН
Защита состоится "17 " июня 2008 г. в 14 часов
на заседании диссертационного совета Д 005.003.03 при Биолого-почвенном институте ДВО РАН по адресу: 600022, г. Владивосток, проспект 100 лет Владивостоку, 159. Факс (4232) 310-193
С диссертацией можно ознакомиться в Центральной научной библиотеке ДВО РАН
Автореферат разослан апреля 2008 г.
Ученый секретарь
диссертационного совета,
кандидат биологических наук Е.М. Саенко
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Формирование флоры и фауны островных сообществ в условиях длительной изоляции способствует образованию уникальных природных комплексов со специфическим набором видов. В тоже время ранимость их биоты многократно выше, чем в континентальных районах. Поэтому проблемам сохранения биоразнообразия островных экосистем уделяется особое внимание. Курильские острова являются уникальной моделью для изучения островных сообществ млекопитающих, но закономерности их функционирования изучены слабо. Без этого невозможно планировать рациональное использование и охрану их биологического потенциала.
Объектами исследования явились мелкие млекопитающие (Micromammalia) – представители отрядов насекомоядных и грызунов. Изучение этой группы животных на южных Курильских островах до 60-70 гг. ХХ века носило эпизодический характер и было направлено на уточнение видового состава населяющих острова животных, в первую очередь охотничье-промысловых видов. В немногочисленной литературе практически отсутствуют данные о биотопическом распределении, размножении, структуре популяций, динамике численности обитающих здесь насекомоядных и грызунов, т.е. сведений, получить которые возможно только при организации стационарных исследований. Такие исследования провел автор данной работы.
Цели и задачи исследования. Главной целью исследований является изучение основных сторон биологии и экологии насекомоядных и грызунов южных Курильских островов. Для этого решались следующие задачи:
- выяснение и уточнение видового состава насекомоядных и грызунов на островах региона;
- изучение закономерностей биотопического распределения изучаемых животных ;
- выяснение половозрастной структуры популяций фоновых видов и ее сезонных и годовых изменений;
- изучение основных черт биологии и экологии островных популяций насекомоядных и грызунов.
Научная новизна. Впервые собран и проанализирован оригинальный материал по экологии и биологии девяти видов и подвидов мелких млекопитающих, обитающих на Южных Курилах. Изучены особенности биотопического распределения, половой и возрастной структуры их популяций и их изменения в зависимости от фазы динамики численности, выяснены адаптивные особенности процесса воспроизводства островных популяций. Впервые для о. Кунашир указана Sorex minutissimus hawkeri Thomas, 1905. Из состава фауны грызунов о. Шикотан выведена Rattus rattus (Linnaeus, 1758), из состава фауны о. Зеленый выведена Myodes sikotanensis (Tokuda, 1935). Предложена новая синонимия для Sorex gracillimus natalae Okhotina, 1993 = S. gracillimus kurodai Hutterer et Zaitsev, 2004, syn. nov.
Практическое значение. Результаты работы составили основу мониторинга популяций мелких млекопитающих природного заповедника «Курильский» и заказника «Малые Курилы» и уже включены в «Летопись природы» указанного заповедника. Они могут быть использованы в проектировании природоохранных мероприятий, проведении экологической экспертизы по оценке ущерба при хозяйственном использовании островных территорий».
Апробация работы. Материалы работы доложены на 2-й научной конференции «Численность грызунов на Дальнем Востоке СССР» (Владивосток, 1988), на заседании отдела зоологии и ботаники Московск. общ-ва испытателей природы (МОИП) (Москва, 1989), на 1-м съезде Всесоюз. Териологич. общ-ва АН СССР (Москва, 1990),
3
на I Всесоюз. совещании по биологии насекомоядных млекопитающих (Новосибирск, 1992), на заседании отдела зоологии БПИ ДВО РАН (Владивосток, 1993, 2008), на научно-практической конференции «Kuril Flyway» (Япония, Токио, 1997).
Публикации. По теме диссертации опубликовано 14 работ.
Структура и объем работы. Диссертация состоит из введения, 5 глав, выводов, списка литературы, содержащего 155 наименований, в том числе 40 на иностранных языках. Работа изложена на 119 страницах, содержит 22 таблицы и 15 рисунков.
Благодарности. Приношу искреннюю благодарность моему научному руководителю д-ру биол. наук, проф. В. А. Костенко, д-ру биол. наук, проф. В. А. Нестеренко и д-ру биол. наук М. П. Тиунову за ценные советы по сбору и обработке материала, а также сотрудникам заповедника «Курильский» за непосредственную помощь в работе.
ГЛАВА 1. МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Сбор фактического материала проводился во время стационарных полевых работ в 1985-1992 гг. на базе ФГУ "Государственный природный заповедник "Курильский" (о-ва Кунашир и Дёмина), федерального биологического заказника "Малые Курилы" (о-ва Шикотан, Полонского, Осколки, Зеленый, Юрий, Анучина, Танфильева, Рифовый), а также кратковременных исследований в 1986-1989, и 1995-2002 гг. на территории государственного заказника областного значения "Островной" (о. Итуруп). Основные исследования проводились на 4 стационарах: двух на о. Кунашир (северный Тятинский и южный Алехинский) и по одному на о-вах Шикотан и Зеленый.
Методы исследования включали круглогодичные учеты мелких млекопитающих плашками Геро в ловушко-линиях (Кучерук, 1952; Кучерук и др., 1963; Наумов, 1964) и ловчими цилиндрами в ловчих канавках и заборчиках (Наумов, 1955; Заблоцкая, 1957; Охотина, Костенко, 1974 и др.). Отловы ловчими канавками осуществлялись лишь на о-вах Кунашир и Дёмина. В сильно увлажненных местах устанавливались полиэтиленовые заборчики. Для количественной оценки результатов учетных работ использовался стандартный показатель относительной численности: количество попадания особей на 100 ловушко-суток (л./с.) либо на 100 цилиндро-суток (ц./с.).
Добытые зверьки перед вскрытием подвергались морфометрической обработке: определялась их масса, длина тела, ступни и хвоста. Затем они дифференцировались по полу и возрасту (Варшавский, Крылова, 1948; Кошкина, 1957; Башенина, 1977 и др.). В качестве критерия для установления возраста землероек использовались общепринятые особенности возрастных изменений в черепе, степень стертости зубов, состояние волосяного покрова. Выделение возрастных группировок у грызунов проводилось по размерам и массе тела и краниологическим признакам. Кроме этого, для определения возраста красно-серой полевки использовался систематический ряд по степени разрушения корней коренных зубов (М2), составленный Фудзимаки (Fujimaki, 1972; Fujimaki, Takeuchi, 1983) для полевок Хоккайдо.
Участие грызунов в размножении определялось по числу эмбрионов и плацентарных пятен у самок и по текучести спермы у самцов (Свириденко, 1944; Кошкина, 1957; Башенина, 1977 и др). Величина и количество пометов у рожавших землероек определялась по методике Н.Е. Докучаева (1990).
Всего за время работы в различных биотопах заложено 28 ловчих канавок и заборчиков. Отработано 14 845 ловушко-суток и 9780 цилиндро-суток, отловлено 13 248 мелких млекопитающих, из них 3 764 красно-серых полевок, 305 шикотанских полевок, 393 японских мышей, 82 серые крысы, бурозубок – 7 375 когтистых, 296 средних, 1 035 дальневосточных и 5 крошечных.
4
ГЛАВА 2. УСЛОВИЯ ОБИТАНИЯ МЕЛКИХ МЛЕКОПИТАЮЩИХ
НА ЮЖНЫХ КУРИЛЬСКИХ ОСТРОВАХ
В состав Курильского архипелага, расположенного в северо-западной части Тихого океана, входит более 30 крупных островов и многочисленные мелкие острова, протянувшиеся на 1200 км между о. Хоккайдо и п-овом Камчатка. Они представлены двумя параллельными Большой и Малой Курильской грядами. Под южными Курильскими островами понимается южное звено Большой Курильской гряды (о-ова Кунашир и Итуруп) и все острова Малой Курильской гряды: Шикотан и группа мелких островов (Зеленый, Полонского, Осколки, Демина, Юрий, Анучина, Танфильева, Рифовый).
В работе приводится характеристика рельефа, климата почвенного покрова, растительного и животного мира и их роль как среды обитания для изучаемых групп животных. Для популяций мелких млекопитающих рассматривается история становления их островных ареалов. Оценивая кормовые ресурсы, защитные и погодные условия на рассматриваемых островах, можно отметить в целом благоприятные для мелких млекопитающих жизненные условия, а их фаунистическая бедность может быть объяснена островным положением небольших участков суши (Grigoriev, 2001).
ГЛАВА 3. АННОТИРОВАННЫЙ СПИСОК ВИДОВ
Классификация млекопитающих приведена по ряду обобщающих мировых и отечественных сводок (Simpson, 1945; Громов, Ербаева, 1965; Каталог млекопитающих …, 1981; Павлинов, 2003; Mammal species of the World …, 2005) с учетом замечаний и исправлений, приведенных в работах И.Я. Павлинова, О.Л. Россолимо, 1987; М.В. Охотиной, 1993; В.А. Нестеренко, 1999; В.А. Костенко, 2000; О.Л. Россолимо и др., 2004.
Список включает 9 видов мелких млекопитающих из 3 семейств и 2 отрядов. Для семейств и родов даны сведения по видовому составу и распространению. Для родов и подродов указывается типовой вид и основные синонимы. Для всех видовых таксонов, включая синонимы, приведены сведения о типовом материале или типовой местности, данные о распространении на Дальнем Востоке и на южных Курильских островах. В список видов не включены ошибочно указанные В.Е. Соколовым (1954) Microtus montebelli для о. Шикотан, С.В. Межжериным (1992) Apodemus agrarius для о. Кунашир и Rattus rattus, отмеченная А.А. Тимофеевой (1962) на о. Шикотан и затем в течение 45 лет, несмотря на поиски, там не обнаруженная.
Отряд INSECTIVORA Bowdich, 1821 – НАСЕКОМОЯДНЫЕ
Семейство Soricidae Fischer, 1817 – Землеройковые
Род Sorex Linnaeus, 1758 – Бурозубки
Sorex (Sorex) caecutiens kunashirensis Hutterer et Zaitsev, 2004 –
Бурозубка средняя кунаширская
Sorex caecutiens kunashirensis Hutterer et Zaitsev, 2004 – Mammal Study, 29: 90 [замещающее название для Sorex caecutiens longicaudatus Okhotina, 1993, не Sorex longicaudatus Kishida, 1930 (nomen nudum), не Sorex longicaudatus Yoshikura, 1956].
Sorex caecutiens longicaudatus Okhotina, 1984 – Наземные млекопит. Дальнего Востока СССР: 66 [типовая местность: о. Кунашир, nomen nudum].
Sorex caecutiens longicaudatus Okhotina, 1993 – Тр. Зоол. ин-та АН СССР, 243 (1991): 65 [голотип: № 77856 (2902), самка, о. Кунашир, окр. оз. Лагунное, 2.09.1972, М. Охотина].
5
Предложенное М.В. Охотиной в 1984 г. без описания (nomen nudum), а в 1993 г. с приведенным диагнозом название Sorex caecutiens longicaudatus оказалось преокупированным, и позже Р. Хуттерер и М.В. Зайцев (Hutterer, Zaitsev, 2004) предложили замещающее название kunashirensis. Обитает на о. Кунашир.
Sorex (Sorex) gracillimus natalae Okhotina, 1993 –
Бурозубка дальневосточная Натали
Sorex gracillimus natalae Okhotina, 1993 – Тр. Зоол. ин-та АН СССР, 243 (1991): 68 [голотип: № 77854 (2851), самка, о. Кунашир, окр. оз. Лагунное, 31.08.1972, М. Охотина].
Sorex gracillimus gracillimus: Охотина, 1984: 62 (Кунашир, Шикотан, Полонского, Зеленый, Танфильева).
Sorex gracillimus granti Okhotina, 1993 - Тр. Зоол. ин-та АН СССР, 243 (1991): 68 [голотип: № 77853 (2672), самец, о. Шикотан, окр. пос. Малокурильск, 27.06.1972]. Синонимизирован Нестеренко, 1999: 41.
Sorex gracillimus kurodai Hutterer et Zaitsev, 2004 – Mammal Study, 29: 90 [замещающее название для Sorex gracillimus granti Okhotina, 1993, не Sorex grantii Barrett-Hamilton et Hinton, 1913]. Syn. nov.
Описанный с Малых Курильских островов Sorex gracillimus granti Okhotina, 1993 впоследствии был сведен в синоним к Sorex gracillimus natalae Okhotina, 1993 (Нестеренко, 1999), но из-за того, что название granti оказалось преокупированным Р. Хуттерером и М.В. Зайцевым (Hutterer, Zaitsev, 2004), предложили замещающее название kurodai. Если принимать синонимию предложенную В.А. Нестеренко (1999), тогда и Sorex gracillimus natalae Okhotina, 1993 = Sorex gracillimus kurodai Hutterer et Zaitsev, 2004, syn. nov. Обитает на о-вах Кунашир, Шикотан, Полонского, Зеленый, Танфильева, Анучина.
Sorex (Sorex) minutissimus hawkeri Thomas, 1905 –
Бурозубка крошечная Хавкери
Sorex minutissimus hawkeri Thomas, 1905 – Proc. zool. Soc. London, 1: 331 [типовая местность: «Mukawa», о. Хоккайдо, Япония].
Распространена на о-вах Кунашир, Сахалин и Хоккайдо (Япония).
Sorex (Sorex) unguiculatus Dobson, 1890 – Бурозубка когтистая
Sorex unguiculatus Dobson, 1890 - Ann. Mag. Nat. Hist. ser. 5: 115 [типовая местность: о. Сахалин, «Tymy-Thal», лектотип № 2387, хранится в Зоологическом институте РАН (г. Санкт-Петербург)].
Ареал охватывает Сев.–Вост. Китай, север Корейского п-ова, о-ва Японского архипелага и южную часть Дальнего Востока России, в том числе о. Кунашир и острова Малой Курильской гряды.
Отряд RODENTIA Bowdich, 1821 – ГРЫЗУНЫ
Семейство Muridae Illiger, 1811 – Мышиные
Род Apodemus Kaup, 1829 – Мыши восточные
Apodemus (Alsomys) speciosus ainu (Thomas, 1905) – Японская (красная) мышь
Micromus speciosus ainu Thomas, 1905 - Proc. zool. Soc. London, 1: 349 [типовая местность: «Аояма», о. Хоккайдо, Япония].
Обитает на о-вах Кунашир (Россия) и Хоккайдо (Япония).
6
Род Mus Linnaeus, 1758 – Мыши домовые
Mus (Mus) musculus raddei Kastschenko, 1910 – Мышь домовая Радде
Mus musculus raddei Kastschenko, 1910 - Ежегодн. Зоол. музея Акад. Наук, 15: 278 [типовая местность: Бурятская АССР, Кяхтинский р-н, 70 км В. от Кяхта («Троицкосавск»)].
Типичный синантроп. Населяет практически все жилые постройки и продуктовые склады в населенных пунктах всего Дальнего Востока, в том числе и южных Курил.
Род Rattus G. Fischer, 1803 – Крысы обыкновенные
Rattus norvegicus caraco (Pallas, 1779) – Крыса серая карако
Mus caraco Pallas, 1779 – Nov. Spec. Quadr. Glir. Ord.: 91 [типовая местность: Читинская область].
Обитает в Зап. и Вост. Сибири, в Сев. и Вост. Монголии, Вост. Китае, на п-ове Корея и на о-вах Хоккайдо и Хонсю в Японии (Corbet, 1978). В пределах России caraco определенно встречается в Забайкалье, Приамурье, Приморье и на о-вах Сахалин и южных Курильских.
Семейство Cricetidae Fischer, 1817 – Хомяковые
Род Myodes Pallas, 1811 – Полевки лесные
Myodes (Craseomys) rufocanus irkutensis Ognev, 1923 –
Полевка красно-серая иркутская
Evotomys irkutensis Ognev, 1923 - Бюл. МОИП. Отд. биол., 31 (1918-1922): 69 [типовая местность: хр. Хамар-Дабан (юж. макросклон), Бурятия].
Распространена на правобережье р. Амур. Интродуцирована на о. Итуруп.
Myodes (Craseomys) rufocanus smithi (Thomas, 1905) –
Полевка красно-серая Смитта
Clethrionomys smithi Thomas, 1905 – Proc. zool. Soc. London, 1: 331
Clethrionomys rufocanus bromleyi Kostenko, 1984 – Наземные млекопит. Дальнего Востока СССР: 188 [типовая местность: Южные Курилы, Nomen nudum].
Распространена на о. Монерон и южных Курильских островах.
Myodes (Craseomys) sikotanensis (Tokuda, 1935) –
Полевка шикотанская
Neoaschizomys sikotanensis Tokuda, 1935 - Mem. Coll. Sci. Univ. Tokyo, ser. B, 10: 241 [типовая местность: о. Шикотан].
Распространена на о-вах Сахалин и Шикотан, а также в Японии (о-ва Дайкоку и Рисири).
ГЛАВА 4. БИОЛОГИЯ И ЭКОЛОГИЯ ВИДОВ
При изложении материала этой главы в отдельных очерках по обитающим на южных Курильских островах мелким млекопитающим мы, по возможности, придерживались следующей схемы: общий ареал вида, особенности его биотопического распределения, суточная и сезонная активность, численность, плотность популяций и динамика этих показателей, питание, норная деятельность и другие вопросы биологии и экологии непосредственно на островных территориях. Так как основной материал получен по фоновым видам, при его изложении мы несколько нарушили систематический порядок, указанный в главе 3, и рассматриваем в первую очередь эти виды.
7
4.1. Sorex unguiculatus Dobson, 1890
В обследованных биотопах южных Курильских островов является абсолютным доминантом среди насекомоядных, причем, ее доля в уловах бурозубок, как правило, превышает 80 % (Григорьев, 1992). Распространена по о. Кунашир неравномерно. На севере этого острова наибольшая плотность популяции отмечена в пойменных ольхово-ивовых зарослях с высокотравьем (25 % от всех пойманных зверьков), несколько меньше в бамбучниках на морских террасах и на высокотравных лугах с элементами злакового разнотравья (по 19 %).
Возрастной состав отловленных зверьков существенно различается: в пойменных биотопах сеголетки составляют 70 %, в бамбучниках на морских террасах - 48 %, на океанических побережьях - 40 %. Менее охотно эта землеройка заселяет сплошные бамбучники с плотной дерновиной, образованной мощной корневой системой этого растения, а также леса, произрастающие на плотных шлаковых почвах. Указанная закономерность биотопического распределения популяций данной землеройки несомненно связана с образом ее жизни. В питании когтистой бурозубки по данным М.В. Охотиной (1974), большое значение имеют дождевые черви, поэтому она поселяется в верхних слоях почвы - гумусовом слое и горизонте вымывания. Немаловажное значение имеет и рыхлость почвы (Григорьев, Пушкарев, 1992). Более крупные по размерам S. unguiculatus чаще встречаются в пойменных биотопах и долинных лугах
По многолетним показателям относительной численности популяции S. unguiculatus (особей на 100 ц./с.) на о. Кунашир выделено 4 группы биотопов: I - наиболее благоприятные (показатель численности более 70 ос. на 100 ц./с.) – это речные долины и приручьевые леса; II - благоприятные (50-70 ос. на 100 ц./с.) – хвойные и смешанные леса, в подросте которых бамбучник составляет менее 50 %; III - менее благоприятные (от 25 до 50 ос. на 100 ц./с.) - широколиственные и смешанно-широколиственные леса, заросли бамбучника необлесенных пространств, кедровый стланик; IV - неблагоприятные (менее 15 ос. на 100 ц./с.) – морские террасы и побережья. Прослеживаются следующие различия возрастного состава популяции S. unguiculatus по группам биотопов: наиболее мелкие и старые особи вытесняются в неблагоприятные местообитания.
Сезонные изменения численности популяции S. unguiculatus происходят по типичной для землероек схеме. В годы «пиков» численность достигает своих максимальных значений к августу (рис. 1).
Размножение когтистой бурозубки начинается сразу после схода снежного покрова. Из-за неравномерности его толщины в различных биотопах этот процесс растянут более чем на месяц. Наиболее ранние встречи беременных самок отмечены на побережьях и поймах (начало апреля – начало мая), значительно позднее - в хвойных лесах (вторая декада июня). Заканчивается репродукционный период в октябре и только в годы максимальной численности популяции - в середине сентября.
Величина выводка может варьировать от 1 до 10 молодых. В начале периода размножения (до августа) величина выводка колеблется от 4 до 8 особей в помёте (n – 29), к осени идёт увеличение в популяции самок с беременностью от 3 до 6 (n - 84) эмбрионов. В сентябре среднее количество эмбрионов на одну самку варьирует от 4,5 до 5,5. Коэффициент успешности размножения в зависимости от уровня численности популяции колеблется в пределах 1,4-5,8.
В сентябре S. unguiculatus активно размножается, доля участвующих в размножении особей стабильно высока и составляет 70 % и выше (рис. 2), и только в 1991 г. (четвёртый год подьёма численности популяции бурозубки и год максимального пика) этот показатель сократился до 57 %. Наличие резорбированных эмбрионов мы отмечали в
8
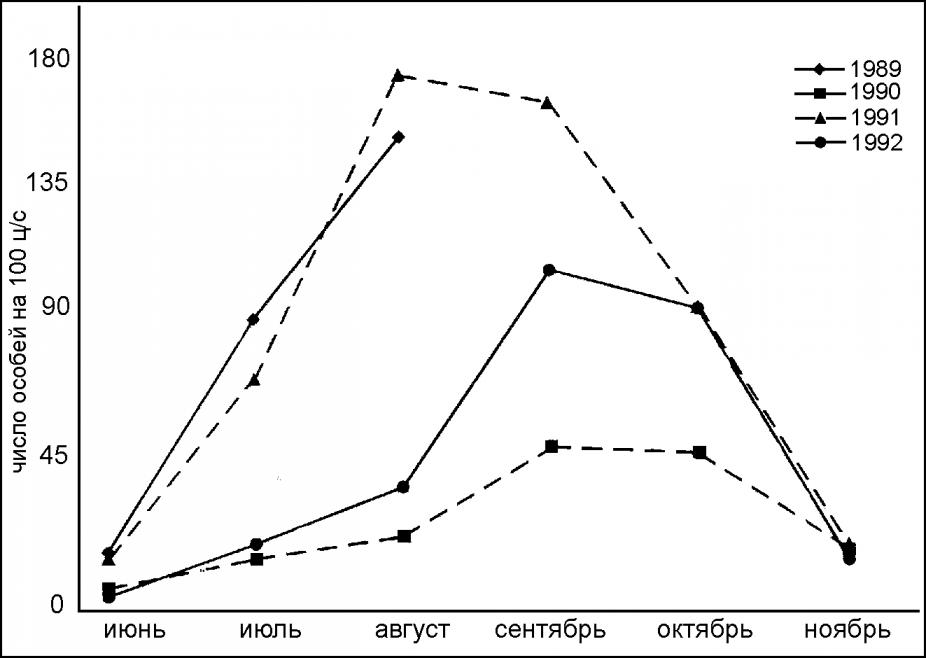
Рис. 1. Сезонные изменения относительной численности популяции
Sorex unguiculatus в 1989-1992 гг. на Тятинском стационаре о. Кунашир
в периоды подъёма численности в 1985-1986 и 1989-1991 гг. В то же время наибольшее количество таких самок отмечено в 1992 г., когда наблюдался резкий спад численности популяции этого вида. Наибольшее количество самок с резорбированными эмбриронами отмечено на морской террасе, т.е. там, куда происходит отселение взрослых заканчивающих размножение зверьков. В сентябре на о. Кунашир, соотношение самок, участвующих в размножении и закончивших его, в различных биотопах в основном схоже и составляет в среднем 1,0:3,5.
В годы низкой численности размножение бурозубок начинается раньше и идёт в течение сезона плавно. В сентябре 56 % самок продолжают размножение, но в октябре этот показатель опускается до 4 %. В годы высокой численности происходит обратная картина: начало размножения несколько запаздывает, только 17 % самок в июне приступают к выкармливанию первого выводка, против 50 % в год спада численности.
Половозрастная структура популяции рассматриваемой землеройки на обоих стационарах была идентичной. В различные фазы динамики численности популяции соотношение взрослых и молодых особей существенно различается. В годы максимальной численности оно равно 1:4, при ее подъеме – 1,0:1,9, во время низкой численности – 1,0:1,1 (Григорьев, 1992). Половой состав в популяции в течение всего времени наблюдений у перезимовавших зверьков был стабильным, соотношение самцов и самок было равно 1:3,6. Соотношение полов у сеголеток не зависит от состояния численности популяции и в среднем составляет 1:1 (Григорьев, 1992).
4.2. Sorex caecutiens kunashirensis Hutterer et Zaitsev, 2004
Широко распространена по о. Кунашир и в годы высокой численности ее популяций отлавливалась в большинстве биотопах. Но везде была немногочисленна. На севере острова наиболее часто S. c. kunashirensis отлавливалась в светлом елово-пихтовом сухом лесу с подростом из бамбучника (30 % всех отловленных насекомоядных), в мелком бамбучнике на морской террасе (20 %), в темнохвойном заболоченном пихтарнике (26 %), а так же в зарослях шиповника на морском побережье (15 %).
9
На юге острова предпочитает хвойные леса, в основном ельники Глена с мертвопокровником и подростом из кедрового стланика. В этих биотопах её численность может достигать своих максимальных показателей – 13,3 особи на 100 ц./с. Сезонный ход изменения численности популяции S. c. kunashirensis в разные годы различен и, по-видимому, зависит от фазы динамики ее численности (рис. 2).
Период размножения у этой бурозубки на о. Кунашир наблюдается со второй половины мая, что совпадает со сходом снежного покрова, и заканчивается в начале октября. Нами зафиксировано два помёта. В помете 6-10 молодых (n- 10)..
Питание сеголеток и взрослых особей различается. Основным кормом мелких по размерам сеголеток являются имаго и личинки мелких насекомых - двукрылых, щелкунов и др. Крупные по размерам, перезимовавшие бурозубки поедают имаго и личинок пластинчатоусых, чешуекрылых, а также дождевых червей.
В годы высокой численности (1989 и 1991) плотность популяции S. c. kunashirensis уменьшалась от июня к августу (в этом месяце отмечена и максимальная численность доминантного вида – когтистой бурозубки). Затем она увеличивалась и достигала максимума в октябре. По-видимому, в летние месяцы популяция более крупного доминантного вида (S. unguiculatus) сдерживает размножение более слабой и малочисленной популяции S. c. kunashirensis. К октябрю, когда у последней землеройки появляются молодые второго выводка численность ее популяции в отдельных биотопах уже может составить конкуренцию популяции когтистой бурозубки.
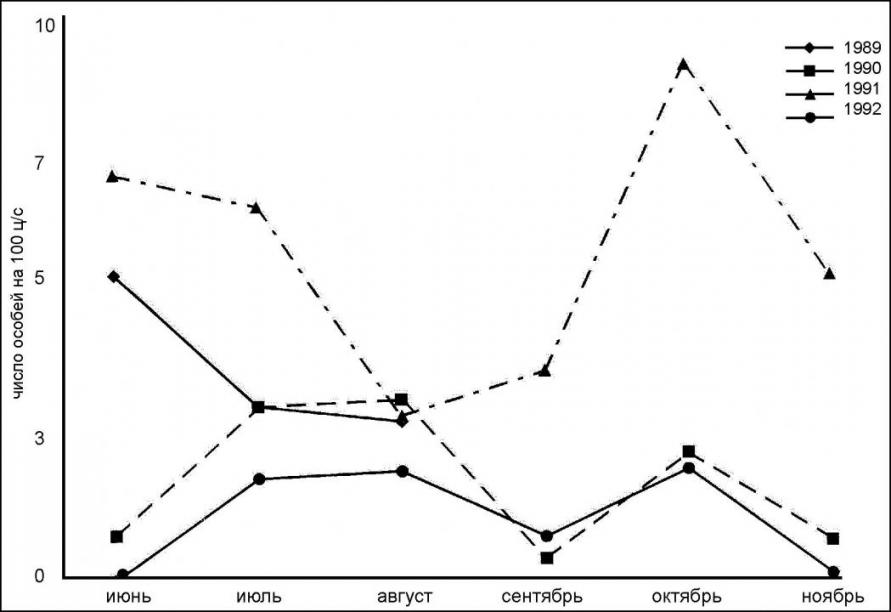
Рис. 2. Сезонная динамика численности популяции Sorex caecutiens kunashirensis
на Алёхинском стационаре (о. Кунашир, 1989-1992 гг.)
4.3. Sorex (Sorex) gracillimus natalae Okhotina, 1993
По численности среди землероек является вторым после когтистой бурозубки видом (Григорьев, 2000). Предпочитает селиться в увлажнённых биотопах. На севере о. Кунашир это влажные, часто сильно заболоченные темнохвойные елово-пихтовые леса зеленомошники, без подлеска первичной формации. В таких биотопах на северном Тятинском стационаре средняя многолетняя относительная численность популяции этого вида за 1985-1992 гг. колебалась в пределах 12-26 особей на 100 ц./с. На юге
10
о. Кунашир на склонах вулкана Головнина, где преобладают трансформированные растительные сообщества, а также сухие темнохвойные леса и заросли кедрового стланика, средняя многолетняя относительная численность популяции S. g. natalae составила от 2 до 7 зверьков на 100 ц./с. В сильно увлажнённых, заболоченных приручьевых лесах относительная численность популяции этой бурозубки возрастала до 17-25 особей на 100 ц./с. Во влажных темнохвойных лесах она достигала 30 ос. на 100 ц./с., а на тихоокеанском побережье этого острова в зарослях шиповника – более 20.
Несмотря на то что на водораздельных болотах эта землеройка отлавливалась только в сентябре, численность ее популяции в этот период была значительной – 100 особей на 100 ц./с., а доля в отловах составила 48 % всех пойманных бурозубок. В остальных обследованных биотопах относительная численность популяций S. g. natalae ниже или около 10 %. На Тятинском стационаре изменения численности популяции S. g. natalae носили хаотичный характер, поэтому её средняя численность оставалась стабильной в течение четырёх лет. Таким образом, характер изменения численности популяции S. g. natalae на севере и юге о. Кунашир существенно различается.
Основу питания S. g. natalae (по 37 желудкам) составляли личинки и имаго мелких жуков (96 % встречаемости корма), куколки муравьев (28 %) и пауки (14 %). На подобный характер питания этой землеройки указывают и другие исследователи (Нестеренко, 1999), подчеркивая большую роль в питании этого вида многоножек.
Период размножения у S. g. natalae начинается на севере о. Кунашир не ранее конца мая и заканчивается в сентябре, а на юге - в октябре. Самки приносят один, редко два приплода, в помете от 4 до 8 молодых. Из 30 пойманных нами участвующих в размножении самок S. g. natalae лишь одна была этого года рождения с 2 эмбрионами.
Сезонное изменение численности популяции S. g. natalae шло синхронно с S. unguiculatus. Аналогичные закономерности в биотопическом распределении, размножении и изменении численности у S. g. natalae отмечены и на о-вах Шикотан и Зеленый.
4.4. Sorex minutissimus hawkeri Thomas, 1905
Самая редкая землеройка южных Курильских островов. Первое упоминание о поимке одного экземпляра этой бурозубки на о. Кунашир относится к 1963 г. (Коротких, 1963; Каталог коллекций млекопитающих СахКНИИ, 1983). Впоследствии на эту находку ссылались Н.Ф. Реймерс с соавторами (1968) и В.Г. Воронов (1974). При просмотре нами коллекции СахКНИИ в 1985 г. было установлено, что экземпляр S. m. hawkeri, отловленный А.Н. Коротких на Кунашире в 1963 г., оказался молодой особью S. c. kunashirensis. Таким образом, достоверных поимок крошечной бурозубки на о. Кунашир до начала наших исследований не было.
S. m. hawkeri отловлена нами (в 1985 г. – 3 экз., 1986 г. – 1 экз., 1990 г. - 1 экз.) в канавку, расположенную на тихоокеанском побережье в 10 метрах от морского пляжа в зарослях шиповника морщинистого высотой 0,4-0,7 м. Травяной ярус здесь представлен осоками, злаками, полынями и пр. Почвы песчано-галечные. Биотоп сильно захламлен выбросами моря, при особо сильных штормах заливается волнами.
4.5. Mus musculus raddei Kastschenko, 1910
На о. Кунашир впервые зарегистрирована в 1956 г., на о. Шикотане в 1985 г. (Реймерс и др., 1968). Вместе с продуктовыми грузами регулярно завозится во все населенные пункты, расположенные на южных Курильских островах, но в природные биотопы не выселяется. Несмотря на высокую интенсивность размножения и пополнение популяции за счет завозимых новых мышей, она высокой численности не достигает.
11
Биология домовой мыши на южных Курильских островах ничем не отличается от биологии материковых популяций этого вида. Всеядна. Размножается круглый год, принося до 6 приплодов по 1-12 молодых в каждом.
4.6. Rattus norvegicus caraco (Pallas, 1779)
Серая крыса появилась на южных Курильских островах вероятно, в середине-конце позапрошлого века. Расселению способствовали развитие зверобойного промысла и постоянный приток зверьков с кораблей. Считается типичным синантропным видом, но подвид. R. n. coraco в условиях южных Курильских островов обитает в естественных условиях круглый год. На о. Кунашир отлавливалась только в поймах рек и ручьёв (52% всех пойманных крыс) и на морских побережьях (30%). Везде немногочисленна. На о. Шикотан приуроченность R. n. coraco к долинам рек сохраняется. Здесь численность ее популяции составляет 8,5 -10,5 особей на 100 л./с. На о. Зелёный вследствие отсутствия значительных ручьёв серая крыса отмечена только на побережьях (2,4 % всех уловов; 1,1 - 22,0 особи на 100 л./с.). Таким образом, распределении R. n. coraco по территории обследованных нами островов сходно. В то же время на о. Итуруп серая крыса заселяет все биотопы и плотность ее популяции в некоторых из них в отдельные годы достигает 60 % попадаемости на 100 л./с.
Раньше в антропогенных ландшафтах, складских помещениях портпунктов и рыбокомбинатов о-вов Кунашир и Шикотан численность популяции серых крыс достигала 40 % (Реймерс и др., 1968). Но в результате проведения систематических дератизационных работ в настоящее время численность крысы в этих местах нередко бывает ниже, чем в природных биотопах.
R. n. coraco всеядна. Во вскрытых нами 27 желудках серых крыс, добытых на о-вах Кунашир и Шикотан, семена растений составляли 66 % встречаемости, зеленая масса растений – 51 %, остатки рыбы – 37 %, кора деревьев и кустарников – 22 %, ягоды – 22 %, шерсть и мясо грызунов – 11 %, хитин насекомых – 7 %. В зимнее время основным кормом для R. n. coraco на южных Курильских островах кроме запасов в норах являются семена и молодые побеги бамбучника, а также органические остатки среди выбросов моря в прибойной полосе.
Начало репродуктивного периода приходится на конец апреля - май. За сезон размножения самка приносит 2 - 3 помёта с количеством 4 – 9 эмбрионов в каждом (n - 11). Окончание размножения на о. Кунашир происходит к началу октября. На Малой Курильской гряде с более мягким климатом оно задерживается до ноября. Подавляющее большинство молодых особей из природных популяций начинают размножаться на следующий год после рождения. В природных биотопах зимнее размножение не отмечено.
Численность R. n. coraco за весь период наблюдений была стабильно невысокой, только в 1988 г. на юге о. Кунашир отмечен подъём численности ее популяции. В этот год здесь поймано 90 % всех добытых за три года зверьков.
Летом на островах для островных как и для материковых популяций характерна в основном сумеречная и ночная активность, осенью и зимой крысы активны в любое время суток. В местах концентрации крыс, особенно в годы с высокой численностью их популяций, отмечена полифазная активность этого грызуна.
4.7. Apodemus speciosus ainu (Thomas, 1905)
Японская мышь распространена по Кунаширу неравномерно, предпочитает биотопы южной части острова, где отловлено 90 % всех зверьков этого вида. На севере ост-
12
рова этот грызун отдает предпочтение лиственным лесам по долинам рек (39,4 % всех отловленных в канавки зверьков), а также зарослям низкорослого курильского бамбучника с богатым разнотравьем на морских террасах (23,3 %). В зарослях шиповника со злаковым травостоем на тихоокеанском побережье эту мышь отлавливали только в годы высокой численности ее популяции (12,7 %). В хвойных лесах предпочтение отдается приручьевым увлажненным участкам леса с фрагментами высокотравья и кустарникового подроста (12,9 %), а также лесным опушкам по морским террасам с примесью широколиственных пород и богатым травостоем. Вертикальная граница распространения этого вида ограничивается пределом произрастания ольхово-каменноберезового пояса растительности высокогорий. В кедровых стланиках и на верховых водораздельных болотах в этой части острова она не отмечена.
На юге острова, так же как и на его севере, основная часть A. s. ainu отловлена в долинных биотопах. Необходимо отметить, что на высокотравных лугах и в разнотравно-злаковых зарослях на склонах морских террас эти грызуны отлавливались только в год максимальной численности их популяции, тогда как на лесной территории они отмечались ежегодно. Характерна концентрация мышей на границе хвойного леса и зарослей стланика. По всему острову они избегают спелых лесов с мертвопокровником и участков с высоким бамбучниковым покрытием. Малочисленны A. s. ainu и в сплошных зарослях курильского бамбучника.
Плотность популяции A. s. ainu в первую очередь зависит от типа и состояния лесной растительности и сопутствующего ей травяного покрова. В смешанно-широколиственных лесах с густым подлеском и высокотравьем долин рек юго-западной части острова отлавливалось до 40-50 особей на 100 л./с., в разреженных зарослях ивы и ольхи в бассейне р. Головнина – не выше 18 особей на 100 л./с., а на сильно увлажненной, занятой болотами долине р. Рикорда не было отловлено ни одной особи этого вида. Таким образом, биотопическая приуроченность A. s. ainu тесно связана с произрастанием различных лиственных лесов. Именно высокие урожаи семян этих древесных пород вызывают значительное повышение численности этого вида. Семена же хвойных пород играют меньшую роль, чем и можно объяснить небольшую численность мышей в хвойных лесах даже в годы урожаев семян на этих деревьях.
Весной популяция японской мыши состоит только из перезимовавших особей, осенью – только из сеголеток весенней и осенней генерации этого года рождения. Начало размножения приходится на последнюю декаду апреля. В конце августа – середине сентября из 31 самки перезимовавшие особи составляли 6,45 %. Они принесли за лето по 2 помета с общим числом молодых в двух генерациях от 8 до 15. Часть молодых первого помета (12,9 % всех самок) к этому времени принесли только по одному помету с числом молодых от 3 до 10 (в среднем 5). Большая часть молодых первого помета и молодые второго помета (80,65 %) в размножении этого года участия не принимали. Зимнее размножение у японской мыши не отмечено.
Сезонная динамика численности популяции A. s. ainu во всех обследованных местообитаниях и при всех уровнях численности в течение всего репродуктивного периода увеличивалась от весны к осени (Григорьев, 1990).
Японские мыши роют простые норы. Летние норы представляют собой неглубокий (35-50 см) отнорки с небольшой камерой на конце, диаметром 12-17 см. Выводковые и зимние норы устроены сложнее. От центрального хода отходят несколько отнорков, в расширениях которых на расстоянии 20–52 см от входа мыши устраивают гнездо и кладовые (Григорьев, 2004).
13
A. s. ainu – типичное семеноядное животное. Остатки семян отмечены в 92,7 % всех 136 обследованных желудков. Анализ содержимого кладовых показывает, что из лиственных пород предпочтение отдается желудям дуба, семенам кленов, ясеня, гортензии, бересклета; из хвойных пород – ели, пихты, орехам кедрового стланика. Из травянистых растений наиболее часто встречаются семена зонтичных, гречихи сахалинской, лизихитона. Несмотря на широкое распространение на о. Кунашир бамбучников, содержание в запасах мышей его семян незначительно, по-видимому, в основном из-за малых по площади участков цветения и плодоношения этого растения.
В весенний период мыши (n – 20) поедают семенной корм (80,0 % встречаемости), насекомых (4,9 %), а также кору деревьев и кустарников (40,0 %). В этот же период отмечено поедание мышами листьев бамбука (5 %).
В летний период основу питания (n - 52) составляют семена разнотравья (91 % встречаемости). Из ягод отмечено поедание шиповника, красники, жимолости (9,6 %), из животной пищи – личинок насекомых и дождевых червей (32,7 %). Средняя масса содержимого желудков составляла 1,25 г (максимальный – 3,22 г, минимальный – 0,36 г). Осенью в желудках 43 мышей обнаружены семена (83,7 % встречаемости), ягоды - в 16,2 %, зеленая масса растений - в 49,3 %, насекомые - 4,7 %. Вегетативные части растений поедаются в основном в зимний и ранний весенний периоды -7,3 % (n – 14). Вышеуказанные корма запасаются мышами и на зиму.
4.8. Myodes (Craseomys) rufocanus smithi (Thomas, 1905)
Среди грызунов доминирует на всех обследованных островах. На о. Зеленый наряду с особями с типичной окраской мы отлавливали темных полевок, у которых пуховые и остевые волосы на боках и спине черные, незначительное количество желтого пигмента присутствует на концах осевых волос щек и загривка, в районе ушных раковин интенсивность желтых тонов выражена сильнее. Брюхо и хвост окрашены как у номинальных форм. Различий в метрических данных у обеих форм нет. Переходных форм по окраске особей не наблюдалось. За пять лет из 515 добытых полевок черными оказались 52 (10,1 %). В 1985 г. в уловах доля полевок с черной окраской составила 6,1 % всех добытых полевок, в 1986 г. – 16,2 %, в 1987 г. – 10,6 %. Встречались они во всех биотопах, но больше всего на осоково-злаковых лугах (46,8 % всех черных), на побережьях (27,7 %) и болотах (25,5 %). В различные годы это соотношение сохранялось. Увеличение доли аберрантно окрашенных форм в популяции приурочено к снижению ее численности. Можно предположить, что жизнеспособность таких зверьков выше, чем у стандартно окрашенных форм (Григорьев, 1989).
На юге о. Кунашир M. r. smithi предпочитает светлые лиственные леса различного состава с густым подлеском из бамбучника (до 56 особей на 100 л./с.). В осеннее время большая плотность популяции этого грызуна наблюдалась и на морских побережьях (до 32 особей на 100 л./с.), куда их привлекали ежегодные обильные урожаи шиповника морщинистого.
На севере Кунашира наибольшей плотности популяции M. r. smithi достигают в хвойных лесах (до 60-70 особей на 100 л./с.) и по долинам рек. Но самая высокая плотность заселения полёвками биотопа была зафиксирована весной 1991 г. в районе урочища Урвитово в «ветроповалах», возникших в 1980 г. и занимающих здесь значительные площади. В выставленную линию из 50 плашек в первый день было отловлено 38 экз., во второй - 33, в третий – 24. Вертикальная граница распространения M. r. smithi поднимается до верхней границы растительности.
На Шикотане M. r. smithi встречается во всех биотопах и, судя по данным отловов, доминирует практически во всех из них (67–87 % всех добытых здесь мелких млеко
14
питающих), но распределяется она по ним неравномерно. Плотность ее популяции в различных местообитаниях варьирует от 2 до 80 особей на 100 л./с. Абсолютно доминировала эта полевка и во всех обследованных биотопах о. Зеленый (до 64,3 % всех добытых зверьков). Она заселяла более или менее равномерно океанические побережья, верховые болота, осоково-злаковые луга (31 - 36 % на 100 л./с.).
Сезонное изменение численности популяции M. r. smithi происходит по схеме - ее нарастание от весны к осени. Обычно осенью отмечается максимальная численность популяции этой полевки за счет выхода молодых полевок из гнезд и миграции молодых зверьков из местообитаний с худшими кормовыми и защитными условиями
На о. Кунашир из-за мозаичного расположения различных биотопов и перераспределения среди них популяции полевок их численность в разных частях острова может не совпадать. Количество эмбрионов на 1 самку - 4 – 9, причем по югу – в среднем 6,1 (п - 48), по северу - 6,3 (п - 64). Прибылые самки (летом 30 % всех, осенью 42 %) могут участвовать в размножении, причём 73 % из них приносят по два помёта.
Продолжительность репродуктивного периода у M. r. smithi на о. Шикотан составляет 5,5-6,0 мес. Начало размножения приходится на вторую половину апреля, заканчивается в первой половине октября. В осенних отловах (октябрь) отсутствуют беременные или кормящие особи. Среднее число эмбрионов на одну зимовавшую самку в 1985 г. было 4,8 (n - 9), в 1986 г. – 6,2 (n - 17), в 1987 г. – 6,1 (n - 20). Осенью 1985 г. у 28.6 % самок отмечены плацентарные пятна трех порядков, в 1986 г. таких самок было 100 %, а в 1987 г. – 41,7 %. Среднее число эмбрионов на одну самку у них также изменялось от 4,8 в 1985 г. до 6,2 в 1986-1987 гг. Таким образом, перезимовавшие самки приносят по 2 - 3 помета. Размножение сеголеток происходит не ежегодно: в 1986 г. в размножении участвовало 18 % (n – 50), из них 2 самки имели по 2 выводка, среднее число эмбрионов составило 5,6; в 1987 г. размножалось 10,2 % (n – 49), среднее число эмбрионов составило 4,2. Зимнее размножение не отмечено.
Продолжительность репродуктивного периода у M. r. smithi на о. Зеленый немного больше чем на других островах и составляет 6,0–6,5 мес. Тем не менее самки за сезон приносят также 2-3 выводка, со средним количеством эмбрионов 6,1 - 6,9 (n - 47). Ежегодно в размножении участвуют от 9 до 21 % самок-сеголеток, в основном от первого помета. Молодые осеннего приплода участвуют в размножении на следующий год. На обследованных островах Малой Курильской гряды соотношение полов в популяциях этих грызунов было стабильно и на всём протяжении наблюдений оставалось в пропорции 47 % самок и 53 % самцов как весной у перезимовавших, так и летом и осенью у прибылых особей.
Большую часть года M. r. smith питаются вегетативными частями растений (побеги, стебли, корневища и пр.) - злаков, осок, полыни. Ранней весной до начала вегетации основу питания этих полёвок составляют листья и стебли бамбука (58-100% встречаемости), прошлогодние семена - бамбук, гортензия, ясень, желуди, орехи (28-58%) и ягоды (до 8%). Кроме этого, они охотно используют в пищу кору деревьев (19-33%), на побережье кору шиповника. По мере появления первых цветов они преимущественно используют в пищу их побеги, иногда цветы. К лету вегетативные части растений становятся основным кормом. В осеннее время в питании M. r. smith возрастает роль семян травянистых, кустарниковых и древесных растений (44-61%), ягод и грибов (3-29%). Зимой, судя по местам кормежки, полевки питаются преимущественно корой деревьев: каменной березы, ольхи, ивы, бархата, пихты. Бамбучник на Кунашире достигает в высоту 2,0-2,5 м. Здесь листья этого растения грызуны поедают только зимой, под снегом. В то же время на о-вах Шикотан и Зелёный, где бамбучник
15
низкорослый и молодые побеги для зверьков доступны в течение всего бесснежного периода, они поедаются в течение всего года.
Острова, имеющие лесную растительность, богаты убежищами, поэтому у обитающих здесь M. r. smithi слабо проявляется роющая деятельность. Одно поколение полевок устраивает не менее двух-трех гнезд. На о. Шикотан на открытых безлесных сопках, заболоченных лугах, а также на безлесных островах (Зелёный, Юрий, Танфильева и пр.) эта полевка образует колонии, которые представляют собой соединённые наземными переходами несколько десятков нор. Зимние гнезда полевки устраивают после образования устойчивого снежного покрова группой по 5-8 особей. Там, где бамбучник отсутствует либо его заросли разреженны или низкорослы, они строятся на земле из травы и мха, от которых прорываются норы под снегом. Там же, где бамбучник образует высокие, от метра и более, густые заросли, гнёзда строятся непосредственно в листьях бамбучника на высоте до 2 м над землей. Вокруг гнезда листья выедаются полностью, а по мере выедания зелёной массы строится новое гнездо.
В июне активность M. r. smithi полифазная, в осенний период дневная и ночная активность крайне слабая, с пиком, который приходится на 17-19 ч.
4. 9. Myodes (Craseomys) rufocanus irkutensis Ognev, 1923
Впервые отмечена на о. Итуруп в 1996 г. (Костенко, 2002). Он предполагает непреднамеренную интродукцию M. r. irkutensis на этот остров в последние 15 лет вместе с контейнерами с сеном и сельскохозяйственными продуктами, регулярно доставляемыми пароходами из Приморского края.
Судя по тому, что в 2002, 2003 и 2005 гг. на этом острове продолжала наблюдаться высокая численность этого грызуна, можно судить, что акклиматизационный «взрыв численности» их популяции еще не закончился.
4. 10. Myodes (Craseomys) sikotanensis (Tokuda, 1935)
В.А. Костенко и Т.В. Алленова (1978, 1988), доказывая видовую самостоятельность шикотанской полевки, оперировали небольшим количеством морфологического материала по этому виду (13–23 взрослых зверьков). Обработав их коллекцию, а также присоединив наш материал (Григорьев, 1990б) мы получили более точные данные о размерах этой островной формы, которые дают возможность различать эти виды только по экстерьерным показателям в полевых условиях.
Шикотанская полевка обитает по всему острову, заселяя преимущественно разреженные каменноберезовые бамбуковые леса; окраины травянистых болот с пушицей влагалищной, росянкой, клюквой, багульником, трифолью; долины рек, заросших ивняком и ольхой, среди куртин которых перемежаются злаковые и разнотравные луга, заросли курильского бамбука. Значительно реже она отмечается в облесенных участках – в тисово-елово-пихтовых лесах с участием широколиственных пород, в зарослях можжевельника на вершинах сопок, а также на морских берегах, где прибрежные пески и морские террасы покрыты зарослями высоких злаков (преимущественно колосняка), осоки, шиповника, ползучего молокана (Григорьев, 2000). Популяция этого вида распределяется по биотопам неравномерно. Характерно, что места обитания шикотанской полевки территориально совпадают с местами обитания красно-серой полевки. Но первый вид предпочитает открытые осветлённые участки с зарослями бамбучника среди отдельных куртин леса, а также ивово-ольховые заросли по пойменным участкам долин рек и ручьев, в то время как второй – преимущественно тисово-елово-пихтовые сомкнутые леса и их производные.
16
В среднем по о. Шикотан доля шикотанской полевки в уловах двух видов полевок составляла 35 %. В пойменных местообитаниях этот показатель превышал 75 %. По данным осенних учетов в последних указанных биотопах уловистость в популяции рассматриваемого вида составила в 1985 г. - 15,8 особей на 100 л./с.; в 1986 г. - 32,6, в 1987 г. - 53,2, в 1989 г. - 21,3 на 100 л/с. В остальных облавливаемых местообитаниях средняя численность популяции этого вида за время отловов составляла от 2,0 в лиственничниках и бамбучниках по склонам сопок до 21,1 особи на 100 л./с. в кустарниковых зарослях и на заболоченном долинном лугу.
В осенних уловах у прибылых особей соотношение полов составляло 1:1 и только в год высокой численности популяции в пойменных биотопах самки преобладали над самцами (61 и 39 %). В весенних отловах доля самок была стабильно несколько выше, в разные годы изменяясь в пределах 62- 57 %, и составляла в среднем 60 %.
К концу апреля 60 % самок приступило к размножению, во второй половине мая - начале июня из 37 самок 80 % были беременными. Количество эмбрионов на самку варьировало от 6,7 до 7,3 (в среднем 7,2). В размножении принимали участие только взрослые перезимовавшие особи. Заканчивается размножение к началу октября.
Питается шикотанская полевка преимущественно вегетативными частями растений (стебли, подземные побеги и корневища).
Суточная активность полифазная. Необходимо отметить, что шикотанская полевка в местах обитания заняла экологическую нишу рода серых полевок. Поэтому некоторые стороны экологии этого вида более характерны для представителей рода Microtus, чем для рода Clethrionomys, наиболее характерные из них – наличие колониальных поселений, характер роющей деятельности, особенности питания и запасания пищи.
ГЛАВА 5. ДИНАМИКА ЧИСЛЕННОСТИ ПОПУЛЯЦИЙ
На о. Кунашир ввиду значительного расстояния между северным (и южным стационарами, а также значительной разницы между ними по составу биотопов мы рассматриваем динамику на каждом из них отдельно. В динамике численности популяции S. unguiculatus на о. Кунашир прослеживается двухгодичная цикличность, характер которой в основном совпадает на обоих стационарах (Григорьев, 2000а). Изменение численности популяции рассматриваемой бурозубки на севере острова в 1990-1992 гг. по большинству биотопов шли синхронно с изменениями на его юге. Также синхронно изменялась численность популяций этого вида в различных биотопах южной части этого острова.. На севере острова средняя многолетняя численность популяций S. unguiculatus в биотопах составила 82,0 особи на 100 ц./с, на юге острова этот показатель несколько меньше – 59,6 особи на 100 ц./с.
Картина изменения численности популяции когтистой бурозубки на о. Шикотан, повторяет динамику численности популяций этого вида на Кунашире (рис. 3).
Численность популяции S. unguiculatus на о. Зелёный в 1985-1987 гг. полностью повторяла динамику численности популяции M. r. smithi, оставаясь высокой в течение 3 лет. Начавшийся затем ее двухгодичный спад характерен для этого вида и отмечался нами на севере Кунашира на морских террасах. Максимальные показатели численности популяции отмечены на океаническом берегу (37 - 70 особей на 100 л./с.).
За период наблюдений в популяции S. caecutitiens kunashirensis на каждом стационаре зарегистрировано по три года с относительно высокими показателями численности ее популяции (рис. 4), которые чередуются с годами низкой численности (1985, 1988, гг.) и 1987 г. глубокой депрессии, когда не было поймано ни одного зверька.
17
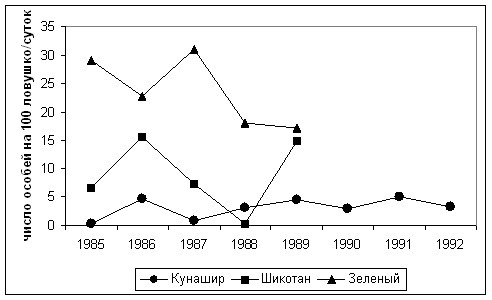
Рис. 3. Динамика численности популяции Sorex unguiculatus
на южных Курильских островах (1985-1992 гг.).
За годами с низкой численностью популяций этой землеройки на обоих стационарах следовали годы относительно высокой ее численности. Однако, в 1988 г. на юге острова и в 1990 г. на севере численность популяции этой бурозубки достигала своих максимальных показателей лишь на третий год (Григорьев, 2000а).
Таким образом, изменение численности популяции S. c. kunashirensis и S. g. natalae и их многолетняя динамика совпадают с ходом динамики численности доминанта – S. unguiculatus. Сходна и годовая флуктуация популяции S. g. natalae на о. Зеленый с популяцией этого вида на юге о. Кунашир.
Межвидовые конкурентные отношения между землеройками-бурозубками на Кунашире, по-видимому, не играют значительной роли в регуляции годовых показателей численности, о чем свидетельствует синхронность ее изменений у трех рассматриваемых видов в подавляющем большинстве случаев.
Популяции бурозубок на островах по характеру изменения численности относятся к циклическим, у всех рассмотренных видов в многолетней динамике присутствуют как двух-, так и трёхфазные циклы.
Численность популяции R.n. coraco на о-вах Шикотан и Зеленый в природных биотопах в годы исследований была низкой (от 0,1 до 1,3 особи на 100 л./с.) и мало различалась в разные годы. На о. Кунашир в 1987 и 1989 гг. она несколько поднималась соответственно до 6,4 и 2,7 особи на 100 л./с.
Для популяции A. s. ainu на юге о. Кунашир характерна ее довольно высокая плотность почти во все годы наблюдений, причем депрессия численности отмечена только однажды в 1987 г. На севере острова, где биотопы для этой мыши менее благоприятны, наблюдается чередование через год высокой и низкой численности ее популяции (рис. 5).
Увеличение численности популяции японской мыши на Кунашире на основании наших наблюдений связано с урожайностью семян основных видов растений. На различных участках острова, а также в различных биотопах эти урожаи по годам различаются.
18
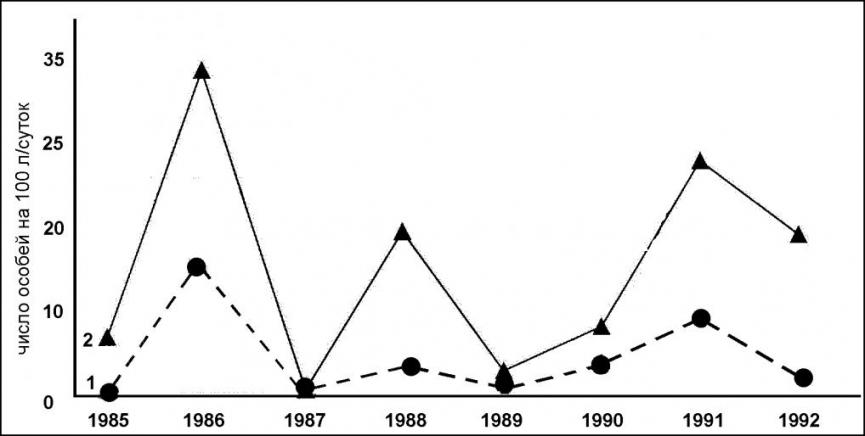
Рис. 4. Динамика численности популяций S. caecutitiens kunashirensis (1) и
S. gracillimus natalae (2) на юге о. Кунашир в 1985-1992 гг.
В связи с этим и показатели численности популяции японской мыши на этих участках различны. Характерно отсутствие глубоких депрессий численности популяции японской мыши. Объясняется это, на наш взгляд, мозаичностью распределения по территории урожаев основных кормов мышей на разных участках острова и перекочевками этих грызунов к местам урожаев. По-видимому, поэтому средняя островная численность популяции полевок обычно высока. Ее изменения напоминают динамику численности популяции этой полевки на о. Кунашир (рис.5).
Численность популяции M. r. smithi в годы "пиков" достигает значительных величин как в отдельных биотопах, так и на островах в целом. Здесь она выше, чем на материковой части, но глубокие депрессии численности наблюдаются редко. Амплитуда колебания может быть очень высокой, изменяясь в 3-7 раз.

Рис. 5. Динамика численности популяций Apodemus speciosus ainu (1 – Кунашир), Myodes rufocanus smithi (2 – Шикотан, 3 – Кунашир) и Myodes sikotanensis (4 – Шикотан) на южных Курильских островах в 1985-1992 гг.
Изменения численности у M. r. smithi на о. Зелёный в течение 3 лет незначительные, во всех облавливаемых здесь биотопах ее показатели близки к средним островным.
19
В целом по островам наблюдается синхронность хода динамики численности этой полевки, как на лесистых, так и в безлесных биотопах.
Динамика численности M. sikotanensis (рис. 5) повторяет динамику численности M. r. smithii на трёх южных Курильских островах, что свидетельствует, как мы считаем, об одних механизмах её регуляции в целом у всех полёвок в этом регионе.
ВЫВОДЫ
1. Фауна мелких млекопитающих южных Курильских островов представлена 2 отрядами: отряд насекомоядные (1 семейство, 1 род и 4 вида) и отряд грызуны (2 семейства, 4 рода и 5 видов). Из них 2 вида – домовая мышь Mus musculus raddei Kastschenko, 1910, серая крыса карако Rattus norvegicus caraco (Pallas, 1779) и подвид красно-серой полевки Myodes rufocanus irkutensis Ognev, 1923 непреднамеренно интродуцированы человеком.
2. Впервые для о. Кунашир указана бурозубка крошечная Sorex minutissimus Zimmermann, 1780. Выведены из состава фауны о. Шикотан черная крыса Rattus rattus Linnaeus, 1758, из состава фауны о. Зеленый – шикотанская полевка Myodes sikotanensis Tokuda, 1935. Предложена новая синонимия для Sorex gracillimus natalae Okhotina, 1993 = S. gracillimus kurodai Hutterer et Zaitsev, 2004, syn. nov.
3. На всех островах у грызунов фоновым является M. r. smithi, которая доминирует во всех местообитаниях за исключением долин рек и елово-пихтовых лесов на о. Шикотан, где доминирует M. sikotanensis. У бурозубок доминирует S. unguiculatus, она присутствует во всех местообитаниях, но наибольшей плотности ее популяции достигают в поймах рек и в пихтовых лесах на о-вах Кунашир и Шикотан, а на безлесном о. Зеленый – на океанических побережьях. S. g. natalae на о-вах Шикотан и Зеленый предпочитает открытые пространства, занятые лугами и верховыми болотами. R. n. coraco занимает исключительно околоводные местообитания: долины рек и океанические побережья.
4. На о. Зеленый впервые отмечены аберрантно окрашенные особи M. r. smithi, характеризующиеся практически черной окраской шерстного покрова верхней половины тела. От номинативной формы они отличаются только по окраске. Увеличение их доли в популяции приурочено к снижению ее численности, поэтому можно предположить, что жизнеспособность таких грызунов выше, чем стандартно окрашенных особей.
5. Фенологические сроки размножения большинства мелких млекопитающих на островах запаздывают примерно на месяц по сравнению с аналогичными по широте районами континента. Это обусловлено прохладным морским климатом – затяжной холодной весной и довольно продолжительной теплой осенью.
6. Для островных сообществ насекомоядных и грызунов характерна регуляция численности популяции путем перераспределения ее по различным биотопам и снижения до минимума репродуктивного потенциала. Высокая плотность популяций характерна только для оптимальных биотопов. Из них постоянно наблюдается миграция молодых и очень старых особей в менее благоприятные биотопы, в которых происходит основной отход популяции. В размножении участвуют в основном перезимовавшие особи. Прибылые зверьки, как правило, в год рождения в размножении не участвуют. Благодаря такой стратегии в оптимальных биотопах ежегодно наблюдается высокая плотность их популяций.
20
7. Анализ численности популяций мелких млекопитающих на южных Курильских островах показал, что в целом она на порядок выше аналогичных показателей на континенте. Глубоких депрессий за период наблюдений не отмечено.
8. На фазе подъема численности жизненного цикла у популяции M. r. smithi отмечается более интенсивное размножение, что выражается в увеличении количества эмбрионов, увеличении числа выводков и участии в размножении сеголеток. Коэффициент успешности размножения у этого грызуна в зависимости от уровня численности популяции колеблется в пределах 1,4-5,8.
9. Ход динамики численности популяций S. unguiculatus, S. g. natalae и S. c. kunashirensis на о. Кунашир происходит синхронно, что не позволяет говорить о существующих серъезных конкурентных отношениях между ними. По-видимому, это объясняется действием внутрипопуляционных механизмов авторегуляции численности популяций, причем как доминирующего, так и второстепенных видов.
10. Динамика численности землероек-бурозубок на о. Кунашир по характеру изменения численности относится к циклической. У всех популяций присутствует как двух-, так и трехфазные циклы изменения численности. Сезонный ход изменения численности популяций мелких млекопитающих в разные годы различен и зависит от фазы динамики численности в которой находится популяция.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Статья, опубликованная в ведущем рецензируемом научном журнале:
1. Григорьев Е.М., Башилов С.В. О распространении крошечной бурозубки (Sorex minutissimus Zimm., 1780) на острове Кунашире // Бюл. МОИП, отд. биол., 1988. Т. 93, № 2. С. 71-72.
Раздел в коллективной монографии:
2. Григорьев Е.М. Шикотанская полевка Clethrionomys sikotanensis Tokuda, 1935 // Красная книга Сахалинской области: Животные. Южно-Сахалинск: Сахалинское кн. изд-во, 2000. С. 13-14.
Статьи, опубликованные в отечественных периодических изданиях и региональных сборниках:
3. Григорьев Е.М. Мелкие млекопитающие Малой Курильской гряды. Темная форма красно-серой полевки с острова Зеленый // Докл. МОИП, отд. зоол. и ботан. М.: Наука, 1989. С. 7-12.
4. Григорьев Е.М. Численность грызунов на острове Кунашир в 1988-1989 гг. //Численность грызунов на Дальнем Востоке СССР в 1989 г. и ее прогноз на 1990 г. Владивосток: ДВО АН СССР, 1990. С. 41-43.
5. Григорьев Е.М. Численность грызунов на острове Кунашир в 1990 г. // Численность грызунов на Дальнем Востоке СССР в 1990 г. и ее прогноз на 1991 г.: Оперативный информационный материал. Владивосток: ДВО АН СССР, 1991. С. 44-46.
6. Григорьев Е. М. Итоги наблюдений за численностью землероек-бурозубок на острове Кунашир // Анализ многолетних рядов наблюдений за природными компонентами в заповедниках Дальнего Востока. Владивосток: Дальнаука, 2000. С. 44-51.
7. Григорьев Е.М. Экология и биология японской (красной) мыши – Apodemus speciosus Temminck, 1845 (Mammalia, Rodentia) острова Кунашир (Южные Курильские острова) // Биологические исследования на островах северной части Тихого океана. Владивосток: БПИ ДВО РАН, 2004. № 8. С. 1-16.
8. Григорьев Е.М., Неведомская И.А., Костенко В.А. Млекопитающие (Mammalia) особо охраняемых природных территорий Южных Курильских островов // Биологиче
21
ские исследования на островах северной части Тихого океана. Владивосток: БПИ ДВО РАН, 2005. № 10. С. 1-18.
Работы, опубликованные в материалах региональных, всероссийских и международных научных конференций, совещаний и съездов.
9. Григорьев Е.М. О динамике численности фоновых видов мелких млекопитающих на южных Курильских островах // Материалы 2-й науч. конф.: Тез. докл. Владивосток: ДВО АН СССР, 1988. С. 20-21.
10. Григорьев Е.М. К морфологической характеристике полевок рода Clethrionomys о. Шикотан // Материалы 5-го съезда Всесоюз. Териол. об-ва АН СССР. Москва, 1990. Т. 1. С. 54.
11. Григорьев Е.М. Половозрастная структура популяции когтистой бурозубки на острове Кунашир // Тез. докл. I-го Всесоюз. совещ. по биологии насекомоядных млекопитающих. М., 1992. С. 32-33.
12. Пушкарев С.В., Шварц Е.А., Григорьев Е.М. Влияние некоторых характеристик биомассы почвенных и напочвенных беспозвоночных на структуру населения бурозубок о. Кунашир // Тез. докл. I совещания по насекомоядным. Новосибирск, 1992. С. 147-149.
13. Grigoriev E. Особо охраняемые природные территории Южно-Курильского района (история, современное состояние, перспективы развития) // Сб. докл. науч.- практ. конф. «Kuril Flyway», Токио, 1997. Р. 37-41. (на яп. яз.).
14. Grigoriev E. Plant and Animal World of the Southern Kuril Island: A Role of Kuril’sky Nature Reserve in the Protection of Nature Reserve in the Protection of Nature Complex and Biodiversity // Nature Conservation Cooperation on Kunashir, Iturup, Shikotan and Habomai Islands. Japanes Coordinating Committee for MAB and Biodiversity Netwoork Japan, 2001. P. 46-53.
22
Подписано в печать 00.00.2008 г. Формат 60х90/16. 1уч.-изд..л.
Тираж 100 экз. Заказ № 00
Отпечатано в типографии издательского центра ФГУП «ТИНРО-Центр»
г. Владивосток, ул. Западная, 10.

