Оценка фотодинамического воздействия in vitro на бактерии из микробоценозов ротовой полости и кожи человека
На правах рукописи

Тучина Елена Святославна
Оценка фотодинамического воздействия in vitro
на бактерии из микробоценозов ротовой полости
и кожи человека
03.00.16 – экология
03.00.07 – микробиология
Автореферат диссертации на соискание ученой степени
кандидата биологических наук
Саратов – 2008
Работа выполнена в государственном образовательном учреждении
высшего профессионального образования
«Саратовский государственный университет имени Н.Г. Чернышевского»
на кафедре микробиологии и физиологии растений
Научный руководитель – доктор биологических наук, профессор
Тихомирова Елена Ивановна
Официальные оппоненты – доктор биологических наук, профессор
Коннова Светлана Анатольевна
доктор биологических наук, профессор
Щербаков Анатолий Анисимович
Ведущая организация – Саратовский государственный медицинский университет, г. Саратов
Защита состоится «18» декабря 2008 г. в 12.00 ч. на заседании
диссертационного совета Д 212.243.13 при государственном
образовательном учреждении высшего профессионального образования «Саратовский государственный университет имени Н.Г. Чернышевского» по адресу: 410012, г. Саратов, ул. Астраханская, 83; E-mail: [email protected]
С диссертацией можно ознакомиться в Зональной научной библиотеке ГОУ ВПО «СГУ им. Н.Г. Чернышевского».
Автореферат разослан «17» ноября 2008 г.
Ученый секретарь
диссертационного совета С.А. Невский
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Нормальная микрофлора представляет собой неотъемлемую часть макроорганизма и играет важную роль в поддержании его гомеостаза (Шендеров, 1994, 1998; Белобородова, 1998; Грачева и др., 2006). Большинство имеющихся в современной литературе работ посвящены детальному изучению микробного сообщества желудочно-кишечного тракта человека и животных в норме и при различных патологических состояниях (Доронин, Шендеров, 2002; Ильина, 2006). Не менее значимо состояние микрофлоры таких биотопов как ротовая полость и кожа, индивидуальная и анатомическая специфичность состава микроорганизмов которых способствует обеспечению колонизационной резистентности организма в целом (Митрохин, 1998; Ильин и др., 2005). Изменения в видовом составе и количественных показателях микробного сообщества под влиянием внешних или внутренних факторов могут привести к нарушению функционирования макроорганизма (Нетрусов, 2004; Тихомирова, 2007). Разработка методических подходов к оценке адаптационного потенциала бактерий, в том числе и представителей микробоценозов организма человека, а также выбор параметров и характеристик, наиболее полно отражающих состояние отдельных микробных популяций на фоне действия стрессовых факторов различной природы являются актуальными задачами экологии микроорганизмов (Митрохин, 2000; Нетрусов, 2004). Для оценки действия стрессовых факторов физической природы (в том числе антропогенного характера) на микроорганизмы многие авторы исследуют изменение их жизнеспособности: по количеству колониеобразующих единиц – КОЕ, оптической плотности бактериальных суспензий, хемилюминесценции микробных клеток (Фомичев др., 1991; Страховская и др., 2002; Malik, 1992; Shrivastava, 2007). В то же время использование традиционных микробиологических методов (описание морфологии клеток и колоний, тинкториальных, культуральных и биохимических свойств) в экологических исследованиях позволяет объективно оценить in vitro состояние микробных популяций.
В настоящее время в клинической практике и биомедицинских исследованиях широко используется оптическое излучение различного спектрального состава (400 – 420, 600 – 660, 800 – 850 нм) для лечения гнойно-воспалительных заболеваний бактериальной природы, а также при физиотерапевтических и косметических процедурах (Тучин, 1998; Ovchinnikov et al., 2000; Hamblin, Hasan, 2004). Антибактериальная фотодинамическая терапия (ФДТ) является альтернативой антибиотикотерапии и заключается в избирательной окислительной деструкции патогенных микроорганизмов при комбинированном воздействии красителя фотосенсибилизатора и света с определенной длиной волны. Контролируемый эффект действия светового и лазерного излучения может быть использован и для коррекции численности определенного вида бактерий в составе нормальной микрофлоры при явлениях дисбиоза, поскольку применение антимикробных препаратов в таких случаях не допустимо. Однако данные о реакциях нормальной микрофлоры на действие различных типов излучений, используемых в ФДТ, практически отсутствуют, а их получение представляет значительный научный интерес и может иметь прикладное значение.
Цель и задачи исследования. Цель работы заключалась в оценке действия светодиодного синего, красного и лазерного инфракрасного излучений в сочетании с фотосенсибилизаторами на бактерии, представляющие нормальную микрофлору кожи и ротовой полости.
Для достижения указанной цели были поставлены следующие задачи:
- Определить оптимальные условия применения фотосенсибилизаторов (необходимую концентрацию, время инкубации и облучения) при фотодинамическом воздействии на бактерии, представляющие нормальную микрофлору макроорганизма.
- Изучить влияние светодиодного синего (405 нм), красного (660 нм) и лазерного инфракрасного (810 нм) излучений в сочетании с фотодинамическими красителями (метиленовым синим, индоцианином зеленым) на жизнеспособность, относительную численность популяций, культуральные свойства и морфологические характеристики бактерий ротовой полости.
- Выявить чувствительность бактерий микробоценоза кожи к действию светодиодного синего (405 нм), красного (625 нм), комбинированного (405, 625 нм) и лазерного инфракрасного (805 нм) излучений в сочетании с фотодинамическими красителями (метиленовым синим, индоцианином зеленым) и оценить изменения их морфологических и физиологических характеристик.
- Отобрать наиболее информативные показатели изменения состояния популяций бактерий in vitro, представляющих нормальную микрофлору, и характеристики их адаптационного потенциала при фотодинамическом воздействии.
Научная новизна. Впервые проведено исследование in vitro влияния на бактерии, представляющие нормальную микрофлору организма человека, лазерного и светодиодного излучения с параметрами, используемыми при ФДТ в медико-биологической практике. Показано изменение жизнеспособности, относительной численности популяций, морфологии клеток и культуральных свойств бактерий микробоценоза ротовой полости под влиянием светодиодного синего (405 нм), красного (660 нм) и лазерного инфракрасного (810 нм) излучения. Исследованы изменения количественных показателей, морфологических и физиологических характеристик бактерий микробоценоза кожи под действием этих излучений. Выявлены особенности действия света на бактериальные клетки, обработанные фотосенсибилизаторами (метиленовым синим и индоцианином зеленым). Впервые разработан комплекс наиболее информативных показателей, позволяющий объективно оценить in vitro состояние микробных популяций кожи и ротовой полости на фоне действия разных типов излучения.
Практическая значимость. Разработаны и методически обоснованы подходы к изучению влияния различных типов излучения на бактерий – представителей нормальной микрофлоры, которые могут быть рекомендованы к применению в практике биологических и медицинских исследований. Определены условия обработки бактериальных клеток растворами фотосенсибилизаторов: их концентрация и длительность предварительной инкубации. Выявлены параметры светодиодного и лазерного излучения, способные привести к увеличению или уменьшению численности определенных микроорганизмов. Предложен комплекс микробиологических тестов, позволяющих оценить адаптационный потенциал бактерий нормальной микрофлоры организма при действии различных типов излучения. Результаты исследований могут быть использованы в клинической практике с целью выбора оптимальных режимов излучения при ФДТ в сочетании обычных косметических процедур с профилактикой гнойно-воспалительных заболеваний. Материалы диссертационного исследования используются при чтении лекций общих (микробиология, экология микроорганизмов, общая биология) и специальных (актуальные проблемы микробиологии) курсов студентам биологического и физического факультетов Саратовского госуниверситета; полученные результаты были использованы при подготовке курсовых и дипломных работ студентами этих факультетов.
Апробация работы. Основные результаты и положения работы представлены на: 2-й региональной конференции молодых ученых «Стратегия взаимодействия микроорганизмов с окружающей средой» (Саратов, 2004); съездах фотобиологов России (Саратов, 2005; Пущино, 2008); 1-й конференции молодых ученых медико-биологической секции ПАГУ (Ульяновск, 2007); 11-й Пущинской школе – конференции «Биология – наука XXI века» (Пущино, 2007); Всероссийских форумах «Дни иммунологии в Санкт-Петербурге» (Санкт-Петербург, 2006, 2007); международных симпозиумах по оптическим технологиям в биофизике и медицине «Saratov Fall Meeting» (Саратов, 2004 – 2008); научных конференциях студентов и аспирантов биологического факультета СГУ им. Н.Г. Чернышевского (Саратов, 2004 – 2006, 2008).
Декларация личного участия автора. Автор лично участвовал в проведении экспериментов по фотодинамическому воздействию на бактерии из микробоценозов кожи и ротовой полости. Анализ полученных данных, их интерпретация и оформление осуществлены автором самостоятельно. В совместных публикациях вклад соискателя составил 70 – 90%. Ряд исследований выполнен в рамках НИР СГУ «Исследование взаимодействия оптического излучения с биологическими тканями и разработка когерентно-оптических и спектральных методов медицинской диагностики и фототерапии» на кафедре оптики и биомедицинской физики при финансовой поддержке гранта CRDF RUB1-570-SA-04 Palomar Medical Technologies, Burlington, USA.
Публикации. По теме диссертации опубликовано 19 работ, в том числе 3 в изданиях перечня ВАК РФ.
Структура и объем диссертации. Диссертация состоит из введения, 5 глав, заключения, выводов. Работа изложена на 140 страницах, иллюстрирована 19 рисунками и содержит 15 таблиц. Список использованных литературных источников включает 170 наименований, в том числе 90 зарубежных авторов.
Основные положения, выносимые на защиту.
- Фотодинамическое воздействие светодиодного красного или лазерного инфракрасного излучения на бактериальные клетки, обработанные метиленовым синим или индоцианином зеленым, приводит к гибели большей части микробной популяции представителей нормальной микрофлоры организма человека.
- Жизнеспособность, относительная численность популяций, культуральных свойств и морфологических характеристик бактерий, представляющих нормальную микрофлору кожи и ротовой полости, под действием используемого при фотодинамической терапии излучения, находятся в пределах нормы реакции и позволяют судить об адаптационном потенциале микроорганизмов.
- Селективный эффект действия каждого типа оптического излучения проявляется в угнетении или стимуляции роста определенного вида или штамма бактерий, входящих в состав нормальной микрофлоры кожи и ротовой полости.
Содержание работы
Во введении обосновывается актуальность исследования, сформулированы основная цель и задачи, научная новизна, теоретическая и практическая значимость исследования.
Глава 1. Характеристика микробоценозов ротовой полости
и кожи и аспекты применения антимикробной фотодинамической терапии (обзор литературы)
В обзоре отечественной и зарубежной литературы рассматриваются свойства и функции нормальной микрофлоры организма человека и животных, даются характеристики микробиоценозов ротовой полости и кожи, описываются наиболее типичные микроорганизмы данных микробоценозов, освещаются аспекты применения антимикробной фотодинамической терапии и различных классов фотосенсибилизаторов в клинической практике и медико-биологических исследованиях.
Глава 2. Материалы и методы Исследования
Экспериментальные исследования проводили на базе кафедры микробиологии и физиологии растений Саратовского государственного университета им. Н.Г. Чернышевского; научной лаборатории бактериологии СГУ; лаборатории восстановительной стоматологии Национального университета Сингапура в период с 2003 по 2008 год.
В качестве объектов исследований использованы типичные представители микробоценозов кожи и ротовой полости: Streptococcus mutans, Staphylococcus lugdunensis, S. epidermidis метициллин-чувствительный (MS), S. epidermidis метициллин-устойчивый (MR), S. aureus 209 P, S. aureus 69, S. hominis, S. warnery, Haemophilus actionomycetemcomitans, Propionibacterium acnes, Rothia mucilaginosa, R. dentacariosa, Curtobacterium albidum, Flavobacterium gleum. Культуры были получены из коллекций и музеев микроорганизмов (ИБФМ РАН, СГМУ, НУС); микроорганизмы ротовой полости были выделены от пациентов стоматологического отделения 3-й клинической больницы г. Саратова, микроорганизмы кожи – от пациентов клиники «Семейный доктор». Отбор проб и подготовку их к исследованию проводили общепринятыми методами (Артемьева, 1989). Посев осуществляли на плотные (ГРМ, МРС, Эндо, желточно-солевой агар, кровяной агар) и жидкие (тиогликолиевая среда) питательные среды. Идентификацию выделенных микроорганизмов проводили на основании фенотипических свойств, а также с помощью стандартных диагностических систем (НПО «Диагностические системы», г. Нижний Новгород).
При постановке экспериментов использовали излучение в видимом синем (405 нм; 23, 5 – 80 мВт/см2), красном (625, 660 нм; 33, 40 мВт/см2) и инфракрасном (805, 810 нм; 50, 45 мВт/см2) диапазонах, генерируемое световыми и лазерными диодами. В качестве фотосенсибилизаторов использовали индоцианин зеленый (ИЗ) с максимумом поглощения 770 – 800 нм и метиленовый синий (МС) с максимумом поглощения 660 нм. Работали с концентрациями метиленового синего – 0.005, 0.025, 0.05 и 0.25%; индоцианина зеленого – 0.05, 0.1, 0.25 и 0.5%. Фотосенсибилизаторы готовили на основе смеси глицерина, этанола и воды (в соотношении 25:25:50 – для метиленового синего, 25:45:30 – для индоцианина зеленого) или дистиллированной воды.
Для создания асептических условий иммунологический полистирольный планшет помешали в стеклянный или пластиковый корпус. Источник света располагали над ячейками планшета на расстоянии, необходимом для формирования определенной плотности мощности излучения. Воздействие проводили на бактериальные клетки во взвеси (5103 мк/мл), находящейся в соответствующих ячейках, последовательно увеличивая дозу излучения. После воздействия взвеси бактерий переносили на чашки Петри с плотной питательной средой и равномерно распределяли по поверхности стерильным шпателем. Учет результатов проводили путем подсчета числа колониеобразующих единиц (КОЕ) через 24 – 72 ч инкубации при 37С. Контролем служили взвеси бактерий, не обработанные сенсибилизатором и не подвергнутые облучению; контрольные значения принимали за 100%. Каждый эксперимент проводили в десятикратной повторности.
При изучении адаптации бактерий к действию разных типов излучений определяли общепринятые в экологических исследованиях показатели: жизнеспособность, численность популяции бактерий, морфологию колоний и особенности роста на питательных средах (Теппер и др., 2004). Для анализа морфологии бактериальных клеток через 24 – 72 ч после облучения готовили микропрепараты и окрашивали по методу Грама; просматривали препараты путем световой микроскопии с объективом 90 под масляной иммерсией, а также с помощью цифровой микрофотокамеры SсopeTek и программ компьютерной обработки изображений. Для статистической обработки данных использовали непараметрические критерии Уилкоксона-Манна-Уитни и параметрический t-критерий Стьюдента. Достоверными считали различия при вероятности ошибки p<0.05 (Ашмарин и др., 1974; Урбах, 1975). Расчёт результатов осуществляли с применением пакета прикладных программ Statistica 6.0, MS Еxcel 2003.
Глава 3. Влияние фотосенсибилизаторов
на жизнеспособность бактерий – представителей нормальной микрофлоры
Однозначных сведений об оптимальных параметрах обработки клеток растворами фотосенсибилизаторов в литературе нами найдено не было, поэтому на предварительном этапе работы отбирали наиболее эффективные сочетания длительности преинкубации клеток и концентрации красителей для каждого исследованного микроорганизма. Показано, что для клеток P. acnes длительность преинкубации с красителями составляет 10 мин, оптимальная концентрация водного раствора метиленового синего 0.025%, водного раствора индоцианина зеленого 0.1%. Для эффективной фотосенсибилизации клеток S. epidermidis достаточно времени обработки метиленовым синим (концентрация не более 0.025%) в течение 5 мин, индоцианином зеленым (концентрация не более 0.1%) в течение 10 мин (табл. 1).
Таблица 1
Оптимальные параметры обработки
бактериальных клеток фотосенсибилизаторами
| Вид бактерий | Краситель | |||
| метиленовый синий | индоцианин зеленый | |||
| время обработки, мин | концентрация, % | время обработки, мин | концентрация, % | |
| P. acnes | 10 | 0.025 | 10 | 0.1 |
| S. epidermidis | 5 | 0.025 | 10 | 0.1 |
| H. actinomycetemcomitans | 5 | 0.005 | 10 | 0.5 |
| S. mutans | 5 | 0.005 | 5 | 0.5 |
Установлено, что для достижения фотодинамического эффекта необходимо обрабатывать клетки H. actinomycetemcomitans метиленовым синим на протяжении 5 мин, индоцианином зеленым – 10 мин. Концентрация метиленового синего в этом случае может достигать 0.005%, а индоцианина зеленого – 0.5%. Оптимальное время обработки клеток S. mutans красителями составляет 5 мин, концентрация водных растворов метиленового синего 0.005%, индоцианина зеленого 0.1% (см. табл. 1).
Глава 4. действие различных типов излучения
на бактерии ротовой полости
Проведен сравнительный анализ действия различных типов излучения на бактерии микробоценоза ротовой полости. Установлено, что фотодинамическое воздействие с использованием светодиодного синего (405 нм; 23 мВт/см2), красного (660 нм; 40 мВт/см2) или лазерного инфракрасного (810 нм; 45 мВт/см2) излучения приводит к изменению жизнеспособности, численности популяции и морфологических характеристик исследованных микроорганизмов.
При оценке влияния светодиодного синего излучения на микроорганизмы ротовой полости было показано его подавляющее действие на колониеобразующую способность основных представителей данного микробного сообщества, таких как H. actinomycetemcomitans, R. mucilaginosa, R. dentacariosa, F. gleum, C. albidum, S. mutans, S. lugdunensis. При этом кокковые формы (S. mutans, S. lugdunensis) оказались более чувствительны к влиянию излучения, чем палочковидные микроорганизмы H. actinomycetemcomitans, F. gleum. Наименьшее влияние синее излучение оказывало на грамотрицательные виды F. gleum и H. actinomycetemcomitans, в то время как уменьшение численности грамположительных видов R. mucilaginosa, R. dentacariosa, C. albidum было более выраженным (табл. 2).
Таблица 2
Изменение числа КОЕ бактерий ротовой полости
под действием светодиодного синего излучения, %
| Время облучения, мин | |||||||
| Вид бактерий | 0 (контроль) | 1 | 5 | 10 | 15 | ||
| Rothia mucilaginosa | 97.56 ± 2.32 | 70.54 ± 1.23* | 63.33 ± 3.30* | 60.22 ± 2.22* | 54.61 ± 0.13* | ||
| Rothia dentacariosa | 97.88 ± 2.12 | 80.40 ± 2.14* | 75.95 ± 2.28* | 72.03 ± 3.12* | 70.55 ± 2.49* | ||
| Curtobacterium albidum | 96.72 ± 3.21 | 71.91 ± 2.84* | 50.36 ± 2.96* | 45.71 ± 3.21* | 37.43 ± 2.37* | ||
| Flavobacterium gleum | 95.85 ± 4.15 | 81.57 ± 2.75* | 80.62 ± 3.41* | 82.14 ± 4.96* | 79.70 ± 0.17* | ||
| Haemophilus actinomycetem-comitans | 97.26 ± 2.86 | 78.75 ± 3.14* | 75.45 ± 4.10* | 75.72 ± 3.92* | 71.41 ± 2.42* | ||
| Staphylococcus lugdunensis | 97.78 ± 2.22 | 66.58 ± 3.73* | 62.83 ± 4.6* | 31.24 ± 2.81* | 15.93 ± 2.48* | ||
| Streptococcus mutans | 97.83 ± 0.17 | 60.79 ± 0.16* | 24.47 ± 0.19* | 16.20 ± 0.15* | 36.62 ± 0.15* | ||
Примечание: * – наличие достоверных различий по отношению к контролю
при уровне значимости Р<0.05.
Известно, что чувствительность к фотовоздействию грамотрицательных и грамположительных бактерий имеет несколько разную природу ввиду строения клеточной стенки (Васильев, Огиренко, 2002; Malik et al., 1992; Wilson, Pratten, 1995), что согласуется с полученные нами данными. Восприимчивость микроорганизмов к действию того или иного типа излучения во многом определяется наличием в их клетках особых молекул – эндогенных фотосенсибилизаторов, в частности, порфиринов. Клетки условно-патогенных и патогенных бактерий, за счет использования ими гемоглобина, характеризуются повышенным содержанием порфиринов. В клетках представителей нормальной микрофлоры количество этих молекул значительно ниже, вследствие чего они менее чувствительны к действию синего излучения (Hamblin, Hasan, 2004).
Известно, что стратегия выживания микроорганизмов под действием экологических факторов во многом зависит от их морфологических признаков, которые определяют их нахождение внутри сообщества с его определенной архитектурой (Заварзин, 2004). Поэтому для более полной оценки действия различных типов излучении на бактерии нормальной микрофлоры нами были проведены исследования морфологии их клеток и колоний. Для всех палочковидных бактерий, за исключением C. albidum, было отмечено изменение морфологии клеток и культуральных свойств под действием синего излучения. Микроскопирование препаратов показало, что клетки S. mutans, подвергнутые воздействию, имели размеры меньше (15 мин – 0.61 ± 0.04 мкм, P<0.05), чем в контроле (0.70 ± 0.01 мкм, P<0.05), и располагались парами, реже короткими цепочками. У клеток S. lugdunensis увеличивался диаметр (контроль – 0.51 ± 0.02, 1 мин – 0.53 ± 0.01, 5 мин – 0.55 ± 0.02, 10 мин – 0.60 ± 0.03, 15 мин – 0.61 ± 0.01 мкм, P<0.05). Изучение морфологии колоний показало изменение характера пигментации с преобладанием бежевого оттенка.
Анализ действия светодиодного красного излучения выявил его незначительное влияние на колониеобразующую способность бактерий вида H. actinomycetemcomitans. Длительность предварительного облучения в течение 1 и 15 мин приводила к снижению числа КОЕ, а к облучению в течение 5 и 10 мин исследуемый вид был более устойчив (контроль – 95.02 ± 4.05, 1 мин –70.13 ± 4.34, 5 мин – 82.31 ± 4.78, 10 мин – 76.52 ± 3.58, 15 мин – 69.35 ± 4.13%, P<0.05). Предварительная обработка клеток H. actinomycetemcomitans метиленовым синим в концентрации 0.005 % приводила к более выраженному угнетающему эффекту действия красного излучения (контроль – 96.72 ± 3.21, 1 мин – 30.16 ± 4.11, 5 мин – 21.41 ± 4.81, 10 мин – 17.33 ± 3.52, 15 мин – 3.15 ± 5.81%, P<0.05). Показано, что красное излучение также подавляло размножение бактерий вида S. mutans: число КОЕ достоверно уменьшалось по сравнению с контрольным значением (контроль – 92.22 ± 3.67, 1 мин – 63.59 ± 4.36, 5 мин – 41.31 ± 2.22, 10 мин – 25.78 ± 4.47, 15 мин – 22.24 ± 4.52%, P<0.05). При использовании 0.005 % раствора метиленового синего в качестве фотосенсибилизатора угнетающий эффект действия красного излучения на S. mutans сохранялся, но приобретал более выраженный характер. Изменение времени облучения от 1 до 15 мин приводило к снижению показателя КОЕ относительно контроля (контроль – 93.47 ± 4.68, 1 мин – 55.76 ± 3.87, 5 мин – 38.82 ± 4.07, 10 мин – 23.08 ± 3.82, 15 мин – 4.82 ± 4.57%, P<0.05).
При микроскопировании препаратов облученных и необлученных бактерий H. actinomycetemcomitans установлено изменение морфологии клеток: после облучения они имели более правильную палочковидную форму и большие размеры, чем полиморфные мелкие клетки в контроле (табл. 4). При изучении морфологии клеток S. mutans, подвергнутых воздействию, выявлено изменение тинкториальных свойств (вариабельная окраска по Граму) и характера расположения клеток. Колонии облученных бактерий имели большие размеры (15 мин – 0.51 ± 0.17 см) по сравнению с контролем (0.3 ± 0.13 см, P<0.05).
Таблица 4
Изменение размеров клеток под действием
светодиодного красного излучения, мкм
| Время облучения, мин | H. actinomycetemcomitans | S. mutans | |
| длина | ширина | диаметр | |
| 0 (контроль) | 1.10 ± 0.08 | 0.42 ± 0.02 | 0.69 ± 0.01 |
| 1 | 1.21 ± 0.06 | 0.42 ± 0.02 | 0.69 ± 0.07 |
| 5 | 1.24 ± 0.04* | 0.42 ± 0.01 | 0.72 ± 0.02* |
| 10 | 1.27 ± 0.05* | 0.45 ± 0.02* | 0.73 ± 0.01* |
| 15 | 1.30 ± 0.04* | 0.49 ± 0.04* | 0.75 ± 0.02* |
Примечание: * – наличие достоверных различий по отношению к контролю
при уровне значимости Р<0.05.
Изучение влияния лазерного инфракрасного излучения на H. actinomycetemcomitans и S. mutans позволило сделать сходные выводы. Ни одна из использованных доз облучения не вызвала стимуляции развития исследуемых микроорганизмов. Применение 0.5% раствора индоцианина зеленого в качестве фотосенсибилизатора приводило к выраженному подавляющему эффекту (табл. 5). Установлено, что инфракрасное излучение изменяет размеры бактерий, подвергнутых воздействию: для палочек и кокков показано увеличение длины облученных клеток (табл. 6).
Таблица 5
Изменение числа КОЕ бактерий ротовой полости
под действием лазерного инфракрасного излучения, %
| Время облучения, мин | H. actinomycetemcomitans | S. mutans | ||
| без фото-сенсибилизатора | с фото- сенсибилизатором | без фото- сенсибилизатора | с фото- сенсибилизатором | |
| 0 (контроль) | 96.51 ± 2.75 | 96.88 ± 4.24 | 98.26 ± 4.20 | 97.64 ± 5.74 |
| 1 | 69.68 ± 3.92* | 32.64 ± 5.61* | 93.69 ± 5.05 | 45.80 ± 5.27* |
| 5 | 58.85 ± 4.15* | 50.61 ± 4.94* | 85.83 ± 5.21* | 30.52 ± 4.55* |
| 10 | 73.53 ± 2.75* | 60.92 ± 4.68* | 82.71 ± 4.35* | 27.77 ± 3.87* |
| 15 | 71.62 ± 3.41* | 18.09 ± 5.07* | 84.47 ± 4.36* | 23.55 ± 4.09* |
Примечание: * – наличие достоверных различий по отношению к контролю
при уровне значимости Р<0.05.
Таблица 6
Изменение размеров бактерий под действием
лазерного инфракрасного излучения, мкм
| Время облучения, мин | H. actinomycetemcomitans | S. mutans | ||
| длина | ширина | длина | ширина | |
| 0 (контроль) | 1.09±0.07 | 0.41±0.05 | 0.67±0.03 | 0.68±0.04 |
| 1 | 1.32±0.05* | 0.40±0.03 | 0.69±0.07 | 0.69±0.07 |
| 5 | 1.34±0.06* | 0.42±0.02 | 0.75±0.05* | 0.70±0.05 |
| 10 | 1.37±0.08* | 0.43±0.04 | 0.75±0.02* | 0.69±0.02 |
| 15 | 1.39±0.03* | 0.42±0.02 | 0.78±0.03* | 0.68±0.03 |
Примечание: * – наличие достоверных различий по отношению к контролю
при уровне значимости Р<0.05.
Глава 5. действиЕ различных типов излучения
на бактерии из микробоценоза кожи
Кожные покровы являются первым барьером на пути проникновения инфекции в макроорганизм. Сохранение определенного микробного состава из числа резидентных бактерий имеет важное физиологическое значение для поддержания здоровья всего организма. Поэтому на следующем этапе работы было изучено влияние светодиодного синего (405 нм; 31.5, 5 80 мВт/см2), красного (625 нм; 33 мВт/см2), комбинированного (405, 625 нм) и лазерного инфракрасного (805 нм; 80 мВт/см2) излучения на бактерии микробиоценоза кожи.
Установлено, что комбинированное излучение незначительно подавляло развитие бактерий S. epidermidis MS, S. hominis, S. aureus 209 P, P. acnes, и стимулировало размножение S. aureus 69 и S. warnery (рис. 1). Обработка клеток 0.005% раствором метиленового синего приводила к резкому сокращению численности всех исследованных видов после фотовоздействия. При анализе микропрепаратов бактерий, подвергнутых облучению, было показано, что размеры клеток S. aureus 209 P, S. epidermidis MS, P. acnes были меньше, чем в контрольных образцах. Отмечено также изменение культуральных свойств: колонии микроорганизмов, предварительно обработанных комбинированным излучением, имели более интенсивную кремово-желтую окраску, чем в контроле. Существенных изменений в морфологии облученных клеток S. warnery и S. hominis, их расположении или культуральных свойствах выявлено не было, в отличие от клеток S. aureus 69, диаметр которых увеличивался (табл. 7). Установлено усиление пигментации колоний этого вида по сравнению с контрольными образцами.
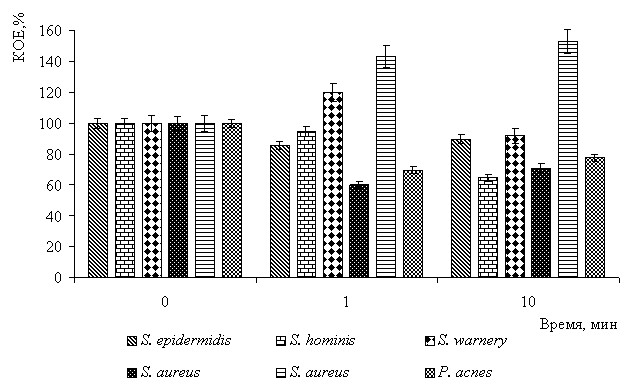 Рис. 1. Изменение числа КОЕ бактерий из микробоценоза кожи под действием
Рис. 1. Изменение числа КОЕ бактерий из микробоценоза кожи под действием
комбинированного излучения
Таблица 7
Изменение размеров бактерий под действием
комбинированного излучения, мкм
| Время облучения, мин | P. acnes | S. epidermidis | S. hominis | S. warnery | S. aureus 209 P | S. aureus 69 | |
| длина | ширина | диаметр | диаметр | диаметр | диаметр | диаметр | |
| 0 (контроль) | 1.47± 0.07 | 0.51± 0.02 | 0.65± 0.05 | 0.70± 0.02 | 0.53± 0.03 | 0.73± 0.02 | 0.63± 0.01 |
| 1 | 1.21± 0.06* | 0.48 ± 0.02 | 0.55± 0.03* | 0.70± 0.04 | 0.54± 0.03 | 0.68± 0.03* | 0.69± 0.02* |
| 10 | 1.20± 0.08* | 0.45± 0.05 | 0.47± 0.07* | 0.71± 0.01 | 0.55± 0.01 | 0.65± 0.04* | 0.74± 0.02* |
Примечание: * – наличие достоверных различий по отношению к контролю при уровне значимости Р<0.05.
В ходе наших экспериментов показано, что микроорганизмы P. acnes чувствительны к действию светодиодного синего излучения. Исследуемые штаммы S. epidermidis, напротив, были устойчивы к подобного рода воздействию. Полиморфизм клеток P. acnes после облучения значительно усиливался; изучение культуральных свойств через 72 ч после облучения выявило уменьшение диаметра колоний данных бактерий по сравнению с контролем. Для обоих исследованных штаммов S. epidermidis MR и S. epidermidis MS изменение морфологии клеток отмечено лишь после облучения дозами 70 и 144 Дж/см2. При анализе микропрепаратов установлено, что кокки, подвергнутые облучению, имели меньшие размеры, чем в контроле. Изучение культуральных свойств через 24 ч после воздействия выявило усиление пигментации колоний. Известно, что клетки P. acnes содержат большое количество порфиринов (Kjeldstad, Johnsson, 1986). Сложноорганизованные молекулы порфиринов имеют максимум поглощения в пределах от 400 до 420 нм и выступают в качестве эндогенных фотосенсибилизаторов. Именно этой физиологической особенностью можно объяснить подверженность P. acnes влиянию синего излучения. К проявлениям адаптации следует отнести изменения морфологии данных бактерий: уменьшении размеров, усилении полиморфизма. В клетках стафилококков содержание порфиринов ниже, а защитные реакции против активных форм кислорода более выражены, поэтому эти бактерии устойчивы к действию синего света. Косвенно об активизации антиоксидантных систем можно судить по изменению пигментации колоний облученных бактерий (Нетрусов, 2004; Ермилова, 2007).
Полученные данные свидетельствуют о подавляющем действии светодиодного красного излучения на микроорганизмы P. acnes (рис. 2). Использование водного или глицерин-спиртового раствора метиленового синего усиливало угнетающее влияние данного излучения вплоть до полного подавления роста бактериальных клеток.
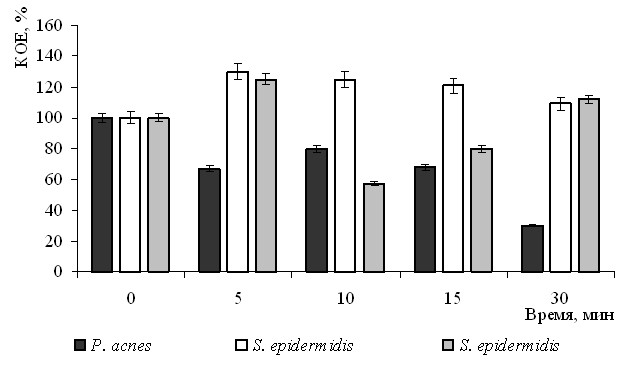
Рис. 2. Действие светодиодного красного излучения на бактерии из микробоценоза кожи
Установлено, что красное излучение стимулировало рост и размножение бактерий S. epidermidis в меньшей степени метициллин-устойчивого штамма, а в большей степени метициллин-чувствительного (см. рис. 2). Применение 0.025% водного раствора метиленового синего обусловливало угнетающий эффект действия излучения на жизнеспособность этих штаммов стафилококка, который был еще более выраженным при использовании глицерин-спиртового раствора фотосенсибилизатора. Известно, что метициллин относится к классу бета-лактамных антибиотиков, мишенями для которых являются ферменты трансептидазы, завершающие синтез пептидогликана клеточной стенки. Устойчивость к метициллину в основном обусловлена слабой проницаемостью клеточной стенки и продукцией бета-лактамаз, разрушающих антибиотик (Егоров, 2004). Вероятно, неодинаковый эффект фотодинамичес кого воздействия на метициллин-чувствительный и метициллин-устойчивый штаммы S. epidermidis объясняется различиями в строении клеточной стенки.
Показано, что инфракрасное излучение с определенными дозами незначительно стимулировало рост и размножение P. acnes и метициллин-устойчивого штамма S. epidermidis и не оказывало воздействия на жизнеспособность метициллин-чувствительного штамма (рис. 3). Использование 0.1% водного раствора индоцианина зеленого не влияло на численность популяции метициллин-чувствительного штамма S. epidermidis и стимулировало метициллин-устойчивого штамма. Применение глицерин-спиртового раствора индоцианина зеленого приводило к значительному подавлению всех исследованных микроорганизмов.
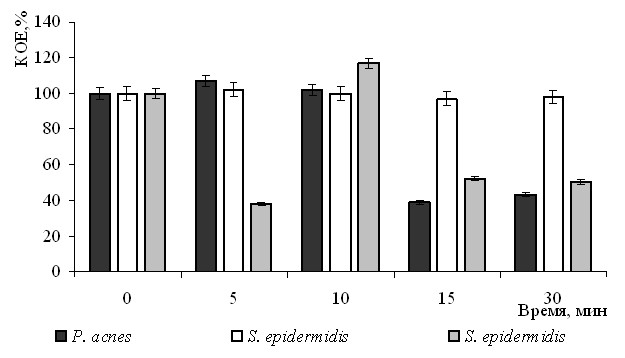
Рис. 3. Действие лазерного инфракрасного излучения на бактерии из микробоценоза кожи
Сравнительный анализ чувствительности различных видов бактерий-симбионтов кожи к действию комбинированного, светодиодного красного и лазерного инфракрасного излучений показал, что наиболее восприимчивыми были клетки P. acnes, однако существенных изменений таких параметров как морфология и характер пигментации колоний, размеры и форма облученных клеток исследованных микроорганизмов выявлено не было.
***
Видовое разнообразие, свойства и нормальное функционирование микробных сообществ в составе нормальной микрофлоры во многом зависит от состояния макроорганизма. Сокращение численности определенного представителя резидентной микрофлоры может привести к снижению устойчивости организма-хозяина и проникновению в свободную экологическую нишу транзиторных микроорганизмов, в том числе и патогенных (Шендеров, 1998; Шуб и др., 2001). Нарушение физиологических процессов, протекающих в макроорганизме, в свою очередь способно спровоцировать возникновение воспалительных реакций, ассоциированных с увеличением числа условно-патогенных микроорганизмов, входящих с состав нормальной микрофлоры. Для устранения негативных последствий таких нарушений может быть использовано фотодинамическое воздействие с применением различных типов излучения, поскольку его эффект, вероятно, обусловлен индивидуальными характеристиками вида или штамма микроорганизма (Demidova, 2005). Более глубокое понимание механизмов действия оптического излучения, обеспечивающих подобную селективность, позволит в дальнейшем использовать метод ФДТ для коррекции численности того или иного вида бактерий в составе микробоценозов макроорганизма, профилактики заболеваний, связанных с нарушениями в функционировании нормальной микрофлоры. Например, синее излучение с длинами волн 400 – 420 нм приводит к сокращению числа КОЕ различных видов бактерий и, в частности, находит применение при лечении такого заболевания как угревая сыпь, связанного с избыточной обсемененностью кожи P. acnes.
Как показано в наших экспериментах, излучение с определенной длиной волны и плотностью мощности способно вызвать уменьшение или увеличение численности, изменение жизнеспособности, морфологии, культуральных и тинкториальных свойств бактерий, входящих в состав нормальной микрофлоры. При этом необходимо отметить, что данные изменения в большинстве случаев были незначительными или слабо выраженными и находились в пределах нормы реакции бактерий на действие оптического излучения, как экологического фактора антропогенной природы. Это позволило нам отобрать комплекс информативных показателей для характеристики влияния различных типов излучения на бактерии из микробоценозов кожи и ротовой полости, который может быть использован и для оценки действия других экологических факторов антропогенного характера на различные микробные сообщества макроорганизма. Из изученных характеристик резидентных бактерий наиболее показательными являются численность популяции, форма и размер клеток, морфология и пигментация колоний. Их определение не требует дорогостоящей аппаратуры и сложных методических приемов и может проводиться при экологических исследованиях в лабораториях различного профиля.
Полученные нами данные на отдельных популяциях микроорганизмов, представляющих нормальную микрофлору, обосновывают необходимость дальнейших исследований в условиях in vivo для установления характера изменений биоценотических связей в микробных сообществах при действии излучений.
ВЫВОДЫ
- Оптимальными условиями применения фотосенсибилизаторов при фотодинамическом воздействии являются: время преинкубации бактериальных клеток с красителями 5 – 10 мин; допустимая концентрация метиленового синего 0.005 – 0.025%; индоцианина зеленого – 0.1 – 0.5%.
- Жизнеспособность бактерий микробоценоза ротовой полости - кокков Streptococcus mutans и Staphylococcus lugdunensis и палочек Rothia mucilaginosa, R. dentacariosa, Curtobacterium albidum, Flavobacterium gleum, Haemophilus actionomycetemcomitans под действием светодиодного синего (405 нм) излучения снижается на 30 – 80 и 5 – 20% соответственно. Уменьшение числа КОЕ S. mutans после воздействия красного (660 нм) излучения происходит на 40 – 77%, H. actionomycetemcomitans на 20 – 25% в зависимости от длительности облучения; в то же время клетки S. mutans оказываются устойчивы к воздействию лазерного инфракрасного (810 нм) излучения.
- Культуральные свойства и морфологические характеристики бактерий ротовой полости изменяются под влиянием различных типов излучения: в популяциях выживших бактерий преобладают формы с интенсивной пигментации колоний.
- Относительная численность популяций бактерий микробоценоза кожи S. epidermidis и P. acnes уменьшается на 15 – 85% после облучения синим (405 нм) светом; без использования фотосенсибилизаторов плотность популяции S. epidermidis увеличивается под влиянием красного (625, 805 нм) излучения на 20% относительно контроля.
- Форма и размеры клеток бактерий микробоценоза кожи изменяются при фотодинамическом воздействии – у S. epidermidis изменяется диаметр клеток: уменьшается после облучения синим (405 нм) светом, увеличивается – после действия инфракрасного (805 нм) излучения.
- Наиболее информативными показателями изменения экологического состояния популяций бактерий, представляющих нормальную микрофлору кожи и ротовой полости, при действии разных типов излучения являются: число колониеобразующих единиц, размеры и форма клеток, размеры и пигментация колоний.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
(* - публикации в печатных изданиях Перечня ВАК РФ)
- Тучина Е.С., Чернова Ю.А., Рудик Д.В., Попов Д.Э. Влияние некогерентного синего излучения на численность популяции грамположительных кокков // Студенческие исследования в биологии. – Саратов, 2004. – Вып. 2. – С. 65 – 69.
- Тучина Е.С., Чернова Ю.А., Рудик Д.В., Попов Д.Э. Изменение численности бактерий под влиянием некогерентного синего излучения // Материалы 2-й регион. конф. молод. ученых «Стратегия взаимодействия микроорганизмов с окружающей средой» – Саратов, 2004. – С. 52 – 53.
- Popov D., Tuchina E., Chernova J., Podshibyakin D., Rudik D., Samsonova M., Gromov I., Tuchin V. The affect of low-coherent light on microbial colony forming ability and morphology of some gram-positive and gram-negative bacteria // Proceedings of The International Society for Optical Engineering. – USA, Washington, 2005. – Vol. 5771. – P. 353 – 356.
- Тучина Е.С., Рудик Д.В. Изменение численности популяций грамположительных и грамотрицательных палочковидных бактерий под действием некогерентного синего излучения //Исследования молодых ученых и студентов в биологии. – Саратов, 2005. – Вып. 3. – С. 103 – 107.
- Тучина Е.С., Рудик Д.В., Еременко А.М., Тучин В.В. Влияние широкополосного света на условно-патогенные микроорганизмы, фотосенсибилизированные образцами наночастиц TiO2, Ag-SiO2 // Тез. докл. IV Съезда фотобиологов России. – Саратов, 2005. – С. 219 – 221.
- Рудик Д.В., Тихомирова Е.И., Тучина Е.С. Функциональная активность нейтрофилов крови человека при действии различных доз инфракрасного лазерного излучения // Тез. докл. IV Съезда фотобиологов России. – Саратов, 2005. – С. 171 – 174.
- Tuchina E.S., Rudik D.V., Tikhomirova E.I. Biochemical activity changing of opportunistic microorganisms under the influence of low-coherent blue light
// Proceedings of The International Society for Optical Engineering. – USA, Washington, 2006. – Vol. 6163. – P. 278 – 281.
- Tuchina E.S., Rudik D.V., Krylova G.V., Smirnova N.P., Eremenko A.M., Tuchin V.V. Broadband light action on opportunistic microorganisms photosensitized by TiO2 and Ag-SiO2 nanoparticle films // Proceedings of The International Society for Optical Engineering. – USA, Washington, 2006. – Vol. 6163. – P. 281 – 285.
- Тучина Е.С. Фотодинамическое влияние красного и инфракрасного лазерного излучения на бактерии Haemophilus actionomycetemcomitans // Исследования молодых ученых и студентов в биологии. – Саратов, 2006. – Вып. 4. – С. 97 – 100.
10*. Тихомирова Е.И., Рудик Д.В., Тучина Е.С. Оценка некоторых показателей киллинга бактерий нейтрофилами периферической крови человека под влиянием инфракрасного низкоинтенсивного лазерного излучения // Медицинская иммунология. – 2006. – Т. 8, № 2 – 3. – С. 35 36.
- Рудик Д.В., Тучина Е.С., Тихомирова Е.И., Сенотов А.С. Оценка функционально-метаболического статуса фагоцитирующих клеток под действием низкоинтенсивного лазерного излучения ИК-диапазона (850 нм) // Фундаментальные исследования. – 2006. – № 5. – С. 100 – 101.
- Rudik D.V., Tikhomirova E.I., Tuchina E.S. The cytokine production by neutrophils and macrophages in time of phagocytosis under the influence of infrared low-level laser irradiation // Proceedings of The International Society for Optical Engineering. – USA, Washington, 2006. – Vol. 6163. – P. 273 – 278.
- Тучина Е.С., Пермякова Н.Ф. Воздействие некогерентного светодиодного излучения на бактерии рода Staphylococcus, фотосенсибилизированные метиленовым синим и наночастицами Ag-SiO2 // Материалы 1-й конф. молод. ученых медико-биологической секции Поволжской ассоциации государственных университетов. – Ульяновск, 2007. – С. 70 – 72.
- Tuchina E. S., Permyakova N. F., Tuchin V. V. The effect of LED-light action on microbial colony forming ability of several species of Staphylococcus // Proceedings of The International Society for Optical Engineering. – USA, Washington, 2007. – Vol. 6535. – P. 301 – 306.
15*. Тихомирова Е.И., Тучина Е.С., Рудик Д.В., Водянова Т.В., Емельянова Н.В. Влияние низкоинтенсивного лазерного излучения на цитокиновую активность макрофагов и нейтрофилов in vitro при фагоцитозе бактерий // Медицинская иммунология. – 2007. – Т. 9, № 2 – 3. – С. 165.
- Тучина Е.С. Использование наночастиц Ag-SiO2 и метиленового синего при фотодинамическом воздействии светодиодного излучения на некоторые виды стафилококков // Материалы 11-й Пущинской школы-конференции молодых ученых – Пущино, 2007. – С. 285.
- Тучина Е.С. Фотодинамическое воздействие светодиодного красного излучения на микроорганизмы кожи человека // Тез. докл. V Съезда фотобиологов России. – Пущино, 2008. – С. 236.
- Тучина Е.С., Пермякова Н.Ф., Алексашин А.В. Экологический аспект действия красного некогерентного светодиодного излучения на микроорганизмы кожи человека // Вестник Российской военно-медицинской академии – 2008. – № 3 (23). – С. 337.
19*. Тучина Е.С., Тучин В.В., Альтшулер Г.Б., Ярославский И.В. Фотодинамическое воздействие красного (625 нм) излучения на бактерии вида Propionibacterium acnes, обработанные фотосенсибилизатором // Естественные и технические науки. – 2008. № 2 (34). – С. 90 – 93.
Тучина Елена Святославна
Оценка фотодинамического воздействия in vitro
на бактерии из микробоценозов ротовой полости и кожи человека
03.00.16 – экология
03.00.07 – микробиология
Автореферат диссертации на соискание
ученой степени кандидата биологических наук
__________________________________________________________
Подписано в печать 00.00.2008 г.
Формат 6084 1/16. Бумага офсетная. Гарнитура Таймс. Печать офсетная.
Объем 1 печ. л. Тираж 100 экз. Заказ №.
___________________________________________________________________________________________________________________
Типография Издательства Саратовского университета.
410012, Саратов, Астраханская, 83.

