Динамика факторов персистенции микроорганизмов под влиянием соединений с антиоксидантной активностью
На правах рукописи
Уткина Татьяна Михайловна
ДИНАМИКА ФАКТОРОВ ПЕРСИСТЕНЦИИ
МИКРООРГАНИЗМОВ ПОД ВЛИЯНИЕМ СОЕДИНЕНИЙ
С АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ
03.02.03 – «Микробиология»
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Оренбург –2010
Работа выполнена в ГУ «Институт клеточного и внутриклеточного симбиоза
Уральского отделения Российской академии наук»
Научный руководитель:
доктор биологических наук
ГУ «Институт клеточного и внутриклеточного
симбиоза УрО РАН» Карташова Ольга Львовна
Официальные оппоненты:
доктор биологических наук,
профессор ГОУ ВПО «Оренбургская
государственная медицинская академия
Федерального агентства по здравоохранению
и социальному развитию» Соловых Галина Николаевна
доктор медицинских наук ГОУ ВПО
«Оренбургский государственный университет» Брудастов Юрий Авенирович
Ведущая организация: Государственное образовательное учреждение высшего профессионального образования «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Защита состоится « » апреля 2010 г. в ________ часов на заседании диссертационного совета Д. 208.066.03. при Государственном образовательном учреждении высшего профессионального образования «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» (Россия, 460000, г. Оренбург, ул. Советская, д. 6, зал заседаний диссертационного совета).
С диссертацией можно ознакомиться в библиотеке Государственного образовательного учреждения высшего профессионального образования «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
Автореферат разослан «______» ________________ 2010г.
Ученый секретарь
диссертационного совета
доктор медицинских наук,
профессор Немцева Наталия Вячеславовна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Феномен выживания бактерий в организме хозяина рассматривается как одно из важных звеньев в патогенезе инфекционного процесса. Выживание бактерий в макроорганизме реализуется через их адаптацию к факторам защиты хозяина и может быть связано с инактивацией последних. В настоящее время установлено, что микроорганизмы способны подавлять многие факторы естественной резистентности организма хозяина, такие как лизоцим, комплемент, лактоферрин и т.д. [Бухарин О.В., 1999]. Ведется поиск лекарственных средств с антиперсистентной активностью [Бухарин О.В. с соавт., 2003; Тарасевич А.В. с соавт., 2003]. Рядом авторов было установлено, что антиперсистентное действие оказывают витамины-антиоксиданты [Чернова О.Л., 1989; Гриценко В.А., Парфенов О.Г., 1990], иммуномодуляторы (полиоксидоний) [Кириллов Д.А., 2004], лекарственные растения, богатые антиоксидантами [Тарасевич А.В., 2004].
В настоящее время растет удельный вес и объем производства лекарственных препаратов полученных путем синтетических трансформаций веществ, выделяемых из дикорастущих и культивируемых растений.
В связи с этим, интерес представляет поиск химически синтезированных веществ, подавляющих персистентный потенциал патогенных и условно-патогенных микроорганизмов и обладающих антиоксидантной активностью.
Цель исследования заключалась в изучении динамики персистентных свойств микроорганизмов под воздействием химически синтезированных соединений, обладающих антиоксидантной активностью.
Задачи исследования
1. Провести сравнительное изучение антиоксидантной активности химически синтезированных соединений разных групп: пентациклических тритерпеноидов и хлорированных циклопентенонов.
2. Определить чувствительность микроорганизмов и изучить изменения их персистентных свойств под воздействием химически синтезированных соединений.
3. Проанализировать связь между степенью влияния на персистентные свойства микроорганизмов химически синтезированных соединений и уровнем их антиоксидантной активности.
4. Определить взаимосвязь в системе «структура вещества - антиперсистентная активность».
Научная новизна
На основании изучения биологической активности 13 синтетических соединений, относящихся к хлорированным циклопентенонам этиленкетального и диметоксикетального рядов впервые установлено, что этиленкетальные хлорциклопентеноны характеризовались более высоким уровнем антиоксидантной активности, низким уровнем минимальной бактерицидной активности по сравнению с диметоксикетальными хлорциклопентенонами, а также выраженным подавляющим действием на факторы персистенции изученных микроорганизмов. Показано, что представители обоих рядов, содержащие в структуре максимальное количество атомов хлора, эффективнее снижали персистентные свойства изученных микроорганизмов, чем их дехлорированные аналоги.
Изучена биологическая активность 22 синтетических соединений, относящихся к пентациклическим тритерпеноидам, структурной основой которых являлись бетулин и аллобетулин. Впервые показано, что циннаматы и метоксициннаматы бетулина наиболее эффективно подавляли рост золотистых стафилококков и клебсиелл.
Установлено, что пентациклические тритерпеноиды с низкой и средней антиоксидантной активностью обладали разнонаправленным антиперсистентным действием, а с высокой антиоксидантной активностью – однонаправлено понижающим.
Выявлена положительная корреляционная связь (r0,75) между степенью понижения персистентного потенциала микроорганизмов химическими соединениями и уровнем их антиоксидантной активности: персистентные свойства микроорганизмов наиболее эффективно подавляли соединения с высокой антиоксидантной активностью.
Установлен структурный компонент, определяющий эффективное подавление факторов персистенции микроорганизмов химическими соединениями и их высокую антиоксидантную активность. Присоединение фрагментов коричной кислоты к бетулину, аллобетулину и хинопимаровой кислоте приводило к повышению эффективности антиперсистентного действия соединений и увеличению уровня их антиоксидантной активности.
Теоретическая и практическая ценность
Изучение антиперсистентного влияния и антиоксидантной активности соединений и их отдельных фрагментов позволило получить новые данные о связи в системе «структура - функция».
Полученные знания о связи антиперсистентного действия соединения и уровня его антиоксидантной активности позволят отбирать наиболее эффективные соединения, обладающие антиперсистентным действием и антиоксидантной активностью, перспективные для создания новых средств, пригодных для борьбы с персистирующими патогенами.
Положения, выносимые на защиту
1. Изменение персистентных свойств микроорганизмов под действием пентациклических тритерпеноидов и хлорированных циклопентенонов разнонаправлено и определяется их химической структурой и видовой принадлежностью бактерий.
2. Эффективность антиперсистентного действия коррелирует с уровнем антиоксидантной активности исследованных новых синтетических соединений. Наличие в структуре пентациклических тритерпеноидов фрагмента коричной кислоты усиливает антиперсистентное действие и антиоксидантную активность химических соединений.
Апробация работы.
Результаты работы были доложены и обсуждены на: III межрегиональной конференции молодых ученых «Стратегия взаимодействия микроорганизмов с окружающей средой» (г. Саратов, 2006), региональной конференции молодых ученых Оренбургской области (г. Оренбург, 2006, 2009), V и VI Всероссийских конференциях «Персистенция микроорганизмов» (Оренбург, 2006, 2009), VI Всероссийском научном семинаре с молодежной научной школой «Химия и медицина» (г. Уфа, 2007), IX съезде Всероссийского научно-практического общества эпидемиологов, микробиологов и паразитологов (г. Москва, 2007), симпозиуме «Фундаментальные науки - новым лекарствам» (г. Москва, 2008), I международной научной конференции студентов, аспирантов и молодых ученых (г. Донецк, 2009), Всероссийской научной конференции с международным участием «Физиология и генетика микроорганизмов в природных и экспериментальных системах» (г. Москва, 2009), VII Всероссийской конференции с молодежной научной школой «Химия и медицина, Орхимед-2009» (г. Уфа, 2009).
Публикации.
По теме диссертации опубликовано 10 печатных работ, в том числе 5 публикаций в журналах, рекомендованных ВАК.
Объем и структура диссертационной работы
Текст диссертации изложен на 124 страницах машинописи, содержит введение, обзор литературы, материалы и методы исследования, 3 главы собственных исследований, заключение, выводы, указатель литературы, включающий 87 отечественных и 104 иностранных источника. Текст иллюстрирован 19 таблицами и 16 рисунками.
СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
Материалы и методы исследования
Материалом для исследования послужили следующие штаммы микроорганизмов: Klebsiella pneumoniae, депонированный в ГИСК им. Тарасевича под номером 278 (АЛА - 1,1-1,2 мкг/мл*ОП и АКрА – 2,5±0,001 мг/мл), предоставленный нам сотрудниками лаборатории молекулярно-генетических исследований и биомониторинга ИКиВС УрО РАН; Staphylococcus aureus, выделенный нами в процессе работы из гнойного отделяемого трофической язвы; (АЛА - 0,8-1 мкг/мл*ОП, АКрА – 2,43±0,38 мг/мл). Лактозонегативная Escherichia coli (АЛА 1,755±0,076 мкг/мл*ОП, АКрА - 3±0,01 мг/мл); лактозопозитивная Escherichia coli (АЛА - 0,949±0,27 мкг/мл*ОП, АКрА - 3±0,001 мг/мл); Citrobacter diversus (АЛА - 0,681±0,11 мкг/мл*ОП, АКрА - 3±0,01 мг/мл); Klebsiella oxytoca (АЛА - 0,671±0,15 мкг/мл*ОП, АКрА - 3±0,001 мг/мл) из коллекции ИКиВС УрО РАН.
Выделение и идентификацию штаммов микроорганизмов проводили на основании общепринятых методов по морфологическим, тинкториальным, культуральным и биохимическим свойствам [Биргер М.О., 1982]. Для идентификации использовали стандартные системы STAPHYtest, ENTEROtest, NEFERMtest (LaChema, Чехия).
Изучение антимикробной активности химически синтезированных соединений проводили общепринятыми методами [Биргер М. О., 1982]. Определение антилизоцимной, антикомплементарной и антикарнозиновой активностей проводили по Бухарину О.В. с соавт. (1999).
Антиоксидантную активность химических соединений определяли амперометрическим методом на анализаторе «ЦветЯуза-01-АА» (НПО «Химавтоматика», Москва). В работе были использованы соединения, синтезированные в Институте Органической Химии УНЦ РАН и отличающиеся различным химическим строением: хлорированные циклопентеноны (табл. 1) и пентациклические тритерпеноиды - производные бетулина и аллобетулина (табл. 2).
Таблица 1
Название, шифр и антиоксидантная активность
хлорированных циклопентенонов
| Название | Шифр | АОА (мг/г) |
| 1 | 2 | 3 |
| Этиленкетальный ряд | ||
| 2,3,5-трихлор-4,4-этилендиоксициклопент-2-ен-1-он | ФА-1 | 0,65 |
| 2,3-дихлор-4,4-этилендиоксициклопент-2-ен-1-он | ФА-1А | 0,81 |
| 3-фенилсульфон-2-хлор-4,4- этилендиоксициклопент-2-ен-1-он | ФА-2 | 1,04 |
| 3-фенилтио-2,5-дихлор-4,4- этилндиоксициклопент-2-ен-1-он | ФА-3 | 1,94 |
| 3-фенилсульфонил-2,5-дихлор-4,4- этилендиоксициклопент-2-ен-1-он | ФА-4 | 0,86 |
Продолжение таблицы 1
| 1 | 2 | 3 |
| Диметоксикетальный ряд | ||
| 4,4-диметокси-2,3,5-трихлорциклопент-2-ен-1-он | KS-1 | 0,72 |
| 4,4-диметокси-2,3-дихлорциклопент-2-ен-1-он | KS-1A | 0,38 |
| 4,4-диметокси-3-фенилтио-2,3-дихлорциклопент-2-ен-1-он | KS-2 | 0,63 |
| 4,4-диметокси-3-фенилтио-2-хлорциклопент-2-ен-1-он | KS-2A | 0,54 |
| 4,4-диметокси-3-фенилсульфонил-2-хлорциклопент-2-ен-1-он | KS-3A | 0,25 |
| 3-диметиламино-4,4-диметокси-2,5-дихлорциклопент-2-ен-1-он | KS 4 | 0,85 |
| 4,4-диметокси-3-пиперидино-2,5-дихлорциклопент-2-ен-1-он | KS 5 | 0,9 |
| 4,4-диметокси-3-морфолино-2,5-дихлорциклопент-1-ен-1-он | KS 6 | 1,05 |
| 4,4-диметокси-3-пиперидино-2,5-дихлорциклопент-2-ен-1-он | KS 5 | 0,9 |
| 4,4-диметокси-3-морфолино-2,5-дихлорциклопент-1-ен-1-он | KS 6 | 1,05 |
Таблица 2.
Название, шифр и антиоксидантная активность
пентациклических тритерпеноидов
| Название | Шифр | АОА (мг/г) |
| 1 | 2 | 3 |
| Бетулин и его производные | ||
| луп-20(29)-ен-3,28-диол (бетулин) | №1 бетулин | 4,33 |
| Оксим 28-ацетоксилуп-20(29)-ен-3-она | №9 | 1,47 |
| 3-гидроксилуп-20(29)-ен-28-ил ацетат | №14 | 2,71 |
| диоксим луп-20(29)-ен-3-он-28-аля | №15 | 0,76 |
| 2-гидрокси-19,28-эпокси-18a-олеан-1-ен-3-он | №5 | 5,91 |
Продолжение таблицы 2
| 1 | 2 | 3 |
| Аллобетулин и его производные | ||
| 19,28-эпокси-18a-олеан-3-ол | №11 аллобетулин | 1,74 |
| 3-оксо-18a-олеан-28-19-олид | №16 | 2,25 |
| 3-О-гемисукцинил-19, 28-эпокси-18-олеан | №25 | 6,0 |
| 3-О-циннамоил-19,28-эпокси-18-олеан | №26 | 8,1 |
| 3-О-n-метоксициннамоил-19,28-эпокси-18-олеан | №27 | 5,9 |
| 3-изоприл-3, 5-эпокси-А-нео-19, 28-эпокси-18-олеан | №23 | 6,15 |
| 3-формиат аллобетулина | №17 | 6,75 |
| 3-фторацетат аллобетулина | №18 | 6,6 |
| 3-О-(2,2,3,3-тетраметилциклопропан-1-карбоксо)-19,28-эпокси-18-олеан | №20 | 6,35 |
| 3-О-(2’-(’,’-дихлорвинил)-3’, 3’-диметилциклопропан-1’-карбоксо)-19, 28-эпокси-18-олеан | №21 | 6,2 |
| Метиловый эфир 2-метилидентиоуреидо-бетулоновой кислоты | №11 | 5,85 |
| Метиловый эфир 2-бензилиден-3-оксо-бетулиновой кислоты | №1 | 5,8 |
| Метиловый эфир 2-(2 метоксибензилиден)-3-оксобетулиновой кислоты | №4 | 6,1 |
| 28-О-циннамат бетулина | №33 | 5,6 |
| 3,28-ди-О-циннамат бетулина | №31 | 8,6 |
| 28-О-метоксициннамат бетулина | №34 | 5,9 |
| 3,28-ди-О-метоксициннамат бетулина | №32 | 7,8 |
Изучение регуляции факторов персистенции синтетическими веществами осуществляли в 2 этапа: определяли чувствительность микроорганизмов методом серийных разведений и проводили изучение влияния МБК на факторы персистенции микроорганизмов. Эффект регуляции персистентных характеристик микроорганизмов являлся существенным, если под воздействием соединений происходило их снижение на 20% и более, а от 0 до 20% - индифферентным [Шеенков Н. В., 1993].
Полученные результаты были подвергнуты статистической обработке с определением средней арифметической величины (М), средней ошибки средней арифметической (m) в соответствии с рекомендациями Лакина Г. Ф. (1990) и Гланца С. (1998). Различия считали достоверными при уровне вероятности ошибки p<0,05.
Для изучения взаимосвязи между исследуемыми признаками проведен корреляционный анализ, позволивший определить величину коэффициента парной корреляции Пирсона анализируемых величин с использованием программы «STATICTICA 6.0» [Кулаичев А. П., 2006].
Результаты исследования и их обсуждение.
Для изучения антиперсистентного действия соединений, обладающих АОА, были использованы две группы химически синтезированных соединений. Первая группа представлена хлорированными циклопентенонами, проявляющими антивирусные, фунгицидные, гербицидные и другие виды активности [Байбулатова Г.М., 2001; Гаврилов О.А., 2004; Усманова Ф.Г., 2007; Егоров В.А., 2008; Кислицина К.С., 2009]. В работе были изучены хлорированные циклопентеноны этиленкетального и диметоксикетального рядов.
Полученные результаты по определению АОА показали, что этиленкетальные хлорированные циклопентеноны характеризовались более высоким уровнем антиоксидантной активности (от 0,65 до 1,94 мг/г) в сравнении с диметоксикетальными хлорциклопентенонами (от 0,25 до 1,05 мг/г) (табл. 1).
При изучении антимикробной активности хлорированных циклопентенонов этиленкетального ряда было установлено, что их МБК была ниже и преимущественно составляла 20-30 мг/мл по сравнению с соединениями диметоксикетального ряда, МБК которых в подавляющем большинстве случаев была равна 30-40 мг/мл. Установлено, что K. pneumoniae по сравнению со S. aureus более устойчива к воздействию хлорированных циклопентенонов.
На следующем этапе работы было изучено действие хлорированных циклопентенонов на АЛА (рис. 1) и АКрА (рис. 2) S. aureus и K. pneumoniae и установлено, что они обладали разнонаправленным действием на факторы персистенции: понижающим, повышающим и индифферентным.
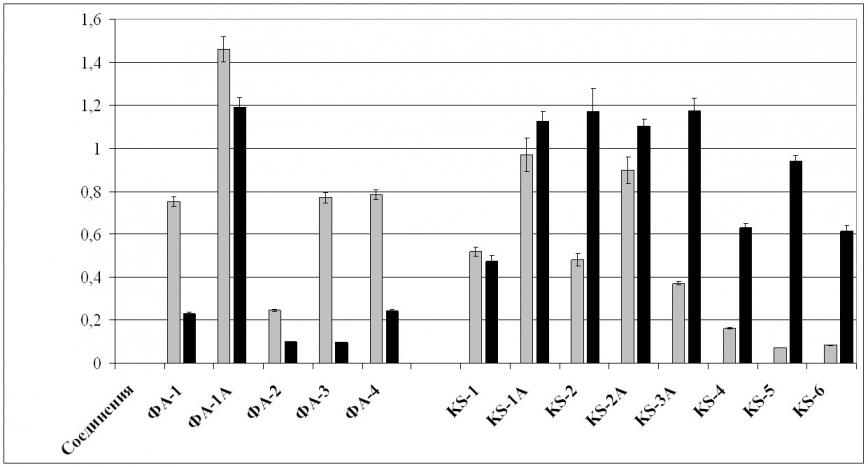
Условные обозначения:
Рис.1. Влияние хлорированных циклопентенонов на АЛА S. aureus и K. pneumoniae.
Повышение АЛА стафилококков и клебсиелл происходило под действием соединения ФА-1А. Соединения KS-1A и KS-2A оставляли без изменения способность стафилококков к инактивации лизоцима, а соединения KS-1A, KS-2, KS-2A, KS-3A и KS-5 – клебсиелл.
Среди изученных соединений подавляющее большинство (ФА-1, ФА-2, ФА-4, KS-1A, KS-2A, KS-3A, KS-4, KS-5 и KS-6) не изменяли АКрА золотистых стафилококков, соединения ФА-1А и KS-1 – повышали. Соединения KS-2, KS-2A, KS-5 повышали АКрА клебсиелл, а соединения ФА-1, ФА-1А, ФА-2, ФА-4, KS-1A, KS-4 оказывали индифферентное действие на антикарнозиновую активность.
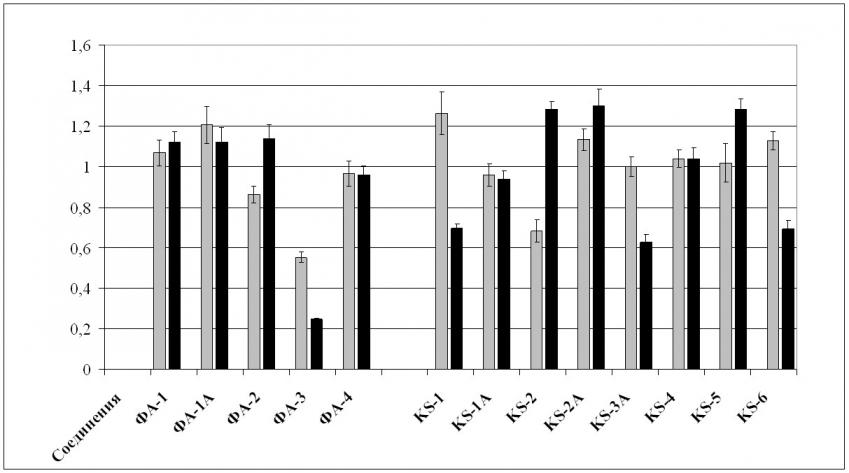
Условные обозначения:
Рис.2. Влияние хлорированных циклопентенонов на АКрА S. aureus и K. pneumoniae.
Соединения этиленкетального ряда наиболее эффективно снижали антилизоцимный признак K. pneumoniae, тогда как подавление АЛА S. aureus было выражено сильнее у соединений диметоксикетального ряда. Что же касается антикарнозиновой активности бактерий, то эффективное ее снижение у S. aureus происходило под действием соединений ФА-3, KS-2; а соединения ФА-3, KS-1, KS-3A и KS-6 эффективно подавляли АКрА K. pneumoniae.
Полученные результаты показали, что наибольшее подавляющее влияние на персистентные свойства как K. pneumoniae, так и S. aureus оказывало соединение ФА-3, которое характеризовалось и самой высокой антиоксидантной активностью в данной группе соединений.
Для выявления связи «структура вещества - активность» был проведен анализ полученных результатов и показано, что соединения ФА-1, KS-1, KS-2, содержащие в своей структуре три атома хлора более эффективно подавляли персистентные свойства изученных микроорганизмов, чем дехлорированные аналоги, которые их либо стимулировали, либо не оказывали никакого влияния.
Проведенный корреляционный анализ позволил установить положительную связь (0,3 < r < 0,75) между эффективностью подавления факторов персистенции микроорганизмов соединениями и величиной их АОА.
На следующем этапе работы нами были изучены соединения, относящиеся к пентациклическим тритерпеноидам. К наиболее изученным тритерпеноидам относится бетулин, входящий в состав коры березы. В экстрактах коры березы наряду с бетулином содержатся его окисленные производные: бетулиновая кислота, бетулиновый альдегид, метиловый эфир бетулиновой кислоты, бетулоновый альдегид, бетулоновая кислота, кроме того, бетулиновая кислота оказывает антибактериальное действие на ряд как грамположительных, так и грамотрицательных микроорганизмов [Seltzer U. N. et. al., 2000] и грибов [Woldemichael G. M. et. al., 2003; Nick A. et. al., 1995]. Из производных олеанана, найденных в экстрактах коры березы, следует отметить продукт перегруппировки бетулина – аллобетулин, легко получающийся при действии кислотных агентов [Simonsen J. L., Ross W. C. J., 1957].
При изучении антимикробного влияния пентациклических тритерпеноидов на S. aureus и K. pneumoniae нами было показано, что МБК бетулина и аллобетулина для S. aureus составляла 80 мг/г, а для K. pneumoniae – 90 мг/г. Однако более эффективно подавляли рост, как золотистых стафилококков, так и клебсиелл циннаматы и метоксициннаматы бетулина: МБК у №34 и № 32 для золотистых стафилококков составила 60 мг/мл, а МБК для клебсиелл - 80 мг/мл.
Установлено разнонаправленное влияние (подавляющее, индифферентное и стимулирующее) на факторы персистенции изученных микроорганизмов пентациклических тритерпеноидов, АОА которых колебалась в диапазоне от 0,76 до 5,91 мг/г. При этом бетулин и производное аллобетулина (№5) проявляли однонаправленное подавляющее действие на факторы персистенции микроорганизмов и характеризовались высокой АОА в данной группе соединений.
Для подтверждения выявленной закономерности нами были использованы 16 специально синтезированных соединений, относящихся к пентациклическим тритерпеноидам, для которых с помощью программы PASS была рассчитана вероятность проявления высокой антиоксидантной активности. Измерения АОА амперометрическим методом у данных соединений показало, что она колебалась в диапазоне от 5,6 до 8,6 мг/г, при этом экспериментально установлено их однонаправлено понижающее действие на факторы персистенции микроорганизмов (табл. 3).
Таблица 3.
Динамика факторов персистенции микроорганизмов
под влиянием пентациклических тритерпеноидов.
| Факторы персистенции Соединения | K. pneumoniae | S. aureus | АОА мг/г | ||
| АЛА 1,1±0,001 мкг/мл*ОП | АКрА 2,5±0,001 мг/мл | АЛА 0,85±0,03 мкг/мл*ОП | АКрА 2,43±0,38 мг/мл | ||
| 1 | 2 | 3 | 4 | 5 | 6 |
| № 25 | -1 | -3 | -3 | -1 | 6,0 |
| № 26 | -2 | -3 | -1 | -3 | 8,1 |
| № 27 | -2 | -3 | -1 | -2 | 5,9 |
| № 23 | -2 | -1 | -2 | -2 | 6,15 |
| № 17 | -3 | -2 | -2 | -1 | 6,75 |
| № 18 | -3 | -3 | -1 | -1 | 6,6 |
| № 20 | -3 | 0 | -2 | 0 | 6,35 |
| № 21 | -2 | -2 | -2 | -1 | 6,2 |
| № 11 | -2 | -2 | -2 | -3 | 5,85 |
| № 1 | -1 | -3 | -2 | -3 | 5,8 |
| № 4 | -1 | -3 | -2 | -3 | 6,1 |
Продолжение таблицы 3
| 1 | 2 | 3 | 4 | 5 | 6 |
| № 33 | -1 | -2 | -1 | -3 | 5,6 |
| № 31 | -3 | -3 | -2 | -2 | 8,6 |
| № 34 | -2 | -2 | -2 | -3 | 5,9 |
| № 32 | -2 | -2 | -1 | -3 | 7,8 |
Примечание: 0 – изменение признака на 0-20%; 1 – изменение признака на 20-40%; 2 – изменение признака на 40-60%; 3 – изменение признака на 60% более; «-» - снижение признака.
Эффективнее всего подавляло персистентные характеристики как S. aureus, так и K. pneumoniae соединение № 31, обладающее максимальной АОА в группе пентациклических тритерпеноидов.
Проведенный корреляционный анализ полученных данных показал, что существует положительная связь (r0,75) между эффективностью подавления факторов персистенции бактерий химическими соединениями и выраженностью их антиоксидантной активности.
Для изучения зависимости уровня АОА от химической структуры соединения нами была изучена АОА как исходных соединений (бетулин и аллобетулин), так и их различных модификаций (см. табл. 2).
Было показано, что присоединение различных заместителей как к аллобетулину, так и бетулину повышало уровень АОА соединений по сравнению с исходным соединением, причем максимально - при введении в их структуру фрагментов коричной кислоты.
Дальнейшие наши исследования были посвящены изучению взаимосвязи «структура вещества – его антиперсистентное действие», для этого было изучено антиперсистентное действие исходных соединений (бетулин, аллобетулин) и их производных.
Показано, что аллобетулин снижал персистентные характеристики стафилококков на 20-40% и оказывал индифферентное влияние на персистентные свойства клебсиелл. Присоединение к нему различных заместителей в большинстве случаев повышало эффективность подавления соединениями факторов персистенции микроорганизмов. При этом введение в структуру аллобетулина циннамата (№ 26) обеспечивало проявление наиболее эффективного антиперсистентного действия (табл. 4).
Таблица 4.
Структурно-функциональная характеристика
производных аллобетулина.
| Факторы персистенции Соединения | K. pneumoniae | S. aureus | ||
| АЛА 1,1±0,001 мкг/мл*ОП | АКрА 2,5±0,001 мг/мл | АЛА 0,85±0,03 мкг/мл*ОП | АКрА 2,43±0,38 мг/мл | |
| 1 | 2 | 3 | 4 | 5 |
 N11(аллобетулин) N11(аллобетулин) | 0 | 0 | -1 | -1 |
 № 23 № 23 | -2 | -1 | -2 | -2 |
 № 25 № 25 | -1 | -3 | -3 | -1 |
 № 26 № 26 | -2 | -3 | -1 | -3 |
 № 27 № 27 | -2 | -3 | -1 | -2 |
 № 17 № 17 | -3 | -2 | -2 | -1 |
Продолжение таблицы 4
| 1 | 2 | 3 | 4 | 5 |
 № 18 № 18 | -3 | -3 | -1 | -1 |
 № 20 № 20 | -3 | 0 | -2 | 0 |
 № 21 № 21 | -2 | -2 | -2 | -3 |
Примечание: «0» - снижение персистентных свойств на 0-20%; «1» - снижение персистентных свойств на 20-40%; «2» - снижение персистентных свойств на 40-60%; «3» - снижение персистентных свойств на 60% и более.
Аналогичные результаты были получены при изучении бетулина и его производных (табл. 5).
Установлено, что наиболее эффективное понижающее действие на факторы персистенции, как стафилококков, так и клебсиелл, оказывало соединение, содержащее в своей структуре фрагменты коричной кислоты (№ 32).
Таблица 5.
Структурно-функциональная характеристика
производных бетулина
| Факторы персистенции Соединения | K. pneumoniae | S. aureus | ||
| АЛА 1,1±0,001 мкг/мл*ОП | АКрА 2,5±0,001 мг/мл | АЛА 0,85±0,03 мкг/мл*ОП | АКрА 2,43±0,38 мг/мл | |
| 1 | 2 | 3 | 4 | 5 |
 № 1 (бетулин) № 1 (бетулин) | -2 | -3 | 0 | 0 |
Продолжение таблицы 5
| 1 | 2 | 3 | 4 | 5 |
 №11 №11 | -2 | -2 | -2 | -3 |
 № 1 № 1 | -1 | -3 | -2 | -3 |
 № 4 № 4 | -1 | -3 | -2 | -3 |
 № 33 № 33 | -1 | -2 | -1 | -3 |
 № 34 № 34 | -2 | -2 | -2 | -3 |
 № 31 № 31 | -3 | -3 | -2 | -2 |
 № 32 № 32 | -2 | -3 | -1 | -3 |
Примечание: «0» - снижение персистентных свойств на 0-20%; «1» - снижение персистентных свойств на 20-40%; «2» - снижение персистентных свойств на 40-60%; «3» - снижение персистентных свойств на 60% и более.
Для доказательства ранее полученных данных о роли коричной кислоты, как фрагмента, повышающего не только антиперсистентное действие соединений, но и их АОА, нами была изучена биологическая активность каждого фрагмента, входящего в состав соединений, а также их комбинаций: коричная кислота + бетулин, коричная кислота + аллобетулин, коричная кислота + хинопимаровая кислота, имеющая с изученными соединениями структурные различия и которая была использована в качестве контроля.
В ходе проведенных исследований показано, что коричная кислота, бетулин, аллобетулин и хинопимаровая кислота оказывали разнонаправленное действие на факторы персистенции изученных микроорганизмов: повышающее, подавляющее и индифферентное, уровень их АОА составлял 6,33 мг/г; 4,33 мг/г; 1,7 мг/г и 2,6 мг/г соответственно. Присоединение к каждому из них коричной кислоты сопровождалось изменением характера влияния на персистентные характеристики микроорганизмов (однонаправленное понижающее действие) и способствовало повышению их АОА до 8,6 мг/г, 8,1 мг/г и 7,1 мг/г соответственно.
Подводя итог проделанной работе следует заключить, что изменение персистентных свойств микроорганизмов под действием пентациклических тритерпеноидов и хлорированных циклопентенонов разнонаправлено и определяется их химической структурой и видовой принадлежностью бактерий; уровень антиперсистентного действия коррелирует с антиоксидантной активностью изученных химических соединений, а введение в структуру пентациклических тритерпеноидов фрагмента коричной кислоты усиливает антиперсистентную и антиоксидантную активности химических соединений.
ВЫВОДЫ
1. Исследовано 35 химически синтезированных соединений (хлорированные циклопентеноны и пентациклические тритерпеноиды), выявлена их антиоксидантная активность, антимикробный спектр и антиперсистентное действие.
2. Показано, что золотистые стафилококки и клебсиеллы обладают разной чувствительностью к хлорированным циклопентенонам и пентациклическим тритерпеноидам, а также отличаются по способности изменять свои персистентные свойства под действием этих соединений.
3. Пентациклические тритерпеноиды с низкой и средней антиоксидантной активностью, кроме подавляющего влияния на персистентные свойства микроорганизмов, проявляли стимулирующее и индифферентное действие, тогда как соединения с высокой антиоксидантной активностью только уменьшали способность микроорганизмов к инактивации факторов естественной резистентности организма.
4. Изучение связи «структура и функция» химических соединений показало, что уровень антиоксидантной активности соединений зависел от их химического строения: присоединение фрагмента коричной кислоты способствовало повышению антиоксидантной активности соединений.
5. Выявлена корреляционная связь между степенью подавления персистентного потенциала микроорганизмов химическими соединениями и уровнем их антиоксидантной активности: наиболее эффективно подавляли персистентные свойства микроорганизмов соединения с высокой антиоксидантной активностью.
6. Модификация персистентных свойств бактерий под влиянием пентациклических тритерпеноидов зависела от их химической структуры. Присутствие в структуре соединения фрагментов коричной кислоты определяло подавляющее влияние пентациклических тритерпеноидов на персистентные свойства микроорганизмов.
Список работ, опубликованных по теме диссертации
1. Пашкова Т.М. (Уткина) Влияние антиоксидантов на антилизоцимную активность микроорганизмов / Т. М. Пашкова // Вестник Оренбургского государственного университета. – 2006. - №13. – С.267-268.
2. Пашкова Т.М. (Уткина) Влияние химических веществ-антиоксидантов на антилизоцимную активность микроорганизмов / Т.М. Пашкова //Стратегия взаимодействия микроорганизмов и растений с окружающей средой. Материалы III межрегиональной конференции молодых ученых. – Саратов. - 2006. - С.57-58.
3. Пашкова Т.М. (Уткина) Модифицирующее действие веществ-антиоксидантов на персистентные свойства Klebsiella pneumoniae / Т.М. Пашкова, О.Л. Карташова, С.Б. Киргизова // Материалы IX съезда всероссийского научно-практического общества эпидемиологов, микробиологов и паразитологов. - Москва. - 2007.- С.124.
4. Уткина Т.М. Влияние химических веществ на персистентные свойства микроорганизмов / Т.М. Уткина, Н.Г. Комиссарова // Тезисы докладов VI всероссийского научного семинара с молодежной научной школой. Химия и медицина. – Уфа. - 2007. – С. 234.
5. Лекарственная регуляция персистентного потенциала микроорганизмов / О.В. Бухарин, О.Л. Карташова, Н.Б. Перунова, С.В. Явнова, Т.М. Пашкова (Уткина) // Материалы симпозиума «Фундаментальные науки новым лекарствам». Москва. - 2008. – С. 30-31.
6. Влияние хлорированных циклопентенонов на персистентные свойства Klebsiella pneumoniae и Staphylococcus aureus / Т.М. Уткина, О.Л. Карташова, С.Б. Киргизова, Н.А. Иванова // Известия Оренбургского государственного аграрного университета. – 2009. - №1. – С. 242-244.
7. Уткина Т.М. Влияние синтетических антиоксидантов на персистентные свойства микроорганизмов / Т.М. Уткина, О.Л. Карташова, С.Б. Киргизова // Журнал микробиологии, эпидемиологии и иммунобиологии.- 2009. - №4. – С. 23-26.
8. Уткина Т.М. Влияние химических соединений на динамику антилизоцимной активности Staphylococcus aureus и Klebsiella pneumoniae / Т.М. Уткина // Вестник Оренбургского государственного университета. – 2009. - №2. – 137-138.
9. Уткина Т.М. Синтетические антиоксиданты как регуляторы персистентных характеристик микроорганизмов / Т. М. Уткина // Бюллетень Московского общества испытателей природы. – 2009.- Т. 114. – №2 (приложение). – С. 272-274.
10. Модификация персистентных свойств микроорганизмов производными бетулина и аллобетулина / О.Л. Карташова, Т.М. Уткина, Н.И. Медведева, О.Б. Казакова // Тезисы докладов VII всероссийской конференции с молодежной школой «Химия и медицина, Орхимед - 2009». – Уфа. – 2009. – С. 176.
УТКИНА ТАТЬЯНА МИХАЙЛОВНА
Динамика факторов персистенции микроорганизмов под влиянием
соединений с антиоксидантной активностью
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
____________________________________________________________________
Оригинал макет подготовлен в программе Word for Windows 2003
Подписано в печать 19.02.2010
Формат 60*84/16. Усл.-печ. л. 1,0. Печать оперативная.
Бумага офсетная. Гарнитура Times.
Тираж 100 экз.

