Поиск путей транспорта d -глюкозы в клетки escherichia coli, альтернативных фосфоенолпируват-зависимой фосфотрансферазной системе
На правах рукописи
СЛИВИНСКАЯ ЕКАТЕРИНА АЛЕКСАНДРОВНА
Поиск путей транспорта D-глюкозы в клетки Escherichia coli, альтернативных фосфоенолпируват-зависимой фосфотрансферазной системе
03.01.03 –Молекулярная биология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Москва 2011
Работа выполнена в лаборатории №2 Закрытого Акционерного Общества «Научно-исследовательский институт Аджиномото-Генетика» (ЗАО «АГРИ»)
Научный руководитель:
кандидат биологических наук, Рыбак Константин Вячеславович
ЗАО «АГРИ»
Официальные оппоненты:
доктор биологических наук, Миронов Александр Сергеевич
профессор ФГУП «ГосНИИгенетика»
доктор биологических наук, Патрушев Лев Иванович
ГУ РАН Институт биоорганической
химии им.ак. М.М. Шемякина и
Ю.А. Овчинникова РАН
Ведущая организация:
Государственное учреждение «Научно-исследовательский институт эпидемиологии и микробиологии им. Н.Ф.Гамалеи»
Защита диссертации состоится « » марта 2011 года в на заседании
Диссертационного Совета Д.217.013.01 при ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» по адресу: 117545, г. Москва, 1-й Дорожный проезд, д.1
С диссертацией можно ознакомиться в библиотеке ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов»
Автореферат диссертации разослан « » февраля 2011 года
Ученый секретарь Диссертационного Совета,
кандидат химических наук Т.Л. Воюшина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Культуры Escherichia coli широко используются в производстве ряда биологически активных веществ, в том числе аминокислот, применяемых в различных отраслях – пищевой, кормовой, фармацевтической промышленности. Для создания высокоэффективных штаммов-продуцентов методами метаболической инженерии требуется понимание основных метаболических процессов, к которым относится и перенос веществ через цитоплазматическую мембрану.
D-глюкоза применяется в микробиологическом производстве в качестве источника углерода для накопления бактериальной биомассы и биосинтеза биологически активных соединений. Показано, что у ряда продуцентов недостаточная эффективность транспорта глюкозы в клетку является фактором, ограничивающим продуктивность.
Известно, что в клетках E. coli основной путь утилизации D-глюкозы начинается с ее транслокации через цитоплазматическую мембрану и фосфорилирования (с образованием D-глюкозо-6-фосфата), осуществляемых фосфоенолпируват:углевод фосфотрансферазной системой (PTS) с использованием фосфоенолпирувата (РЕР) в качестве донора фосфатной группы. При этом на долю PTS приходится 50% пула фосфоенолпирувата, в то время как на долю основных биосинтетических ферментов, использующих РЕР как субстрат, - фосфоенолпируваткарбоксилазы, пируваткиназы, уридиндифосфат-N-ацетилглюкозамин-енолпирувил-трансферазы и 3-деокси-D-арабино-гептулозонат-7-фосфатсинтазы - 16, 15, 16, 3%, соответственно (Kim, Lees et al. 1996).
К настоящему времени большинство работ, посвященных увеличению эффективности транспорта глюкозы в клетку, было связано именно с модификацией активности PTS. Однако, транспорт через эту систему не выгоден в тех случаях, когда расходующийся на перенос и фосфорилирование глюкозы фосфоенолпируват одновременно является прямым метаболическим предшественником целевого продукта (к примеру, аминокислот аспарагинового семейства). Таким образом, экономия РЕР вследствие использования клетками альтернативных PTS-независимых систем транспорта глюкозы, имеет очевидные преимущества для подобных процессов.
На момент начала работы были известны две PTS-независимые системы транспорта моносахаров E. coli, способные к переносу глюкозы. Это GalP - низкоафинный Н+-симпортер (пермеаза) D-галактозы (Hernandez-Montalvo et al., 2003), который из-за схожести пространственной структуры, субстратной специфичности и способности к ингибированию некоторыми антибиотиками часто рассматривают в качестве бактериального аналога пассивного транспортера глюкозы млекопитающих – GLUT1, и АТФ-зависимый транспортер (ABC-транспортер) -метилгалактозидов MglABC - высокоаффинный переносчик, активный на завершающих стадиях культивирования при малых концентрациях глюкозы (Franchini and Egli, 2006). Было показано, что использование этих транспортных систем в дополнение к активной PTS позволяет увеличить выход целевого продукта при культивировании ряда штаммов-продуцентов E. сoli на средах с глюкозой.
Цель и задачи исследования
Основной целью настоящей работы являлся поиск PTS-независимых транспортеров сахаров E.coli, способных к переносу глюкозы внутрь клетки
Для достижения этой цели были поставлены следующие задачи:
- Разработка методического подхода к изучению процесса PTS-независимого транспорта глюкозы (на примере пермеазы галактозы GalP)
- Поиск и исследование транспортных систем E.coli, потенциально способных к транспорту глюкозы
- Исследование влияния этапа внутриклеточного фосфорилирования глюкозы на эффективность ее утилизации клеткой
- Использование систем PTS-независимого транспорта глюкозы при создании штаммов-продуцентов аминокислот.
Научная новизна и практическая ценность работы
На основании разработанного методического подхода впервые продемонстирована способность ряда PTS-независимых транспортных систем (XylE, FucP, AraFGH и AlsABC) переносить D-глюкозу в клетки E.coli. Показано, что увеличение активности глюкокиназы улучшает эффективность утилизации D-глюкозы при использования PTS-независимого пути ее транспорта; однако чрезмерное увеличение экспрессии генов, кодирующих PTS-независимый транспортер GalP и глюкокиназу Glk, приводит к ингибированию роста клеток штамма E.coli с неактивной PTS. Наблюдаемый эффект, по-видимому, связан с накоплением токсического для клетки количества фосфорилированных производных D-глюкозы вследствие дисбаланса между стадиями их синтеза и продуктивного вовлечения в клеточный метаболизм. Использование новых PTS-независимых транспортеров D-глюкозы, дополнительно к нативной фосфотрансферазной системе, увеличивает накопление и скорость синтеза ряда аминокислот соответствующими штаммами-продуцентами E.coli.
Результаты работы могут быть полезны при дальнейшем изучении систем транспорта углеводов, исследованных в данной работе, и процессов утилизации D-глюкозы клетками E.coli, а также найти практическое приложение в биотехнологии.
Апробация работы
Материалы диссертационной работы были доложены на V Съезде Вавиловского Общества Генетиков и Селекционеров (ВОГиС) (Москва, 21-27 июня 2009г.) и на смотре-конкурсе работ сотрудников ЗАО «АГРИ» (Москва, 16-17 июня 2010г.).
Диссертационная работа была апробирована на семинаре совместного заседания секций «Молекулярная биология» и «Генетика микроорганизмов»
Ученого Совета ФГУП «ГосНИИгенетика» и Научно-Технического совета НИИ «Аджиномото-Генетика» (ЗАО «АГРИ») 20 декабря 2010 года.
Публикации
По теме диссертации опубликовано шесть печатных работ; из них одна статья в журнале, входящем в список, рекомендованный ВАК, четыре патента и одно сообщение в материалах научной конференции.
Структура работы
Диссертация изложена на _ страницах печатного текста, включая _ рисунков и _ таблиц. Работа состоит из введения, обзора литературы, описания методов исследования, изложения и обсуждения экспериментальных данных, выводов и списка цитируемой литературы ( _ наименований).
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Разработка методического подхода для оценки способности PTS-независимых транспортных систем к переносу глюкозы на примере пермеазы галактозы GalP.
1.1. Обеспечение конститутивной экспрессии гена galP.
В E.coli экспрессия гена galP происходит с индуцируемого галактозой CRP-зависимого промотора, а, значит, при росте клеток дикого штамма на среде с глюкозой синтез транспортера подавлен. Для выявления способности GalP к транспорту глюкозы необходимо было обеспечить конститутивную экспрессию соответствующего гена в клетках. При этом следовало учитывать следующие факторы:
- сверхпродукция мембранного белка может быть губительна для клетки;
- недостаточно сильная экспрессия гена транспортера может затруднить оценку способности GalP к транспорту глюкозы.
В связи с этим осуществляли замену природного промотора гена galP в штамме MG1655 несколькими tac-подобными промоторами различной «силы» из библиотеки, полученной ранее путем рандомизации области «-35» сильного промотора Ptac (Каташкина и др., 2005).
Были выбраны три промотора:
1) высокоэффективный Ptac с канонической структурой областей «35» и «10»
2) Ptac3 - более «слабый» вариант Ptac с измененной областью «35».
3) PL-tac - более «сильный» гибридный промотор, полученный добавлением «upstream» области промотора PL (UP-elements) к Ptac по схеме, использованной ранее при конструировании гибридного промотора PLtrp.
Эффективность tac-подобных промоторов, определенная с использованием гена lacZ в качестве репортера (Каташкина и др., 2005), соотносится как:
{PL-tac} : {Ptac} : { Ptac3} 4.5: 3.0 : 1.0

Рис. 1. Схема замены промоторной области гена galP конститутивным промотором и структура tac-подобных промоторов.
Эксперименты по замене промотора в составе бактериальной хромосомы проводились с помощью метода, основанного на Red-зависимой системы рекомбинации бактериофага по методу, изложенному в работе (Datsenko, Wanner, 2000) с модификациями, разработанными в нашем Институте (Каташкина и др., 2005).
Отметим, что эти замены не затрагивали участок перед структурной частью гена, содержащий сайт связывания рибосомы (SD-последовательность). Схема замены природного промотора galP кассетой, содержащей один из выбранных синтетических промоторов, и структура промоторов tac-семейства изображены на Рис. 1.
1.2. Оценка способности пермеазы галактозы GalP к транспорту
D-глюкозы внутрь клетки.
Для исследования способности PTS-независимых транспортных систем к переносу глюкозы нами был сконструирован штамм MG1655 с неактивной PTS (делеция оперона ptsHIcrr, кодирующего общие компоненты PTS, а также глюкозоспецифический компонент ЕIIA), названный MGdel и далее используемый в качестве реципиентного штамма.
Регуляторная область гена galP в этом штамме была заменена тремя кассетами, содержащими промоторы tac-семейства. Полученные штаммы были исследованы на способность к росту в жидкой минимальной среде с глюкозой в качестве единственного источника углерода.
Как можно видеть на Рис. 2, замена нативного промотора гена galP любой из модификаций промотора Ptac приводило к восстановлению роста клеток MGdel на среде с глюкозой; при этом наблюдаемый эффект существенно не зависел от эффективности используемого промотора. Так, скорость роста штамма, содержащего перед геном galP самый «слабый» из промоторов Ptac3, была примерно равна скорости роста штамма, содержащего наиболее «сильный» промотор PL-tac.
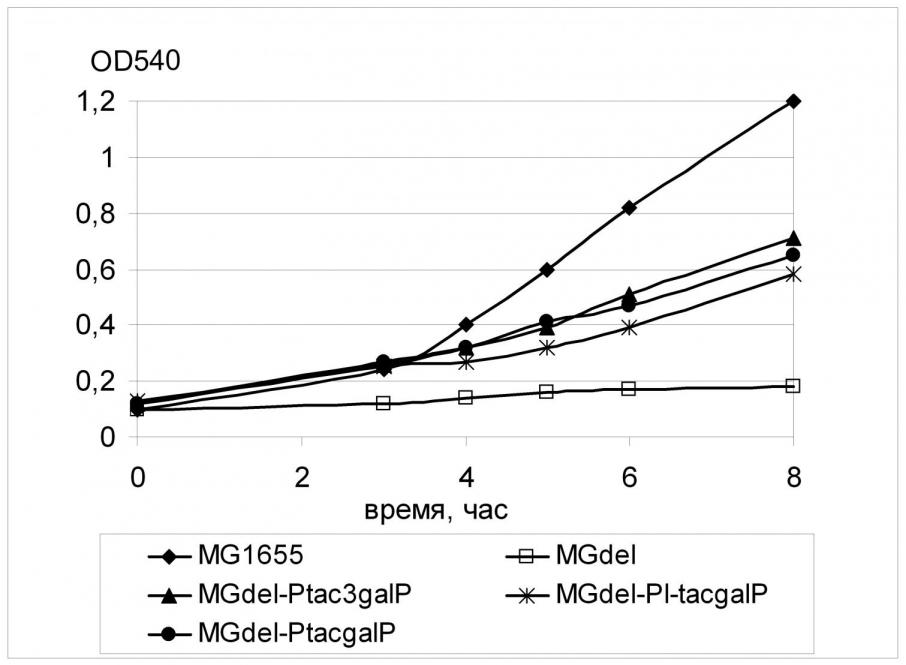
Вероятно, отсутствие зависимости скорости роста клеток от уровня экспрессии гена galP связано с тем, что промоторные модификации по тем или иным причинам (нестабильность мРНК, низкая эффективность трансляции, ограничения на встраивание белка в мембрану) не влияли на количество синтезируемого белка-транспортера и, как следствие, на перенос глюкозы через цитоплазматическую мембрану. Возможно также, при использовании сильных промоторов для экспрессии galP «узким местом» является уже не транспорт глюкозы в клетку, а одна из последующих стадий ее утилизации, в частности, фосфорилирование субстрата. Следующий этап работы был посвящен выяснению этого вопроса.
1.3. Изучение транспорта D-глюкозы в клетках дефектного по PTS штамма E.coli с разным уровнем экспрессии гена galP.

Исследование транспорта глюкозы внутрь клетки проводили с помощью флуоресцентного аналога глюкозы 2-NBDG (2-(N-(7-нитробензо-2-оксо-1,3-диазол-4-ил)амино)-2-деоксиглюкоза) (Yoshioka et al., 1996). Об эффективности переноса судили по интенсивности тушения флуоресценции в реакционной среде, содержащей культуру живых клеток исследуемого штамма.
Как можно видеть на Рис. 3, конститутивная экспрессии гена galP привело к увеличению скорости поглощения 2-NBDG клетками штамма MGdel. При этом скорость транспорта аналога была тем выше, чем более эффективный промотор использовался (Табл.2). Полученные результаты согласуются с данными об относительной «силе» tac-подобных промоторов и позволяют говорить о том, что отсутствие разницы в скорости роста штаммов с различным уровнем экспрессии galP связано с одним из этапов последующего метаболизма глюкозы, в частности, с недостаточной активностью её фосфорилирования.
Заметим, что даже штамм с наиболее «сильным» промотором PL-tac в скорости транспорта 2-NBDG заметно уступал штамму дикого типа с нативной фосфотрансферазной системой.
1.4. Влияние увеличения активности глюкокиназы на рост PTS- штамма E.coli с конститутивной экспрессией гена galP.
Известно, что в процессе PTS-независимого транспорта глюкоза поступает в клетки в нефосфорилированной форме и для дальнейшего метаболизма должна быть фосфорилирована. Давно известно (Asenio and Sols, 1958), что такое фосфорилирование у E. coli осуществляет глюкокиназа, кодируемая геном glk. Вероятно, усиление активности глюкокиназы в клетках, транспортирующих глюкозу через PTS-независимые системы, сможет ускорить рост таких клеток на среде с этим субстратом.
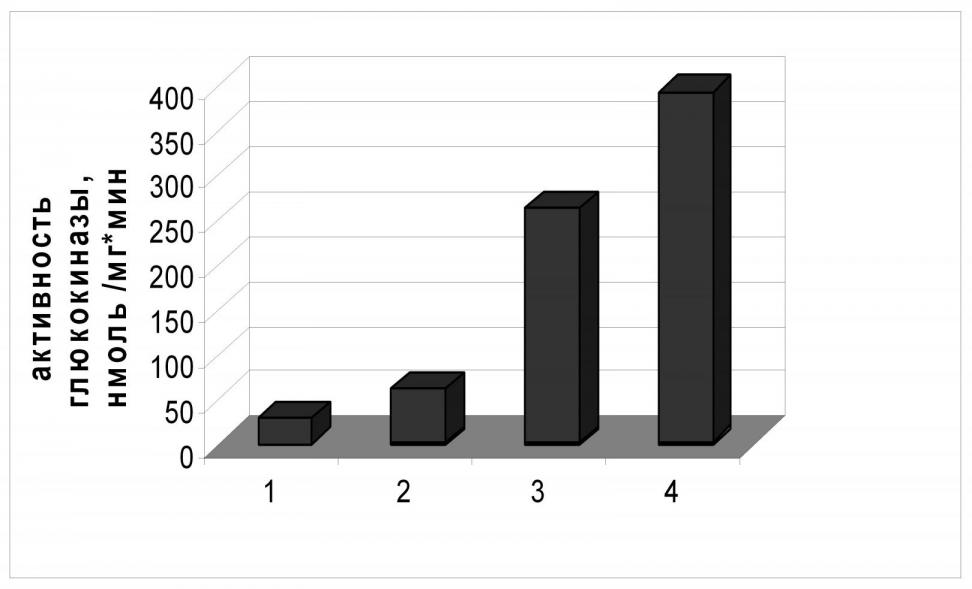
По схеме, ранее использованной для замены промоторной области гена galP, мы заменили природную регуляторную область glk в хромосоме E. coli MG1655 тремя tac-подобными промоторами разной силы. Активность глюкокиназы была определена в экстрактах полученных штаммов. Как можно видеть на Рис.4, для наиболее «сильного» промотора PL-tac активность глюкокиназы была более чем в 20 раз выше активности фермента в клетках штамма дикого типа; в случае наиболее «слабого» искусственного промотора Ptac3 уровень активности Glk примерно в 2,5 раза превышал исходный.
Все три промоторные модификации гена glk были перенесены трансдукцией в дефектные по PTS штаммы c различным уровнем экспрессии гена galP, после чего был проверен рост полученных клеток на среде с глюкозой.
Положительный эффект увеличения активности глюкокиназы был отмечен лишь в случае штамма, в котором транскрипция гена galP находилась под контролем наиболее «слабого» из tac-подобных промоторов Ptac3 (Рис.5). Скорость роста клеток возрастала с увеличением активности глюкокиназы, и при использовании наиболее «сильного» промотора PL-tac для экспрессии гена glk штамм имел скорость, приближающуюся к характерной для клеток дикого типа.

В то же время те штаммы, в которых galP выражался с более «сильных» промоторов Ptac и PL-tac, при увеличении активности глюкокиназы теряли способность к росту на среде с глюкозой (данные не приведены). Это явление может быть связано с токсичностью D-глюкозо-6-фосфата, который избыточно накапливается в клетках этих штаммов при росте их на глюкозе из-за несоответствия чрезмерно высокой эффективности синтеза этого соединения и его продуктивного вовлечения в клеточный метаболизм.
1.5. Влияние амплификации гена ybiV на рост штамма MGdel с сильной экспрессией генов galP и glk в минимальной среде с глюкозой.
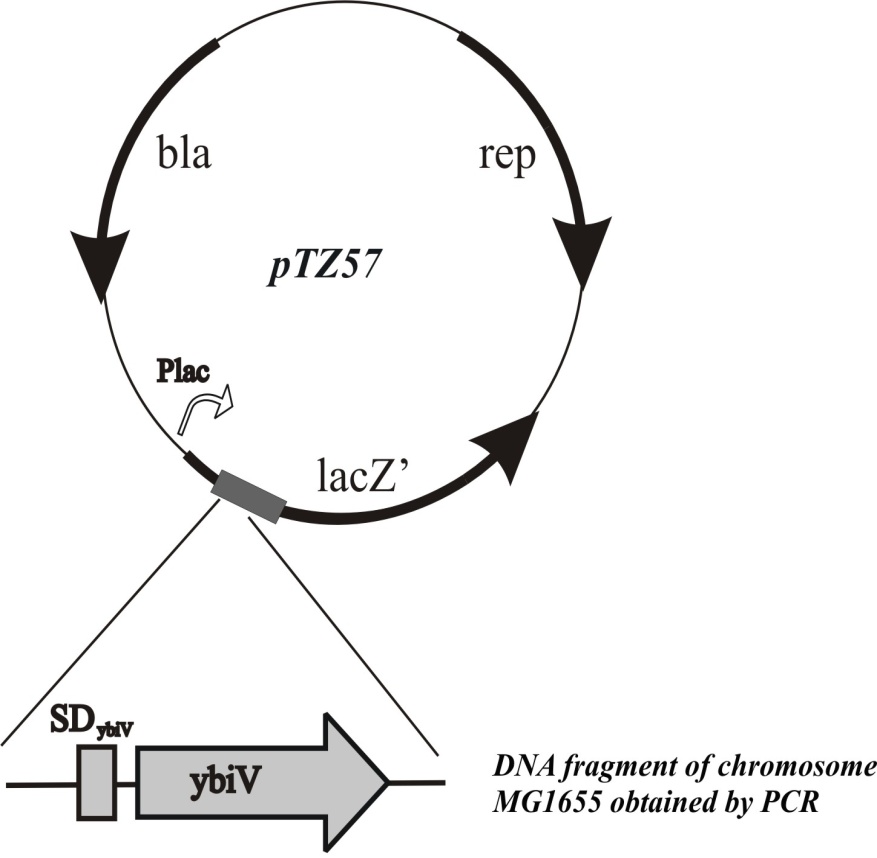
Хромосома E.coli содержит в своем составе ген ybiV, кодирующий белок, аннотированный как специфичная к фосфорилированным производным сахаров фосфатаза (Roberts et al., 2005). Мы предположили, что амплификация этого белка в штамме с сильной экспрессией генов galP и glk может привести к восстановлению роста клеток на среде с глюкозой вследствие гидролиза избыточного количества сахарофосфатов.
Ген ybiV был клонирован в составе мультикопийного вектора pTZ57 под контролем индуцибельного промотора Plac (Рис.6). Полученная гибридная плазмида была введена в клетки дефектного по PTS штамма, с высоким уровнем экспрессии генов galP и glk. После этого проверяли способность полученного плазмидного штамма к росту в жидкой минимальной среде с глюкозой.
Как можно видеть на Рис. 7, амплификация гена ybiV восстанавливала роста клеток штамма MGdelPLtacgalPPLtacglk в этих условиях. Полученный результат косвенно свидетельствует о том, что одновременная сильная экспрессия генов транспорта глюкозы и глюкокиназы подавляет рост клеток вследствие накопления в них токсичной концентрации фосфорилированных производных глюкозы. Этот факт, в свою очередь, показывает, что при использовании PTS-независимых путей транспорта необходимо соблюдать строгий баланс между скоростью поступления глюкозы внутрь клетки и её последующим метаболизмом.

Таким образом, из данных, полученных при исследовании пермеазы галактозы GalP, следует, что оценка способности той или иной транспортной системы к переносу глюкозы должна включать следующие этапы:
- Обеспечение конститутивной транскрипции соответствующего гена;
- Количественная оценка транспорта глюкозы внутрь клетки;
- Изучение влияния конститутивной экспрессии гена-транспортера, а также усиленного фосфорилирования сахара на рост PTS- штамма на среде с глюкозой.
2. Идентификация новых PTS-независимых систем транспорта углеводов, способных к переносу D-глюкозы внутрь клетки.
2.1. Выбор PTS-независимых транспортеров, потенциально способных к переносу D-глюкозы.
Для поиска новых PTS-независимых систем, способных к переносу глюкозы внутрь клетки, исследовались известные транспортеры моносахаров E.coli, и при этом были использованы следующие два критерия отбора:
- структурное сходство белка-транспортера с уже известными транспортерами GalP и MglABC
- сходство конформаций специфического и потенциального (D-глюкоза) субстратов.
В результате поиска были отобраны восемь потенциально способных к переносу глюкозы транспортных систем, четыре из которых принадлежат к H+-симпортерам MFS-семейства транспортеров, а четыре – к семейству АВС-транспортеров. Выбранные системы представлены в Табл. 3.
| Транспортный белок (система) | Семейство транспортеров/ переносимый сахар | Тип конформации углеводов | |
| 4C1 | 1C4 | ||
| XylE | H+ симпортер/ D-ксилоза | 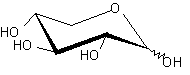 | - |
| FucP | H+ симпортер/ L-фукоза | - | |
| AraE | H+/ симпортер/ L-арабиноза | - | 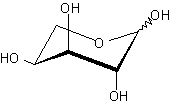 |
| RhaT | H+ симпортер/ L-рамноза | - | 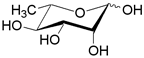 |
| XylFGH | ABC-транспортер/ D-ксилоза | 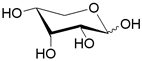 | - |
| AlsABC | ABC-транспортер/ D-алллоза | 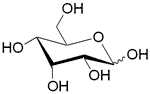 | - |
| AraFGH | ABC-транспортер/ D-арабиноза | 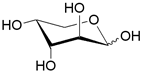 | - |
| RbsABCD | ABC-транспортер/ D-рибоза |  | - |
| PtsG | PTS/ D-глюкоза | - | |
2.2. Обоснование выбора XylE как потенциального транспортера глюкозы.
Наиболее полно обоим критериям отбора соответствовал транспортер D-ксилозы. Данное заключение основано, в первую очередь, на сходстве этого белка со структурой Н+-пермеазы галактозы GalP. Действительно, оба этих транспортера наряду с высокой гомологией аминокислотных последовательностей (которая составляет 34% идентичных аминокислотных остатков), имеют схожую мембранную топологию, включающую локализацию N- и С-концевых участков в цитоплазме, и состоят из 12 гидрофобных трансмембранных -спиралей с гидрофильным цитоплазматическим доменом из 50-60 аминокислот между 6-ым и 7-ым трансмембранными сегментами (ТМС). При этом наибольшая степень гомологии характерна именно для последовательностей ТМС (Рис. 8).
1 60
XylE (1) -----MNTQYNSSYIFSITLVATLGGLLFGYDTAVISGTVESLNTVFVAPQNLSESAANS
GalP (1) MPDAKKQGRSNKAMTFFVCFLAALAGLLFGLDIGVIAGALPFIADEFQITSHTQEWVVS-
Consensus (1) N N A F I LA LAGLLFG D AVIAG L I F E
61 120
XylE (56) LLGFCVASALIGCIIGGALGGYCSNRFGRRDSLKIAAVLFFISGVGSAWPELGFTSINPD
GalP (60) -------SMMFGAAVGAVGSGWLSFKLGRKKSLMIGAILFVAGSLFSAAAPN--------
Consensus (61) S L G IGA GW S K GRK SL IAAILF L SA
121 180
XylE (116) NTVPVYLAGYVPEFVIYRIIGGIGVGLASMLSPMYIAELAPAHIRGKLVSFNQFAIIFGQ
GalP (105) ----------VEVLILSRVLLGLAVGVASYTAPLYLSEIAPEKIRGSMISMYQLMITIGI
Consensus (121) V II RII GIAVGLAS APLYIAEIAP IRG LIS Q I G
181 240
XylE (176) LLVYCVNYFIARSGDASWLNTDGWRYMFASECIPALLFLMLLYTVPESPRWLMSRGKQEQ
GalP (155) LGAYLS--------DTAFSYTGAWRWMLGVIIIPAILLLIGVFFLPDSPRWFAAKRRFVD
Consensus (181) L Y D AF T AWRWM A IPAIL LI LF LPDSPRW AK K
241 300
XylE (236) AEGILRKIMGNTLATQAVQEIKHSLDHGRKTGGRLLMFG--VG-VIVIGVMLSIFQQFVG
GalP (207) AERVLLRLRDTSAEAKRELDEIRESLQVKQSGWALFKENSNFRRAVFLGVLLQVMQQFTG
Consensus (241) AE IL KI S D K SG L I IGVLL I QQF G
301 360
XylE (293) INVVLYYAPEVFKTLGAS-TDIALLQTIIVGVINLTFTVLAIMTVDKFGRKPLQIIGALG
GalP (267) MNVIMYYAPKIFELAGYTNTTEQMWGTVIVGLTNVLATFIAIGLVDRWGRKPTLTLGFLV
Consensus (301) INVILYYAP IF G S T L TIIVGL NL T IAI VDKFGRKP IG L
361 420
XylE (352) MAIGMFSLGTAFYT----QAPGIVALLSMLFYVAAFAMSWGPVCWVLLSEIFPNAIRGKA
GalP (327) MAAGMGVLGTMMHIGIHSPSAQYFAIAMLLMFIVGFAMSAGPLIWVLCSEIQPLKGRDFG
Consensus (361) MA GM LGT H A AI LL FI AFAMS GPL WVL SEI P R A
421 480
XylE (408) LAIAVAAQWLANYFVSWTFPMMDKNSWLVAHFHNGFSYWIYGCMGVLAALFMWKFVPETK
GalP (387) ITCSTATNWIANMIVGATFLTMLN------TLGNANTFWVYAALNVLFILLTLWLVPETK
Consensus (421) I A A NWIAN V TF M NA SFWIYA L VL L VPETK
481 504
XylE (468) GKTLEELEALWEPETKKTQQTATL
GalP (441) HVSLEHIERNLMKGRKLREIGAHD
Consensus (481) SLE IE K A
Рис. 8. Выравнивание аминокислотных последовательностей генов xylE и galP E.coli. Рамками обозначены последовательности ТМС (pdbtm.enzim.hu).
Помимо структурного сходства белков-транспортеров, о сходстве функций может говорить и конформационное подобие специфических (D-галактоза, D-ксилоза) и потенциального (D-глюкоза) субстратов (Табл.3). Наиболее энергетические выгодные конформации D-глюкозы, D-галактозы, D-ксилозы принадлежат к 4С1 конформации типа «кресло» пиранозного цикла, поскольку именно в этом случае минимальна энергия невалентных взаимодействий между отдельными заместителями. Отметим, что и в случае D-ксилозы, и в D-глюкозе все объемные группы (гидроксилы и оксиметильная группировка в D-глюкозе) находятся в экваториальном положении, что делает эти два сахара похожими друг на друга.
Совокупность этих данных указывает на XylE, как на наиболее вероятный транспортер глюкозы, поэтому на его изучении мы остановились более подробно.
2.3. Изучение роста PTS- штамма E.coli с различным уровнем экспрессии гена xylE на среде с глюкозой
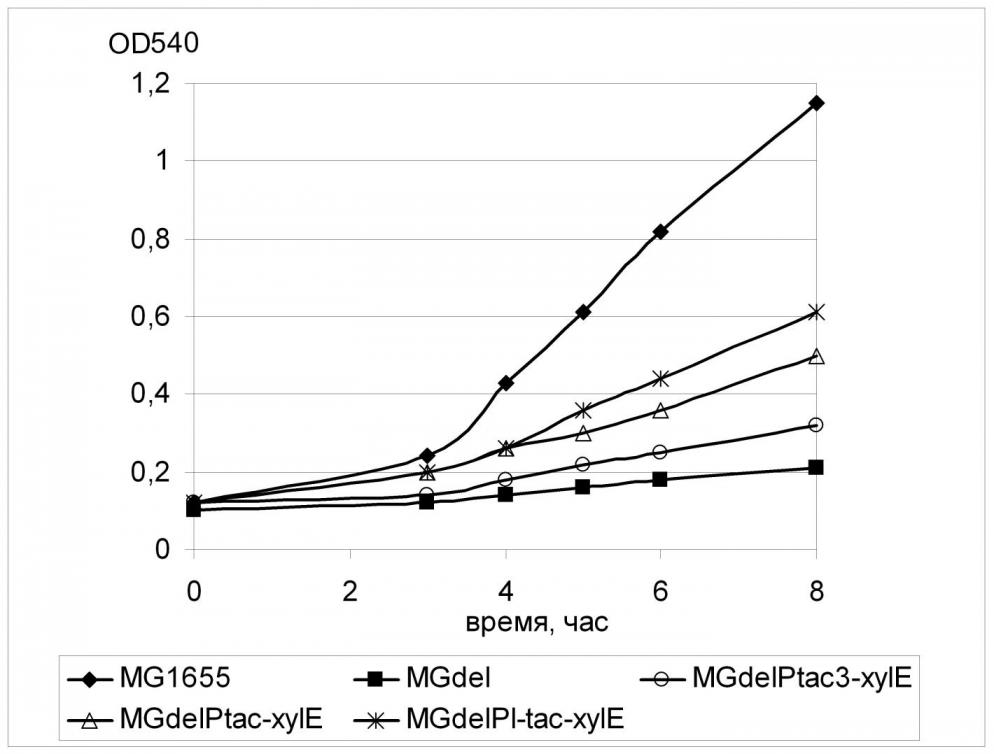
Для обеспечения конститутивной транскрипции гена xylE была использована та же схема, что применялась ранее для гена galP. Регуляторная область xylE в штамме MGdel была заменена набором промоторов tac-семейства (tac3, tac, L-tac). Полученные штаммы были исследованы на способность к росту в жидкой минимальной среде с глюкозой в качестве единственного источника углерода.
| Штамм | Скорость роста µ, час-1 |
| MG1655 | 0,44 ± 0,1 |
| MGdel | 0,03 |
| MGdel- Ptac3galP | 0,26 ± 0,05 |
| MGdel- Ptac3xylE | 0,16 ± 0,05 |
| MGdel- PtacxylE | 0,22 ± 0,05 |
| MGdel- PLtacxylE | 0,25 ± 0,05 |
Как можно видеть на Рис. 9, присутствие любой из использованных промоторных модификаций гена xylE приводило к восстановлению роста PTS-дефектного штамма на глюкозе, причем наблюдаемый эффект был тем более выражен, чем более эффективный промотор использовался для транскрипции xylE. Так, величина скорости роста для клеток, содержащих наиболее «сильный» из используемых промоторов составляла 0.25 (час-1) и была в полтора раза выше величины, измеренной для клеток штамма с наиболее «слабым» промотором Ptac3 (0.16 час-1). Однако, во всех случаях скорость роста штамма дикого типа (0.44 час-1) достигнута не была. Тем не менее, полученный результат означает принципиальную способность транспортера ксилозы ХylE к переносу глюкозы внутрь клетки.
Заметим, что скорость роста штамма с наиболее сильной экспрессией гена xylE была примерно равна скорости роста, рассчитанной ранее для клеток с наименьшей экспрессией galP (Табл.4), что может говорить о различии в специфичности двух исследуемых транспортных белков, ХylE и GalP, к D-глюкозе.
2.4. Исследование транспорта глюкозы клетками PTS- штамма с конститутивной экспрессией гена xylE.
О том, что XylE обеспечивает транспорт 2-NBDG, а значит и глюкозы, свидетельствует следующий, обнаруженный нами, факт: присутствие в реакционной среде нефлуоресцирующего субстрата - D-глюкозы, приводит к снижению транспорта аналога в клетку и, как следствие, к заметному ослаблению эффекта тушения флуоресценции. Это возможно только в случае конкуренции двух этих соединений за связывание с белком-транспортером (Рис. 10). Кроме того, в обоих случаях имело место стереоспецифическое ингибирование транспорта 2-NBDG – D-форма глюкозы подавляла поглощение аналога, в то время как присутствие L-формы в реакционной смеси никак не сказывалось на транспорте 2-NBDG.
К аналогичному результату приводит и внесение в реакционную среду специфического для XylE сахара - D-ксилозы, что также подтверждает факт переноса аналога через транспортную систему XylE.

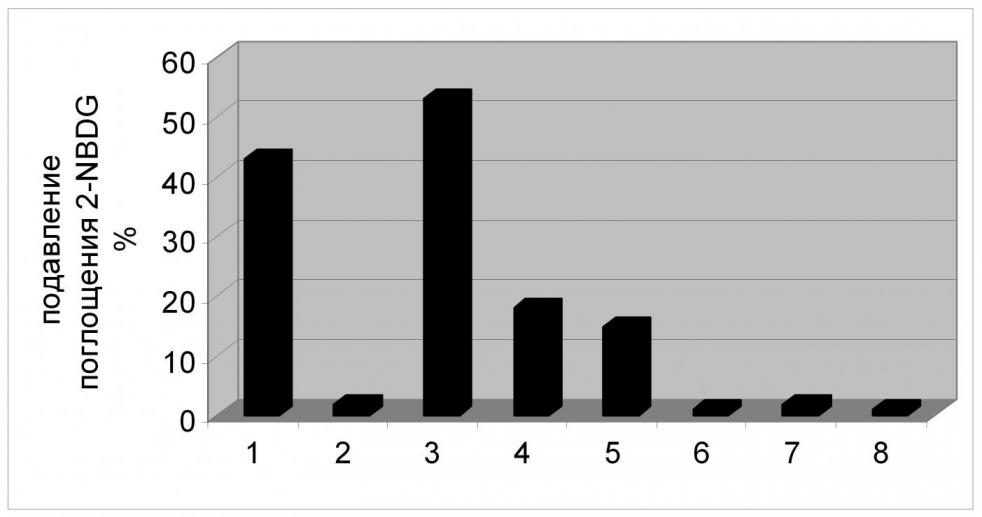
С другой стороны, некоторые другие сахара, будучи добавленными в реакционную смесь, также оказывали влияние на перенос аналога внутрь клетки. Транспорт 2-NBDG через XylE в разной степени был снижен в присутствии D-галактозы и L-арабинозы (Рис. 10), что может говорить о потенциальной способности XylE к транспорту и этих соединений.
Как упоминалось ранее, XylE относится к семейству H+-симпортеров, а значит, использует для транспорта субстрата электрохимическую энергию протонного потенциала, присутствующего на цитоплазматической мембране. При добавлении протонного разобщителя, к примеру, карбонилцианид-m-хлорфенилгидразона (СССР), функция этого белка должна подавляться (Landgraf et al, 1996). Действительно, как можно видеть на Рис. 11, транспорт глюкозы в присутствии СССР сильно снижен в клетках PTS- штамма с конститутивной экспрессией xylE, тогда как уровень транспорта в клетках контрольного штамма MG1655 остался неизменным. Этот факт служит ещё одним доказательством переноса глюкозы именно с помощью протон-зависимымой транспортной системой XylE.
Заметим, что, как и в опыте, описанном ранее для пермеазы галактозы GalP, обеспечение конститутивной экспрессии гена xylE не только привело к увеличению скорости поглощения 2-NBDG клетками штамма MGdel, но и обнаружило зависимость ее от эффективности промотора, используемого для экспрессии гена транспортера. (Рис. 12). Однако при этом скорость транспорта 2-NBDG в клетках с сильной экспрессией xylE совпадает со скоростью поглощения его клетками с наименьшей экспрессией GalP (Табл. 5), что также может свидетельствовать о меньшем сродстве XylE к глюкозе.
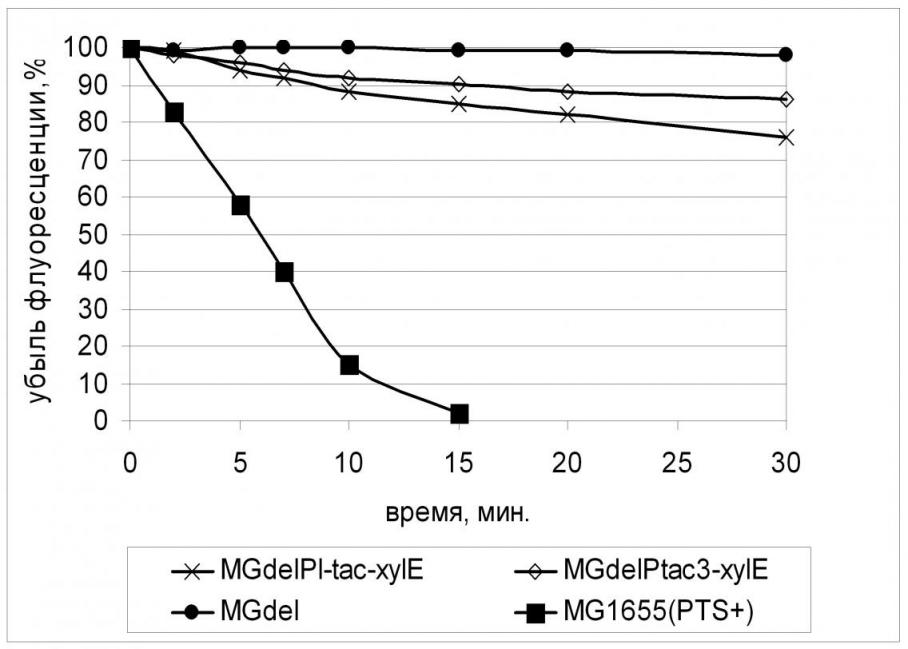
2.5. Влияние увеличения активности глюкокиназы на рост PTS- штамма с конститутивной экспрессией гена xylE.
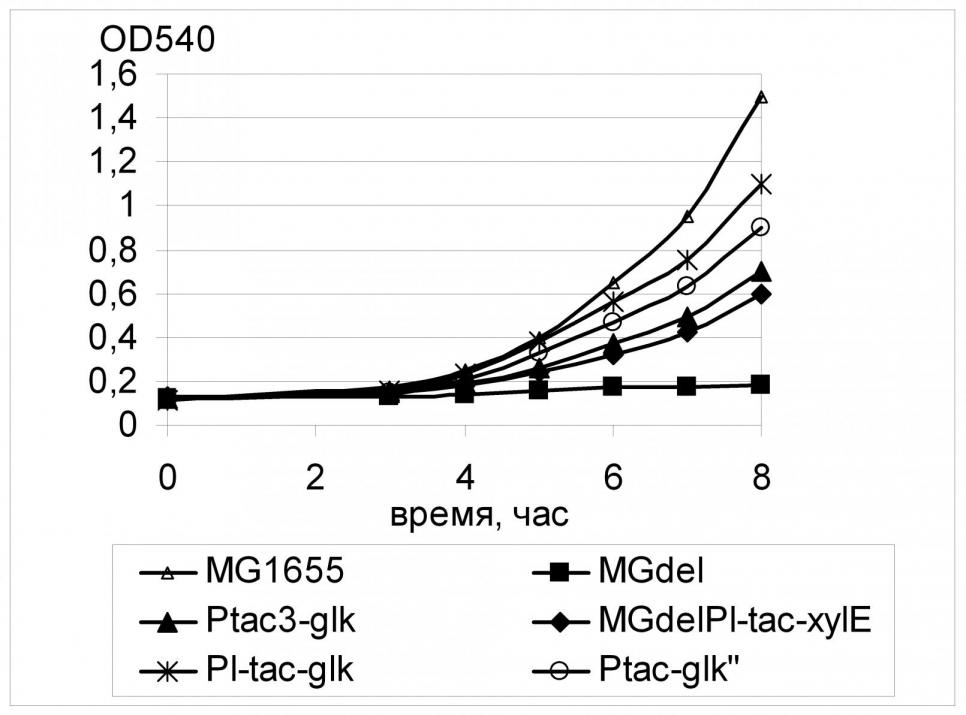
О меньшей, по сравнению с GalP, специфичности XylE к глюкозе свидетельствуют и результаты эксперимента по увеличению активности глюкокиназы в штаммах MGdel с различным уровнем экспрессии хylE. Было показано, что в этом случае увеличение активности глюкокиназы даже в штамме с сильной экспрессией гена транспортера не приводило к ингибированию роста на глюкозе и гибели клеток; более того, с увеличением активности фосфорилирования было отмечено последовательное увеличение скорости роста штаммов на среде с глюкозой (Рис. 13). Так, наилучший рост наблюдался для штамма с максимальным уровнем экспрессии обоих генов - xylE, и glk: в этом случае расчетный параметр скорости = 0,40 час-1 составлял около 90% от скорости роста штамма дикого типа в тех же условиях.
2.6. Оценка способности других PTS-независимых транспортеров сахаров к переносу D-глюкозы внутрь клетки.
Аналогичный, но более простой, подход использовался нами для исследования транспорта глюкозы другими выбранными нами PTS-независимыми системами (Табл. 3).
Для оценки способности выбранных нами транспортеров к переносу глюкозы была проведена Red-зависимая замена регуляторных областей соответствующих генов на синтетический промотор PL-tac на хромосоме штамма MGdel по схеме, аналогичной схеме замены регуляторной области гена galP. Штаммы с конститутивной экспрессией генов fucP, alsABC, araFGH показали эффективный рост на глюкозе, уступая, однако, аналогичным вариантам с конститутивной транскрипцией galP или xylE (Рис. 14, 15). Поскольку в этой работе был использован только один конститутивный промотор PL-tac, уровень экспрессии этих генов мог быть не оптимален, поэтому полученный результат означает лишь принципиальную способность соответствующих белковых продуктов обеспечивать транспорт глюкозы, достаточный для роста клеток E. coli.
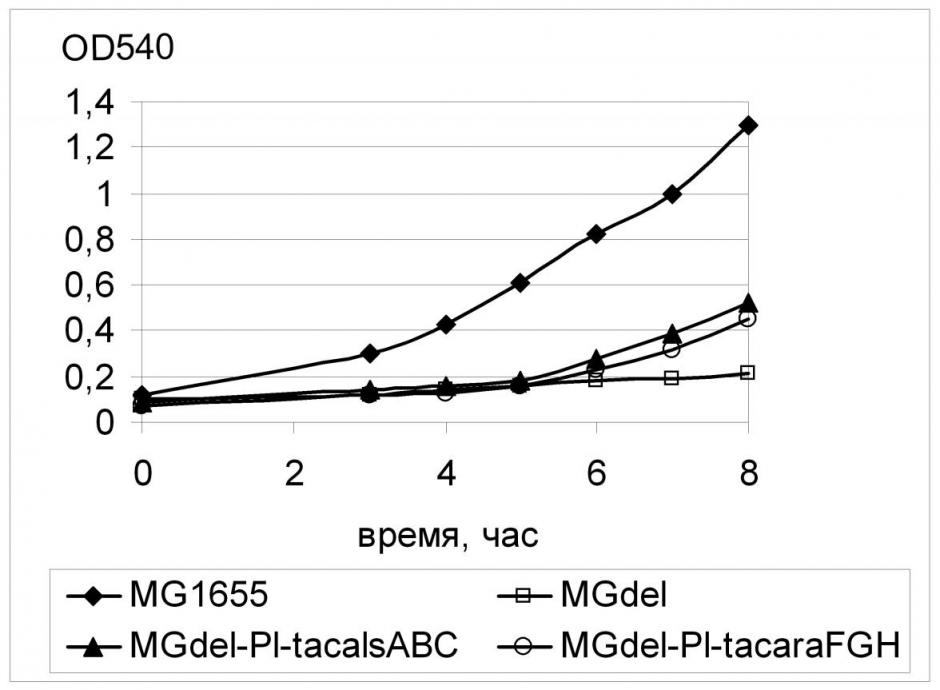

В свою очередь, штаммы c конститутивной экспрессией arаЕ, rhaT, rbsABC, xylFGH, как и контрольный PTS--штамм MGdel, не были способны к выраженному росту на среде с глюкозой. Нельзя было исключать, однако, что при конститутивном синтезе этих генов с сильного промотора PL-tac поток глюкозы в клетку уже настолько велик, что даже природный уровень активности глюкокиназы обеспечивает токсичные для клетки количества D-глюкозо-6-фосфата. Для проверки этого предположения на основе названых штаммов были созданы их Ptac3-варианты с пониженной экспрессией гена-транспортера, после чего клетки были проверены на способность к росту на минимальной среде с глюкозой. Заметный рост таких штаммов обнаружен не был, что говорит, по-видимому, о неспособности транспортеров АraЕ, RhaT, RibABCD и XylFGH к переносу D-глюкозы, поэтому в дальнейшем эти транспортеры нами не исследовались.
2.7. Исследование транспорта глюкозы клетками PTS- штамма с конститутивной экспрессией генов alsABC, araFGH, fucP.
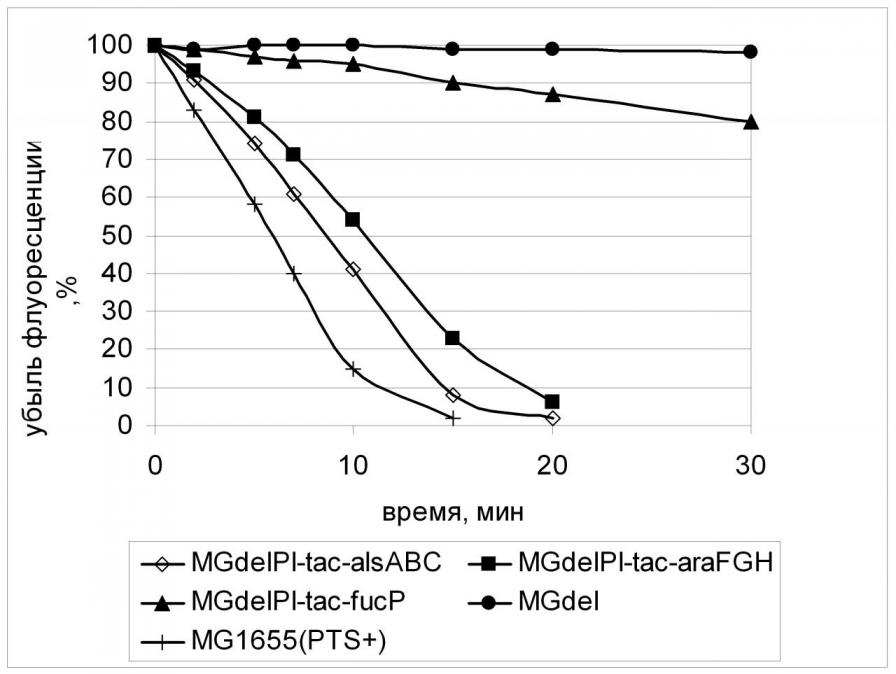
При изучении транспорта 2-NBDG в клетках с конститутивной экспрессией alsABC, araFGH, fucP применялись подходы, аналогичные тем, что были использованы при исследовании XylE. Добавление в реакционную среду специфического для данного транспортера субстрата, а также D-глюкозы приводило к ингибированию транспорта аналога внутрь клеток с конститутивной экспрессией генов PTS-независимых транспортеров. Причем, этот эффект носил стереоспецифический характер (Рис.16). Подобный же эффект вызывало присутствие в реакционной среде некоторых других сахаров, что, вероятно, говорит о способности АlsABC, АraFGH, FucP к их транспорту. В частности, D-ксилоза может служить субстратом для АraFGH.
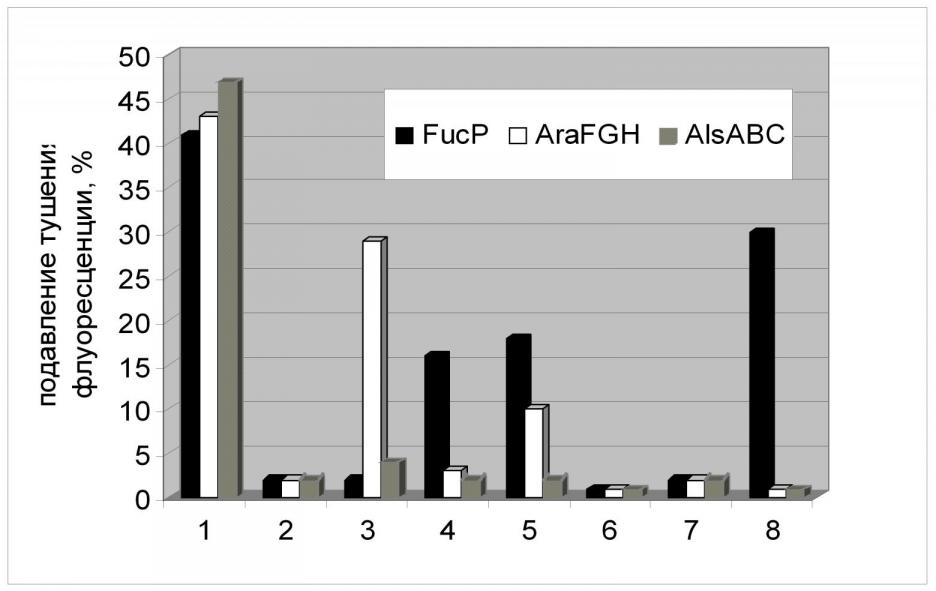
Следует отметить интересный факт - скорость поглощения аналога глюкозы через FucP была сравнима со скоростью, рассчитанной для ХуlE, что согласуется с данными о скорости роста соответствующих штаммов. (Рис. 17, Табл. 6). В это же время скорость транспорта 2-NBDG АВС-зависимыми транспортерами АlsABC и АraFGH была гораздо более высока и сравнима со скоростью, рассчитанной для штамма дикого типа с нативной фосфотрансферазной системой. Этот факт не согласуется с данными о скоростях роста соответствующих штаммов и мы не имеем пока объяснения этому феномену. Возможно, дело в структуре транспортных систем и использовании различных источников энергии для процесса транспорта. Изучение этого вопроса является предметом наших дальнейших исследований.
| Штамм | Скорость поглощения 2-NBDG, нмоль/мин. |
| MG1655 | 0,65 ± 0,05 |
| MGdel-GalP | 0,16 ± 0,03 |
| MGdel-XylE | 0,10 ± 0,01 |
| MGdel-FucP | 0,08 ± 0,01 |
| MGdel-AraFGH | 0,30 ± 0,03 |
| MGdel-AlsABC | 0,40 ± 0,03 |
3. Влияние PTS-независимого транспорта глюкозы на синтез некоторых аминокислот штаммами-продуцентами.
Как было отмечено во введении, использование PTS-независимого транспорта для переноса глюкозы в клетку может повысить уровень синтеза ряда аминокислот клетками штаммов-продуцентов в связи с экономией фосфоенолпирувата и, как следствие, увеличением его потока в биосинтетические пути. Очевидно этот эффект может иметь место в тех продуцентах, где РЕР является непосредственным предшественником целевой аминокислоты, а именно, при синтезе аминокислот ароматического ряда и членов семейства аспарагиновой кислоты и L-аспарагина.
В нашей работе мы исследовали влияние конститутивного PTS-независимого транспорта глюкозы на синтез L-фенилаланина и L-треонина соответствующими штаммами-продуцентами. В клетках штаммов AJ12739 (продуцент L-фенилаланина) и В3996 (продуцент L-треонина) конститутивным промотором PL-tac были заменены регуляторные области одного из четырех транспортеров моносахаров, показавших способность к переносу глюкозы: FucP, XylE, AraFGH и AlsABC. Полученные штаммы культивировали на соответствующих ферментационных средах в течение 48-72 часов и измеряли накопление целевой аминокислоты в культуральной жидкости. Результаты экспериментов представлены в Табл. 7 и Табл. 8.
| Штамм | OD540 | L-фенилаланин | |
| г/л | % | ||
| AJ12739 | 14,7 ± 0,3 | 1,9 ± 0,1 | 100 |
| AJ12739PL-tacfucP | 14,1 ± 0,3 | 2,3 ± 0,1 | 121 |
| AJ12739PL-tacxylE | 14,2 ± 0,3 | 2,4 ± 0,1 | 126 |
| Штамм | OD540 | L-треонин | |
| г/л | % | ||
| B-3996 | 15,5 ± 0,3 | 16,0 ± 0,2 | 100 |
| B-3996 PL-tacfucP | 17,4 ± 0,2 | 19,4 ± 0,2 | 121 |
| B-3996 PL-tacxylE | 19,2 ± 0,2 | 22,4 ± 0,2 | 140 |
Использование PTS-независимого транспорта глюкозы, помимо экономии PEP, может быть выгодно для штаммов, у которых непосредственное поступление глюкозы в клетку является «узким местом» всех последующих метаболических процессов. Иллюстрацией тому служит изменение скорости синтеза L-треонина в клетках штамма В-3996 при дополнении активной PTS альтернативным PTS-независимым путем транспорта глюкозы в клетку за счет конститутивной экспрессии генов xylE либо fucP. Как видно на Рис. 18, накопление треонина такого рода штаммами в течение всего процесса ферментации происходит быстрее, чем накопление этой аминокислоты реципиентным штаммом с неактивным PTS-независимым транспортом.
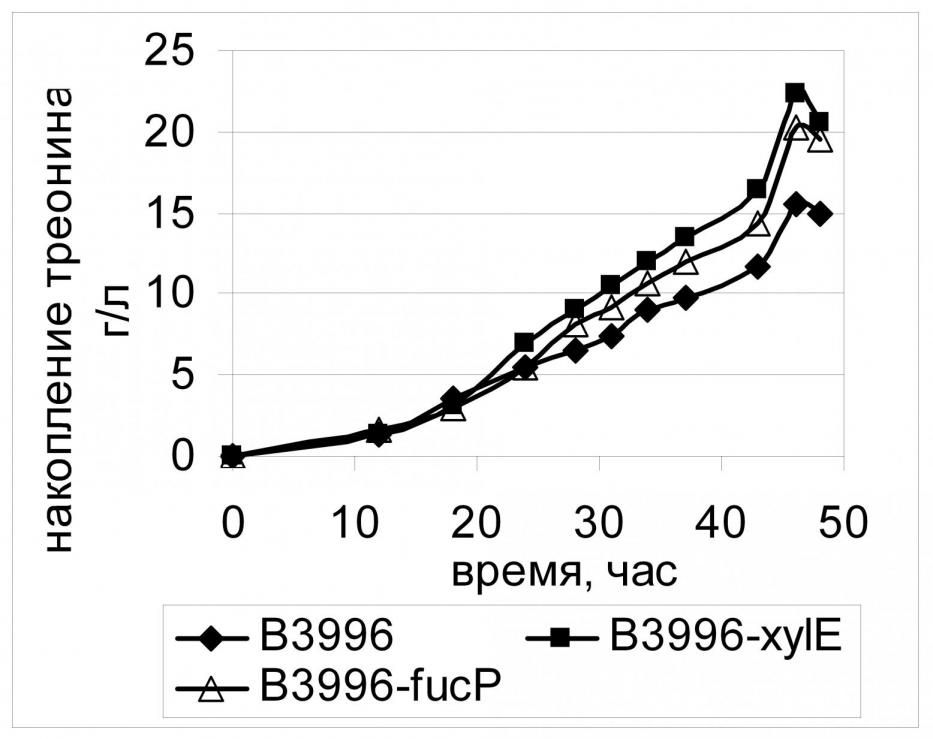
Конститутивная экспрессия генов PTS-независимого транспорта действительно приводит к увеличению накопления ряда аминокислот в ферментационной среде при культивировании соответствующих штаммов-продуцентов, однако, этот эффект имеет избирательный характер. Очевидно, это связано с разной эффективностью работы исследуемых транспортеров, а также с тем, достигнуто или нет в клетке оптимальное соотношение концентраций РЕР/пируват. Для обеспечения максимального эффекта использования PTS-независимых транспортеров глюкозы, по-видимому, необходимо тонкое регулирование уровня экспрессии соответствующих генов.
Выводы:
- Разработан методический подход, позволяющий оценивать способность различных PTS-независимых транспортеров углеводов переносить в клетки E.coli глюкозу.
- На основании разработанного подхода впервые продемонстрирована способность 4-х транспортных систем (XylE, FucP, AraFGH и AlsABC) переносить D-глюкозу в клетки E.coli при конститутивной экспрессии кодирующих их генов.
- Обнаружено, что чрезмерное увеличение экспрессии генов, кодирующих PTS-независимый транспортер GalP и глюкокиназу Glk, приводит к ингибированию роста штамма E. coli с неактивной PTS. Это явление, вероятно, связано с накоплением в клетках высоких концентраций фосфорилированных производных D-глюкозы вследствие дисбаланса между стадиями их синтеза и продуктивного вовлечения в клеточный метаболизм.
- Показано, что использование новых PTS-независимых транспортеров D-глюкозы, дополнительно к нативной фосфотрансферазной системе, увеличивает накопление и скорость синтеза ряда аминокислот соответствующими штаммами-продуцентами E.coli.
Список печатных работ, опубликованных по теме диссертации:
1. Рыбак К.В., Сливинская Е.А., и др. Способ получения L-аминокислот с использованием бактерии, принадлежащей к семейству Enterobacteriaceae (XylE). Патент РФ №2304615. Выдан 20.08.2007.
2. Сливинская Е.А., Рыбак К.В., Каташкина Ж.И., Машко С.В., Козлов Ю.И. «Конститутивный синтез в Escherichia coli низкоафинных Н+-симпортеров D-галактозы (GalP), D-ксилозы (XylE) или L-фукозы (FucP) приводит к возможности эффективного роста PTS-штаммов на среде с D-глюкозой» Биотехнология, 2007, №5, 24-37.
3. Рыбак К.В., Сливинская Е.А., и др. Способ получения L-аминокислот с использованием бактерии, принадлежащей к семейству Enterobacteriaceae (FucPIKUR). Патент РФ № 2318870. Выдан 10.03.2008.
4. Рыбак К.В., Сливинская Е.А., и др. Способ получения L-аминокислот с использованием бактерии, принадлежащей к семейству Enterobacteriaceae (AraFGH). Патент РФ №2338783. Выдан 20.11.2008.
5. Рыбак К.В., Сливинская Е.А., и др. Способ получения L-аминокислот с использованием бактерии, принадлежащей к семейству Enterobacteriaceae (AlsABC). Патент РФ №2351646. Выдан 10.04.2009.
6. Сливинская Е.А., Рыбак К.В., Шереметьева М.Е., Машко С.В., Козлов Ю.И. «Влияние конститутивного синтеза Н+-симпортеров некоторых моносахаридов на потребление D-глюкозы клетками E.coli». Материалы 5-го Конгресса Вавиловского Общества Генетиков и Селекционеров, 21-27.06.2009.

