Особенности метаболизма и кинетики сократительных белков скелетных мышц голени в условиях репаративной регенерации костной ткани
На правах рукописи
Гайдышев Альберт Игоревич
ОСОБЕННОСТИ МЕТАБОЛИЗМА И КИНЕТИКИ СОКРАТИТЕЛЬНЫХ БЕЛКОВ СКЕЛЕТНЫХ МЫШЦ ГОЛЕНИ В УСЛОВИЯХ РЕПАРАТИВНОЙ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ
03.01.04 – биохимия
АВТОРЕФЕРАТ
Диссертации на соискание ученой степени
кандидата биологических наук
Казань – 2012
Работа выполнена в Федеральном государственном бюджетном учреждении «Российский научный центр «Восстановительная травматология и ортопедия» им. академика Г.А. Илизарова» Министерства здравоохранения и социального развития Российской Федерации
Научный руководитель:
Доктор биологических наук, профессор С.Н. Лунева
Официальные оппоненты:
Шакирова Фаина Владимировна- доктор ветеринарных наук, Казанская государствен- ная академия ветеринарной медицины им.Н.Э.Баумана, старший преподаватель.
Шалабодов Александр Дмитриевич доктор биологических наук, профессор, Тюменский государственный университет, профессор.
Ведущая организация:
ГБОУ ВПО Государственный университет физической культуры, г. Челябинск
Защита диссертации состоится: «29» марта 2012 в 13.00 часов на заседании диссертационного совета Д 212.081.08 Казанского (Приволжского) федерального университета (420008, Казань ул. Кремлевская, 18)
С диссертацией можно ознакомиться в Научной библиотеке имени Н.И. Лобачевского Казанского (Приволжского) федерального университета (420008, Казань, ул. Кремлевская, д. 35.)
Автореферат разослан «13» января 2012
Ученый секретарь диссертационного совета,
профессор Абрамова З.И.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Репаративные возможности мышечной ткани принципиально отличаются от репаративных возможностей других опорных тканей, в связи с чем, в большинстве случаев, функциональное состояние скелетных мышц является определяющим в процессе лечения и реабилитации ортопедо-травматологических больных (Шевцов В.И., 1997). Возможность решения этой проблемы тесно связана с наличием надежных критериев, оценивающих состояние скелетных мышц, способных дать лечащему врачу возможность оценить их метаболический статус и ввести в случае необходимости соответствующие корректировки на этапах лечения (Стогов М. В., Кузнецова Л.С., Ерофеев С.А., 2001). В ортопедии и травматологии наиболее распространенным является повреждение мышечного волокна в процессе оперативного удлинения и травм, таких как обширные повреждения мышечного волокна, разрывы и микроразрывы, связанные со спортивными травмами (Шевцов В.И., Чикорина Н.К., Ерофеев С.А., 2000). Представленные в литературе данные физиологических, морфологических и гистохимических исследований создают достаточно полное представление о функциональных и структурных изменениях, происходящих в скелетных мышцах при их репаративной регенерации в результате скелетных травм, а также в условиях оперативного удлинения (Сайфутдинов М.С., Менщикова Т.И., Чикорина Н.К., 2008). Однако для более полной картины происходящих процессов биохимических исследований метаболизма скелетных мышц в тех же условиях проведено недостаточно. Так, в настоящее время практически не изучены изменения активности двигательных белков в мышцах оперированных конечностей (Щуров В.А., Колчева О.В., Щуров И.В., 2007). При этом недостаток фактического материала о биохимии мышц в процессе регенерации не позволяет делать выводы о целесообразности проведения коррекций метаболических изменений, происходящих с мышцами в послеоперационный период. В этой связи особый интерес представляет изучение изменений, происходящих с двигательными белками в процессе лечения аппаратом Илизарова. Исходя из изложенного выше, была поставлена следующая цель:
Цель исследования: Охарактеризовать кинетику белков экстрагируемых 0,6М раствором KCl из скелетных мышц собак, при оперативном удлинении голени и при моделировании оскольчатого перелома костей голени в условиях применения метода чрезкостного остеосинтеза по Илизарову.
Задачи исследования:
- Изучить особенности АТФ-азной активности белков экстрагируемых 0,6М раствором KCl из скелетных мышц голени взрослых беспородных собак при удлинении аппаратом Илизарова.
- Исследовать особенности изменений креатинкиназной и лактатдегидрогеназной активности белков экстрагируемых 0,6М раствором KCl из скелетных мышц голени взрослых беспородных собак при удлинении аппаратом Илизарова.
- Изучить особенности АТФ-азной активности белков экстрагируемых 0,6М раствором KCl из скелетных мышц голени взрослых беспородных собак при моделировании оскольчатого перелома костей голени с последующим лечением аппаратом Илизарова.
- Исследовать особенности изменений креатинкиназной и лактатдегидрогеназной активности белков экстрагируемых 0,6М раствором KCl из скелетных мышц голени взрослых беспородных собак при моделировании оскольчатого перелома костей голени с последующим лечением аппаратом Илизарова.
- Определить сроки восстановления кинетики белков экстрагируемых 0,6М раствором KCl из скелетных мышц собак после оперативного вмешательства.
Научная новизна работы. Впервые показано, что при повреждениях мышечного волокна, вызванного удлинением и травмой конечности, наряду с изменениями кинетических показателей АТФ-азной активности препарата миозина происходило изменение его ЛДГ и КК активности как в процессе удлинения, так и при лечении переломов голени. Изменения показателей ферментативной активности миозина скелетных мышц сопровождаются изменениями концентраций продуктов перекисного окисления белка как в мышцах оперированной конечности, так и в мышцах контралатеральной конечности, а также в сыворотке крови, и носят системный характер. При исследовании кинетических показателей препарата миозина был выявлен эффект повышения Vmax как в оперированной, так и в контралатеральной конечности. Этот эффект проявлялся системно и оказывал действие на весь организм в целом. Как в случае травмы, так и в случаи оперативного удлинения наблюдается повреждение мышечных волокон, и механизмы их репаративного восстановления принципиально не отличаются. Механизм компенсации ферментативной активности в обоих случаях сводится к изменениям белковых молекул по средством их перекисного окисления с последующей модификацией.
Практическая значимость работы. Обнаружено, что при удлинении конечности и травме, с точки зрения гидролиза АТФ миозином, происходит увеличение сродства фермента к субстрату, и как следствие этого, интенсификация потребления субстрата. В посттравматический период общее снижение сократительной способности скелетных мышц после травм не связано со снижением сродства миозина к АТФ. Показано, что снижение ЛДГ и КК активности на начальных этапах лечения обусловлено не столько изменениями соответствующих центров белковых молекул, сколько вымыванием ферментов из мышц вследствие разрывов мышечного волокна и попаданием ферментов в цитоплазму. Выявлено, что при травме и удлинении наблюдаемый рост активности белка был спровоцирован модификацией белковых молекул, что подтверждается высоким уровнем Vmax реакции и низким значением константы Михаэлиса в период окончания фиксации и после снятия аппарата Илизарова. В результате разрушения модифицированных белковых молекул наблюдалось снижение активности ферментов. Обнаружено, что способствующие модификации белковых молекул реакции перекисного окисления относятся к реакциям неспецифического ответа ткани на внешнее воздействие, затрагивающие не только поврежденные участки мышечной ткани, но и весь организм в целом.
Апробация работы и публикация результатов. Материалы диссертации доложены на научно-практической конференции «Актуальные вопросы ветеринарной хирургии», Курган, 2006; всероссийской научно-практической конференции «Клеточные и нанотехнологии в биологии и медицине», Курган, 2007; международной научно-практической конференции «5th Meeting of the A.S.A.M.I. International», Kurgan, 2008; всероссийской научно-практической конференции «Илизаровские чтения 2011», Курган, 2011; международной научно-практической конференции «Психолого-педагогические и медико-биологические проблемы физической культуры, спорта, туризма и олимпизма: инновации и перспективы развития», Челябинск, 2011.
По теме диссертации опубликовано 9 научных работ в международных, республиканских и областных изданиях, из них 3 в журналах, рекомендованных ВАК.
Объем и структура диссертации. Работа состоит из введения, трех глав, заключения, выводов и списка литературы. Диссертация изложена на 137 страницах машинописного текста. Работа иллюстрирована 13 рисунками, 8 таблицами. Список литературы включает в себя 412 работ, в том числе 121 отечественную. Диссертация выполнена по плану НИР ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова Минздравсоцразвития России» (№ государственной регистрации 0120.0802849)
Положения, выносимые на защиту:
- При удлинении голени на 15-17% кинетические показатели миозиновой АТФ-азы, равно как и лактатдегидрогеназная и креатинкиназная активность белков экстрагируемых 0,6М раствором KCl из скелетных мышц взрослых беспородных собак восстанавливается в период с 1-го по 3-й месяц после снятия аппарата Илизарова.
- Кинетические показатели миозиновой АТФ-азы скелетных мышц взрослых беспородных собак, лактатдегидрогеназная и креатинкиназная активность белков экстрагируемых 0,6М раствором KCl в послеоперационном периоде, при моделировании оскольчатого перелома голени, восстанавливается не раньше, чем через 3 месяца после снятия аппарата Илизарова.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования: Объектами исследования были 56 взрослых беспородных собак, разделенных на три группы. Первая группа состояла из 6 здоровых животных одного возраста, на которых изучали особенности кинетики и ферментативной активности миозина скелетных мышц. Данная группа рассматривалась как интактная. Вторая группа состояла из 20 животных, на которых изучали особенности кинетики и ферментативной активности миозина скелетных мышц в условиях оперативного удлинения костей голени по методу Илизарова в режиме удлинения 1мм/сутки за 4 приема. Третья группа состояла из 30 животных, на которых изучали особенности кинетики и ферментативной активности миозина скелетных мышц при моделировании оскольчатого перелома костей голени и последующим лечением аппаратом Илизарова. Материалом исследования служила мышечная ткань. В ходе выполнения исследования применялись экспериментальные, биохимические и статистические методы. На проведение экспериментальных исследований получено разрешение комитета по этике при ФГУ «РНЦ «ВТО» им. акад. Г.А. Илизарова Минздравсоцразвития России». Содержание животных, оперативные вмешательства и эвтаназию осуществляли в соответствии с требованиями Европейской конвенции по защите экспериментальных животных. Объектом исследования во всех сериях служила передняя большеберцовая и икроножная мышца, во 2-й и 3-й группах – это были мышцы как оперированной, так и контралатеральной конечности. Для изучения ферментативной активности препарата миозина скелетных мышц, из мышечной ткани приготавливали саркоплазматическую вытяжку согласно модифицированной нами схеме (рисунок 1) (Северин Е.С., 2000).
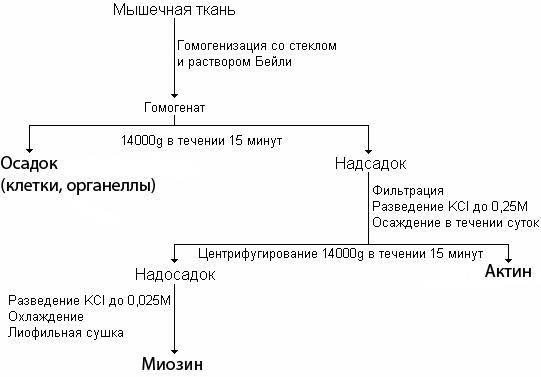 |
| Рисунок 1. Схема выделения миозина из мышечной ткани |
Материал для исследований из оперированной и контралатеральной конечностей брали сразу же после эвтаназии. Проверку чистоты полученного препарата миозина проводили с помощью электрофореза на системе Paragon (Beckman, США) с использованием реактивов и пластин этой же фирмы.
Полученный препарат миозина растворяли в 0,6М растворе хлорида калия до концентрации 0,2 (г белка)/л и изучали его ЛДГ (ЛДГ, КФ: 1.1.1.27) и КК (КК, КФ: 2.7.3.2) активность. Перед исследованием кинетических свойств полученный препарат миозина растворяли в 0,6М растворе хлорида калия до концентрации 2 (г белка)/л и изучали его АТФ – азную активность. Об активности фермента судили по количеству неорганического фосфата, который образовался при действии миозина на АТФ в присутствии Ca2+.
Неорганический фосфат, образовавшийся в процессе ферментативного расщепления АТФ, определяли по реакции с молибдатом аммония. Для определения предобразованного фосфата параллельно ставили контрольную пробу, в которую трихлоруксусную кислоту приливали к инкубационной смеси перед добавлением миозина. Ферментативную активность миозиновой АТФ-азы рассчитывали на мг белка в пробе. Белок определяли по Лоури. КК и ЛДГ активность препарата миозина определяли на биохимическом фотометре Stat Fax 1904+ (США), используя наборы реагентов фирмы Vital Diagnostic (СПб). Продукты ПОБ сыворотки крови определяли в белковом осадке по реакции с 2,4-динитрофенилгидразином, так же продукты ПОБ определяли в мышцах. Продукты реакции регистрировали при длинах волн 270нм (ПОБ270), 363нм и 370нм (ПОБ363+370) (Стогов М. В., Кузнецова Л.С., Ерофеев С.А., 2001). Степень окисленной модификации белков выражали в единицах оптической плотности (ед.оп.пл.) на 1 мг белка. Результаты исследования обрабатывали методами непараметрической статистики. Достоверность различий между двумя выборками оценивали с помощью W-критерия Вилкоксона для независимых выборок и критерия знаков. Достоверность межгрупповых различий определяли с помощью непараметрического критерия Краскела-Уоллиса, с последующим множественным сравнением с использованием критерия Дана.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Нами было показано, что к концу дистракции при оперативном удлинении голени наблюдалось достоверное увеличение сродства фермента к субстрату, выраженное в увеличении величины 1/KM на 69% (рисунок 2) для белка мышц контралатеральной и 84% для белка мышц оперированной конечности по сравнению со значениями, характерными для интактных животных.
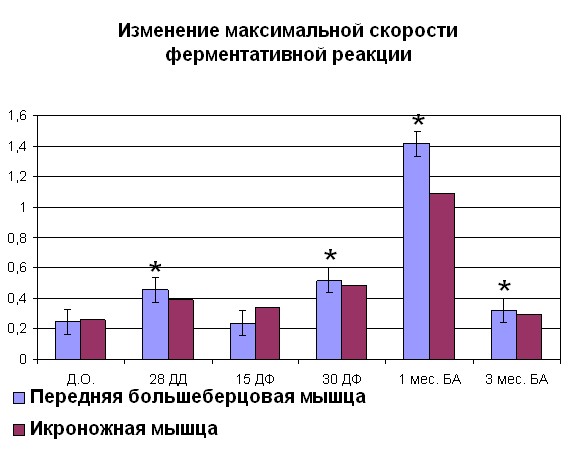 | 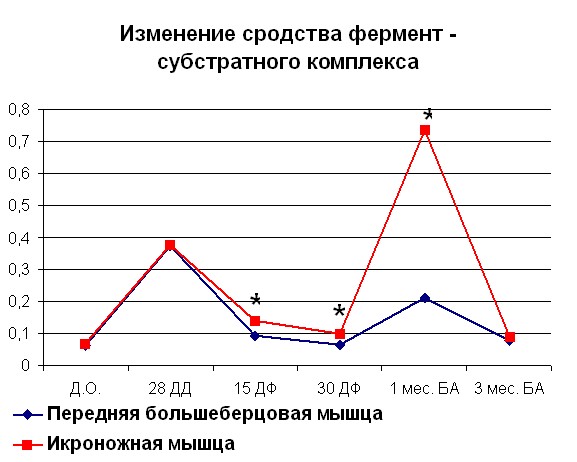 |
| Рисунок 2. Изменение АТФ-азной активности миозина скелетных мышц собак (оперированная конечность) при удлинении Примечание: по оси OX – сроки проведения эксперимента: Д.О. - до операции; 28 ДД – 28 дней дистракции; 15 ДФ - 15 дней фиксации; 15 ДФ - 15 дней фиксации; 1 мес БА – 1 месяц без аппарата; 3 мес БА – 3 месяц без аппарата. По оси OY: Слева - Vmax М·с-1·103; справа – сродство фермент-субстратного комплекса выраженное в 1/Km. *- различия между мышцами достоверны при р<0,05. | |
Начиная с середины срока фиксации сегмента конечности аппаратом Илизарова, нами отмечено снижение сродства до значений 1/Km, превышающих норму на 30% для белка мышц контралатеральной и 38% белка мышц оперированной конечности. В середине срока фиксации наблюдалось снижение Vmax до минимально отличных от дооперационных значений. В то же время во второй группе наблюдалось увеличение сродства на 78% для белка мышц контралатеральной и 85% для белка мышц оперированной конечности по сравнению с интактными животными. После снятия аппарата наблюдалось резкое увеличение сродства фермента к субстрату. В течение 3 месяцев после снятия аппарата наблюдалась тенденция к уменьшению сродства фермента к субстрату. Та же картина наблюдалась и для Vmax. Изменения, происходящие в контралатеральной конечности, носили схожий характер за исключением увеличения Vmax в конце фиксации (рисунок 3). В то же время, изменение сродства фермент – субстратного комплекса было аналогично наблюдаемому в мышцах оперированной конечности.
 | 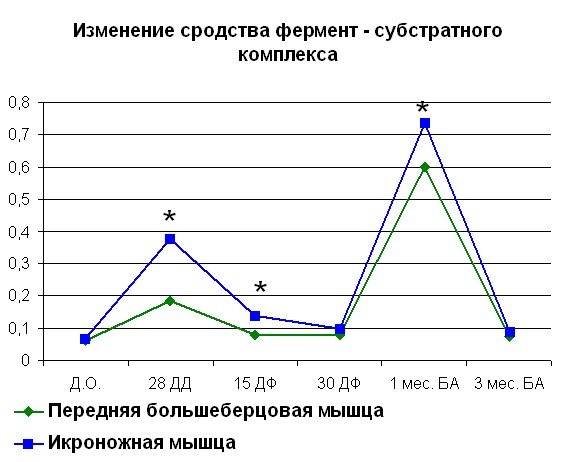 |
| Рисунок 3. Изменение АТФ-азной активности миозина скелетных мышц собак (контралатеральная конечность) при удлинении Примечание: по оси OX – сроки проведения эксперимента: Д.О. - до операции; 28 ДД – 28 дней дистракции; 15 ДФ - 15 дней фиксации; 15 ДФ - 15 дней фиксации; 1 мес БА – 1 месяц без аппарата; 3 мес БА – 3 месяц без аппарата. По оси OY: Слева - Vmax М·с-1·103; справа – сродство фермент-субстратного комплекса выраженное в 1/Km. *- различия между мышцами достоверны при р<0,05. | |
В то же время изменение сродства фермент – субстратного комплекса было аналогично наблюдаемому в мышцах оперированной конечности. Начиная с 3-х месяцев после снятия аппарата значения сродства в фермент-субстратном комплексе и Vmax для первой группы животных стали сравнимы со значениями в дооперационный период, что говорит о практически полном восстановлении изначальных показателей. Разница показателей не превышала 15% от нормы. Наряду с кинетическими показателями, характеризующими степень сродства фермента и субстрата, а также скорости реакции гидролиза АТФ наиболее значимым показателем является способность миозина выступать как лактатдегидрогеназа и креатинкиназа (таблица 1, 2). В литературных данных нами было обнаружено отсутствие четкой корреляции повышения ЛДГ и КК активности с интенсивностью повышения активности миозина при оперативном вмешательстве.
| Таблица 1. Лактатдегидрогеназная активность белков экстрагируемых 0,6М раствором KCl из скелетных мышц собак при оперативном удлинении костей голени (медиана) | ||||
| Срок эксперимента | ПББМ | ИКМ | ||
| К | О | К | О | |
| Здоровые животные | 4,009 | 3,729 | ||
| 28-е сутки дистракции | 2,261* | 3,579* | 7,100 | 3,435* |
| 15-е сутки фиксации | 1,546 | 8,073 | 2,878 | 7,294 |
| 30-е сутки фиксации | 2,386* | 0,920* | 0,965* | 1,602* |
| 1 месяц без аппарата | 2,470 | 1,664* | 2,694* | 0,767 |
| 3 месяца без аппарата | 4,918* | 9,517 | 4,416* | 7,670 |
| Примечание: К - контралатеральная конечность, О – оперированная конечность. *- достоверные различия с интактными мышцами при р<0,05. | ||||
К концу срока дистракции наблюдалось снижение как КК, так
| Таблица 2. Креатинкиназная активность белков экстрагируемых 0,6М раствором KCl из скелетных мышц собак при оперативном удлинении костей голени (медиана) | ||||
| Срок эксперимента | ПББМ | ИКМ | ||
| К | О | К | О | |
| Здоровые животные | 5,228 | 4,967 | ||
| 28-е сутки дистракции | 1,327 | 2,287* | 5,400 | 2,134 |
| 15-е сутки фиксации | 3,462 | 5,768 | 2,682 | 9,498 |
| 30-е сутки фиксации | 1,997 | 1,133* | 1,963 | 2,168* |
| 1 месяц без аппарата | 1,699 | 1,726 | 3,344* | 4,309 |
| 3 месяца без аппарата | 3,807 | 4,954* | 4,728* | 6,112 |
| Примечание: К - контралатеральная конечность, О – оперированная конечность. *- достоверные различия с интактными мышцами при р<0,05. | ||||
и ЛДГ активности (таблица 1, 2). В мышце контралатеральной конечности снижение КК активности белка составило 15% от показателя интактных животных, ЛДГ 56%. В мышце оперированной конечности КК активность составляла 56,2% от нормы, ЛДГ 11%. К середине фиксации при общем снижении ЛДГ и КК активности миозина мышц контралатеральной конечности в оперированной наблюдался резкий подъем активности миозина до значений на 90% -100% больше, характерных для интактных животных. К концу периода фиксации значения ЛДГ и КК активности миозина уменьшились для оперированной конечности до 20% от значений интактных животных, для контралатеральной до 38% от значений интактных животных. В послеоперационный период в срок до 3-х месяцев ЛДГ и КК активность имела тенденцию к возрастанию до значений, характерных для интактных животных.
После переломов костей голени, проведенные физиологические исследования показывают, что происходит снижение сократительных характеристик скелетных мышц травмированного сегмента, причем неполное восстановление их функций наблюдается как на момент окончания лечения, так и в отдаленные сроки после него (Щуров В.А., Сагымбаев М.А., Горбачева Л.Ю., 2003). Нами отмечено, что после травмы в период с момента нанесения травмы до 21 дня фиксации наблюдается рост Vmax (рисунок 4, 5). После 21 дня и до конца срока фиксации наблюдалось снижение Vmax. Также стоит отметить, что сродство фермента к субстрату как в случае оперированной, так и контралатеральной конечности повышалось с момента травмы. Через 15 дней после снятия аппарата отмечено повышение Vmax до значений 0,75 для ПББМ и 0,64 для ИКН. Постепенное снижение Vmax отмечалось с 15 дня после снятия аппарата, вплоть до отдаленных сроков. Стоит отметить тот факт, что полное восстановление кинетики миозина
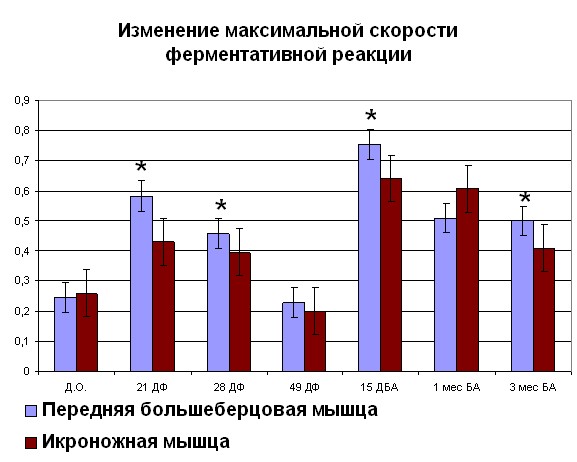 | 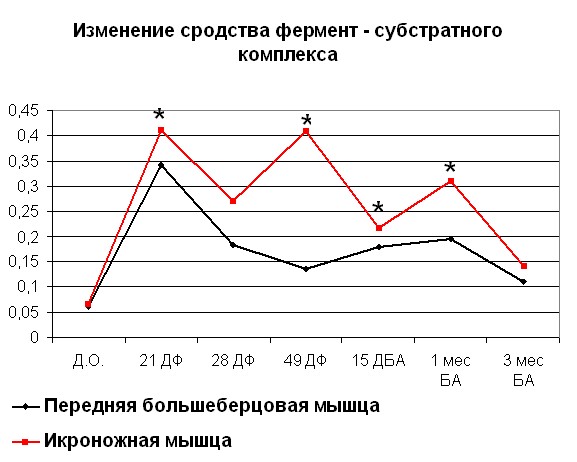 |
| Рисунок 4. Изменение АТФ-азной активности миозина скелетных мышц собак (оперированная конечность) при травме Примечание: по оси OX – сроки проведения эксперимента: Д.О. - до операции; 21 ДФ – 28 дней фиксации; 49 ДФ – 49 дней фиксации; 15 ДБА - 15 дней без аппарата; 1 мес БА – 1 месяц без аппарата; 3 мес БА – 3 месяц без аппарата. По оси OY: Слева - Vmax М·с-1·103; справа – сродство фермент-субстратного комплекса выраженное в 1/Km. *- различия между мышцами достоверны при р<0,05 | |
мышц голени после травмы наблюдалось на сроках, существенно больших, чем при удлинении по методу Илизарова.
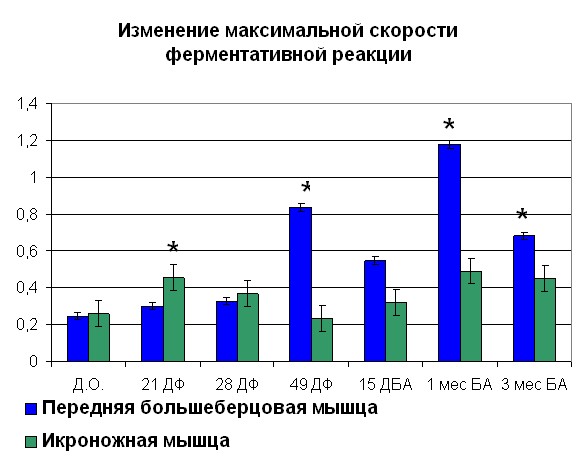 | 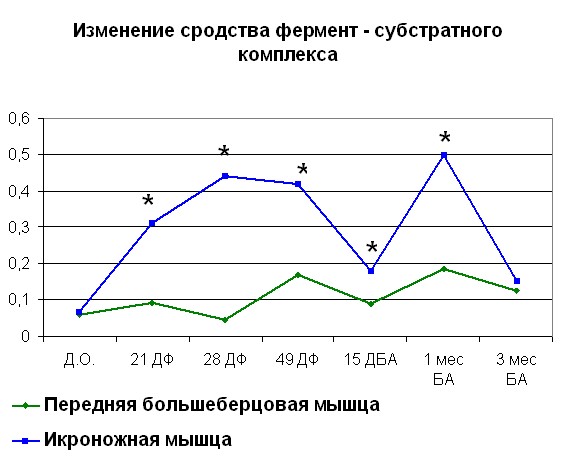 |
| Рисунок 5. Изменение АТФ-азной активности миозина скелетных мышц собак (контралатеральная конечность) травме Примечание: по оси OX – сроки проведения эксперимента: Д.О. - до операции; 21 ДФ – 28 дней фиксации; 49 ДФ – 49 дней фиксации; 15 ДБА - 15 дней без аппарата; 1 мес БА – 1 месяц без аппарата; 3 мес БА – 3 месяц без аппарата. По оси OY: Слева - Vmax М·с-1·103; справа – сродство фермент-субстратного комплекса выраженное в 1/Km. *- различия между мышцами достоверны при р<0,05 | |
Данный факт объяснялся обширными повреждениями мягких тканей и более глубокими биохимическими изменениями как мышц травмированной конечности, так и организма в целом. Наряду с изменениями кинетики миозина как АТФ-азы вплоть до окончания периода фиксации аппаратом Илизарова наблюдалось снижение ЛДГ и КК активности.( таблица 3, 4)
| Таблица 3. Лактатдегидрогеназная активность белков экстрагируемых 0,6М раствором KCl из скелетных мышц собак после моделирования оскольчатого перелома костей голени (медиана) | ||||
| Срок эксперимента | ПББМ | ИКМ | ||
| К | О | К | О | |
| Здоровые животные | 4,009 | 3,729 | ||
| 21-е сутки фиксации | 1,815* | 2,960 | 2,315* | 4,552 |
| 28-е сутки фиксации | 0,586* | 1,417* | 0,836* | 1,287 |
| 49-е сутки фиксации | 3,755 | 2,173* | 4,968 | 5,521* |
| 15-е сутки без аппарата | 0,864 | 1,639 | 6,529 | 2,577* |
| 1 месяц без аппарата | 3,708 | 1,031* | 2,566* | 3,732* |
| 3 месяца без аппарата | 1,589* | 1,380* | 2,746 | 2,911* |
| Примечание: К - контралатеральная конечность, О – оперированная конечность. *- достоверные различия с интактными мышцами при р<0,05. | ||||
В конце срока фиксации аппаратом, для оперированной конечности ЛДГ активность составляла 54,7%, КК активность 93% от значе
| Таблица 4. Креатинкиназная активность белков экстрагируемых 0,6М раствором KCl из скелетных мышц собак после моделирования оскольчатого перелома костей голени (медиана) | ||||
| Срок эксперимента | ПББМ | ИКМ | ||
| К | О | К | О | |
| Здоровые животные | 5,228 | 4,967 | ||
| 21-е сутки фиксации | 1,867* | 2,737* | 2,454 | 1,694* |
| 28-е сутки фиксации | 1,483* | 1,109 | 0,559* | 0,251 |
| 49-е сутки фиксации | 1,159 | 1,633* | 1,310* | 4,059* |
| 15-е сутки без аппарата | 1,270* | 1,504 | 6,733 | 3,349* |
| 1 месяц без аппарата | 1,884* | 1,748 | 1,589* | 1,697 |
| 3 месяца без аппарата | 1,251* | 1,244* | 3,608* | 6,054 |
| Примечание: К - контралатеральная конечность, О – оперированная конечность. *- достоверные различия с интактными мышцами при р<0,05. | ||||
ний, характерных для интактных животных. После снятия аппарата Илизарова наблюдалось снижение ферментативной активности миозина. Аналогично изменениям в АТФ-азной активности миозина снижение КК и ЛДГ активности имело низкую динамику по сравнению с первой группой животных. Через 3 месяца после снятия аппарата КК активность была на 60,3%, а ЛДГ на 76% ниже значений характерных для интактных животных. На отдаленных сроках, через 1–3 месяца после снятия аппарата при удлинении конечности мы наблюдали восстановление как кинетических показателей АТФ-азной активности препарата миозина, так и его ЛДГ и КК активности. В то же время при травме восстановление наблюдалось на сроках, превышающих 3 месяца.
Анализ полученных кинетических характеристик миозина как АТФ-азы провести достаточно трудно по ряду причин. Прежде всего, характер зависимости скорости гидролиза АТФ миозином от концентрации субстрата имел сигмоидальную зависимость (рисунок 6). Это свидетельствует о том, что реакция взаимодействия миозина с АТФ носила полисубстратный характер с большим числом аллостерических центров. При росте сродства миозина к субстрату и параллельном увеличении скорости данной ферментативной реакции происходит снижение числа активных центров с одновременным увеличением активности оставшихся. Причина наблюдаемого увеличения сродства миозина к АТФ, на наш взгляд, состоит в том, что в посттравматический период в мышцах как травмированного, так и контралатерального сегмента конечности синтезировался миозин с измененными кинетическими характеристиками, и происходила модификация уже функционирующих молекул данного сократительного белка. Последнее предположение объясняет наблюдаемый нами высокий уровень Vmax и сродства миозина к АТФ через три месяца после окончания лечения, при полном цикле обмена миозина в скелетных мышцах до 100 дней (Иванов И.И., Коровкин Б.Ф., Пинаев Г.П. Биохимия мышц, 1977).
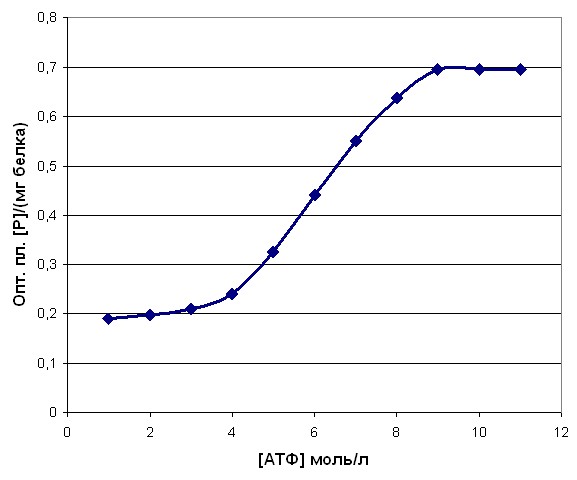 |
| Рисунок 6. Зависимости скорости гидролиза АТФ миозином от концентрации субстрата |
Полученные нами данные позволяют утверждать, что снижение сократительной способности скелетных мышц после травм происходило на фоне роста сродства миозина к АТФ в мышцах в посттравматический период. Данные, полученные при исследовании перекисного окисления белка на длинах волн 270 нм, 363 и 370 нм подтверждают, что при повреждении мышечного волокна как вследствие удлинения конечности по методу Илизарова, так и при травме, происходит модификация миозина и, как следствие, повышение сродства и скорости реакции гидролиза АТФ.
Наблюдаемая нами картина при длинах волн 363 нм и 370 нм для ИКМ была аналогична таковой при 270 нм. В середине срока дистракции нами отмечено возрастание содержания продуктов перекисного окисления белка до 250 ед/г белка. Тенденция к возрастанию оптической плотности продолжалась также в середине фиксации (рисунок 7, 8). К концу срока фиксации нами отмечено снижение оптической плотности до физиологической нормы. После снятия аппарата на сроке 3 месяца без аппарата наблюдался подъем оптической плотности до 300 ед/г белка. В данный период происходило окончательное замещение модифицированного белка на белок, по характеристикам схожий с белком взрослых здоровых неоперированных животных. В целом картина образования продуктов перекисного окисления белка согласуется с данными, полученными при изучении кинетических особенностей реакции гидролиза АТФ препаратом миозина скелетных мышц собак и его КК и ЛДГ активности.
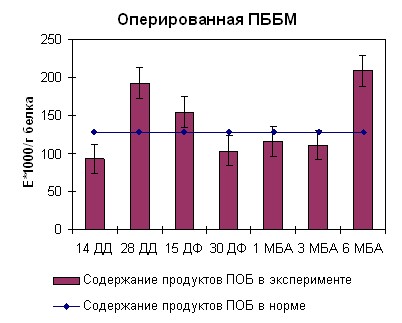 | 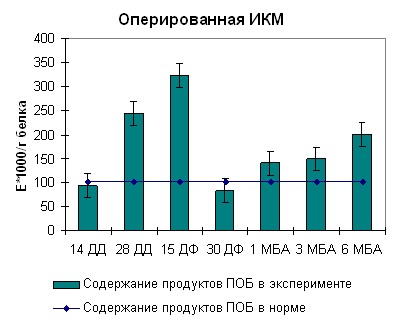 |
| Рисунок 7. Содержание продуктов перекисного окисления белка регистрируемых при длине волны 270нм в скелетных мышцах собак при оперативном удлинении костей голени | |
Наблюдаемые изменения в системе перекисного окисления в скелетных мышцах при удлинении конечности можно отнести к реакциям
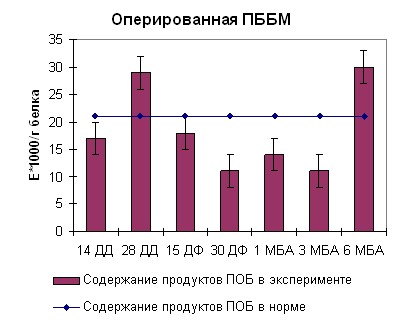 |  |
| Рисунок 8. Содержание продуктов перекисного окисления белка регистрируемых при длинах волн 363 и 370нм в скелетных мышцах собак при оперативном удлинении костей голени | |
неспецифического ответа ткани на внешнее воздействие, т.к. подобные изменения данных показателей обнаруживались и в сыворотке крови (рисунок 9).Такие изменения на системном и тканевом уровне мы сочли возможным рассматривать как неспецифические на том основании, что подобные изменения наблюдались и при воздействиях иного рода (М.В. Стогов, Л.С. Кузнецова, С.А. Ерофеев, 2001).
 |
| Рисунок 9. Содержание продуктов ПОБ в сыворотке крови экспериментальных животных Примечание: по оси ОХ – сроки эксперимента: 1 – до операции, 2 – 7-е сутки дистракции, 3 – 14-е сутки дистракции; 4 – 21-е сутки дистракции, 5 – 28-е сутки дистракции; 6 – 15-е сутки фиксации; 7 – конец фиксации (30-е сутки); 8 – 1 месяц после снятия аппарата |
Сравнивая результаты исследования мышц оперированных и неоперированных конечностей, можно заключить, что процесс ПОБ затрагивает не только поврежденные участки мышечной ткани, но и весь организм в целом.
В начале фиксации аппаратом Илизарова в оперированной передней большеберцовой мышце нами отмечена активация процессов перекисного окисления белка, что было выражено в достоверном резком подъеме оптической плотности до 250 ед*1000/г белка (рисунок 10). К середине фиксации наблюдался статистически значимый рост концентрации продуктов перекисного окисления белка, выраженный в подъеме оптической плотности до 270 ед/г белка. Тенденция к накоплению продуктов перекисного окисления белка сохранялась до конца фиксации. Через месяц после снятия аппарата Илизарова происходило снижение концентрации продуктов перекисного окисления белка до 190 ед*1000/г белка. На отдаленных сроках после снятия аппарата вновь наблюдалось достоверное увеличение оптической плотности во всех типах исследуемых мышц больше 300 ед*1000/г белка.
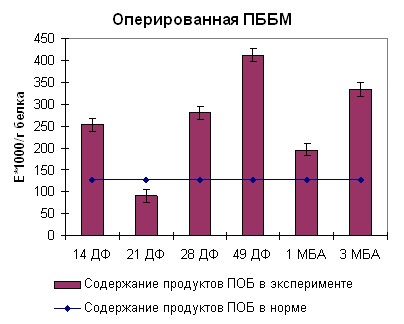 |  |
| Рисунок 10. Содержание продуктов перекисного окисления белка регистрируемых при длине волны 270нм в скелетных мышцах собак после моделирования оскольчатого перелома костей голени | |
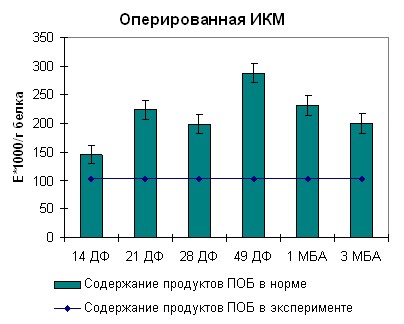
Для оперированной икроножной мышцы динамика изменения содержания продуктов перекисного окисления белка была несколько иной, нежели для передней большеберцовой мышцы.
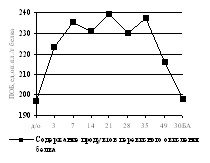 |
| Рисунок 11. Содержание продуктов перекисного окисления белков в сыворотке крови в условиях лечения оскольчатого перелома костей голени Примечание: по оси ОХ – сутки эксперимента, д/о – дооперационные значения; 30БА – 30-е сутки после снятия аппарата. |
Она характеризовалась постепенным увеличением количества продуктов перекисного окисления белка в мышце до окончания фиксации аппаратом Илизарова и постепенным их снижением вплоть до отдаленных сроков. Как видно на рисунке 11, концентрация продуктов ПОБ в крови экспериментальных животных находилась выше нормы все время проведения эксперимента. Наблюдаемые нами увеличения концентрации соответствовали пикам в мышечной ткани. Уменьшение концентрации продуктов ПОБ имело более низкую динамику, чем при удлинении аппаратом Илизарова. Через 30 дней после снятия аппарата разница концентраций продуктов ПОБ с дооперационными значениями составляла 0,5%.
ВЫВОДЫ
- После удлинения конечности аппаратом Илизарова в срок до 1 месяца после снятия аппарата наблюдается рост АТФ-азной активности белков экстрагируемых из скелетных мышц 0,6М раствором KCl, а также снижение их лактатдегидрогеназной активности до 23% от нормы и креатинкиназной активности до 21,6% от нормы. В крови наблюдался рост активности креатинкиназы до 1060 Е/л и лактатдегидрогеназы до 2700 Е/л.
- После лечения травмы конечности аппаратом Илизарова в срок до 1 месяца после снятия аппарата в мышцах происходит рост АТФ-азной активности белков экстрагируемых из скелетных мышц 0,6М раствором KCl, а также наблюдается снижение их лактатдегидрогеназной активности до 54% от нормы и креатинкиназной активности до 30,7% от нормы. В крови отмечается подъем лактатдегидрогеназной активности до 3900 Е/л и креатинкиназной до 3000 Е/л.
- В посттравматический период в мышцах как травмированного, так и контралатерального сегмента конечности, на основании данных, полученных при исследовании перекисного окисления белка в мышцах и крови, происходит модификация зрелых молекул белков экстрагируемых из скелетных мышц 0,6М раствором KCl. Снижение сократительной способности скелетных мышц после повреждения конечности не связано со снижением сродства фермента к АТФ.
- АТФ-азная, креатинкиназная и лактатдегидрогеназная активность белков экстрагируемых из передней большеберцовой мышцы 0,6М раствором KCl, как в норме, так и при травме выше на 5-7%, чем из икроножной мышцы.
- После удлинения конечности аппаратом Илизарова происходит восстановление кинетических свойств белков экстрагируемых из скелетных мышц 0,6М раствором KCl до значений, характерных для интактных животных, не ранее чем через 2 месяца. После травмы конечности и последующего лечения аппаратом Илизарова динамика восстановления кинетических свойств белков экстрагируемых из скелетных мышц 0,6М раствором KCl снижена, и их восстановление до значений, характерных для интактных животных, происходит не ранее, чем через 3 месяца.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Гайдышев А.И. Изучение АТФ-азной активности препарата скелетных мышц собак / А.И. Гайдышев, М.В. Стогов // Актуальные вопросы ветеринарной хирургии : материалы науч.-практ. конф. - Курган, 2006. - C. 12-14.
- Стогов М.В. АТФ-азная активность препарата миозина скелетных мышц после удлинения конечности / М.В. Стогов, А.И. Гайдышев // Гений ортопедии. - 2007. - № 3. - С.53-56.
- Стогов М.В. Активность ферментов в тканях у собак при удлинении конечности методом Илизарова с темпом дистракции 3 мм в сутки в автоматическом режиме / М.В. Стогов, С.Н. Лунева, А.И. Гайдышев, и др. // Клеточные и нанотехнологии в биологии и медицине: Мат. Всерос. науч.-практ. конф. - Курган, 2007. - C. 122-123.
- Шевцов В.И. О перспективах использования наноматериалов в лечении повреждений и заболеваний тканей опорно-двигательной системы / В.И. Шевцов, С.Н. Лунева, А.И. Гайдышев, и др. // Гений ортопедии. - 2008. - № 4. - С. 26-31.
- Стогов М.В. Biochemical investigations of skeletal muscles in limb lengthening according to the Ilizarov method / М.В. Стогов, А.А. Еманов, А.И. Гайдышев // 5th Meeting of the A.S.A.M.I. International. -Kurgan, 2008. - P. 333-334.
- Лунева С.Н. Влияние низкомолекулярных неколагеновых белков с инсулинподобными свойствами на активность препарата миозина / С.Н. Лунева, М.В. Стогов, А.И. Гайдышев, и др. // Медицинская наука и образование Урала. - 2009. - № 3. - С. 14-15.
- Гайдышев А.И. Изменение максимальной скорости реакции препарата миозина скелетных мышц собак при моделировании оскольчатого перелома костей голени с последующим лечением аппаратом Илизарова / А.И. Гайдышев, С.Н. Лунева, М.В. Стогов, // Мат. Всероссийской научно-практической конференции с международным участием «Илизаровские чтения». -Курган, 2011. -С. 469.
- Стогов М.В. Активность миозина в скелетных мышцах собак при удлинении костей голени / М.В. Стогов, А.И. Гайдышев // Сб. материалов междун. науч.-практической конф. «Психолого-педагогические и медико-биологические проблемы физической культуры, спорта, туризма и олимпизма: инновации и перспективы развития». -Ч. 2. Челябинск, 2011.- С. 209-212.
- Стогов М.В. Кинетические характеристики миозиновой АТФ-азы в скелетных мышцах собак после перелома костей голени / М.В. Стогов, С.Н. Лунева, А.И. Гайдышев // Бюллетень экспериментальной биологии и медицины. -2011. -Т.151, № 4.- С. 398-400.
СПИСОК ОСНОВНЫХ СОКРАЩЕНИЙ
АТФ – аденозинтрифосфат
ИНМ – икроножная мышца
ПББМ – передняя большеберцовая мышца
ЛДГ – лактатдегидрогеназа
КК – креатинкиназа
ПОБ – перекисное окисление белка
Vmax – максимальная скорость ферментативной реакции
Km – константа Михаэлиса
Отзывы на автореферат просим высылать по адресу: 420008, Казань, ул.Кремлевская, 18. Казанский федеральный университет, отдел аспирантуры, Ученому секретарю Диссертационного совета Д212.081.08 Абрамовой З.И.; факс(843) 238-76-01 E-mail: [email protected]
Отпечатано в типографии «Дамми»
640001, г. Курган, пр. Машиностроителей, 13 А.
тел./факс: (3522) 255-530

