Использование рекомбинационной инженерии для прецизионного изменения структуры, уровня экспрессии и механизмов регуляции генов в хромосоме escherichia coli
На правах рукописи
Крылов Александр Александрович
«Использование рекомбинационной инженерии для
прецизионного изменения структуры, уровня экспрессии и механизмов регуляции генов в хромосоме
Escherichia coli»
03.01.03 - Молекулярная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
- Москва 2010 -
Работа выполнена в лаборатории №4 Закрытого Акционерного общества «Научно-исследовательский институт Аджиномото-Генетика» (ЗАО «АГРИ»).
Научный руководитель:
кандидат биологических наук, доцент И.В. Бирюкова
Научный консультант:
доктор биологических наук, профессор С.В. Машко
Официальные оппоненты:
доктор биологических наук, профессор В.П. Вейко
ФГУП ГосНИИгенетика
доктор биологических наук, доцент Л.И. Патрушев
Институт биоорганической химии РАН
Ведущая организация: Институт молекулярной генетики РАН
Защита диссертации состоится «21» декабря 2010 года в 1400 на заседании Диссертационного совета Д 217.013.01 при ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» по адресу: 117545, г. Москва, 1-й Дорожный проезд, д. 1.
С диссертацией можно ознакомиться в библиотеке ФГУП «ГосНИИгенетика»
Автореферат разослан «______» ноября 2010 г.
Ученый секретарь
Диссертационного совета,
кандидат химических наук, доцент Т.Л. Воюшина
Общая характеристика работы
Актуальность проблемы. В настоящее время приоритетным для биотехнологии является конструирование бесплазмидных, безмаркерных бактериальных штаммов-продуцентов. Интеграция в хромосому генов, кодирующих целевые рекомбинантные белки или ферменты, катализирующие необходимые метаболические превращения, коренным образом решает проблемы, связанные со стабильным наследованием целевых плазмид [Friehs, 2004] и их отрицательным влиянием на жизнеспособность клеток [Sauer, 2001; Brownlie и др., 1990], а также удовлетворяет законодательному запрету на использование в промышленности плазмидных штаммов-продуцентов в ряде стран. Смещение приоритета метаболической инженерии на бесплазмидные системы экспрессии целевых генов привело к необходимости адаптации классических и разработки новых молекулярно-биологических подходов конструирования на основе современного инструментария модификации хромосомы.
Escherichia coli является удобным микроорганизмом для разработки таких подходов. В настоящее время создан разнообразный генно-инженерный инструментарий для модификации хромосомы E. coli. Например, метод Red/RecET-зависимой рекомбинационной инженерии (Recombination mediated genetic engineering = Recombineering) позволяет инактивировать целевые гены путем делеции «с сохранением открытой рамки считывания» гена-мишени, заменять регуляторные области и проводить сайт-специфический мутагенез кодирующих участков [Sawitzke и др., 2007]. Разработаны методы интеграции протяженных фрагментов ДНК в случайные [Ахвердян и др., 2007] и в строго определенные участки генома E. coli [Minaeva и др., 2008]. В тоже время штаммы E. coli традиционно используют в биотехнологическом производстве в качестве промышленных продуцентов рекомбинантных белков, органических кислот, витаминов, этанола и аминокислот, а также относительно новых продуктов – бутанола, 1-3-пропандиола, лейкопина, полифенолов и растительных флаваноидов [Wendisch и др., 2006; Patnaik, 2008; Demain и др., 2008]. Поэтому все разработанные на данном виде бактерий подходы конструирования приобретают практическую значимость. Необходимо также отметить, что многие из перечисленных методов, исходно разработанных для E. coli, постепенно адаптируются для работы с другими микроорганизмами, такими как Salmonella [Husseiny и Hensel, 2005; Karlinsey, 2007], Shigella [Shi и др., 2003; Ranallo и др., 2006], Yersinia [Derbise и др., 2003; Lesic и др., 2004], Pseudomonas [Lesic и Rahme, 2008], Pantoea [Katashkina и др, 2009]. Следовательно, разработка новых подходов оптимизации экспрессии генов в E. coli позволяет надеяться на их будущую универсальность.
Цель и задачи работы. Диссертационная работа посвящена разработке новых молекулярно-биологических подходов прецизионного изменения структуры, уровня экспрессии и механизмов регуляции генов в хромосоме Escherichia coli на основе рекомбинационной инженерии.
В ходе работы решались следующие задачи:
- прецизионная модификация локусов хромосомы Escherichia coli посредством применения Red-зависимой интеграции «вырезаемого» маркера;
- оптимизация экспрессии генов биосинтетических путей на поздних стадиях культивирования бактериальных штаммов путем использования метаболически регулируемых промоторов Pho регулона;
- разработка метода оптимизации экспрессии дистально расположенных цистронов в искусственных оперонах на основе TGATG-оверлаппонов;
- исследование возможности применения конвергентной транскрипции для эффективного подавления экспрессии целевых генов.
Научная новизна и практическая значимость работы. Показано, что рекомбинационная инженерия позволяет прецизионно маркировать целевые генетические локусы, для удобства их переноса в другие штаммы, с последующим удалением маркера, тем самым, осуществлять конструирование штаммов, не содержащих генов устойчивости к антибиотикам.
Показано, что промоторы Pho регулона E. coli, PphoA и PpstS, могут быть использованы для повышения уровня экспрессии целевого биосинтетического гена на поздних стадиях роста бактерий на комплексной среде с глюкозой, если растворимый неорганический фосфат является фактором ограничения роста биомассы.
Разработан метод оптимизации экспрессии дистально расположенных цистронов в искусственных оперонах посредством создания трансляционного сопряжения между цистронами.
Разработана модификация метода регулируемого подавления экспрессии генов путем организации встречной транскрипции, повышающая его эффективность за счет Rho-зависимой антитерминации.
Разработанные в ходе выполнения диссертации методы и подходы апробированы на модельных системах и успешно использованы в экспериментах по метаболической инженерии продуцентов аминокислот, имеющих значение для индустриальной биотехнологии.
Публикации и апробация работы. По теме диссертации опубликовано 4 статьи в ведущих рецензируемых журналах, входящих в перечень ВАК РФ, 2 сообщения в материалах международных научных конференций (Prague, Czech Republic, 2006; Lisbon, Portugal, 2009), оформлена заявка на патент РФ №2008105793. Материалы диссертации докладывались автором на конкурсе работ молодых сотрудников ЗАО «АГРИ» (Москва, 2009). Апробация диссертации состоялась на совместном семинаре ЗАО «АГРИ» и секций «молекулярная биология» и «генетика микроорганизмов» Ученого Совета ФГУП ГосНИИгенетика (Москва, 2010).
Структура и объем работы. Диссертация состоит из 6 разделов: «Введение», «Обзор литературы», «Материалы и методы», «Результаты и обсуждение», «Выводы» и «Список цитируемой литературы». Работа изложена на ____ страницах, включая____рисунков и____таблицы. Список цитируемой литературы содержит_____ источника, в том числе_____на русском языке.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Red-зависимое маркирование целевых локусов хромосомы
Конструирование нового штамма – это процесс последовательного введения новых модификаций и мутаций в геном исходного штамма. В практике конструирования нового штамма часто возникает необходимость переноса в его геном известной мутации, не имеющей легко тестируемого фенотипического проявления. Безусловно, классическая генетика микроорганизмов имеет разнообразные методы «маркирования» таких мутаций для их последующего селективного переноса. Например, можно использовать представительные коллекции штаммов, содержащих в известных позициях генома транспозоны с генами устойчивости к антибиотикам [Singer, et al., 1989]. Однако эти подходы достаточно трудоемки и длительны, особенно на этапе удаления использованного маркера из генома целевого штамма после переноса мутации. Использование инструментария рекомбинационной инженерии позволяет революционным образом модифицировать процедуру переноса таких мутаций, обеспечивая существенные преимущества. Первым преимуществом является возможность выбора точки интеграции маркера, обеспечивающей эффективную ко-трансдукцию маркера с целевым локусом. Второе – предварительный выбор точки позволяет избежать негативных последствий интеграции маркера на функциональность окружающих генетических единиц. Третье – метод предусматривает использование «вырезаемого» маркера [Каташкина и др., 2005], что значительно облегчает конструирование безмаркерных штаммов.
Эффективность модифицированного подхода была продемонстрирована в данной работе на примере создания штамма MG1655 с улучшенными ростовыми характеристиками.
1.1 Получение штамма MG1655 с улучшенными ростовыми характеристиками
Штамм E. coli MG1655 с полностью установленной последовательностью генома [Blattner и др., 1997] представляет значительный интерес для метаболической инженерии в качестве исходного штамма для дальнейших модификаций. Однако некоторые из имеющихся в этом штамме мутаций (ilvG, rfb-50, rph-1) в определенных условиях негативно влияют на рост бактерий, важнейший параметр для метаболической инженерии. В частности, следствием мутации rph-1 (делеция одной пары оснований в 3’-конце кодирующей части гена rph) является приблизительно 100 кратное снижение уровня экспрессии ниже расположенного гена pyrE, приводящее к частичной ауксотрофности по пиримидинам и снижению скорости роста на минимальных средах [Jensen, 1993]. Известно, что данная мутация свойственна не всем лабораторным штаммам E. coli [Jensen, 1993; Gaal и др., 1997]. Так другой лабораторный штамм TG1 содержит ген rphwt, а известные для этого штамма мутации (supE, hsd, thi, (lac-proAB)) локализованы на значительном от гена rph расстоянии [Sambrook и Russel, 2001]. Поэтому, было решено перенести локус rph-pyrE хромосомы TG1 с помощью P1 трансдукции в штамм MG1655, предварительно маркировав его с использованием метода Red-зависимой рекомбинации.
Для этого в точку на хромосоме TG1 между генами yicC и dinD, имеющую позицию 3.815.639 по геному E. coli MG1655 [GenBank U00096] и находящуюся на расстоянии 1737 нуклеотидов от места мутации rph-1, был интегрирован ген хлорамфениколацетилтрансферазы (cat), обеспечивающей устойчивость клеток к хлорамфениколу, фланкированный сайтами attL/R. Наличие данных сайтов позволяло на последнем этапе конструирования быстро и прецизионно удалить маркер посредством механизма Int/Xin сайт-специфической рекомбинации с образованием на его месте последовательности attB длинной в 31 нуклеотид.
Полученный таким образом штамм E. coli TG1-[yicC-attR-cat-attL-dinD] был использован в качестве донора для Р1 трансдукции маркера устойчивости к хлорамфениколу (CmR) в MG1655. Ко-трансдукция гена rphwt в MG1655 была доказана с помощью специфической ПЦР (MAMA-PCR [Cha и др., 1992]) (см. рис. 1).
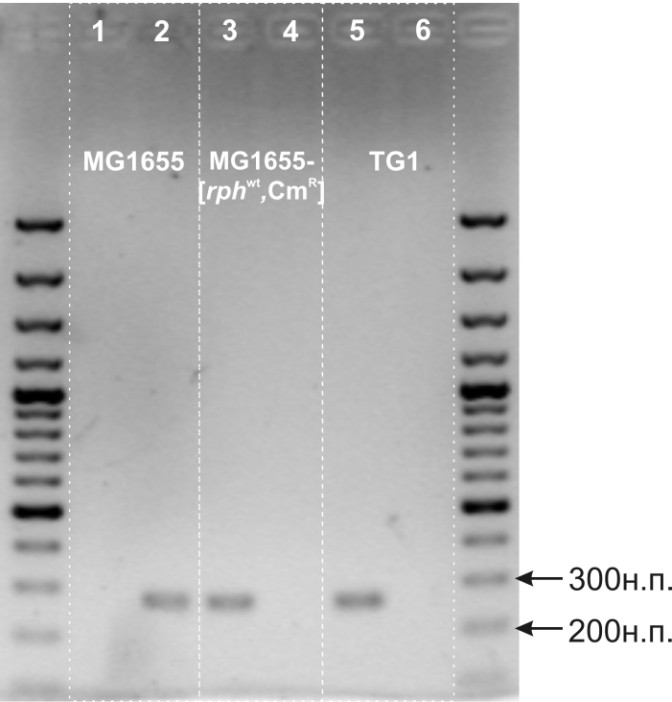
Рисунок 1. Электрофоретическое разделение в агарозном геле (1,6%) фрагментов ДНК, амплифицированных с хромосом штаммов: MG1655, MG1655-[rphwt,CmR] и TG1. Дорожки 1, 3, 5 - rphwt, 2, 4, 6 – rph-1
Использованные праймеры:
прямые
5’-ctacaatggattcgattcccct-3’ - rph-1
5’-tacaatggattcgattccccct-3’ - rphwt
комплиментарный
5’-agaagctggtggaaaacgg-3’
После удаления маркера CmR Int/Xis рекомбиназой из хромосомы нового штамма и подтверждения структуры rphwt секвенированием, был исследован рост клеток штамма MG1655-[rphwt] на минимальной среде с глюкозой (Глк). Показано, что замена мутантного локуса rph-1 pyrE в хромосоме MG1655 на соответствующий локус «дикого типа» приблизительно на 20 % (от 0,56 час-1 до 0,69 час-1) увеличила скорость роста нового штамма по сравнению с исходным MG1655 (см. рис. 2). Полученные нами данные согласуются с имеющимися литературными данными [Soupene и др., 2003].
![Кинетика роста штаммов MG1655 () и MG1655-[rphwt] () на-1](/images1/393800/kinetika-rosta-shtammov-mg1655-mg1.jpg)
Рисунок 2. Кинетика роста штаммов MG1655 () и MG1655-[rphwt] () на минимальной среде с Глк
Таким образом, типичная задача по переносу исходно немаркированных мутаций была успешно решена, благодаря использованию современных методов, основанных на механизмах Red-зависимой гомологичной и Int/Xis-зависимой сайт-специфической рекомбинации. Несомненными достоинствами использованного подхода является также быстрота проведения процедуры и полностью охарактеризованная структура модифицированной области хромосомы.
2. Метаболически регулируемая активация экспрессии целевых генов
Одной из основных проблем современной метаболической инженерии является снижение продуктивности клеток штаммов-продуцентов при переходе в стационарную фазу роста за счет существенного снижения их метаболической активности [Hengge-Aronis, 1996]. В связи с этим, особый интерес представляют подходы, обеспечивающие регулируемую активацию экспрессии целевых генов в стационарной фазе роста клеток.
Известно, что одним из ключевых ферментов биосинтеза ароматических аминокислот является 3-деокси-d-арабино-гептулозонат 7-фосфат синтетаза (DAHPS, ЕС 2.5.1.54). В нашем распоряжении имелся штамм-продуцент l-фенилаланина (l-Phe), DV269-2, [Doroshenko и др., 2010]. В его хромосоме наряду с тремя генами aroG, aroF и aroH, кодирующими DAHPS, чувствительные к ретроингибированию l-Phe, l-тирозином (l-Tyr) и l-триптофаном (l-Trp), соответственно [Pittard, 1996], присутствовал также мутантный ген aroG4, продукт которого устойчив к ретроингибированию l-Phe [Kikuchi и др., 1997]. Гены aroG и aroG4 находились под транскрипционной регуляцией нативного промотора ParoG. Измерение активности DAHPS в экстрактах клеток штамма DV269-2, выросших на комплексной среде в условиях ограничения роста биомассы при истощении неорганического фосфата (Pi), выявило: (i) ее приблизительно двукратное падение на поздних стадиях культивирования (см. рис. 3); (ii) пренебрежимо малый вклад в общую активность двух других изоферментов, AroF и AroH (данные не представлены) и (iii) примерно одинаковую активность AroG и AroG4 (см. рис. 3).
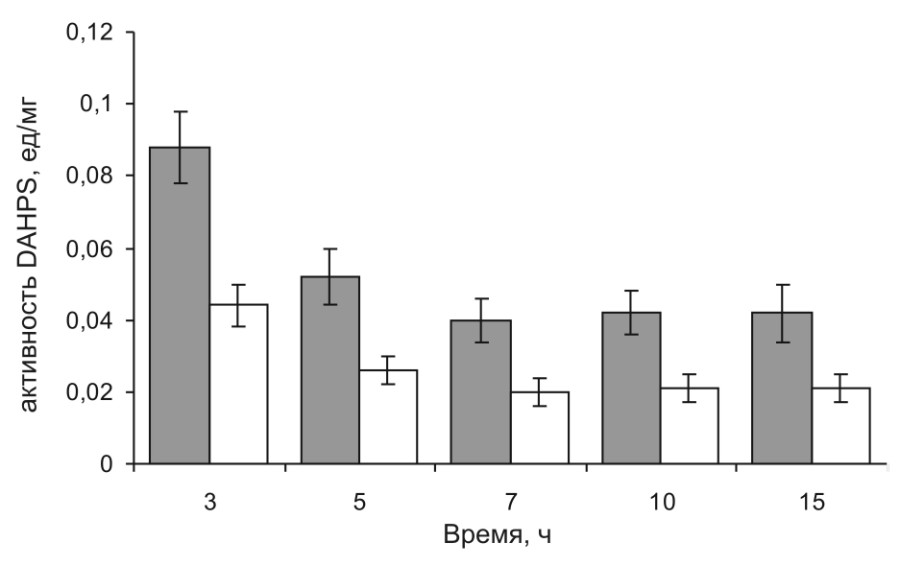
Рисунок 3. Временной профиль активности DAHPS в клетках штамма DV269-2 измеренной без () и с добавлением () l-Phe (5 мМ).
Также было обнаружено, что истощение Pi в среде в процессе культивирования клеток, приводящее к активации Pho регулона [Wanner, 1996; Hsieh и Wanner, 2010] и возрастанию активности щелочной фосфатазы E.coli (PhoA) (см. рис. 4А), происходило, когда оптическая плотность культуры не превышала 70% от максимально достигаемого значения (см. рис. 4Б).
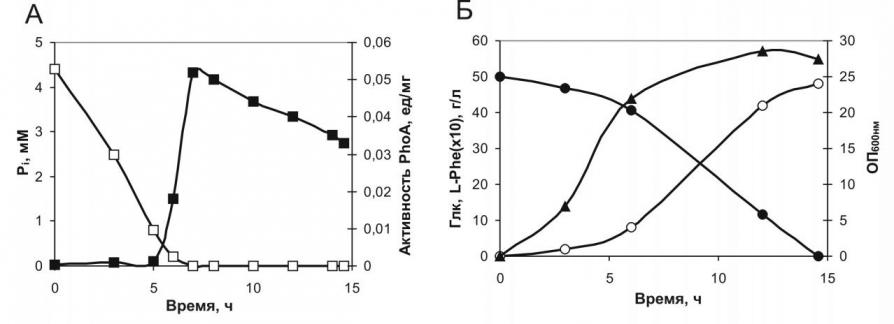
Рисунок 4. Временные профили культивирования клеток штамма DV269-2, отражающие:(A) потребление Pi () и активность PhoA (); (Б) потребление Глк (), рост клеток () и накопление l-Phe ()
Кроме того, были основания полагать, что AroG не вносит существенного вклада в накопление l-Phe клетками штамма DV269-2 при суперпродукции этой аминокислоты из-за ретроингибирования фермента «дикого типа» [Doroshenko и др., 2007]. Действительно, делеция гена aroG в штамме DV269-2, полученная методом Red-зависимой рекомбинации, не повлияла на накопление l-Phe новым штаммом ((4,7±0,3) г/л). Поэтому мы ожидали, что введение в геном штамма DV269-2 вместо aroG второй копии aroG4 под транскрипционным контролем одного из промоторов Pho регулона E. coli приведет к увеличению уровня активности DAHPS на поздней стадии роста клеток и, следовательно, к повышению уровня продукции l-Phe.
2.1. Конструирование PphoA/pstS-aroG4 методами рекомбинационной инженерии
На первом этапе в штамме MG1655-[80attBnative] вместо гена aroG с помощью Red-зависимой интеграции был введен фрагмент, содержащий маркер устойчивости к канамицину (KmR), окруженный сайтами 80attL/R. Затем данный маркер был удален с помощью 80Int/Xis рекомбиназы, и в образовавшийся сайт 80attB с помощью 80 сайт-специфической интеграции была интегрирована плазмида pAH162-[aroG4]. Вся процедура была проведена согласно предложенной Минаевой и соавт. стратегии прецизионной интеграции протяженных участков ДНК в хромосому E. coli [Minaeva и др., 2008]. Полученная конструкция содержала беспромоторную копию гена aroG4 вместо гена aroG в бактериальной хромосоме. На следующем этапе методом ПЦР были получены два фрагмента, содержащие «вырезаемый» маркер CmR и один из промоторов Pho регулона: PphoA или PpstS [Taschner et al., 2004]. Фрагменты были интегрированы с помощью Red-зависимой гомологичной рекомбинации перед геном aroG4. Полученные штаммы MG1655-[aroG::PphoA-aroG4, 80attBnative] и MG1655-[aroG::PpstS-aroG4, 80attBnative] использовали в качестве доноров для P1 трансдукции структур PphoA/pstS-aroG4 в штамм DV269-2. Int/Xin зависимое удаление маркера из хромосом штаммов DV269-2-[PphoA/pstS-aroG4] завершило процедуру введения второй копии гена aroG4 под контролем Pi-индуцибельных промоторов (см. рис. 5).
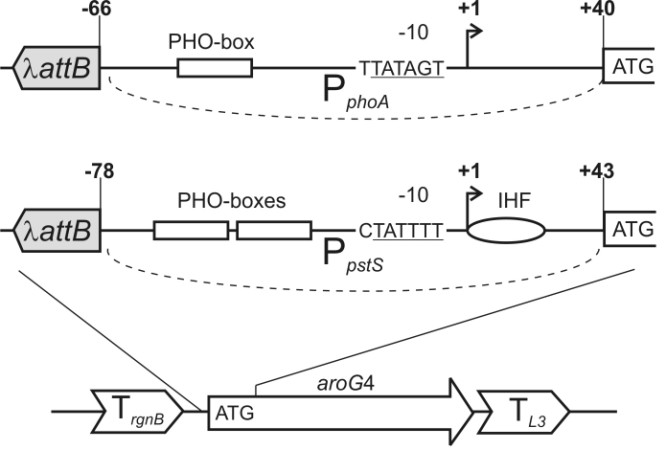
Рисунок 5. Существенные компоненты промоторов PpstS и PphoA: PHO-бокс (прямоугольник), сайт связывания белка IHF (овал), последовательность области «10» (подчеркнута) содержащая C в позиции -13, существенная для связывания с S [Taschner и др., 2006]. Сайт attB остается после Int/Xin-зависимого удаления маркера CmR. TrgnB и TL3, терминаторы транскрипции из интегративной плазмиды pAH162 [Minaeva и др., 2008]
2.2. Характеристика новых штаммов DV269-2-[PphoA/pstS-aroG4]
Измерение активности DAHPS в экстрактах клеток штаммов DV269-2-[PphoA/pstS-aroG4] продемонстрировало эффект метаболической активации экспрессии введенной копии aroG4 (см. рис. 6).
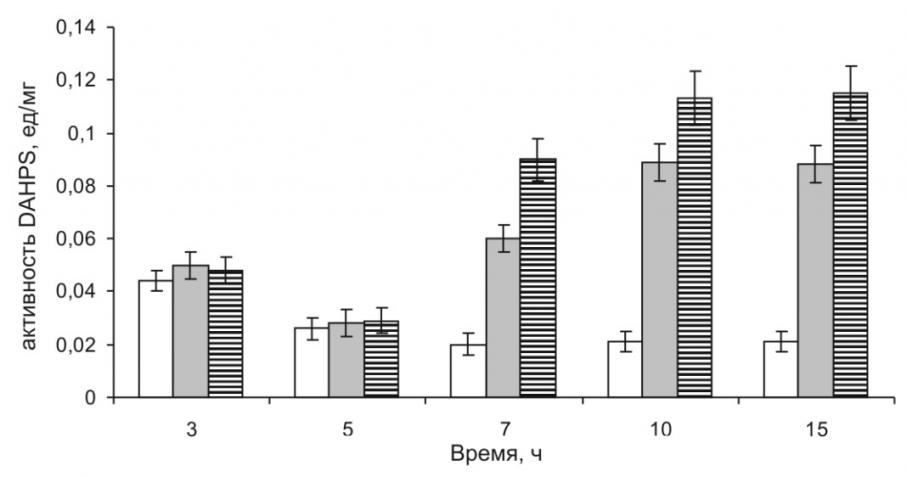
Рисунок 6. DAHPS активность в клетках штамма DV269-2 содержащего: aroG4 (), PphoA-aroG4 () и PpstS-aroG4 ()
Повышение уровня активности DAHPS на поздних стадиях культивирования клеток привело к увеличению накопления l-Phe соответствующими штаммами (см. таб. 1).
Таблица 1
Максимальный рост и накопление l-Phe штаммами-продуцентами
| Штамм | мах ОП600нм | l-Phe, г/л |
| DV269-2 | 28±1 | 4,8±0,3 |
| DV269-2-[aroG] | 27±1 | 4,7±0,3 |
| DV269-2-[PphoA-aroG4] | 30±1 | 6,1±0,3 |
| DV269-2-[PpstS-aroG4] | 31±1 | 6,7±0,3 |
Известно, что промотор PpstS единственный из изученных промоторов Pho регулона, который узнается комплексом кор-фермента РНК полимеразы E. coli (E) как с 70, так и с S субъединицей [Taschner и др., 2006]. Поэтому его использование для поддержания высокого уровня транскрипции на поздних стадиях культивирования выглядит более перспективным. Действительно, двумерный электрофорез белков, выделенных из клеток штамма DV269-2-[PpstS-aroG4] после длительного (>40 ч) культивирования, наглядно продемонстрировал, что количество белка AroG4, ген которого в данном штамме находился под контролем PpstS, остается практически неизменным, а доли таких белков, как PhoA и глутамат дегидрогеназы (GdhA), гены которых транскрибируются лишь E70, уменьшаются в препаратах клеточных белков на поздних стадиях ферментации (см. рис. 7).

Рисунок 7. Двумерный гель-электрофарез белков клеток штамма DV269-2-[PpstS-aroG4] на 20ч и 40ч в условиях длительного культивирования
Таким образом, использование современного инструментария рекомбинационной инженерии, позволило нам эффективно повысить уровень биосинтеза целевого продукта за счет искусственно обеспеченной транскрипции ключевых биосинтетических генов с метаболически регулируемых промоторов, активных в стационарной фазе роста клеток. Отметим, что использование промоторов Pho регулона, особенно промотора PpstS, может быть целесообразно в случаях длительного культивирования клеток на комплексных средах в условиях ограничения роста биомассы количеством исходно добавленного неорганического фосфата.
3. Повышение уровня экспрессии дистальных цистронов искусственных оперонов за счет эффекта трансляционного сопряжения
Практика конструирования искусственных оперонов из отдельных цистронов в метаболической инженерии давно существует и весьма успешна. Однако имеются многочисленные примеры, когда для таких искусственных оперонов наблюдаются полярные эффекты, приводящие к снижению уровня экспрессии дистальных цистронов [Smolke и Keasling, 2002]. Проблема обостряется при переносе искусственных оперонов с плазмидных систем в хромосому, так как при этом копийность генов, входящих в состав оперона, значительно снижается.
Для преодоления этих трудностей нами был разработан метод оптимизации экспрессии дистальных цистронов посредством организации в хромосоме искусственных «TGATG-оверлаппонов» [Машко и др., 1984; Schoner и др., 1984]. Метод основывается на явлении трансляционного сопряжения [Oppenheim и Yanofsky, 1980], суть которого заключается в ре-инициации трансляции дистального цистрона 30S субъединицами рибосом, терминирующихся на стоп-кадоне проксимального цистрона. Тем самым нивелируется зависимость инициации трансляции последующего гена от вторичной структуры межцистронной области, и снижается вероятность возникновения полярного эффекта.
3.1. Оценка эффективности экспрессии генов оперона Ptacideal-aroG4-serA5
В нашей лаборатории был сконструирован искусственный оперон Ptacideal-aroG4-serA5, кодирующий устойчивые к ретроингибированию варианты ключевых ферментов пути биосинтеза l-Trp, находящихся под контролем искусственного, ИПТГ индуцибельного промотора Ptacideal [Машко и др., 2001; Скороходова и др., 2006]. Интегрированный в хромосому MG1655 оперон был маркирован в дистальной области «вырезаемым» CmR для облегчения его переноса в другие штаммы с помощью Р1 трансдукции.
Клетки штамма AB3257(lacIwt, Aro), получившие оперон Ptacideal-aroG4-serA5 в результате Р1 трансдукции, при высеве на минимальную среду восстанавливали способность к синтезу ароматических соединений даже без индукции ИПТГ. Отметим при этом, что уровень репрессии транскрипции с Ptacideal в штаммах с lacIwt составляет около 10% от уровня максимальной дерепрессии [Машко и др., 2001]. В клетках штамма E. coli TG1(lacIQ), куда оперон также был перенесен с помощью P1 трансдукции, уровень активности DAHPS при росте на среде без ИПТГ не отличался от контрольных значений в исходном штамме TG1 (0,220,23) ед/мг, и значительно возрастал в условиях индукции (1,08 ед/мг). Исходя из известных данных об удельной ферментативной активности очищенного AroG (67 ед/мг [Simpson и Davidson, 1976]), уровень накопления AroG/AroG4 в условиях индукции можно оценить в 1,6% от суммарных клеточных белков. Таким образом, полученные данные свидетельствовали о высоком уровне экспрессии первого в опероне гена aroG4. В тоже время, уровень экспрессии дистального цистрона, serA5, был явно ниже. Так для клеток штамма MG1655(lacIwt, Ser), содержащих данный оперон, ауксотрофность по Ser частично комплементировалась лишь в условиях индукции оперона: в присутствии ИПТГ наблюдался достоверный рост клеток на минимальной среде, но более слабый, чем у клеток контрольного штамма MG1655, а без добавления ИПТГ рост практически отсутствовал.
Секвенирование оперона показало отсутствие мутаций в гене serA5. Удаление маркера CmR с сохранением за serA5 лишь attB перед тандемом -независимых терминаторов транскрипции фага fd, которые, как правило, обеспечивают стабилизацию мРНК [Makrides, 1996], не повлияло на эффективность экспрессии гена serA5. Хотя компьютерный анализ [Reuter и Mathews, 2010] четко не выявил вторичных структур РНК, маскирующих SD последовательность гена serA5, единственным объяснением наблюдаемого низкого уровня его экспрессии был полярный эффект, возникающий вследствие неэффективной инициации трансляции. Повысить ее эффективность предполагалось, обеспечив сопряжение трансляции гена serA5 с геном aroG4, по механизму сопряжения цистронов в природных оперонах.
3.2. Оптимизация экспрессии serA5 путем преобразования структуры оперона
Для проведения модификации оперон Ptac-ideal-aroG4-serA5 был перенесен трансдукцией в штамм BW25113 [Datsenko и Wanner, 2000] с последующим Int/Xis-зависимым удалением дистального маркера CmR. In vitro, двумя раундами ПЦР амплификации, был получен ДНК фрагмент, на одном фланге которого содержался участок природного сопряжения между генами rplC и rplD, (условно rplD'), кодирующими рибосомальные белки L3 и L4, и область гомологии к гену aroG4, а на другом – участок природного сопряжения между генами trpE и trpD (условно 'trpE), кодирующими две субъединицы одного фермента, и область гомологии к гену serA5. Использование последовательности природного трансляционного сопряжения rplCD является ключевым моментом подхода. Особенность данной группы природных межцистронных участков заключается в расположении терминирующего кодона проксимального гена перед SD последовательностью дистального цистрона (см. рис. 8). Такая структура обеспечивает сопряжение без дополнительной модификации 3’-концевого участка кодирующей последовательности проксимального гена.

Рисунок 8. Межцистронные участки некоторых пар трансляционно-сопряженных генов E. coli и их существенные компоненты: терминирующий кодон проксимального гена (подчеркнут), SD-последовательность (жирный курсив) и ATG-кодон дистального гена (жирный шрифт)
В центральной части полученного in vitro фрагмента находился маркер CmR, окруженный сайтами attL/R для его последующего Int/Xin-зависимого удаления. Сайты attL/R были ориентированы таким образом, чтобы после удаления маркера остающийся в хромосоме attB не содержал в открытой рамке считывания, начинающейся с ATGrplD и заканчивающейся TGAtrpE, терминирующий кодон. Описанный фрагмент ДНК был прецизионно интегрирован с помощью Red-системы в оперон, в область между генами aroG4 и serA5. Наличие маркера позволяло переносить частично модифицированный оперон в различные штаммы трансдукцией. Удаление маркера из области модификации приводило к образованию трицистронного оперона Ptacideal-aroG4-(rplD'-attB-'trpE)-serA5, в котором трансляция гена serA5 через сопряжение с искусственно образованным промежуточным цистроном (rplD'-attB-'trpE) становилась сопряженной с трансляцией гена aroG4 (см. рис. 9).
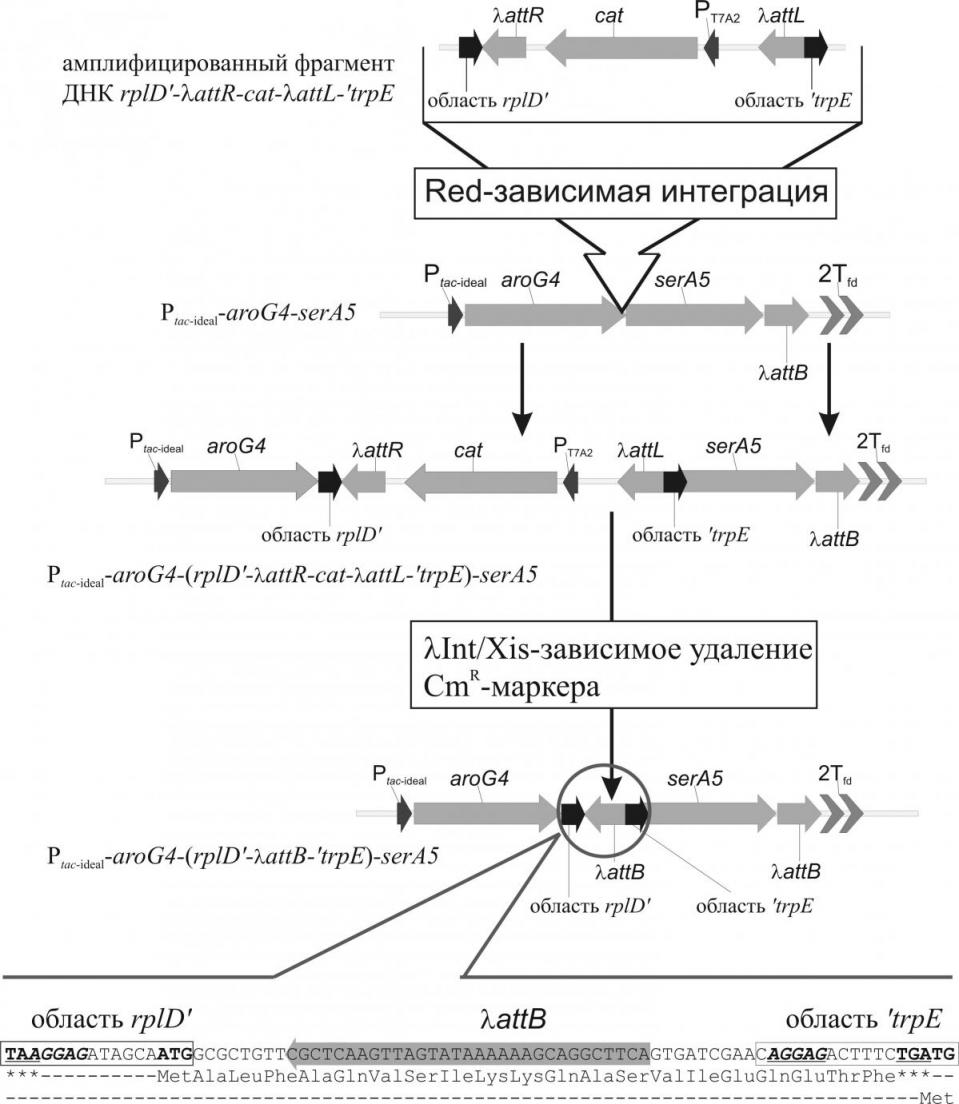
Рисунок 9. Схема конструирования трансляционно-сопряженного трицистронного оперона Ptacideal-aroG4-(rplD'-attB-'trpE)-serA5
3.3. Оценка уровня экспрессии гена serA5 в трицистронном опероне
Модифицированный оперон Ptac-ideal-aroG4-(rplD'-attR-cat-attL-'trpE)-serA5 был введен с помощью P1 трансдукции в штамм MG1655(lacIwt, Ser). Напомним, что изогенный штамм с Ptacideal-aroG4-serA5 был способен к достоверному росту на минимальной среде только в условиях полной индукции оперона ИПТГ. Вновь полученный штамм, содержащий маркированный оперон Ptac-ideal-aroG4-(rplD'-attR-cat-attL-'trpE)-serA5 имел фенотип Ser независимо от присутствия ИПТГ в среде. Однако, после удаления маркера с помощью Int/Xin-рекомбиназы штамм с трицистронным опероном, Ptac-ideal-aroG4-(rplD'-attB-'trpE)-serA5, был способен к заметному росту на минимальной среде даже в отсутствии ИПТГ. Этот качественный тест однозначно указывал на существенное повышение уровня экспрессии serA5 в результате модификации исходного оперона.
Для количественной оценки уровня биосинтеза SerA5 препараты клеточных белков из штаммов E.coli BW25113, содержащих модифицированный и исходный опероны, разделяли двумерным электрофорезом (см. рис. 10). Идентификацию зон AroG/AroG4 и SerA/SerA5 проводили с помощью масс-спектрометрии, а количественное определение синтезированного белка проводили с помощью денситометрии прокрашенного геля. Этот метод не позволял различить AroG и AroG4, а также SerA и SerA5, поэтому из суммарных значений интенсивностей пятен AroG/AroG4 и SerA/SerA5 вычитали значения, характерные для штамма BW25113, содержавшего только нативные гены aroG и serA. В условиях индукции уровень синтеза AroG4 в двух штаммах практически совпадал и составлял ~1,5% от определяемых клеточных белков, что соответствовало данным по активности DAHPS. Уровень же SerA5 существенно отличался (см. рис. 10).
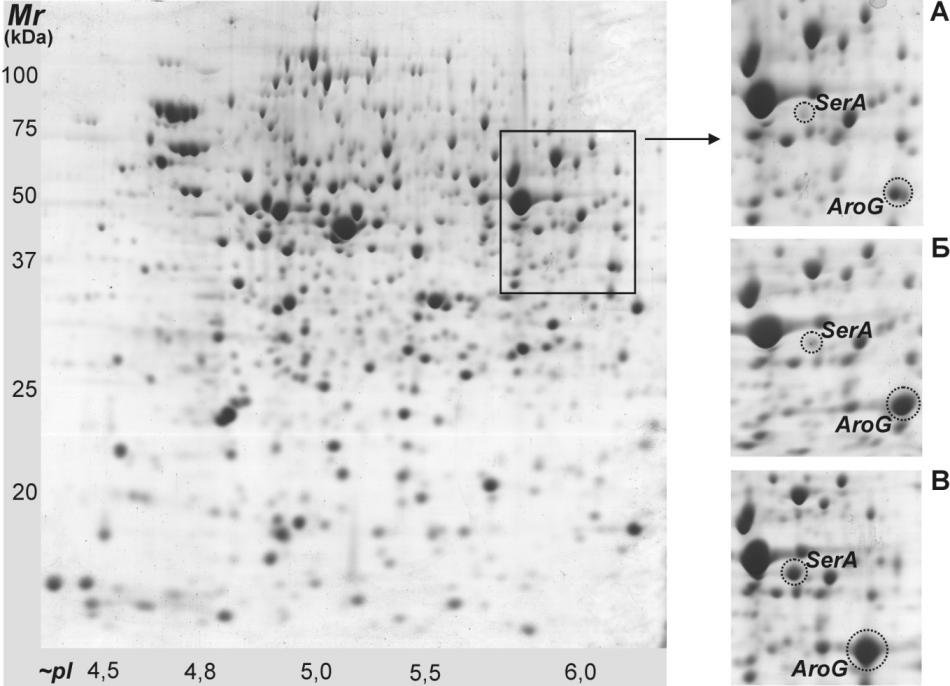
Рисунок 10.
Результат двумерного электрофореза клеточных белков и фрагменты гелей, полученных для штаммов на основе E. coli BW25113 с интегрированными оперонами:
(А) Ptac-ideal-aroG4-serA5, ИПТГ– (Б) Ptac-ideal-aroG4-serA5, ИПТГ+ (В) Ptac-ideal-aroG4-(rplD'-attB-'trpE)-serA5, ИПТГ+
Так, в клетках с исходным двуцистронным опероном рассчитанное молярное соотношение AroG4 и SerA5 составляло примерно 100/10, в то время как в клетках с модифицированным трицистронным опероном оно достигало примерно 100/25.
Таким образом, использование современного инструментария рекомбинационной инженерии позволило нам оптимизировать экспрессию дистального цистрона искусственного оперона за счет организации трансляционного сопряжения с эффективно транслируемым проксимальным геном. Заметим, что при соблюдении общего принципа разработанного метода можно варьировать нуклеотидную последовательность вводимого в межцистронную область фрагмента ДНК. Так в качестве «вырезаемого» маркера можно использовать ген устойчивости к любому антибиотику, фланкированный сайтами других специфических рекомбиназ (например, FRT – для Flp [Datsenko и Wanner, 2000; Huang и др., 1997], loxP – для Cre [Altier и Suyemoto, 1999; Buchholz и др., 1996]), а также использовать другие природные межцистронные последовательности. Важно отметить, что данный метод может применяться для организации более сложных, чем бицистронные, генетических элементов. Примеры таких модификаций в настоящее время получены в нашей лаборатории при создании промышленно значимых продуцентов ароматических аминокислот.
4. Снижение уровня экспрессии генов за счет искусственно организованной встречной транскрипции
В современной метаболической инженерии крайне востребованы методы, осуществляющие регулируемое снижение экспрессии генов («gene silencing»). Данные методы являются хорошей альтернативой инактивации «нежелательного» гена путем его делеции, особенно в случаях, когда экспрессия гена нежелательна для целевого синтеза, но важна для жизнеспособности клетки [Nakashima и др., 2006]. В прокариотах для решения этой задачи, как правило, используют метод, основанный на взаимодействии между мРНК и анти-смысловой (anti-sense) РНК (асРНК) [для обзора см. Brantl, 2002]. Однако такие искусственные регуляторы пока проигрывают в эффективности природной регуляции экспрессии генов, основанной на том же молекулярном механизме [Kim и Cha, 2003; Ji и др., 2004; Kemmer и Neubauer, 2006]. Организация встречной по отношению к целевому гену транскрипции является одним из альтернативных методов. Его эффективность впервые была продемонстрирована в 80-е годы [Ward и Murray, 1979, Elledge и Davis, 1989]. Кроме того, в виду обнаружения в бактериях большого числа коротких асРНК, транскрипция которых конвергентна синтезу соответствующих мРНК, в современной литературе обсуждается возможность широкого использования регуляции такого рода в природе[Dornenburg и др., 2010]. Тем не менее, к моменту начала данного исследования в современной метаболической инженерии встречная транскрипция как метод снижения уровня экспрессии генов-мишеней не использовалась.
Представляло интерес исследовать возможность применения данного подхода с помощью современных методов модификации бактериальной хромосомы, основанных на рекомбинационной инженерии.
4.1. Конструирование штаммов E. coli для исследования эффектов встречной транскрипции
Для организации встречной транскрипции в качестве гена-мишени был выбран ген pykF, кодирующий одну из двух пируваткиназ E. coli [Ponce и др., 1995], ключевого фермента гликолиза, эффективно синтезирующегося в быстро растущих клетках [Bledig, 1996]. Для качественной оценки уровня экспрессии гена pykF был сконструирован модельный штамм E. coli MG1655, содержащий делеции генов pykA, кодирующего вторую пируваткиназу, и edd-eda, кодирующих ферменты пути Энтнера-Дудорова, полученные с помощью Red-зависимой рекомбинации. Модельный штамм AK001 = MG1655-[pykA, (edd-eda)] являлся реципиентом для всех последующих модификаций.
Уровень экспрессии гена pykF оценивали фенотипически, используя тест «рост/отсутствие роста» на минимальной среде с рибозой (Риб). В этих условиях, на фоне инактивации генов pykA и edd-eda, образование пирувата (см. рис. 11), а, следовательно, и рост клеток практически полностью зависел от активности белка PykF [Ponce и др., 1995].
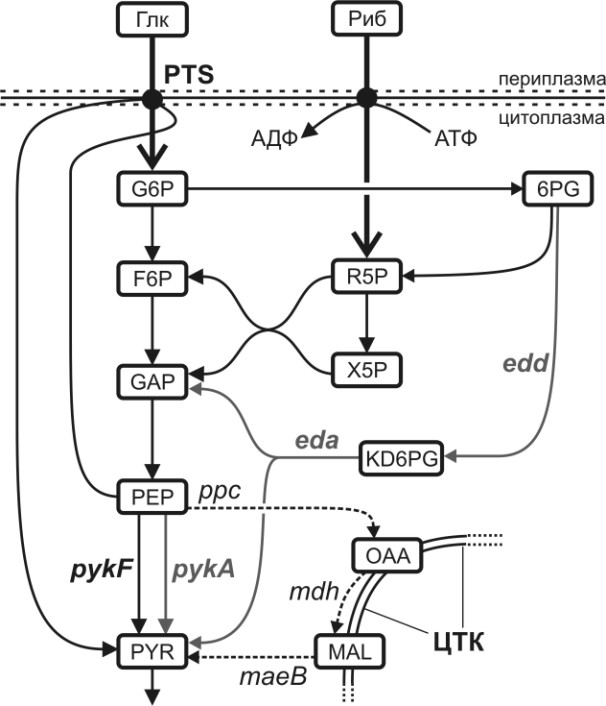
Рисунок 11. Схема биосинтеза пирувата в E. coli из рибозы (Риб) и глюкозы (Глк). Отмечены только упомянутые в тексте гены. 6PG = глюконат-6-фосфат, F6P = фруктозо-6-фосфат, G6P = глюкозо-6-фосфат, GAP = глицеральдегид-3-фосфат, KD6PG = 2-кето-3-дезокси глюконат-6-фосфат, MAL = малат, OAA = оксалоацетат, R5P = рибоза-5-фосфат, ЦТК = цикл трикарбоновых кислот, X5P = ксилозо-5-фосфат
В геном штамма AK001 дистальнее предполагаемого Rho-независимого терминатора транскрипции pykF (TpykF) [Kingsford и др., 2007] с помощью Red-зависимой рекомбинации был интегрирован фрагмент ДНК с регуляторной областью PL/OL (PL), обеспечивающей встречную, по отношению к pykF, транскрипцию. Известно, что транскрипция с PL негативно регулируется репрессором CI [Ptashne, 1992], а в условиях дерепрессии PL является одним из наиболее «сильных» промоторов, узнаваемых РНК полимеразой E.coli [Deuschle и др., 1986; Liang, 1999]. В состав интегрированного фрагмента ДНК входил также существенный для N-зависимой системы анти-терминации транскрипции фага участок nutL, расположенный по ходу транскрипции c PL [Ptashne, 1992]. Полученный таким образом штамм, AK002, использовали для дальнейшей модификации.
С помощью рекомбинационной инженерии, была проведена замена nutL на последовательность анти-терминатора транскрипции рибосомального оперона rrnG (ATrrnG) [Albrechtsen и др., 1991]. Предполагалось, что в полученном таким образом штамме AK003 транскрипция с PL будет защищена от Rho-зависимой терминации [Epshtein и др., 2010; Albrechtsen и др., 1990]. Также в хромосомы штаммов AK002 и AK003 между PL /PL-ATrrnG и TpykF был прецизионно интегрирован эффективный Rho-зависимый терминатор транскрипции, rho_a [Brown и др., 1982]. Соответствующие штаммы были обозначены как AK004 и AK005. Положение по отношению к гену pykF введенных функциональных элементов приведено на рисунке 12.
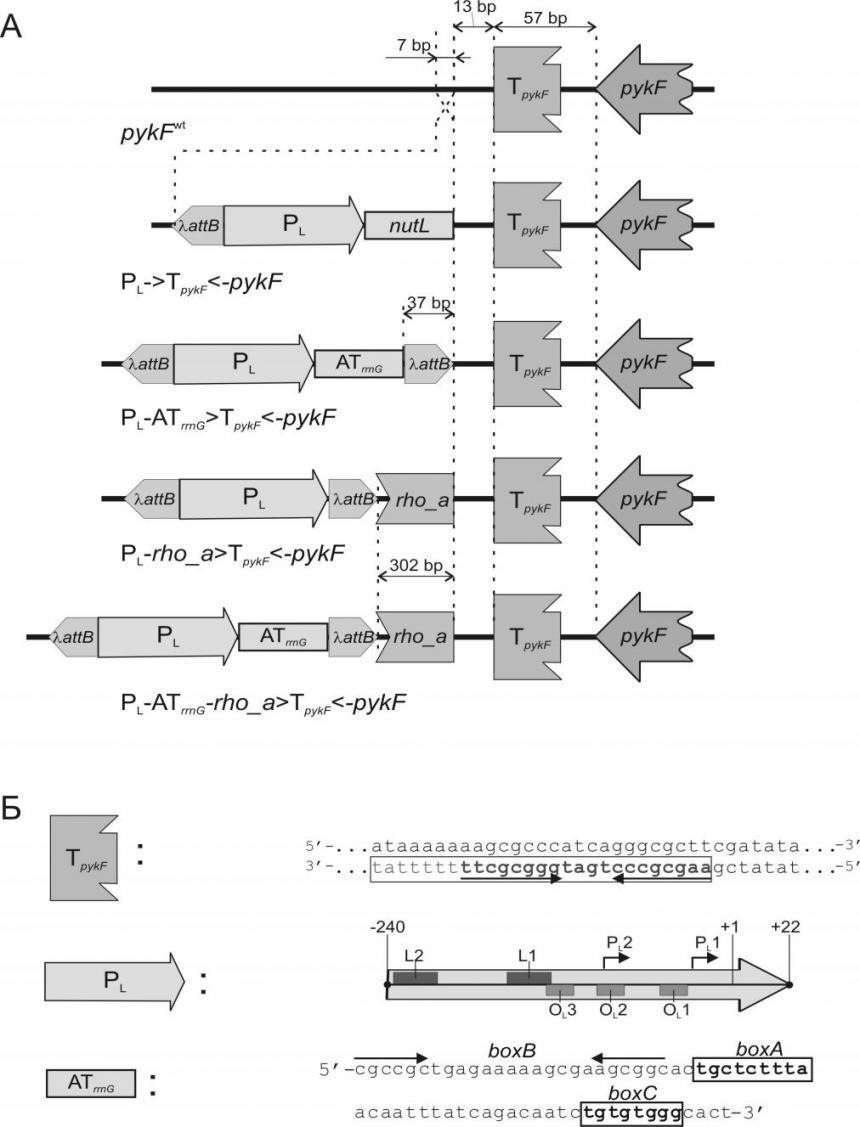
Рисунок 12. (A) схема расположения промотора PL относительно Rho-независимого терминатора pykF (TpykF)[Kingsford и др., 2007]; позиция интегрирования анти-терминатора rrnG (ATrrnG) вместо nutL по ходу транскрипции с PL: а также последовательность Rho-зависимого терминатора (rho_a)[ Brown и др., 1982]. Участок attB остается после Int/Xin-зависимого удаления маркера. (Б) Приведена: нуклеотидная последовательность TpykF, демонстрирующая GC-богатый ивертированый повтор (стрелки) и T-богатый участок; структура PL [Giladi и др., 1992, 1996], включающая промоторы PL1 и PL2, сайты связывания с IHF (L1, L2), и операторные участки связывания с CI (OL1, OL2, OL3); структура ATrrnG, включающая элементы boxA, boxB, boxC [Li и др., 1984]. Способность boxB формировать шпилечную структуру отмечена стрелками
4.2. Изучение конститутивного режима встречной транскрипции
Клетки экспериментальных штаммов серии AK были проверены на способность расти на агаризованной среде с Риб или Глк в качестве единственного источника углерода. Рост клеток штаммов AK000 и AK001 с инактивированным pykF или с pykFwt в этих условиях полностью совпадал с ожидаемым [Ponce и др., 1995] (см. табл. 2). Незначительный рост клеток штамма AK000 (pykF) на Риб видимо был обусловлен образованием пирувата за счет активности ферментов пути Ppc-Mdh-Mez [Siddiquee и др., 2004; Kurata и др., 2007]. Способность к росту штамма AK000 на Риб была условно принята за «».
Таблица 2
Рост полученных штаммов на минимальной среде с различными источниками углерода и уровень активности PykF в клеточных экстрактах
| Штамм | Описание | Сравнительный рост на: | Акт. PykF, мЕд/мг | |
| глюкозе | рибозе | |||
| AK000 | MG1655-[pykF, pykA, (edd-eda)] | +++ | - | н.д. |
| AK001 | MG1655-[pykA, (edd-eda)] | ++++ | ++++ | 590±30 |
| AK002 | AK001-[PLTpykFpykF] | +++ | - | 10±5 |
| AK003 | AK001-[PL-ATrrnGTpykFpykF] | +++ | - | 10±5 |
| AK004 | AK001-[PL-rho_aTpykFpykF] | ++++ | +++ | 480±20 |
| AK005 | AK001-[PL-ATrrnG-rho_a TpykFpykF] | +++ | - | 10±5 |
Клетки штаммов AK002 и AK003, содержащие структуры PL и PL-ATrrnG, демонстрировали близкий к PykF фенотип, что соответствовало также следовым значениям активности PykF в экстрактах клеток, выращенных в жидкой минимальной среде с Глк. В обоих случаях уровень этой активности не превышал 5% от активности PykF в клетках AK001 с геном pykFwt. Таким образом, конститутивная встречная транскрипция с PL приводила к существенному снижению экспрессии pykF, независимо от наличия или отсутствия последовательности ATrrnG в составе синтезируемой асРНК. Однако роль этого специфического анти-терминатора проявлялась в случае введения Rho-зависимого терминатора ориентированного на встречную транскрипцию. Эффективность подавления экспрессии pykF драматически падала в штамме AK004 с интегрированным rho_a, но оставалась высокой в штамме AK005 с PL-ATrrnG-rho_a из-за присутствия в составе асРНК специфического анти-терминатора.
Для штаммов AK001, AK002, AK003, выращенных на минимальной среде с Глк, проанализировали транскрипты участка структурной части гена pykF методом ПЦР c обратной транскрипцией (ОТ-ПЦР). Эксперимент проводился в соответствии с представленной на рис. 13А схемой.
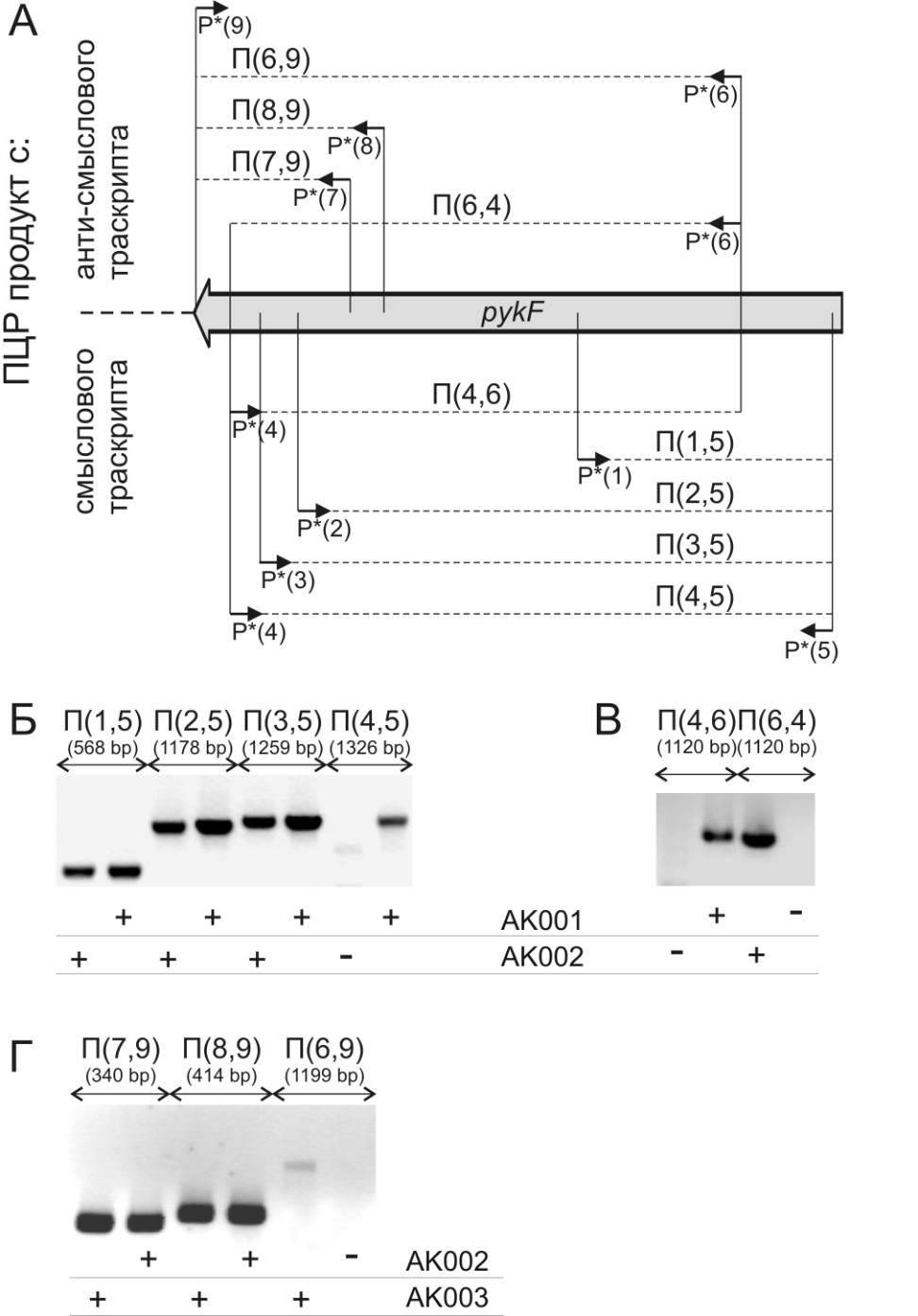
Рисунок 13. (А) Схема ОТ-ПЦР анализа транскриптов из штаммов AK001, AK002, AK003. Амплимеры П(i,j) получались после обратной транскрипции с праймера P*(i) и последующего ПЦР с добавлением праймера P*(j). Амплимеры, соответствующие (Б) мРНКpykF и (В) мРНКpykF и асРНК из штаммов AK001 и AK002. (Г) Амплимеры, соответствующие асРНК из штаммов AK002 и AK003.
Для штаммов AK002 и AK001 в определяемых количествах присутствовала мРНКpykF, по размеру соответствующая 90% кодирующей части гена. Однако более длинные транскрипты удалось зарегистрировать только в клетках штамма AK001 (см. рис. 13Б). При этом, в штамме AK002 присутствовала асРНК, соответствующая по длине 85% 3’-концевой части pykF (см. рис. 13В). Данный факт позволил предположить, что снижение уровня экспрессии pykF обусловлено уменьшением доли полноразмерных молекул мРНКpykF из-за искусственно организованной встречной по отношению к pykF транскрипции в клетках AK002.
Также анализ ОТ-ПЦР выявил, что в клетках штамма AK003 присутствует более длинная асРНК, чем в клетках штамма AK002 (см. рис. 13Г). Это, по-видимому, указывало на существование преждевременной диссоциации «встречных» РНК полимераз с ДНК матрицы за счет Rho-зависимой терминации. Введение же ATrrnG снижало эффективность терминации встречной транскрипции.
4.3. Изучение регулируемого снижение уровня экспрессии гена pykF
Для осуществления регуляции подавления экспрессии pykF в хромосому MG1655 посредством 80-зависимой сайт-специфической интеграции была введена кассета, несущая ген термочувствительного репрессора CIts857 [Ptashne, 1992] и гибридный ген cro’-cat под контролем PR/OR (PR) [Машко и др., 1989]. Далее интегрированная кассета была перенесена с помощью P1 трансдукции в штаммы AK000, AK001, AK002, AK003. Полученные при этом штаммы получили название AK006, AK007, AK008, AK009, соответственно. Хорошо известно [Ptashne, 1992], что постепенное повышение (с 30 до 42оС) температуры культивирования бактерий с геном cIts857 приводит сначала к частичной, а затем к полной инактивации репрессора CI и дерепрессии транскрипции с PR и PL промоторов. Как было показано ранее, в результате экспрессии гибридного гена cro’-cat происходит образование как белка-гибрида Cro’-Cat, так и полноразмерной и функционально активной хлорамфениколацетилтрансферазы (Cat) [Машко и др., 1989]. Измерение активности Cat в экстрактах полученных штаммов позволило оценить уровень дерепрессии транскрипции с промотора PL.
Клетки исследуемых штаммов предварительно выращивали на минимальной среде с Риб в условиях репрессии PL (30°C), и, следовательно, нормальной экспрессии pykF. Затем выросшие клетки пересевали на свежую среду того же состава и культивировали при 30, 37 и 42°C. Два последних температурных режима соответствовали условиям частичной и полной дерепрессии транскрипции с PL промотора, соответственно.

Рисунок 14. Эффект регулируемого температурой подавления экспрессии pykF. Рост экспериментальных штаммов, несущих ген cIts857 на агаризованной минимальной среде с Риб.
Рост клеток штаммов AK009 и AK008 сильно отличался при 42°C. Так для клеток AK009, содержащих PL-ATrrnG, он совпадал с ростом изогенного штамма AK006 с pykF. Клетки же AK008, не содержащие анти-терминатор rrnG, демонстрировали промежуточный между PykF и PykF+ фенотип. На 30 и на 37°C, рост обоих штаммов AK009 и AK008 практически не отличался от роста клеток штамма AK007 с геном pykFwt (см. рис. 14).
Эффективность регулируемого подавления экспрессии гена-мишени оценивали также по изменению ферментативной активности PykF в клетках после дерепрессии встречной транскрипции (см. рис. 15А).
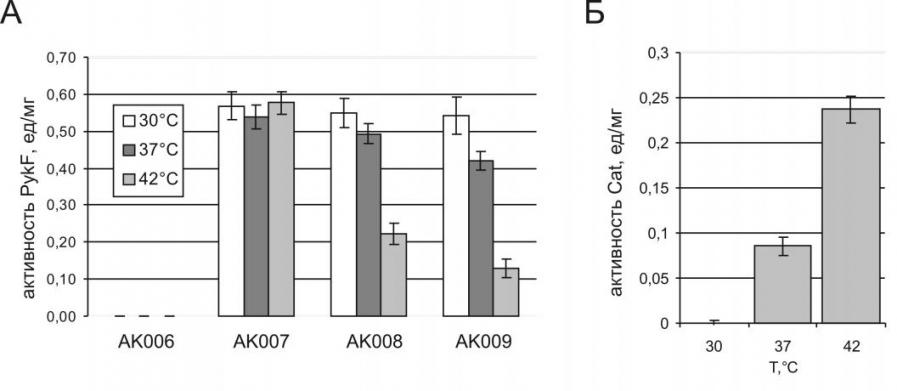
Рисунок 15. Активности белков (А) PykF и (Б) Cat в экстрактах клеток штаммов AK-серии, культивируемых при различных температурах
Так во всех исследованных штаммах AK-серии, содержащих cIts857, наблюдалось практически одинаковое возрастание активности Cat, а, следовательно, происходила индукция транскрипции с промоторов PL/PR при переносе клеток на повышенную температуру (см. рис. 15Б). Однако изменение активности PykF для разных штаммов было различным. Уровень активности оставался практически неизменным для штамма AK007 с геном pykFwt при культивировании на всех температурах. В то же время достоверное снижение активности наблюдалось в случае индукции встречной транскрипции в штаммах AK008 и AK009. (на Рис. 15 представлены результаты, полученные через 3-3,5 часа после повышения температуры). При этом в штамме AK009 уровень активности PykF снижался быстрее, чем в штамме AK008, что было особенно заметно при небольших временах термоиндукции (данные не представлены).
Результаты проведенного исследования подтверждают показанную ранее [Ward и Murray, 1979, Elledge и Davis, 1989] высокую эффективность подавления экспрессии гена-мишени путем организации встречной транскрипции. Однако впервые явно демонстрируют критический момент практической реализации такого подхода – чувствительность встречной транскрипции к преждевременной терминации по Rho-зависимому механизму. Для преодоления этого момента предложена стратегия защиты встречной транскрипции системой Rho-зависимой анти-терминации. Эффективность данной модификации метода продемонстрирована на примере подавления экспрессии гена pykF. В настоящее время искусственно организованная встречная транскрипция, устойчивая к Rho-зависимой терминации, активно используется в нашем институте для метаболически регулируемого подавления экспрессии различных генов-мишеней.
Выводы.
- На примере модификации хромосомы E. coli MG1655 и создания штаммов с улучшенными ростовыми характеристиками показано, что рекомбинационная инженерия позволяет прецизионно маркировать целевые генетические локусы для удобства их трансдукции. В дальнейшем введенный селективный маркер может быть удален с помощью сайт-специфической рекомбинации, и, тем самым, осуществлено конструирование штаммов, не содержащих генов устойчивости к антибиотикам.
- В результате конструирования новых штаммов продуцентов l-фенилаланина впервые в практике метаболической инженерии показано, что промоторы Pho регулона E. coli, PphoA и PpstS, могут быть использованы для повышения уровня экспрессии биосинтетического гена aroG4 и увеличения накопления аминокислоты на поздних стадиях культивирования клеток при росте бактерий на комплексной среде с глюкозой, когда исходно добавленный неорганический фосфат является фактором ограничения роста биомассы.
- При оптимизации продуцента l-триптофана разработан и апробирован новый способ конструирования искусственных оперонов с трансляционно-сопряженными генами в бактериальной хромосоме. Метод включает конструирование in vitro оперона с эффективно транслируемым проксимальным цистроном; интеграцию оперона в хромосому E. coli; модификацию оперона в хромосоме путем интеграции специального «переходника» с вырезаемым селективным маркером в межцистронную область с последующим удалением маркера.
- На модели гена pykF E. coli, регуляторной области PL/OL, белка-регулятора CIts857 и анти-терминатора транскрипции ATrrnG разработана новая стратегия регулируемого снижения уровня экспрессии целевого гена в результате организации с помощью рекомбинационной инженерии его конвергентной транскрипции, устойчивой к Rho-зависимой терминации.
Список работ, опубликованных по теме диссертации:
- А.Ю. Гулевич, А.Ю. Скороходова, В.Ю. Ермишев, А.А. Крылов, Н.И. Минаева, З.М. Полонская, Д.В. Зименков, И.В. Бирюкова, С.В. Машко. «Новый метод конструирования оперонов с трансляционно-сопряженными генами в бактериальной хромосоме», Молекулярная Биология. 2009;43(3):1-11
- Гулевич А.Ю., Скороходова А.Ю., Ермишев В.Ю., Минаева Н.И., Зименков Д.В., Крылов А.А., Бирюкова И.В., Машко С.В. «Способ конструирования оперонов, содержащих трансляционно-сопряжённые гены», Заявка на патент РФ №2008105793, 2008
- И.В. Бирюкова, А.А. Крылов, Е.М. Киселева, Н.И. Минаева, С.В. Машко «Конструирование на основе E.coli K-12 MG1655 нового штамма с улучшенными ростовыми характеристиками для экспериментов по метаболической инженерии», Генетика. 2010; 46(3):349-355
- Krylov AA, Airich LG, Kiseleva EM, Minaeva NI, Biryukova IV, Mashko SV. «Conditional silencing of the Escherichia coli pykF gene results from artificial convergent transcription protected from Rho-dependent termination», J Mol Microbiol Biotechnol. 2010;18(1):1-13
- Doroshenko VG, Tsyrenzhapova IS, Krylov AA, Kiseleva EM, Ermishev VY, Kazakova SM, Biryukova IV, Mashko SV «Pho regulon promoter-mediated transcription of the key pathway gene aroG (Fbr) improves the performance of an L-phenylalanine-producing Escherichia coli strain», Appl Microbiol Biotechnol. 2010;88:1287-1295
- Gulevich A., Zimenkov D., Skorokhodova A., Minaeva N., Krylov A., Ivanov D., Doroshenko V., Biryukova I., Mashko S. «Improvement of the performances of aromatic amino acids producing E. coli strains could be achieved due to enhancement of PckA and/or Pgl activity», 10th Intern. Sympos. on the Genetics of Industrial Microorganisms, Prague (Czech Republic), 24-28 June, 2006, P387
- Krylov A.A., Airich L.G., Doroshenko V.G., Biryukova I.V., Mashko S.V. «Metabolically engineered E. coli gene expression: Efficient conditional gene silencing can be achieved using artificial convergent transcription protected from Rpo-dependent termination», Intern. Conf. on Environmental, Industrial and Applied Microbiology, Lisbon (Portugal), 2-4 December, 2009, P415

