Мутации с изменением копийности в генах park2 и snca при болезни паркинсона в россии
На правах рукописи
Семенова Елена Владимировна
МУТАЦИИ С ИЗМЕНЕНИЕМ КОПИЙНОСТИ В ГЕНАХ PARK2 И SNCA ПРИ БОЛЕЗНИ ПАРКИНСОНА В РОССИИ
Специальность 03.01.03 – Молекулярная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
МОСКВА – 2010
Работа выполнена в Отделе молекулярных основ генетики человека Учреждения Российской академии наук Института молекулярной генетики РАН (зав. отделом доктор биологических наук, профессор С. А. Лимборская).
Научный руководитель:
кандидат биологических наук Мария Игоревна Шадрина
ИМГ РАН
Официальные оппоненты:
доктор биологических наук, профессор Валерий Вячеславович Носиков
ФГУП «ГосНИИгенетика»
доктор биологических наук, профессор Игорь Анатольевич Гривенников
ИМГ РАН
Ведущая организация:
Учреждение Российской академии наук Институт биологии гена РАН
Защита диссертации состоится « » _____________ 2010 г. в часов
на заседании Диссертационного совета Д.217.013.01 при ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» по адресу: 117545, Россия, Москва, 1-ый Дорожный проезд д.1. Тел: (495)315-3747.
С диссертацией можно ознакомиться в научной библиотеке ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов»
Автореферат разослан « » 2010 г.
Ученый секретарь Диссертационного совета,
кандидат химических наук Т. Л. Воюшина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
На современном этапе достигнут большой прогресс в идентификации генов, вовлеченных в этиологию моногенных наследственных болезней. Это связано, как с успешным применением стратегии позиционного клонирования и развитием новых технологий, так и с успехами, достигнутыми в расшифровки генома человека. Основной проблемой сейчас является выявление генов, вовлеченных в патогенез мультифакториальных заболеваний. К такому типу заболеваний относятся, прежде всего, болезни сердечно-сосудистой системы, астма, сахарный диабет, многие нейропсихиатрические и неврологические заболевания. Особый интерес представляет изучение молекулярно-генетических основ мультифакториальных неврологических заболеваний, поскольку это позволит, во-первых, выявить новые закономерности в функционировании нервной системы на всех уровнях – от уровня клетки до организма в целом. Кроме того, выявление генетических маркеров данных заболеваний поможет разработать новые методы их диагностики. Разрабатываемые методы лечения и профилактики, в свою очередь, будут максимально учитывать генетические особенности каждого конкретного человека.
К числу тяжелых неврологических патологий относится болезнь Паркинсона (БП), которая является вторым по распространенности (после болезни Альцгеймера) нейродегенеративным заболеванием человека. Болезнь Паркинсона – это мультисистемное хроническое медленно прогрессирующее нейродегенеративное заболевание, связанное с нарушением деятельности базальных ганглиев головного мозга. В настоящее время полагают, что в основе БП лежит дегенерация или дисфункция дофаминергических нейронов в черной субстанции, однако причины такой избирательной гибели нейронов полностью не выяснены.
С генетической точки зрения БП представлена двумя формами: семейной и спорадической. В 10-15% случаев заболевание может наследоваться по моногенному аутосомному типу, но в большинстве случаев носит спорадический идиопатический характер. В настоящее время картировано 17 локусов моногенных форм болезни Паркинсона. Анализ известных локусов и генов БП позволил выделить несколько механизмов, вовлеченных в патогенез паркинсонизма. К их числу, в первую очередь, относятся процессы убиквитин зависимой протеасомной деградации белков, которые часто связаны с мутациями в генах паркина (PARK2) и -синуклеина (SNCA). Известно, что гомозиготность или компаундная гетерозиготность по мутациям в гене PARK2 является причиной развития заболевания у примерно половины больных с ювенильной аутосомно-рецессивной формой БП и у примерно 10% спорадических больных с ранним началом развития заболевания. Более того, установлено, что даже в гетерозиготном состоянии мутации в гене PARK2 могут вести к субклиническим нарушениям обмена дофамина в полосатом теле. Эти данные позволяют предположить, что гетерозиготность по мутациям в гене PARK2 может приводить к БП или повышать риск ее развития при взаимодействии с другими факторами. Для проверки этой гипотезы необходимо проведение массового скрининга мутаций в гене PARK2 у больных спорадической формой БП. Интересной особенностью мутаций в этом гене является высокая частота делеций или дупликаций, захватывающих целиком один или несколько экзонов. Следовательно, анализ мутаций гена PARK2 целесообразно начинать именно с поиска экзонных делеций и дупликаций. Также, сравнительно недавно появились данные о том, что мутации гена SNCA, связанные с изменением его копийности, могут приводить к развитию семейной формы БП с аутосомно-доминантным типом наследования. Было показано, что дупликации и трипликации гена SNCA встречаются гораздо чаще, чем точковые мутации данного гена.
Цель и задачи исследования
Целью настоящей работы являлось оценить вклад делеций и дупликаций экзонов гена PARK2 и мультипликаций гена SNCA в развитие болезни Паркинсона у пациентов из России. Для этого были поставлены следующие задачи:
- Разработка быстрого и эффективного метода анализа дозы отдельных экзонов гена PARK2 и гена SNCA на основе ПЦР в реальном времени.
- Анализ делеций и дупликаций всех 12 экзонов гена PARK2 у пациентов со спорадической формой БП с ранним и поздним началом развития заболевания.
- Оценка риска развития спорадической БП у носителей делеций/дупликаций экзонов гена PARK2. Анализ корреляции мутаций с изменением копийности с клиническими характеристиками БП.
- Анализ дупликаций и трипликаций экзонов 4-6 гена SNCA в выборке пациентов с БП.
Научная новизна и практическая значимость работы
Разработан быстрый и эффективный метод выявления делеций и дупликаций экзонов 1-12 в гене PARK2 и мультипликаций гена SNCA на основе ПЦР в реальном времени технологии TaqMan.
Впервые проведен анализ спорадических больных с ранним началом развития заболевания (<45 лет) из России на наличие экзонных перестроек в гене PARK2. Установлено, что частота больных с экзонными перестройками в гене PARK2 составляет 12,4%, и показано, что наиболее подвержены экзонным перестройкам экзоны 3 и 4. Обнаружено, что относительный риск развития БП у лиц в молодом возрасте при наличии делеций или дупликаций в гене PARK2 повышен в 12,4 раза. Получено подтверждение гипотезы о том, что мутации в гетерозиготном состоянии в гене RARK2 влияют на риск развития заболевания.
Впервые проведен анализ представительной выборки спорадических больных с поздним началом развития заболевания (45 лет) из России на наличие экзонных перестроек в гене PARK2. Установлено, что частота больных с экзонными перестройками в гене PARK2 составляет 3,8%.
Впервые в российской популяции проведен корреляционный анализ в выборках спорадических больных с ранним и поздним началом развития заболевания между наличием экзонных перестроек в гене PARK2 и характерными клиническими признаками БП. Установлено, что наличие экзонных перестроек способствует существенному снижению возраста начала БП (на 9 лет), развитию дистонии и симметричному протеканию заболевания и не влияет на скорость и тяжесть протекания болезни.
Впервые проведен анализ больных с семейной формой БП с аутосомно-доминантным типом наследования на наличие дупликаций и трипликаций гена SNCA. В результате анализа было показано, что мультипликации гена SNCA не вносят существенного вклада в патогенез БП у больных из России.
Показано, что экзонные перестройки в гене PARK2 вносят существенный вклад в патогенез БП у больных из России. Разработан эффективный метод их выявления, подходящий, в том числе, для массового скрининга больных в клинических условиях. Выявление данных мутаций на ранних стадиях заболевания может скорректировать терапию и при грамотном лечении значительно уменьшить тяжесть его протекания. Выявление таких мутаций у лиц из группы риска на доклинической стадии поможет вовремя принять профилактические меры и, если не предотвратит развитие БП, то отодвинет ее появление на более поздний срок и значительно снизит тяжесть протекания заболевания. В будущем, в том числе с использованием результатов данного исследования, возможно создание единого комплексного генетического теста, выявляющего риск развития БП по результатам анализа локусов заболевания.
Публикации
По материалам диссертации опубликовано 8 печатных работ, из них 4 статьи и 4 материала конференций и симпозиумов.
Апробация диссертации
Результаты, полученные в данной работе, были представлены на конференциях Европейского Общества Генетики человека (ESHG) в 2006, 2007 и 2009 гг., на IX Международном симпозиуме по мутациям в геноме (IX International Symposium on Mutations in the Genome, Китай) в 2007 г., на второй Международной школе молодых ученых по молекулярной генетике «Геномика и биотехнология» в 2006 г. Основные положения диссертационной работы доложены и обсуждены на заседании Ученого совета ИМГ РАН 19 апреля 2010 г. и на заседании секции «Молекулярная биология» Ученого совета ФГУП «ГосНИИ генетики и селекции промышленных микроорганизмов» 28 апреля 2010 г.
Структура и объем диссертации
Диссертация включает введение; обзор литературы, материалы и методы исследования, результаты исследования и их обсуждение; заключение; выводы; библиографический указатель. Список литературы состоит из 249-ти источников, среди которых 11 источников отечественной и 238 источников зарубежной литературы. Материалы диссертации изложены на 140 страницах машинописного текста, содержат 17 таблиц и 6 рисунков.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
В настоящей работе был проведен анализ трех групп больных: 170 спорадических больных БП с ранним началом развития заболевания, 183 спорадических больных БП с поздним началом развития заболевания и 61 больного БП из семей с аутосомно-доминантным типом наследования из России. Все больные являлись русскими по происхождению и для постановки диагноза БП были исследованы по международной унифицированной оценочной шкале болезни Паркинсона (Unified Parkinson’s Disease Rating Scale, UPDRS) [Fahn et al., 1987] и шкале Hoehn Yahr (Hoehn and Yahr scores) [Goetz et al., 2004] в Научном центре неврологии Российской академии медицинских наук, г. Москва. Клинические характеристики спорадических больных БП с ранним и поздним началом развития заболевания представлены в таблице 1. В качестве популяционного контроля была сформирована выборка в количестве 100 человек, для которой отбирались лица из русской популяции (Тверская и Ивановская области) в возрасте от 30 до 50 лет. Все образцы крови были взяты с информированного согласия исследуемых лиц. Для анализа брали венозную кровь, из которой стандартным методом выделяли геномную ДНК из лейкоцитов периферической крови [Miller et al., 1988].
Анализ дозы экзонов 1-12 гена PARK2 и экзонов 4-6 гена SNCA проводили методом ПЦР в реальном времени с использованием TaqMan зондов. Праймеры и зонды подбирали с помощью программы Vector NTI Suite 9 (Invitrogen, Carlsbad, CA, USA), Beacon Designer 6 и нуклеотидных последовательностей гена PARK2 (GenBank Accession number AB009973) и гена SNCA (GenBank Accession number AF163864). В качестве референсного гена был выбран ген -глобина (НВВ), так как в нем крайне редко встречаются делеции и дупликации. Ген HBB, праймеры и зонды для которого были описаны ранее Lo и соавторами [Lo et al., 1998] (таблица 2), амплифицировали совместно с каждым отдельным экзоном гена PARK2/SNCA. ПЦР проводили в 25 мкл реакционной смеси, содержащей: 10-20 нг геномной ДНК; 2,5 мкл ПЦР буфер (10х) (Syntol, Москва, Россия); 2,5 мкл 25 мМ MgCl2; 10 пM праймеров (Syntol, Москва, Россия); 4 пМ зонда (Syntol, Москва, Россия); 200 мкM каждого дНТФ; 1,25 единиц активности Hot-Rescue Taq ДНК-полимеразы (Syntol, Москва, Россия). Для проведения амплификации использовали следующий режим: 50 °C – 30 сек., 95 °C – 90 сек., далее 50 циклов 60°C, 50 сек. и 95 °C, 15 сек. Последовательности праймеров и зондов для экзонов 1-12 гена PARK2 и экзонов 4-6 гена SNCA, а также температура отжига приведены в таблице 2.
Таблица 1. Клинические характеристики спорадических больных БП с ранним и поздним началом развития заболевания.
| Характеристики | Больные БП с ранним началом развития (n=170) | Больные БП с поздним началом развития (n=183) |
| Пол, n | Ж (88) М (82) | Ж (100) М (83) |
| Возраст на момент исследования [Среднее значение ± стандартное отклонение (диапазон)], годы | 39,8±10,1 (12-67) | 65,2±8,5 (46-81) |
| Возраст начала заболевания [среднее значение ± стандартное отклонение (диапазон)], годы | 32,1±9,9 (2-44) | 57,4±7,6 (45-75) |
| Длительность заболевания [среднее значение ± стандартное отклонение, (диапазон)], годы | 7,8±6,3 (1-44) | 8,2±4,5 (1-33) |
| UPDRS [среднее значение ± стандартное отклонение (диапазон)] | 41,8±19,3 (10-98) | 49,3±20,1 (15-134) |
| Hoehn Yahr стадия [среднее значение (диапазон)] | 2 (0-5) | 2 (1-5) |
| Schwab активность [среднее значение (диапазон)], % | 76,1±12,7 (20-100) | 73,4±14,9 (10-90) |
| Формы болезни, n | Дрожательная (7) Смешанная (123) Акинетико-ригидная (17) Ригидная (6) | Дрожательная (8) Смешанная (137) Акинетико-ригидная (19) Ригидная (3) |
| MMSE [среднее значение ± стандартное отклонение, (диапазон)] | 28,3±1,7 (22-30) | 27,0±2,6 (15-30) |
| Скорость прогрессирования заболевания, n | Быстрая (34) Средняя (75) Медленная (23) | Быстрая (16) Средняя (60) Медленная (25) |
| Дистония, n | Есть (30) Нет (140) | Есть (16) Нет (167) |
| Ассиметрия, n | Есть (116) Нет (54) | Есть (89) Нет (94) |
| Дискинезия, n | Есть (34) Нет (136) | Есть (26) Нет (157) |
Интенсивность флуоресценции ПЦР-продуктов измерялась с помощью амплификатора АНК-32 (Институт аналитического оборудования, Санкт-Петербург, Россия). Для расчетов использовали значение порогового цикла (Ct), которое рассчитывалось с использованием принципа второй производной. Все образцы исследовали трижды. Полученные значения усреднялись и вычислялось среднее значение Сt (Ct) и стандартное отклонение (SD).
Далее для определения числа копий исследуемого экзона гена PARK2/SNCA мы проводили сопоставление величин порогового цикла для экзонов гена PARK2/SNCA и одновременно амплифицируемого с ним гена HBB при помощи коэффициента R, который рассчитывался по формуле, предложенной Livak [Livak, 1997]:
RPARK2(SNCA)/ HBB = 2 –(Ct)
где (Ct) = [CtHBB (контрольный образец ДНК) – CtPARK2(SNCA) (контрольный образец ДНК)] – [CtHBB (образец ДНК больного) – CtPARK2(SNCA) (образец ДНК больного)].
Для определения числа копий экзонов гена PARK2 использовались следующие известные диапазоны значений коэффициента R:
- 0,7<R<1,3 – свидетельствует об отсутствии делеций и дупликаций;
- 0,4<R<0,6 – свидетельствует о наличии делеции в гетерозиготном состоянии;
- R>1,4 – свидетельствует о наличии дупликации;
- R<0,2 – свидетельствует о наличии делеции в гомозиготном состоянии.
Относительные риски (ОР) развития БП были посчитаны с использованием программы GraphPad InStat 3.06 по формуле:
ОР = [A/(A+B)] / [C/(C+D)],
где A – число лиц с наличием мутации, B – с отсутствием мутации среди больных; C и D – число лиц, соответственно, с наличием и отсутствием мутации среди здоровых.
Статистически значимыми считали относительные риски при р<0,05 [Реброва, 2002].
Таблица 2. Нуклеотидные последовательности праймеров и зондов для гена НВВ, экзонов 1-12 гена PARK2 и экзонов 4-6 гена SNCA с температурой отжига. FAM – флуоресцентный краситель, ROX – флуоресцентный краситель, RTQ1 – тушитель флуоресценции, BHQ2 – тушитель флуоресценции.
| Ген/ экзон | Нуклеотидные последовательности | Тотж0С | |
| HBB | Прямой праймер: 5’-GTGCACCTGACTCCTGAGGAGA-3’ Обратный праймер: 5’-ccttgataccaacctgcccag-3’ Зонд: 5’-FAM-AAGGTGAACGTGGATGAAGTTGGTGG-RTQ1-3’ | 60°C | |
| PARK2/ экзон 1 | Прямой праймер: 5’-CAGCGGCTCTCCTGGGTTAAA-3’ Обратный праймер: 5’-TACGACTCCCAGCAGGCCCT-3’ Зонд: 5’-ROX-CCTAGGAATGCGCACGCGCGGAG-RTQ1-3’ | 60°C | |
| PARK2/ экзон 2 | Прямой праймер: 5’-ATCTCAGGCATGAATGTCAGATT-3’ Обратный праймер: 5’-TGACCAGTTGCGTGTGATTT-3’ Зонд: 5’-ROX-ATGAGCAATGGAGCTGGCGGCATCC-RTQ1-3’ | 60°C | |
| PARK2/ экзон 3 | Прямой праймер: 5’-CATTGTGCAGAGACCGTGGAGAA-3’ Обратный праймер: 5’-GCTGAGGTCCACCCGAGTCAA-3’ Зонд: 5’-ROX-AAATGAATGCAACTGGAGGCGACGACCC-RTQ1-3’ | 60°C | |
| PARK2/ экзон 4 | Прямой праймер: 5’-TAGCCACTTCTTCTGCTTTT-3’ Обратный праймер: 5’-TGCACTGTACCCTGAGTTTT-3’ Зонд: 5’-ROX-ATTGCAAAGGCCCCTGTCAAAGAGTGCA-RTQ1-3’ | 60°C | |
| PARK2/ экзон 5 | Прямой праймер: 5’-TCTTGCTGGGATGATGTTTTAATTCCAAA-3’ Обратный праймер: 5’-TTGCAATAAGAGGAATGAAT-3’ Зонд: 5’-ROX-AATGCCAATCCCCACACTGCCCTGG-RTQ1-3’ | 60°C | |
| PARK2/ экзон 6 | Прямой праймер: 5’-CCGTGGAGGGAAGTGACACTAT-3’ Обратный праймер: 5’-TGCACCTGATCGCAACAAAT-3’ Зонд: 5’-ROX-TGTGCGCGTAATGCAAGTGATGTTCCG-RTQ1-3’ | 60°C | |
| PARK2/ экзон 7 | Прямой праймер: 5’-GGGTCGTGAACAAACTGCCGATCATT-3’ Обратный праймер: 5’-AGGAGCCCCGTCCTGGTTTT-3’ Зонд: 5’-ROX-AAGCAAATCACGTGGCGGGAGTTGCAC-RTQ1-3’ | 60°C | |
| PARK2/ экзон 8 | Прямой праймер: 5’-TCACTCACCTGCTCTTCTCCCAGAAT-3’ Обратный праймер: 5’-CAGAGTGAAAGTGACGTTTT-3’ Зонд: 5’-ROX-TCAAGGAGTTGGGACAGCCAGCTGTTGG-RTQ1-3’ | 60°C | |
| PARK2/ экзон 9 | Прямой праймер: 5’-ACCCCACAGCCCAGGCCATT-3’ Обратный праймер: 5’-TGCAGATGGGGGGCGTGTTA-3’ Зонд: 5’-ROX-TTCGCAGGTGACTTTCCTCTGGTCAGGC-RTQ1-3’ | 60°C | |
| PARK2/ экзон 10 | Прямой праймер: 5’-GCTTGGAGGAATGAGTAGGGCATT-3’ Обратный праймер: 5’-GTTTGCCTTCTGCCGGGAAT-3’ Зонд: 5’-ROX-AGGCTTCAAATACGGCACTGCACTCCCC-RTQ1-3’ | 60°C | |
| PARK2/ экзон 11 | Прямой праймер: 5’-TGGTGGTTTTCTTGATGGTTT-3’ Обратный праймер: 5’-AACGCCTTTCCTCTTTGTTT-3’ Зонд: 5’-ROX-TCGGCGGCTCTTTCATCGACTCTGTAGG-RTQ1-3’ | 60°C | |
| PARK2/ экзон 12 | Прямой праймер: 5’-CACGATCTTCCTGAGAAGTCAGACAAT-3’ Обратный праймер: 5’-ACAACACTGCATGCGGCAAA-3’ Зонд: 5’-ROX-TCTGCGTAGTGTGGGTAAGAGCATGCGG-RTQ1-3’ | 60°C | |
| SNCA/ экзон 4 | Прямой праймер: 5’-TACCACCCTTTAATCTGTTGTTGC-3’ Обратный праймер: 5’-CACTGTCTTCTGGGCTACTGC-3’ Зонд: 5’-ROX-ACACCCGTCACCACTGCTCCTCCA-RTQ1-3’ | 60°C | |
| SNCA/ экзон 5 | Прямой праймер: 5’-AGGAAGGAATTCTGGAAGATATGC-3’ Обратный праймер: 5’-TTGGTACTGTCTTGTTAGAAAGATTC-3’ Зонд: 5’-ROX-CTTGGACTCCTACCTCAGAAGGCATTTCAT-RTQ1-3’ | 60°C | |
| SNCA/ экзон 6 | Прямой праймер: 5’-TGCTGACAGATGTTCCATCCTG-3’ Обратный праймер: 5’-CAGGTACAGATACTTCAATCACTGC-3’ Зонд: 5’-ROX-CAAGTGCTCAGTTCCAATGTGCCCAGTCA-BHQ2-3’ | 60°C | |
Статистическая обработка полученных данных проводилась с использованием пакета программ “Statistica for Windows 8.0” и программного обеспечения MS Excel 2007 (Microsoft). Для выявления корреляций между делециями/дупликациями гена PARK2 и клиническими характеристиками больных был использован ранговый коэффициент корреляции по Спирмену (Spearman Rank Order Correlations). Для дальнейшей оценки статистической значимости выявленных корреляций использовали тест Манна-Уитни (Mann-Whitney U Test) и метод 2. Статистически значимыми считали корреляции при р<0,05 [Реброва, 2002].
Результаты исследования
Подбор праймеров и оптимизация метода анализа дозы отдельных экзонов генов PARK2 и SNCA.
Для определения дозы отдельных экзонов генов PARK2 и SNCA нами был выбран метод ПЦР в реальном времени с использованием TaqMan зондов. Использование TaqMan зондов позволяет проводить совместную амплификацию исследуемого и референсного генов, что значительно повышает точность и скорость анализа. Для проведения ПЦР анализа были подобраны комбинации праймер-зонд для 1-12 экзонов гена PARK2 и 4-6 экзонов гена SNCA. Результаты подбора праймеров для соответствующих экзонов генов PARK2 и SNCA представлены в таблице 2. Для определения числа копий экзонов генов PARK2 и SNCA использовались известные диапазоны значений коэффициента R, подтверждение которых было получено нами при анализе ДНК контроля и больных ювенильным паркинсонизмом с типированными ранее гетерозиготными делециями экзонов гена PARK2 [Illarioshkin et al., 2003].
Таким образом, предложенный нами вариант быстрой молекулярной диагностики делеций и дупликаций отдельных экзонов гена PARK2 и мультипликаций гена SNCA ранее описан не был. ПЦР в реальном времени на основе технологии TaqMan обладает целым рядом преимуществ перед другими имеющимися методами. Совместная амплификация отдельных экзонов гена PARK2/SNCA с геном HBB, используемым в качестве референсного гена, и оценка количества ДНК с помощью метода второй производной, учитывающей эффективность реакции, значительно повышают точность анализа и обеспечивают хорошую воспроизводимость результатов. Быстрота исполнения, точность в определении числа копий экзонов, относительно недорогая стоимость и безопасность данного метода делают возможным его применение для массового анализа больных.
Анализ делеций и дупликаций экзонов гена PARK2 в выборке cпорадических больных болезнью Паркинсона с ранним началом развития заболевания.
При анализе 170 спорадических больных БП с ранним началом развития заболевания (<45 лет) был выявлен 21 больной (12,4%), носители делеций и дупликаций экзонов гена PARK2. Распределение выявленных нами делеций и дупликаций экзонов гена PARK2 представлено на рисунке 1.
№ больных
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
Легенда:
делеция в гетерозиготном состоянии
делеция в гомозиготном состоянии
дупликация
Рисунок 1. Распределение делеций и дупликаций в гене PARK2 при анализе 170 спорадических больных БП с ранним началом развития заболевания.
Из представленных данных видно, что в рассматриваемой группе больных с наибольшей частотой встречаются делеции в гетерозиготном состоянии, как единичных экзонов, так и групп экзонов гена PARK2. Они были найдены у 15 больных (8,8%). Подобные делеции отдельных экзонов были найдены у 7 больных: экзон 2 (больные 16, 17), экзон 3 (больной 6, 21), экзон 4 (больной 13), экзон 7 (больной 12), экзон 9 (больной 12), экзон 11 (больной 11). Делеции групп экзонов гена PARK2 были обнаружены у 7 больных: экзоны 2-4 (больные 4, 14, 18), экзоны 3-4 (больные 3, 10), экзоны 3-5 (больной 7), экзоны 3-7 (больной 1). А также был выявлен 1 больной (больной 15), у которого, наряду с делецией отдельного экзона (экзон 12), присутствовала делеция группы экзонов (экзоны 3-4). Необходимо отметить, что с помощью нашего метода на основе TaqMan ПЦР в реальном времени нельзя напрямую определить, являются ли делеции групп экзонов в гетерозиготном состоянии протяженными делециями, затрагивающими одну хромосому, или сложными компаундными делециями. Такая оценка с использованием разработанного нами метода возможна лишь при совместном анализе больных и их близких родственников, ДНК которых в большинстве случаев была недоступна. В нашем случае ДНК близких родственников больных была нам недоступна. К тому же, необходимо подчеркнуть, что в данном исследовании нас интересовала, в первую очередь, оценка частоты больных с делециями и дупликациями экзонов гена PARK2, а не точная характеристика мутаций в каждом конкретном случае.
Помимо делеций в гетерозиготном состоянии в анализируемой группе больных, у 3 больных (1,8%) были выявлены делеции в гомозиготном состояний. Были обнаружены 2 единичные делеции в гомозиготном состоянии: экзон 3 (больной 5) и экзон 4 (больной 2), и одна делеция экзонов 3-4 (больной 19).
Как видно из рисунка 1 и таблицы 3, наиболее часто делетируемыми экзонами гена PARK2 в данной группе больных являются экзоны 3 и 4.
В результате анализа экзонов гена PARK2 дупликации были найдены у 4 больных: экзон 2 (больной 20), экзон 3 (больной 12) и экзон 5 (больные 8, 9) (рисунок 1). Все дупликации были выявлены в гетерозиготном состоянии. Таким образом, дупликации в гене PARK2 у спорадических больных БП с ранним началом развития встречаются достаточно редко, и частота больных, носителей дупликаций, составляет 2,4%. Частоты больных с дупликациями экзонов гена PARK2 представлены на таблице 4.
Таблица 3. Частота больных с делециями экзонов гена PARK2 в выборке 170 спорадических больных БП с ранним началом развития заболевания.
| Экзон | Частота больных с делециями в гетерозиготном состоянии | Частота больных с делециями в гомозиготном состоянии | ||
| N | % | N | % | |
| 2 | 5 | 2,9 | - | - |
| 3 | 10 | 5,9 | 2 | 1,2 |
| 4 | 9 | 5,3 | 2 | 1,2 |
| 5 | 2 | 1,2 | - | - |
| 6 | 1 | 0,6 | - | - |
| 7 | 2 | 1,2 | - | - |
| 9 | 1 | 0,6 | - | - |
| 11 | 1 | 0,6 | - | - |
| 12 | 1 | 0,6 | - | - |
Таблица 4. Частота больных с дупликациями экзонов гена PARK2 в выборке 170 спорадических больных БП с ранним началом развития заболевания.
| Экзон | Частота больных с дупликациями в гетерозиготном состоянии | |
| N | % | |
| 2 | 1 | 0,6 |
| 3 | 1 | 0,6 |
| 5 | 2 | 1,2 |
Таким образом, наше исследование показало, что частота больных спорадической формой БП с ранним началом развития заболевания из России, являющихся носителями делеций/дупликаций экзонов гена PARK2, значительно превышает частоты больных с экзонными перестройками в гене PARK2 в большинстве популяций мира. Так, частота спорадических больных ранней формой БП с мутациями данного типа в популяциях из Европы составляет от 1,3% (Сербия) до 5,5% (Италия) и 6% (Германия) [Djarmati et al., 2004; Sironi et al., 2008; Kann et al., 2002]. Среди экзонных перестроек гена PARK2 при спорадической БП с ранним началом развития наиболее часто встречались перестройки экзонов 3 и 4. Наши данные согласуются с данными Periquet и соавторов (2003), также показавших, что в гене PARK2 наиболее часто встречаются перестройки экзонов 3 и 4 [Periquet et al., 2003]. Наиболее распространенным типом экзонных перестроек экзонов 3 и 4 гена PARK2 являлись делеции. Из структуры паркина известно, что экзоны 3 и 4, соответствуют двум функциональным фрагментам этого белка: паркин-специфическому домену (UPD) и участку, который содержит сайт, узнаваемый проапоптотическими каспазами 1 и 8. Делеция одного или группы экзонов гена может приводить к возникновению сдвига рамки считывания. Вследствие этого аминокислотная последовательность белка от участка, кодируемого делетированным фрагментом гена до конца полипептидной цепи, будет полностью изменена. Измененный участок белка, а часто и весь белок, в свою очередь, утратит функциональность. Если же подобная делеция не приведет к сдвигу рамки считывания, то в транслируемом белке будут отсутствовать домены, соответствующие делетированной области гена. Применительно к делеции какого-либо из экзонов 3 и 4 гена PARK2 это означает, что в полипептидной цепи белка будет значительно сокращен участок, соединяющий RING-IBR-RING домены, обеспечивающие убиквитин-лигазную активность паркина, и убиквитин-подобный (UBL) домен, взаимодействующий с протеасомным комплексом [Kahle, Haass, 2004]. Подобное нарушение первичной структуры белка обязательно вызовет изменение пространственного взаиморасположения этих доменов. Это, в свою очередь, уменьшит эффективность связывания паркина со своими субстратами и 26S протеасомой. Таким образом, рассматриваемые делеции 3 и 4 экзонов могут приводить к нарушению функционирования системы убиквитин-зависимой деградации белков и развитию нейродегенеративных процессов при БП.
Полученные данные свидетельствуют о важной роли делеций экзонов гена PARK2 в патогенезе спорадической БП с ранним началом развития у больных из России. Дупликации экзонов гена PARK2 встречаются редко и не вносят существенного вклада в патогенез заболевания.
Анализ делеций и дупликаций экзонов гена PARK2 в выборке спорадических больных болезнью Паркинсона с поздним началом развития заболевания.
При анализе 183 больных БП с поздним началом развития заболевания (45 лет) было выявлено 7 больных (3,8%), носителей экзонных перестроек гена PARK2. Распределение выявленных нами мутаций представлено на рисунке 2.
№ больных
1
2
3
4
5
6
7
Легенда:
делеция в гетерозиготном состоянии
Рисунок 2. Распределение экзонных перестроек в гене PARK2 при анализе 183 спорадических больных БП с поздним началом развития заболевания.
Из представленных данных видно, что в рассматриваемой группе больных были найдены только делеции гена PARK2 в гетерозиготном состоянии. При этом были обнаружены делеции как отдельных экзонов, так и делеции групп экзонов гена PARK2. Делеции отдельных экзонов были найдены у 3 больных: экзон 5 (больные 2, 7), экзон 6 (больной 1). Делеция групп экзонов была обнаружена у 1 больного: экзоны 3-4 (больной 4). Также были выявлены 3 больных, у которых, наряду с делециями отдельных экзонов, присутствовали делеции групп экзонов. Это больной 3 (экзоны 2-3, 7), больной 5 (экзоны 4-5, 7) и больной 6 (экзоны 4-5, 7). Как видно из рисунка 2 и таблицы 5, явного преобладания частоты делеций какого-либо экзона гена PARK2 не наблюдалось. Делеции в гомозиготном состоянии и дупликации экзонов гена PARK2 при анализе данной группы больных выявлены не были.
Таблица 5. Частота больных с делециями экзонов гена PARK2 в выборке 183 спорадических больных БП с поздним началом развития заболевания.
| Экзон | Частота больных с делециями в гетерозиготном состоянии | |
| N | % | |
| 2 | 1 | 0,5 |
| 3 | 2 | 1,1 |
| 4 | 3 | 1,6 |
| 5 | 4 | 2,2 |
| 6 | 1 | 0,5 |
| 7 | 3 | 1,6 |
Частота больных спорадической формой БП с поздним началом развития заболевания с делециями экзонов гена PARK2 (3,8%) сопоставима с результатами полученными в другом исследовании нашей лаборатории [Сломинский и соавт., 2003]. В этом исследовании были проанализированы больные из Башкирии с поздней формой БП, частота больных с делециями в гетерозиготном состоянии составила 5,3%. В мире экзонные перестройки в гене PARK2 при спорадической БП с поздним началом развития исследованы мало. В популяции из Индии делеций и дупликаций экзонов гена PARK2 при поздней спорадической форме БП обнаружено не было [Chaudhary et al., 2006]. В большинстве же популяций мира таких исследований не проводилось.
Полученные нами данные позволяют сделать вывод, что экзонные перестройки в гене PARK2 вносят существенный вклад в патогенез БП у спорадических больных из России, в особенности у больных с ранним началом развития заболевания. Можно предположить, что делеции в гомозиготном состоянии и дупликации экзонов гена PARK2 приводят к более раннему развитию заболевания, и, таким образом, их отсутствие в выборке спорадических больных с поздним началом развития БП объяснимо. Также наше исследование показало, что наш метод на основе ПЦР в реальном времени технологии TaqMan применим для быстрой и точной детекции экзонных перестроек в гене РARK2. Это делает возможным его применение для проведения массового скрининга больных на наличие данных мутаций в клинических условиях. Клиническую диагностику экзонных перестроек в гене PARK2 целесообразно начинать с анализа наиболее делетируемых экзонов, в первую очередь, с экзонов 3 и 4.
Анализ делеций и дупликаций экзонов гена PARK2 в выборке популяционного контроля и расчет относительных рисков развития болезни Паркинсона в российской популяции.
Помимо анализа делеций и дупликаций экзонов гена PARK2 у больных спорадической формой БП, было также проанализировано 100 здоровых людей из России, взятых в качестве популяционного контроля. В результате исследования была выявлена гетерозиготная делеция экзона 7 у 1 человека – женщины 37 лет (RPARK2/HBB±SD=0,51±0,04). Таким образом, частота лиц с экзонными перестройками в гене PARK2 составила 1%, что является более низким показателем, по сравнению с частотой больных спорадической БП с ранним (12,4%) и поздним (3,8%) началом развития заболевания. При этом надо учитывать, что для данного человека, носителя гетерозиготной делеции, которому на момент исследования было 37 лет, существует риск развития БП, принимая во внимание средний возраст начала заболевания (60 лет).
Основываясь на данных, полученных в результате анализа групп спорадических больных с ранней и поздней формами БП и контрольной выборки, были рассчитаны относительные риски развития БП у людей с делециями и дупликациями экзонов гена PARK2. Расчеты показали, что по сравнению с нормой у людей с экзонными перестройками вероятность развития ранней формы БП повышена в 12,4 раза. При этом, коэффициент р=0,0022 свидетельствует о высокой достоверности повышения риска развития ранней формы БП. Вероятность развития поздней формы БП у носителей экзонных перестроек гена PARK2 повышена в 3,8 раза, но коэффициент р=0,3195 свидетельствует о том, что такое повышение риска развития поздней формы БП нельзя считать достоверным. Эти данные могут свидетельствовать о том, что экзонные перестройки в гене PARK2 обладают высокой степенью пенетрантности, и их патогенное действие, приводящее к развитию заболевания, начинает проявляться в раннем возрасте. Роль мутаций в гетерозиготном состоянии в гене PARK2 в развитии БП до сих пор остается до конца не выясненной. По результатам нашего исследования можно предположить, что делеции в гомозиготном и гетерозиготном состоянии в гене PARK2 приводят к развитию ранней формы БП, в то время как к позднему развитию БП могут приводить только делеции в гетерозиготном состоянии. Эти результаты согласуются с предположением, выдвинутым Foroud и соавторами, заключающимся в том, что гомозиготность по мутациям в гене PARK2 приводит к развитию заболевания в раннем возрасте, тогда как гетерозиготность по мутациям в гене PARK2 может приводить к позднему развитию заболевания [Foroud et al.,2003]. Это предположение подтверждают и данные, полученные в других исследованиях. Так, в 2000 году Klein и соавторы описали семью с поздним началом развития паркинсонизма дрожательного типа, в которой развитие заболевания было связано с мультиэкзонной делецией в гетерозиготном состоянии в гене PARK2 [Klein et al., 2000]. А в работе Сломинского и соавторов (2003) была выявлена делеция в гетерозиготном состоянии экзона 12 гена PARK2 у 2 больных спорадической формой БП с поздним началом развития [Сломинский и соавт., 2003]. Также результаты нашего исследования показали, что помимо того, что делеции экзонов в гетерозиготном состоянии гена PARK2 могут приводить к развитию поздней формы БП, их наличие может повышать риск развития БП в раннем возрасте. Наши данные согласуются с исследованием Clark и соавторов, включавшим анализ 101 больного со спорадической БП с ранним началом развития и 105 человек контрольной выборки, и показавшим, что мутации в гетерозиготном состоянии в гене PARK2 могут повышать риск развития ранней формы БП [Clark et al., 2006]. Это может быть связано с тем, что в гетерозиготном состоянии мутация в гене PARK2 может приводить к развитию болезни из-за недостаточного синтеза белка и его сниженной активности. Такая гипотеза была высказана West и соавторами в 2002 году [West et al., 2002].
Выявление корреляций между наличием делеций/ дупликаций экзонов гена PARK2 и клиническими характеристиками больных.
Все больные были оценены по следующим критериям: полу, возрасту на момент исследования, возрасту начала заболевания, длительности заболевания, UPDRS, стадии Hoehn Yahr, Schwab активности, формам БП, MMSE, скорости прогрессирования заболевания, наличию или отсутствию дистонии, ассиметрии или дискинезии. Клинические характеристики больных с ранним и поздним началом развития БП приведены в таблице 1. Был проведен корреляционный анализ в выборках спорадических больных с ранним и поздним началом развития БП с целью выявления корреляций между наличием делеций/дупликаций экзонов гена PARK2 и клиническими характеристиками больных. Корреляционный анализ проводился с использованием ранговой корреляции по Спирмену, его результаты представлены в таблице 6.
В выборке больных с ранним началом развития заболевания были выявлены корреляции между наличием делеций/дупликаций экзонов гена PARK2 и возрастом больных на момент исследования, возрастом начала заболевания, длительностью заболевания и развитием дистонии. Корреляционный анализ не выявил корреляций с полом, стадиями по шкалам UPDRS и Hoehn Yahr, активностью по шкале Schwab & England, формами болезни, результатами MMSE, скоростью прогрессирования заболевания, наличием ассиметрии и дискинезии (таблица 6). Наибольший интерес представляют корреляции с возрастом начала заболевания и наличием дистонии. Возраст на момент исследования и длительность заболевания являются производными от возраста начала заболевания. Более детальный анализ корреляции с возрастом начала БП показал, что средний возраст начала заболевания носителей экзонных перестроек составляет 24±11 лет, в то время как средний возраст начала заболевания людей с отсутствием мутаций подобного типа составляет 33±9 лет. Таким образом, показано, что носители экзонных перестроек заболевают в среднем на 9 лет раньше (рисунок 3). Достоверность этой корреляции была подтверждена тестом по Манну-Уитни (р=0,000130). Таким образом, была выявлена прямая связь между наличием экзонных перестроек в гене PARK2 и возрастом начала заболевания. Наши данные согласуются результатами исследования Sun и соавторов, показавшего, что у больных с мутацией в гене PARK2 болезнь развивалась почти на 12 лет раньше, чем у больных без мутаций в нем [Sun et al., 2006].
Таблица 6. Коэффициенты ранговой корреляции по Спирмену между делециями/дупликациями экзонов гена PARK2 и клиническими характеристиками спорадических больных с ранним и поздним началом развития БП. Жирным крупным шрифтом выделены достоверные корреляции.
| Клинические характеристики | Больные с ранним началом развития БП | Больные с поздним началом развития БП |
| Пол | 0,01 | 0,01 |
| Возраст на момент исследования | -0,19 | 0,06 |
| Возраст начала заболевания | -0,30 | 0,04 |
| Длительность заболевания | 0,21 | 0,09 |
| UPDRS | -0,06 | 0,08 |
| Hoehn Yahr стадия | 0,02 | 0,06 |
| Schwab активность | -0,12 | -0,08 |
| Формы болезни | -0,05 | 0,06 |
| MMSE | -0,03 | – |
| Скорость прогрессирования заболевания | 0,03 | – |
| Дистония | 0,20 | -0,06 |
| Ассиметрия | 0,06 | -0,19 |
| Дискинезия | 0,08 | -0,08 |
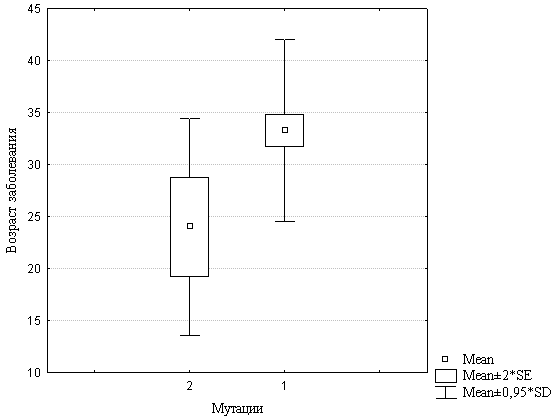
Рисунок 3. Корреляция между делециями/дупликациями экзонов гена PARK2 и возрастом начала заболевания у спорадических больных с ранним началом развития БП. 1 – отсутствие мутаций, 2 – наличие мутаций.
Также, в выборке спорадических больных с ранней формой БП был проведен подробный анализ корреляции между наличием делеций/дупликаций экзонов гена PARK2 и развитием дистонии. Так, среди 21 больного, у которых были обнаружены экзонные перестройки в гене PARK2, было выявлено 8 больных с дистонией и 13 больных без нее. Анализ 149 больных без экзонных перестроек выявил 22 больных с наличием дистонии и 127 с ее отсутствием. В результате оценки частоты больных с дистонией и без нее при наличии/отсутствии экзонных перестроек в гене PARK2 по методу 2 было показано, что наличие делеций и дупликаций способствует развитию дистонии (р=0,0203).
Корреляционный анализ в выборке больных с поздним началом развития БП выявил только одну корреляцию между наличием делеций экзонов гена PARK2 и симметричным течением заболевания (таблица 6). Было показано, что у всех 7 больных, носителей делеций в гене PARK2, наблюдалось симметричное течение заболевания, в то время как среди 176 больных без делеций в гене PARK2 было выявлено 89 больных с ассиметрией и 87 без нее. В результате оценки частоты больных с ассиметрией и без нее при наличии/отсутствии делеций по методу 2 было показано, что наличие делеций способствует симметричному развитию заболевания (р=0,0251).
Таким образом, наличие делеций/дупликаций экзонов гена PARK2 способствует более раннему началу заболевания с симметричным возникновением симптомов и развитием дистонии, но не влияет на такие важные клинические признаки, как тяжесть протекания и скорость прогрессирования БП. Таким образом, полученные данные позволяют сделать вывод о том, что делеции и дупликации экзонов гена PARK2 не вносят существенного вклада в формирование большинства клинических признаков заболевания.
Анализ дупликаций и трипликаций гена SNCA в выборке аутосомно-доминантных больных болезнью Паркинсона.
С использованием описанного метода ПЦР в реальном времени на основе технологии TaqMan, проведен анализ 61 больного БП с аутосомно-доминантным типом наследования. Для анализа дупликаций и трипликаций гена SNCA проанализировали экзоны 4, 5 и 6 на наличие экзонных перестроек. При этом для всех трех анализируемых экзонов получены значения коэффициента R, лежащие в диапазоне от 0,76 до 1,21. Эти данные свидетельствуют об отсутствии экзонных перестроек в данных экзонах и, следовательно, отсутствии дупликаций и трипликаций гена SNCA в исследуемой выборке. Наши результаты согласуются с данными исследований, проведенных в США, Германии и Португалии, не выявивших увеличения копий гена SNCA у семей с аутосомно-доминантной формой наследования БП [Bras et al., 2008; Gispert et al., 2005; Johnson et al., 2004]. Более того, скрининг такого рода мутаций у спорадических больных БП в различных популяциях также не выявил носителей дупликаций и трипликаций гена SNCA [Bras et al., 2008; Johnson et al., 2004; Hofer et al., 2005; Nishioka et al., 2006]. По всей видимости, мутации такого типа редки в нашей популяции, и можно предположить, что дупликации и трипликации гена SNCA не вносят существенного вклада в патогенез аутосомно-доминантной формы БП у больных из России. В связи с этим, представляется нецелесообразным дальнейший анализ мультипликаций гена SNCA при спорадической форме БП у больных из России.
ЗАКЛЮЧЕНИЕ
В последнее время особое значение приобретают исследования тяжелых нейродегенеративных заболеваний человека, поскольку эти заболевания широко распространены и в большинстве случаев неизлечимы. Современные технологии позволяют попробовать взглянуть на патогенез данных заболеваний с молекулярно-генетической точки зрения, что дает надежду на их выявление на доклинической стадии и разработку эффективных методов профилактики и лечения. Одним из таких заболеваний является болезнь Паркинсона. К настоящему моменту найдены основные локусы семейных форм БП и ведется активный поиск генетических факторов развития гораздо более распространенной спорадической формы БП. Из литературных данных известно, что наиболее частой генетической причиной развития БП являются мутации в гене PARK2, основную долю которых составляют экзонные делеции и дупликации. Также относительно недавно были получены данные о том, что мутации, связанные с увеличением числа копий гена SNCA, могут быть частой причиной развития семейной формы БП с аутосомно-доминантным типом наследования. Высокая частота данных мутаций требует разработки эффективного метода их типирования. В связи с этим нами был разработан быстрый и точный метод выявления экзонных перестроек в генах PARK2 и SNCA, применимый для массового скрининга больных в клинических условиях. Полученные нами данные подтверждают высокую встречаемость экзонных перестроек в гене PARK2 и их важную роль в патогенезе спорадической формы БП, особенно с ранним началом развития, у больных из России. При анализе спектра делеций и дупликаций экзонов гена PARK2 было установлено, что наиболее часто встречаются экзонные перестройки экзонов 3 и 4. Анализ мультипликаций гена SNCA показал, что данные мутации не играют существенной роли в развитии БП в российской популяции. Таким образом, можно сделать вывод о необходимости анализа делеций и дупликаций экзонов гена PARK2 (в первую очередь, экзонов 3 и 4) у больных из России, особенно на ранних стадиях заболевания, когда с помощью грамотной терапии возможно замедлить развитие заболевания или уменьшить его тяжесть. Также анализ экзонных перестроек в гене PARK2 может быть очень эффективен на доклинических стадиях у родственников спорадических больных, которые составляют группу риска. В случае выявления экзонных перестроек, им может быть предложена терапия, способная, если не остановить развитие заболевания, то сдвинуть его дебют на более поздний срок и снизить тяжесть его протекания.
ВЫВОДЫ
- Разработан основанный на ПЦР в реальном времени метод анализа дозы отдельных экзонов гена PARK2 и гена SNCA, позволяющий проводить диагностику мутаций с изменением копийности при семейной и спорадической формах болезни Паркинсона.
- Показано, что делеции и дупликации экзонов гена PARK2 встречаются у 21 из 170 (12,4%) обследованных пациентов со спорадической формой болезни Паркинсона с ранним началом развития (до 45 лет) из России. Наиболее часто у этих больных встречаются делеции экзонов 3, 4 гена PARK2. Риск развития болезни Паркинсона в молодом возрасте у лиц с наличием мутаций с изменением копийности в гене PARK2 повышен в 12,4 раза.
- У пациентов со спорадической формой болезни Паркинсона с ранним началом развития выявлены корреляции между наличием мутаций с изменением копийности в гене PARK2, возрастом начала заболевания и наличием дистонии. Показано, что у носителей делеций и дупликаций в гене PARK2 возраст начала заболевания в среднем на 9 лет меньше и составляет 24 года.
- Показано, что мутации с изменением копийности в гене PARK2 встречаются у 7 из 183 (3,8%) обследованных пациентов со спорадической формой болезни Паркинсона с поздним началом развития (после 45 лет) из России. В данной выборке больных выявлена корреляция между наличием мутации с изменением копийности в гене PARK2 и симметричным течением заболевания.
- У 61 обследованного больного с аутосомно-доминантной формой болезни Паркинсона из России не выявлено дупликаций и трипликаций гена SNCA.
СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ
- Шадрина М.И., Семенова Е.В., Сломинский П.А., Иллариошкин С.Н., Багыева Г.Х., Маркова Е.Д., Иванова-Смоленская И.А., Лимборская С.А. Метод определения делеций и дупликаций в гене паркина с использованием полимеразной цепной реакции в реальном времени // Медицинская генетика. 2006. Т. 5(2). С. 52-54.
- Шадрина М.И., Багыева Г.Х., Иллариошкин С.Н., Семенова Е.В., Сломинский П.А., Загоровская Т.Е., Маркова Е.Д., Федорова Н.В., Проскокова Т.Н., Лимборская С.А., Иванова-Смоленская И.А. Структурные перестройки в гене паркина (PARK2) у больных с паркинсонизмом молодого возраста // Медицинская генетика. 2006. Т. 5(12). С. 22-26.
- Shadrina M., Semenova E., Slominsky P., Bagyeva G., Illarioshkin S., Ivanova-Smolenskaia I., Limborska S. Effective quantitative real-time polymerase chain reaction analysis of the parkin gene (PARK2) exon 1–12 dosage // BMC Medical Genetics. 2007. V. 8. P. 6.
- Семенова Е.В., Шадрина М.И., Сломинский П.А., Иллариошкин С.Н., Багыева Г.Х., Карабанов А.В., Иванова-Смоленская И.А., Лимборская С.А. Анализ изменения дозы гена -синуклеина при аутосомно-доминантной форме болезни Паркинсона // Генетика. 2009. Т. 45(4). С. 573-576.
- Semenova E., Shadrina M., Bagyeva G., Moskovskaya S., Slominsky P., Illarioshkin S., Limborska S. Analysis of exon deletions and duplications in PARK2 gene by TaqMan Real-time PCR method in patients with early-onset Parkinson disease from Russia // European Journal of Human Genetics. 2006. V. 14. P. 269. The European Human Genetics Conference, 6-9 мая 2006 г., Амстердам, Голландия.
- Semenova E., Shadrina M., Bagyeva G., Farkhiulina M., Slominsky P., Illarioshkin S., Limborska S. Analysis of the parkin gene (PARK2) exon 1-12 dosage in patients with sporadic Parkinson’s disease from Russia // European Journal of Human Genetics. 2007. V. 15. P. 219. The European Human Genetics Conference, 16-19 июня 2007 г., Ницца, Франция.
- Shadrina M., Semenova E., Bagyeva G., Partola M., Illarioshkin S., Nikopensius T., Metspalu A., Limborska S. Genetic markers analysis of sporadic Parkinson’s disease from Russia // Mutation Detection. 2007. Р. 33. IX International Symposium on Mutations in the Genome, 23-27 сентября 2007 г., Сямэнь, Китай.
- Semenova E., Shadrina M., Slominsky P., Illarioshkin S., Bagyeva G., Karabanov A., Ivanova-Smolenskaia I., Limborska S. Analysis of the -synuclein gene dosage in autosomal dominant Parkinson’s disease // European Journal of Human Genetics. 2009. V. 17. P. 393. The European Human Genetics Conference, 23-26 мая 2009 г., Вена, Австрия.

