Использование систем гомологичной и сайт-специфической рекомбинации фага для целенаправленной модификации хромосомы pantoea ananatis.
На правах рукописи
ГОЛУБЕВА ЛЮБОВЬ ИГОРЕВНА
Использование систем гомологичной и сайт-специфической рекомбинации фага для целенаправленной модификации хромосомы Pantoea ananatis.
03.01.03 – Молекулярная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва 2010
Работа выполнена в Лаборатории №3 Закрытого Акционерного Общества «научно-исследовательский институт Аджиномото-Генетика» (ЗАО «АГРИ»)
Научный руководитель:
кандидат биологических наук, ЗАО «АГРИ» Ж.И. Каташкина
Официальные оппоненты:
доктор биологических наук, А.С. Миронов
профессор, ФГУП “ГосНИИ генетика”
доктор биологических наук, И.В. Голденкова-Павлова
доцент, Институт общей генетики
им. Н.И. Вавилова
Ведущая организация:
Институт молекулярной генетики РАН.
Защита диссертации состоится « 25 » мая 2010 года в 1400 на заседании Диссертационного совета Д.217.013.01. при ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» по адресу: 117545, г. Москва, 1-й Дорожный проезд, д.1.
С диссертацией можно ознакомиться в библиотеке ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов».
Автореферат диссертации разослан « 22 » апреля 2010 года.
Ученый секретарь Диссертационного Совета, Т.Л. Воюшина
Кандидат химический наук
Общая характеристика работы.
Актуальность проблемы.
Использование бактерий в промышленном производстве биологически активных веществ (витаминов, антибиотиков, гормонов, аминокислот), органических кислот и биокатализаторов насчитывает более чем 50-ти летнюю историю, и в настоящее время объем микробных биотехнологических производств продолжает расти (Demain A.L., Adrio J.L., 2008). При этом, перед современной биотехнологией стоят такие задачи как расширение спектра производимых веществ и используемых субстратов, создание более рентабельных и экологичных технологий производства. Решение этих задач требует не только улучшения свойств существующих продуцентов, но и поиск новых микроорганизмов, обладающих определенными преимуществами и биотехнологическим потенциалом. Более того, относительная доступность секвенирования бактериального генома и наличие целого пакета компьютерных программ, позволяющих реконструировать метаболические пути, опираясь только на нуклеотидную последовательность генома, обеспечивает достаточно большой объем начальной информации о метаболизме вновь отобранного организма. С другой стороны, накопленный опыт, а также данные, полученные на базе современных экспериментальных и аналитических методов исследования метаболизма (анализ распределения и контроля потоков, анализ уровня экспрессии генов, компьютерное моделирование и т.д.) однозначно указывают на необходимость тонкой настройки метаболизма для обеспечения высокоэффективного синтеза интересующего продукта бактериальными клетками. Успех в создании высокоэффективного штамма зависит не только от физиологических особенностей организма, но и от возможности быстро конструировать необходимые генетические модификации. Для решения этой задачи необходим удобный генно-инженерный инструментарий, позволяющий создавать бесплазмидные, безмаркерные штаммы, штаммы, несущие множественные мутации, модулировать уровень экспрессии целевого гена и интегрировать протяженные фрагменты ДНК в хромосому. Наиболее подробно подходы для подобных генетических манипуляций ранее были разработаны для Escherichia coli (Peredelchuk M.Y., Bennett G.N., 1997; Каташкина Ж. И., 2003; Meynial-Salles I. et al, 2005; Каташкина Ж.И. и др, 2005; Minaeva N.I. et al, 2008). Основу этих методов составляет использование систем гомологичной (Red) и сайт-специфической рекомбинации фага. Однако, несмотря на кажущуюся простоту Red-системы, включающей всего 3 фаговых гена, и подробное изучение механизма Red-зависимой рекомбинации, до сих пор этот чрезвычайно эффективный метод генной инженерии, первоначально разработанный для E. coli K12, удавалось использовать только в ряде патогенных штаммах E. coli и некоторых штаммах Salmonella, Erwinia, Yersinia и Pseudomonas. Поэтому расширение рамок применимости известных методов генной инженерии для манипулирования геномами новых потенциальных продуцентов является актуальной и практически значимой задачей.
Цели и задачи работы.
Целью данной диссертационной работы является адаптация высокоэффективного генно-инженерного инструментария, разработанного в настоящее время для E. coli, для использования в клетках близкородственного организма Pantoea ananatis.
В ходе работы решались следующие задачи:
- адаптация Red-зависимой системы гомологичной рекомбинации фага для создания целенаправленных модификаций (делеций, замен регуляторных областей, точечных мутаций) в хромосоме P. ananatis;
- разработка инструментария для конструирования штаммов P. ananatis, содержащих множественные модификации хромосомы;
- создание охарактеризованной библиотеки промоторов для обеспечения плавного изменения уровня экспрессии целевых генов в P. ananatis;
Научная новизна и практическая значимость работы.
В ходе адаптации Red-зависимой системы рекомбинации фага E. coli для целенаправленной модификации хромосомы близко родственного организма P. ananatis была выявлена токсичность одновременной экспрессии Red-генов для клеток данной бактерии. В ходе работы был отобран мутантный штамм P. ananatis, устойчивых к экспрессии генов Red-системы. Использование данного штамма в качестве реципиента позволяет интегрировать линейные двуцепочечныые фрагменты ДНК в хромосому P. ananatis с частотой не меньшей, чем в E. coli К12. Было показано, что одновременная экспрессия gam и bet генов не приводит к токсическому эффекту, что позволяет использовать данные гены для модификации хромосомы штамма дикого типа с помощью олигонуклеотидов.
Для P. ananatis были адаптированы процедура переноса маркированных мутаций с помощью электропорации геномной ДНК и Int/Xis-зависимая система сайт-специфицеской рекомбинации для вырезания селективного маркера после его использования, что позволяет конструировать штаммы со множественными модификациями. Была разработана двухстадийная методика создания целенаправленных точечных мутаций в хромосоме P. ananatis с использованием гена sacB Bacillus subtilis в качестве контр-селективного маркера. Данная методика находит применение в решение задач белковой инженерии. Была получена и охарактеризована библиотека Ptac-подобных промоторов узнаваемых РНКП P. ananatis для плавного варьирования уровня экспрессии целевых генов в данном организме.
Совокупность разработанных методов активно применяется в работе НИИ «Аджиномото-Генетика» и позволяет быстро и эффективно решать как прикладные задачи по конструированию штаммов-продуцентов на базе P. ananatis, так и задачи по изучению метаболизма данной бактерии.
Публикации и апробация работы.
По теме диссертации опубликовано 4 печатные работы, из них 2 в журналах, рекомендованных ВАК, 1 патентная заявка и 1 материалы научной конференции. Материалы диссертации докладывались на конкурсе работ сотрудников ЗАО «АГРИ» (июнь 2006).
Диссертационная работа была апробирована на совместном семинаре секции «Молекулярная биология» Ученого совета ФГУП ГосНИИгенетика и НТС ЗАО «АГРИ» 9 марта 2010 года.
Структура и объем работы.
Диссертация состоит из 6 разделов: «Введение», «Обзор литературы», «Материалы и методы», «Результаты и обсуждения», «Выводы» и «Список цитируемой литературы». Работа изложена на страницах, включая рисунков и таблиц. Список цитируемой литературы содержит источника, в том числе на русском языке.
Основное содержание работы.
Объектом данной работы является бактерия вида P. ananatis, принадлежащая к семейству Enterobaсteriacea. Природный штамм данной бактерии AJ13355 был селектирован из почвы Iwata-shi (Сизуока, Япония) как штамм, способный расти при низких значениях pH и устойчивый к высоким концентрациям глутаминовой кислоты (Izui H. et al, 2003). Данная физиологическая особенность делает этот организм перспективным объектом биотехнологии, в частности, для продукции глутаминовой кислоты в условиях ферментации при кислых значениях рН, сопровождающейся кристаллизацией продукта (Izui H. et al, 2003). Штамм AJ13355 прошел тест на биобезопасность.
Штамм AJ13355 выделяет большое количество экзополисахарида при росте в лабораторных условиях, что значительно затрудняет работу с ним. С помощью УФ-зависимого мутагенеза исходного штамма AJ13355 был отобран штамм, SC17, со сниженной способность к образованию экзополисахарида (Izui H. et al, 2003). Именно этот штамм является объектом дальнейших исследований.
К началу данной работы было известно, что:
- в клетках P. ananatis реплицируются плазмиды - pUC19 (ColEI репликон), pMW218/219 (pSC101 репликон) и плазмида RSF1010;
- клетки P. ananatis не заражаются известными трансдуцирующими фагами E. coli;
- клетки P. ananatis не трансформируются c помощью Са2+-зависимой трансформации;
- возможна эффективная интеграция генетического материала в геном P. ananatis с использованием mini-Mu системы;
- последовательность генома P. ananatis.
- Трансформация клеток P. ananatis методом электропорации.
Для введения ДНК в клетки P. ananatis был разработан протокол электротрансформации данной бактерии. Для этого изучалась зависимость частоты электротрансформации клеток P. ananatis плазмидной ДНК от таких факторов как: фаза роста культуры клеток, процедура приготовления электрокомпетентных клеток, напряженность электрического поля и длительность электрического импульса. В результате для клеток P. ananatis был разработан простой протокол, обеспечивающий частоту плазмидной электротрансформации до 106 трансформантов на 108 клеток, выживших после электропорации. Электропорация проводилась при следующих значениях параметров электрического импульса: Е=20 кВ/см и =5 мкс (R=200, C=25F). Разработанный протокол обеспечивал эффективное введение в клетки P. ananatis плазмид, несущих ColEI, pSC101 и RSF1010 репликоны. Размер вводимых плазмид варьировался от 4 до 15 т.п.н. Данный протокол также был использован для введения линейных фрагментов ДНК и олигонуклеотидов в клетки P. ananatis.

Рисунок 1. Структура плазмиды pMW-hisR-SceKm-hisL, содержащей области хромосомы P. ananatis, располагающиеся левее и правее сайта SmaI гена hisD. Внизу схематично изображен участок хромосомы P. ananatis, несущий hisD ген.
В клетках E. coli линейные двухцепочечные молекулы ДНК быстро деградируют за счет АТФ-зависимой экзонуклеазной активности RecBCD белка (Cosloy S.D., Oishi M., 1973). Поэтому для интеграции в хромосому E. coli линейных двухцепочечных фрагментов ДНК либо используют специальные штаммы-реципиенты, в которых данная активность отсутствует (Cosloy S.D., Oishi M., 1973; Russell C.B. et al, 1989), либо используют фрагменты ДНК, защищенные специальным образом ориентированными Chi-последовательностями (Dabert P., Smith G.R., 1997). Процедура электропорации также приводит к значительному снижению АТФ-зависимой экзонуклеазной активности, что позволяет интегрировать линейные двухцепочечные фрагменты ДНК с протяженными областями гомологии в хромосому штамма E. coli дикого типа (El Karoui M. Et al, 1999). Для P. ananatis была продемонстрирована возможность конструирования хромосомных модификаций с помощью электропорации штамма SC17 линейным двухцепочечным фрагментом ДНК с протяженными областями гомологии к заданному месту хромосомы. Для этого была сконструирована плазмида pMW-hisR-SceKm-hisL (Рис. 1), несущая ген устойчивости к канамицину (kan), фланкированный областями хромосомы P. ananatis, располагающимися левее и правее сайта SmaI гена hisD. Плазмида pMW-hisR-SceKm-hisL была использована в качестве матрицы для получения с помощью ПЦР интегративной кассеты, содержащей области гомологии к целевому месту хромосомы P. ananatis длиной 500 н.п. Штамм SC17 P. ananatis был электротрансформирован полученной интегративной кассетой в соответствии с вышеописанным протоколом. В результате гомологичной рекомбинации между интегративной кассетой и хромосомой P. ananatis происходила инактивация гена hisD гистидинового оперона. После электропорации на селективной среде, содержащей канамицин, было получено 20-30 колоний. Все отобранные KmR колонии имели His- фенотип. Для нескольких KmRHis- колоний структура хромосомы была подтверждена с помощью ПЦР. Полученный штамм был назван SC17hisD::kan. Необходимо отметить, что при увеличении длины участков, гомологичных целевому месту хромосомы P. ananatis, выход интегрантов увеличивался.
Метод общей трансдукции является наиболее эффективным и распространенным методом переноса мутаций между бактериальными штаммами. К сожалению, ни один из трансдуцирующих фагов E. coli не заражает клетки P. ananatis. Поэтому было необходимо разработать удобный метод для переноса маркированных мутаций между штаммами P. ananatis.
В некоторых работах для переноса генетических маркеров между различными штаммами E. coli и Pseudomonas была использована электропорация геномной ДНК (Mylroie J.R. et al, 1978; Kilbane J.J. 2nd, Bielaga B.A., 1991). Возможность использования такого подхода для переноса маркированных мутаций между штаммами P. ananatis была проверена экспериментально.
Известно, что для эффективного введения крупных плазмид (длинной от нескольких десятков т.п.н и выше) в бактериальную клетку необходимо использовать специальные параметры электрического импульса – более длительное время импульса и меньшую напряженность электрического поля (Sheng Yu.L. et al, 1995). Влияние именно этих параметров на частоту переноса маркера между штаммами P. ananatis с помощью электропорации геномной ДНК было исследовано в первую очередь. Штамм SC17hisD::kan был использован в качестве донора маркера устойчивости к канамицину. Штамм SC17 был использован в качестве реципиента. В ходе работы было обнаружено, что способ выделения геномной ДНК может оказывать сильное влияние на частоту трансформации. В результате был разработан протокол, обеспечивающий максимальный выход трансформантов – 100 KmR His- колоний в расчете на 108 клеток, выживших после электропорации. Эффективное введение геномной ДНК в клетки P. ananatis обеспечивалось следующими условиями элетропорации: напряженностью электрического поля 12,5 кВ/см и временем импульса 10 мкс (R=400, C=25F). Вся процедура, включая выделение геномной ДНК, может быть проведена в течение одного дня. Необходимо отметить, что метод электропорации геномной ДНК в отличие от трансдукции позволяет предотвратить одновременный перенос близкорасположенных мутаций. Для этого, препарат хромосомы перед электропорацией необходимо обработать рестриктазой/рестриктазами, чьи сайты узнавания располагаются между мутациями и не содержатся в целевом фрагменте.
2. Адаптация Red-зависимой системы гомологичной рекомбинации фага для создания целенаправленных модификаций в хромосоме P. ananatis.
Red-зависимая система гомологичной рекомбинации фага обеспечивает эффективную интеграцию линейных фрагментов ДНК с короткими областями гомологии (обычно 36-40 п.н.) в заданную точку молекулы-мишени. Red-система активно используется в клетках E. coli для целенаправленной модификации хромосомы этого организма, искусственных бактериальных хромосом и плазмид. К настоящему времени Red-система также была использована для модификации хромосомы ограниченного числа близкородственных E. coli организмов (Salmonella, Erwinia, Yersinia, Shigella) и бактерий рода Pseudomonas. Однако только при использовании в клетках бактерии Salmonella enterica Serovar Typhimurium удалось получить эффективности интеграции, сравнимые с таковыми в E. coli.
2.1. Конструирование плазмиды-помощника, обеспечивающей регулируемую экспрессию генов Red-системы фага .
Для обеспечения экспрессии генов Red-системы в клетках P. ananatis была сконструирована плазмида-помощник pRSFRedTER (Рис. 2). Данная плазмида сконструирована на базе репликона широкого круга хозяев RSF1010. Транскрипция генов Red-системы осуществляется с промотора PlacUV5. Экспрессия генов Red-системы находится под контролем авторегулируемого элемента PlacUV5-lacI, обеспечивающего низкий базальный уровень экспрессии генов (Скороходова А.Ю. и др, 2004). Дополнительное снижение базального уровня экспрессии генов Red-системы было обеспечено терминатором транскрипции rrnB оперона E. coli, предотвращающим сквозную транскрипцию с области плазмиды, располагающейся левее. В состав плазмиды был введен ген левансахаразы B. subtilis (ген sacB), обеспечивающий эффективную элиминацию плазмиды из клеточной популяции при росте на сахарозе.
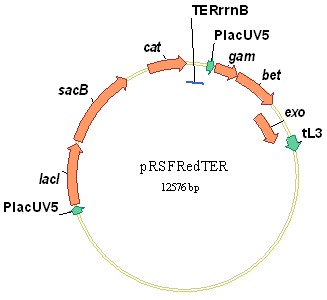
Рисунок 2. Структура плазмиды-помощника pRSFRedTER, обеспечивающей регулируемую экспрессию генов Red-системы.
Для проверки функциональности сконструированной плазмиды была проведена интеграция двухцепочечного фрагмента ДНК, содержащего ген устойчивости к канамицину, фланкированный сайтами attL и attR ((attL-kan-attR)-кассета), в структурную часть гена galK E. coli в присутствии плазмиды pRSFRedTer. Выход трансформантов составил около 300 KmR колоний на 108 колоний, выживших после электропорации. Структура хромосомы 10 независимых KmR колоний была подтверждена ПЦР анализом. Достигнутая частота интеграции сравнима с частотой интеграции двухцепочечных фрагментов ДНК в хромосому E. coli, обеспечиваемой плазмидой pKD46 (Datsenko K.A., Wanner B.L., 2000).
Так как основные, функционально-значимые элементы плазмиды pRSFRedter являются активными в ряде других бактерий, то, потенциально, данная плазмида может быть использована для обеспечения экспрессии генов Red-системы в этих микроорганизмах.
2.2. Одновременная экспрессия генов Red-системы фага является токсичной для клеток P. ananatis.
При электротрансформации штамма SC17 P. ananatis плазмидой pRSFRedTER колонии, полученные на селективной среде с хлорамфениколом, были меньшего размера, чем трансформанты, полученные на идентичной селективной среде после электропорации штамма SC17 контрольной плазмидой pRSFsacB, не несущей гены Red-системы. При этом трансформанты, несущие плазмиду pRSFRedTER, росли значительно медленнее на LB среде с хлорамфениколом по сравнению с трансформантами, несущими плазмиду pRSFsacB. Добавление же ИПТГ в среду культивирования для индукции экспрессии генов Red-системы полностью останавливало рост культуры клеток, несущих плазмиду pRSFRedTER, но не влияло на рост культуры клеток, несущих контрольную плазмиду pRSFsacB. Ранее было показано, что авторегулируемый элемент PlacUV5-lacI обеспечивает эффективную репрессию (минимум 100-кратную) и низкий базальный уровень экспрессии целевых генов (Скороходова А.Ю. и др, 2004). Тем не менее, даже базальный уровень экспрессии генов Red-системы был токсичен для клеток штамма SC17 P. ananatis и приводил к значительному снижению скорости роста.
Для того чтобы выявить, экспрессия какого из компонентов Red-системы является токсичной, была сконструирована плазмида pRSFGamBet (Рис. 3), не содержащая в своем составе ген exo, кодирующий 5’3’ экзонуклеазу фага.

Рисунок 3. Структура плазмиды-помощника: pRSFGamBet, обеспечивающей регулируемую экспрессию генов gam и bet.
Известно, что активность 5’3’ экзонуклеазы Red-системы фага необходима для осуществления интеграции двухцепочечных фрагментов ДНК. Однако для интеграции одноцепочечных фрагментов, таких как химически синтезированные олигонуклеотиды, необходима экспрессия только гена bet фага. Плазмида pRSFGamBet была использована для осуществления рекомбинации между олигонуклеотидом длинной 72 н.п. и хромосомой ранее полученного штамма MG1655galK::(attL-kan-attR). В результате рекомбинации происходило восстановление структурной части гена galK E. coli и способности штамма расти на галактозе как единственном источнике углерода. В трех независимых экспериментах выход трансформантов составил от 1,5*104 до 2,5*104 Gal+ клонов в расчете на 108 клеток, выживших после электропорации. Таким образом была доказана функциональность полученной плазмиды pRSFGamBet.
Введение плазмиды pRSFGamBet в штамм SC17 не приводило к ингибированию роста клеток даже в присутствии ИПТГ в среде культивирования. Таким образом, выявленный ранее токсический эффект от присутствия плазмиды pRSFRedTER в клетках P. ananatis был обусловлен либо экспрессией гена exo, либо одновременной экспрессией всех трех генов Red-системы – gam, bet, exo.
2.3. Селекция штамма-реципиента для осуществления Red-зависимой интеграции двухцепочечных фрагментов ДНК в хромосому P. ananatis.
По современным представлениям мишенью при Red-зависимой интеграции служат одноцепочечные участки ДНК, образующиеся между фрагментами Оказаки при репликации. Поэтому для осуществления высокоэффективной Red-зависимой интеграции необходима активная репликация хромосомы, и, следовательно, хороший рост клеток. Поэтому значительное замедление роста штамма SC17 P. ananatis в результате экспрессии генов Red-системы являлось серьезным препятствием при решении задачи об адаптации метода Red-зависимой рекомбинации для использования в клетках P. ananatis. Возможным решением данной проблемы являлся отбор специального штамма, устойчивого к экспрессии генов Red-системы.
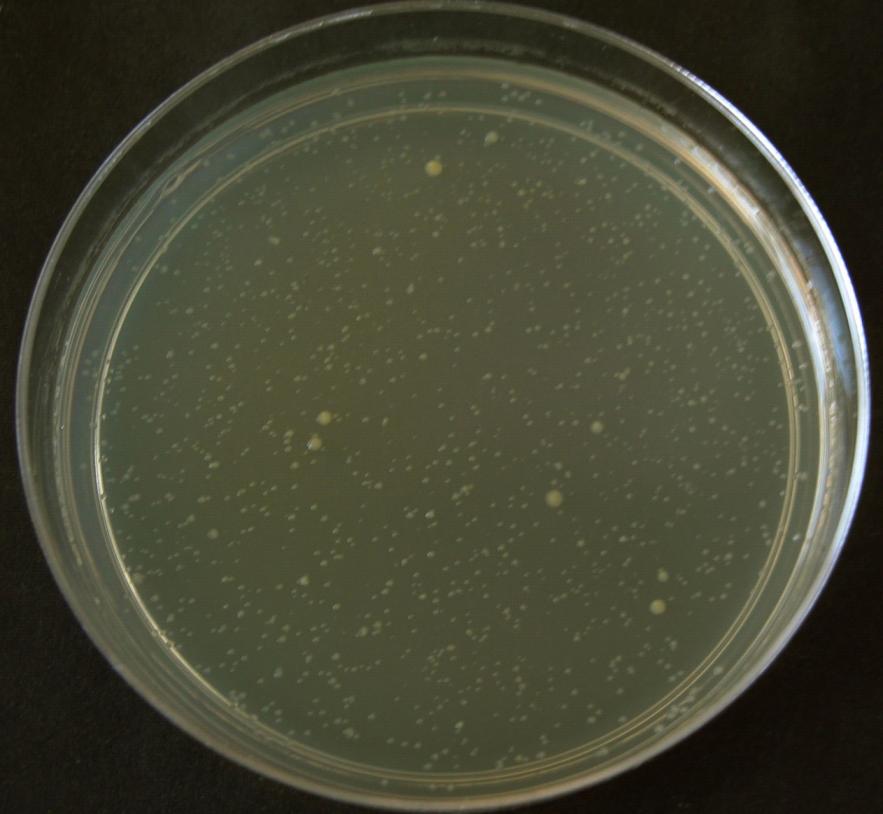

Рисунок 4. Расщепление колоний штамма P. ananatis SC17 по размеру после электротрансформации плазмидой pRSFRedTER, обеспечивающей регулируемую экспрессию генов Red-системы.
Мутантный штамм, устойчивый к экспрессии генов Red-системы, был отобран следующим образом. При трансформации штамма SC17 плазмидой pRSFRedTER среди трансформантов, выросших на LB среде с хлорамфениколом, было отобрано около 10 колоний большего размера (Рис. 4). Клетки из отобранных колоний росли в жидкой LB среде с хлорамфениколом так же хорошо, как клетки штамма SC17, несущие контрольную плазмиду pRSFsacB. Более того, добавление ИПТГ в среду культивирования лишь незначительно замедляло рост отобранных «крупных» колоний. Резкое отличие свойств «крупных» колоний от ранее описанного поведения может быть объяснено двумя возможными причинами: во-первых, эти колонии могли нести мутантную плазмиду pRSFRedTER, не обеспечивающую экспрессию генов Red-системы; во-вторых, «крупные» колонии могли быть мутантами, устойчивыми к экспрессии генов Red-системы.
Для проверки первого предположения плазмидная ДНК, выделенная из трех независимых «крупных» колоний, была перетрансформирована в штамм E. coli MG1655. В качестве контроля штамм E. coli MG1655 был трансформирован исходным препаратом плазмиды pRSFRedTER. Полученные трансформанты были использованы в качестве реципиентов для Red-зависимой инактивации гена galK E. coli путем интеграции линейного фрагмента ДНК, содержащего (attL-kan-attR) кассету в структурную часть гена. Во всех случаях выход трансформантов был высоким и составил от 200 до 300 KmR колоний в расчете на 108 клеток, выживших после электропорации. Таким образом, плазмиды pRSFRedTER, выделенные из «крупных» колоний, обеспечивают такой же уровень экспрессии всех трех генов Red-системы, как и исходно полученная плазмида.
Три «крупных» колонии, являвшиеся донорами плазмиды pRSFRedTER в предыдущем опыте, были излечены от данной плазмиды и вновь трансформированы исходным препаратом pRSFRedTER. Во всех трех случаях все полученные колонии были большого размера и имели те же свойства, что и родительские клоны. Один независимый трансформант для каждой родительской «крупной» колонии был использован в качестве реципиента для Red-зависимой интеграции линейного фрагмента ДНК, несущего (attL-kan-attR) кассету, фланкированную областями гомологии к гену hisD P. ananatis длиной 40 н.п. В результате было получено от 100 до 150 KmR колоний в расчете на 108 клеток, выживших после электропорации. Факт интеграции линейного фрагмента ДНК в соответствующую точку хромосомы P. ananatis был подтвержден для 10 независимых KmRHis- колоний для каждого реципиента. Один из реципиентов, использованный в вышеописанных экспериментах и излеченный от плазмиды pRSFRedTER, был назван SC17(0). При использовании данного штамма в качестве реципиента для Red-зависимой интеграции линейных фрагментов ДНК с короткими плечами гомологии в хромосому P. ananatis достигнутая частота интеграции сравнима с частотой, получаемой в аналогичных экспериментах в E. coli (Datsenko K.A., Wanner B.L., 2000). Штамм, несущий в хромосоме ген hisD, инактивированный (attL-kan-attR) кассетой, был назван SC17(0)hisD:: (attL-kan-attR).
В настоящее время метод Red-зависимой интеграции линейных фрагментов ДНК был использован для создания в хромосоме штамма SC17(0) делеций, различных модификаций регуляторных областей и интеграции гетерологичных генов. При этом мишенями для генетических манипуляций служили: гены центрального метаболизма (гликолиза, пентозо-фосфатного пути, ТСА); гены дыхательной цепи; гены, кодирующие транспортные белки; гены, кодирующие белки-регуляторы. Частота интеграции варьировалась в зависимости от конкретной модификации от нескольких сотен до нескольких десятков интегрантов в расчете на 108 клеток, выживших после электропорации.
- Введение множественных модификаций в хромосому P. ananatis с использованием комбинированной системы Red-Int/Xis.
Создание штаммов, содержащих несколько различных модификаций в хромосоме, является необходимым этапом как при конструировании современных штаммов-продуцентов, так и при изучении сложных биологических процессов, происходящих в бактериальной клетке. При решении такой задачи исследователи сталкиваются с проблемой ограниченного набора селективных маркеров, используемых в целевом организме. Немаловажным является также существование законодательных ограничений на присутствие селективных маркеров в промышленных штаммах продуцентах. В настоящее время разработан и активно применяется инструментарий, позволяющий удалять селективный маркер из хромосомы после его использования. Разработанные подходы базируются на различных системах сайт-специфической рекомбинации: Cre/lox фага P1 (Dale E.C., Ow D.W., 1991), Flp/FRT 2 мкм дрожжевой плазмиды (Cherepanov P.P., Wackernagel W., 1995), система mrs плазмиды RP4 (Kristensen C.S. et al, 1995) и системы фага (Peredelchuk M.Y., Bennett G.N., 1997).
Ранее в нашей лаборатории была разработана система, позволяющая удалять селективный маркер из хромосомы E. coli после его использования (Каташкина Ж. И., 2003). Данная система, основанная на сайт-специфической рекомбинации фага, аналогична системе, представленной в работе Peredelchuk и Bennet (Peredelchuk M.Y., Bennett G.N., 1997), но имеет ряд преимуществ. Плазмида-помощник pMW-intxis-ts создана на базе термочувствительного репликона pSC101-ts, что позволяет легко элиминиравать ее из популяции после использования. Гены xis-int экспрессируются в составе плазмиды под контролем PR промотора, регулируемого термочувствительным репрессором CIts857. Также был сконструирован набор вырезаемых маркеров, содержащих эффективно экспрессирующиеся гены антибиотической устойчивости к канамицину, хлорамфениколу и тетрациклину, фланкированные областями attL/attR. Было показано, что созданная система эффективно функционирует при температуре +37 С, соответствующей неполной инактивации CIts857 репрессора. Этот факт является очень важным, так как P. ananatis имеет более низкую оптимальную температуру для роста (+34С) и не растет при +42С – стандартной температуре инактивации CIts857 репрессора.
Известно, что в процессе сайт-специфической рекомбинации фага принимают участие не только фаговые белки Int и Xis, но и белки E. coli Fis и IHF. Компьютерный анализ выявил присутствие в геноме P. ananatis открытых рамок считывания, кодирующих гомологи белка Fis E. coli (степень идентичности АК последовательностей 99%) и и субъединиц белка IHF E. coli (степень идентичности АК последовательностей 97% и 94% соответственно). Поэтому можно было ожидать, что гомологи из P. ananatis смогут заменить белки Fis и IHF E. coli, необходимые для эффективного Int/Xis зависимого удаления маркера из хромосомы.
P. ananatis имеет природную устойчивость к ампициллину, поэтому исходная плазмида pMW-intxis-ts, несущая ген bla в качестве селективного маркера, не может быть использована в клетках данного организма. Ген bla был заменен в составе плазмиды pMW-intxis-ts на ген устойчивости к хлорамфениколу. Полученная в результате плазмида была названа pMW-intxis-cat (Рис. 5). Штамм SC17(0)hisD::(attL-kan-attR) был трансформирован плазмидой pMW-intxis-cat с помощью электропорации. Клетки после электропорации высевались на LB среду с хлорамфениколом и инкубировались при +37С в течении 16 часов. В результате около 30% трансформантов имели KmS фенотип. Вырезание маркера устойчивости к канамицину из хромосомы этих клонов было подтверждено ПЦР анализом. Далее несколько KmS колоний были рассеянны до отдельных клонов на среде без хлорамфеникола и инкубировались в течении 16 часов при +37С для излечивания от плазмиды-помощника. Эффективность излечивания составила (10-20)%.
В настоящее время разработанные системы Red-зависимой интеграции линейных фрагментов ДНК, Int/Xis зависимого удаления маркера из хромосомы P. ananatis и метод электропорации геномной ДНК позволили совместить в хромосоме штаммов SC17(0) и SC17 до 10 модификаций различного рода. При этом присутствие большого количества сайтов attB в хромосоме не влияло ни на стабильность полученных штаммов, ни на частоту Red-зависимой интеграции линейных фрагментов ДНК, имеющих в своем составе последовательности attL и attR.
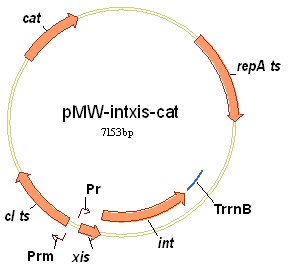
Рисунок 5. Структура плазмиды-помощника pMW-intxis-cat, имеющей термочувствительный репликон и обеспечивающей термоиндуцибельную экспрессию int и xis генов.
- Введение точечных мутаций в хромосому штамма SС17(0) P. ananatis.
Для введения точечных замен в искусственные бактериальные хромосомы или хромосому E. coli несколькими исследовательскими группами был использован подход, основанный на использовании Red-зависимой или RecET-зависимой рекомбинации и двойного маркера – для прямой и контр-селекции. В качестве маркера для прямой селекции чаще всего используют гены антибиотической устойчивости. Контрселективный маркер представляет собой последовательность ДНК, присутствие которой в хромосоме приводит к гибели клеток в определенных условиях. Введение точечных замен в молекулу-мишень осуществляется в два последовательных этапа. На первом этапе в интересующую точку молекулы-мишени с помощью Red/RecET-зависимой рекомбинации вводится кассета, содержащая двойной маркер и целевую мутацию. На данном этапе отбор интегрантов проводится с помощью прямой селекции. На втором этапе в результате Red/RecET-зависимой рекомбинации между двухцепочечным фрагментом ДНК или олигонуклеотидом, также содержащим необходимую мутацию, и целевым местом молекулы-мишени происходит удаление ранее интегрированной кассеты. На данном этапе селекция обеспечивается маркером для контрселекции. Полученный таким образом штамм не несет в своей хромосоме никаких дополнительных модификаций, кроме целевой. В качестве контрселективного маркера часто используют ген левансахаразы Bacillus subtilis, чья экспрессия приводит к гибели клеток при росте на сахарозе из-за синтеза полимера -2,6-фруктана (левана). Для E. coli при использовании гена sacB частота отбора целевой модификации составляла от 10% до 25% (Zhang Y. et al, 1998; Muyrers J.J.P. et al, 2000).
Для проверки возможности использования вышеописанной методики для конструирования точечных замен в хромосоме P. ananatis была произведена замена двух нуклеотидов в структурной части гена hisD данной бактерии, приводящая к исчезновению сайта рестрикции SmaI и возникновению в этой точке сайта рестрикции XhoI. При этом вводимые замены не изменяли аминокислотной последовательности белкового продукта. Была сконструирована плазмида pRSFPlacsacB, содержащая в своем составе кассету (PlacUV5-sacB-cat), несущую селективный (ген cat) и контрселективный (ген sacB) маркеры. Ген левансахаразы в данной конструкции экспрессируется под контролем PlacUV5 промотора. На базе плазмиды pRSFRedter была сконструирована плазмида pRSFRedkan. В составе данной плазмиды гены sacB и cat были заменены на ген устойчивости к канамицину. Плазмида pRSFRedkan была использована в качестве плазмиды-помощника для обеспечения Red-зависимой интеграции кассеты (PlacUV5-sacB-cat) в ген hisD штамма SС17(0) P. ananatis. Отбор интегрантов производился на LB среде с хлорамфениколом. В полученных интегрантах был подтвержден His-SucS фенотип (Рис. 6Б). Далее с помощью ПЦР был сконструирован линейный двухцепочечных фрагмент длиной 170 н.п., содержащий необходимую мутацию, фланкированную областями гомологии к гену hisD P. ananatis (Рис. 6А). Полученный фрагмент был интегрирован в хромосому ранее сконструированного штамма SС17(0)hisD::PlacUV5-sacB-cat с помощь Red-зависимой рекомбинации, обеспечиваемой генами Red системы в составе плазмиды-помощника pRSFRedkan. В результате рекомбинации в ген hisD вводились необходимые нуклеотидные замены, и одновременно происходила элиминация (PlacUV5-sacB-cat) кассеты из хромосомы (Рис. 6Б). Около 300 трансформантов было полученно на LB среде с добавлением 30% сахарозы и 1мМ ИПТГ для индукции PlacUV5 промотора. Необходимо отметить, что P. ananatis хорошо растет на сахарозе как единственном источнике углерода, а в геноме данной бактерии были найдены гены утилизации сахарозы (scrK, scrYABR). Поэтому в данном опыте для отбора интегрантов были использованы более высокие концентрации сахарозы по сравнению с аналогичными опытами для E. coli (обычно используют (5-10)%). Из 100 проанализированных трансформантов 25 имели His+CmS фенотип. Для 15 из SucRHis+CmS клонов была подтверждена замена сайта рестрикции SmaI на сайт XhoI в hisD гене путем обработки соответствующих ПЦР-фрагментов рестриктазами SmaI или XhoI.
Таким образом, был разработан метод введения точечных замен в хромосому штамма SС17(0) P. ananatis. Эффективность введения точечной мутации составила 25%.

Рисунок 6. Схема конструирования немаркированных точечных замен в гене hisD P. ananatis. А) Конструирование двухцепочечного фрагмента ДНК, несущего необходимую мутацию. На первом этапе два комплементарных олтгонуклеотида HisD-XhoI-1 и HisD-Xho-2 были гибридизированы друг с другом. Оба олиглнуклеотида содержат в своей последовательности целевые нуклеотидные замены (обозначены звездочками), приводящие при отжиге к образованию сайта узнавания рестриктазы XhoI. Далее полученный двухцепочечный фрагмент ДНК был амплифицирован с помощью ПЦР с использованием олигонуклеотидов his-SL/his-SR. В результате был получен двухцепочечный фрагмент ДНК, содержащий целевые нуклеодидные замены, фланкированные областями гомологии к гену hisD P. ananatis длиной 82 п.н. Б) Схема конструирования замены двух нуклеотидов в структурной части гена hisD P. ananatis с помощью двухстадийной методики, основанной на использовании Red-зависимой рекомбинации и кассеты с двойным селективным/контрселективным маркером.
- Целенаправленная модификация хромосомы штамма SC17 P. ananatis с помощью Bet-зависимой интеграции олигонуклеотидов.
Разработанной в данной работе метод электропорации геномной ДНК позволяет переносить маркированные мутации, полученные в хромосоме штамма SС17(0) с помощью Red-зависимой системы рекомбинации, в штамм дикого типа SС17. Перенос точечных мутаций в штамм SС17 представляется более сложным процессом, включающим дополнительные стадии. Во-первых, необходимо маркировать целевую точечную мутацию; во-вторых, удалить аллель дикого типа из хромосомы штамма SС17 и только после этого переносить в штамм целевую модификацию. При этом в результирующем штамме помимо необходимой модификации будет присутствовать селективный маркер или attB в случае использования вырезаемого маркера. На втором этапе эксперимента, описанного в предыдущем разделе, вместо линейного двухцепочечного фрагмента ДНК может быть использован олигонуклеотид, содержащий необходимую замену. Для интеграции одноцепочечной ДНК необходима только Bet активность фага. Ранее было установлено, что совместная экспрессия белков Gam и Bet не является токсичной для клеток штамма SС17 (см. Раздел №2.2). Используя эти факты и метод переноса маркированных мутаций между штаммами P. ananatis была показана принципиальная возможность создавать нуклеотидные замены непосредственно в хромосоме штамма SC17 с использованием олигонуклеотидов.
Замена двух нуклеотидов в последовательности гена hisD штамма SС17, приводящая к исчезновению сайта рестрикции SmaI и возникновению в этой точке сайта рестрикции XhoI, были сконструирована следующим образом. Сначала маркированная хромосомная модификация hisD::PlacUV5-sacB-cat была перенесена в штамм SС17 с помощью электропорации геномной ДНК, выделенной из штамма SС17(0)hisD::PlacUV5-sacB-cat. Полученный штамм, SС17hisD::PlacUV5-sacB-cat, был далее трансформирован плазмидой pRSFGamBetkan. Плазмида pRSFGamBetkan была получена из плазмиды pRSFGamBet (Рис. 3) путем замены генов sacB и cat на ген устойчивости к канамицину. Известно, что эффективность интеграции олигонуклеотидов зависит от направления репликации в сайте рекомбинации. Направление репликации хромосомы P. ananatis в области hisD гена неизвестно. Поэтому штамм SС17hisD::PlacUV5-sacB-cat/pRSFGamBetkan был трансформирован олигонуклеотидами HisD-XhoI-1 и HisD-Xho-2, комплементарными друг другу и несущими необходимые нуклеотидные замены. Клетки после электропорации высевались на LB среду с добавлением 30% сахарозы и 1мМ ИПТГ. После 24 часов инкубации ни одного клона не выросло в случае, когда для электропорации был использован олигонуклеотид HisD-Xho-2. Около 200 клонов выросло на селективной среде при использовании олигонуклеотида HisD-XhoI-1 для электропорации. Только 7 из 100 проверенных клонов имели His+CmS фенотип. В этих клонах также была подтверждена замена природного сайта рестрикции SmaI на сайт XhoI. Таким образом, описанный метод позволяет вводить точечные модификации в хромосому штамма SС17 P. ananatis. Снижение частоты отбора интегрантов на втором этапе данного эксперимента, вероятно, связано с меньшим размером областей гомологии, чем в опыте с двухцепочечным фрагментом (34 п.н. и 82 п.н. соответственно).
- Ген -галактозидазы - природный репортер, локализованный в хромосоме P. ananatis.
Для изучения свойств регуляторных элементов широко применяют подход, заключающейся в клонировании целевых фрагментов и экспрессии под их контролем гена-репортера в составе плазмид. Однако копийность плазмид может существенно зависеть от свойств клонированного фрагмента, поэтому при сравнении свойств различных регуляторных элементов предпочтительнее интегрировать исследуемые элементы в состав бактериальной хромосомы. Одним из часто используемых репортерных генов является ген lacZ E. coli, кодирующий -галактозидазу. Активность -галактозидазы легко измеряется с помощью высокоспецифичной хромогенной реакции.
Клетки P. ananatis могут использовать лактозу как единственный источник углерода. При анализе генома P. ananatis в хромосоме данного организма были найдены открытые рамки считывания (ORF), кодирующие гомологи -галактозидазы LacZ (степень идентичности АК последовательностей 78,8%) и пермеазы LacY (степень идентичности АК последовательностей 94,2%) и участвующие в утилизации лактозы в E. coli. Присутствие -галактозидазы в клетках P. ananatis подтверждалось появлением у колоний голубой окраски при росте на среде с добавлением красителя X-gal. С меньшей степенью гомологии в хромосоме P. ananatis были обнаружены ORF, кодирующие гомологи тиогалактозид ацетилтрансферазы LacA и репрессора лактозного оперона LacI E. coli - степень идентичности АК последовательностей 52,5% и 50,1%, соответственно. Гены lacZYA E. coli транскрибируются в виде полицистронной мРНК под контролем репрессора LacI. Ген репрессора конвергентно транскрибируется с собственного промотора. В хромосоме P. ananatis только гены lacZ и lacY находятся в одном локусе и предположительно образуют оперон. Гены lacI и lacA, напротив, не сцеплены ни с генами lacZY, ни друг с другом.
Сравнение аминокислотных последовательностей LacI репрессора E. coli и белка-гомолога, найденного в хромосоме P. ananatis показало высокую степень гомологии N-концевых ДНК-узнающих участков белков. При этом кластеры высокой степени гомологии располагаются в областях, образующих H-T-H узнающую структуру LacI репрессора E. coli (Рис. 7). Аминокислотные остатки (Asn125, Asp149, Ser191, Ser193, Arg197, Asn246, Asp274), непосредственно связывающиеся с индуктором, также идентичны в обоих белках. Более того, в регуляторной области lacZY генов P. ananatis можно выделить участки ДНК (далее О1 и О2), похожие на сайты связывания репрессора LacI E. coli по нуклеотидной последовательности и расположенные аналогично соответствующим операторным участкам лактозного промотора E. coli. Непосредственное измерение активности -галактозидазы в грубых экстрактах клеток штамма SC17(0) (Таблица№ 1) показало, что данная активность увеличивается в несколько десятков раз в присутствии ИПТГ – неметаболизируемого индуктора LacI репрессора. Для подтверждения действительно ли найденный белок-гомолог является LacI репрессором в P. ananatis, ген, кодирующий данный белок, был инактивирован в хромосоме штамма SC17(0) с помощью адаптированной системы Red-зависимой интеграции. Инактивация этого гена действительно привела к независимости уровня активности -галактозидазы от присутствия ИПТГ в среде культивирования.
P.a. 4 SVTLDDVAQLAGVSYQTVSRVLNRSEQVSPRTREKVEAAMQQLNYVPNRVAQQLAGKATR 64
VTL DVA+ AGVSYQTVSRV+N++ VS +TREKVEAAM +LNY+PNRVAQQLAGK +
E.c. 2 PVTLYDVAEYAGVSYQTVSRVVNQASHVSAKTREKVEAAMAELNYIPNRVAQQLAGKQSL 62
-спираль 1 -спираль 2 -спираль 3 -спираль 4
Рисунок 7. Сравнение аминокислотных последовательностей N-концевых участков LacI репрессоров E. coli и P. ananatis. Аминокислоты, образующие -спирали ДНК-узнающего домена LacI репрессора E. coli, отмечены подчеркиванием. Для LacI репрессора E. coli цветом выделены функционально-значимые аминокислоты: синим - аминокислоты, участвующие во взаимодействии LacI репрессора с ДНК, зеленым - аминокислоты, участвующие в стабилизации HTH мотива LacI репрессора. Аминокислоты, не чувствительные к заменам, закрашены желтым цветом.
Таблица №1. Зависимость экспрессии гена lacZ P. ananatis от присутствия в клетках репрессора LacI и/или ИПТГ в среде культивирования. Штамм SC17(0)lacI предварительно был излечен от плазмиды рRSFRedTER, несущей в своем составе ген lacI E. coli.
| Strain | IPTG concentration, мМ | |
| 0 | 1 | |
| SC17(0) | 6±2 | 500±10 |
| SC17(0)lacI | 530±20 | 550±20 |
Идентифицированный в хромосоме P. ananatis ген -галактозидазы может быть использован в качестве репортера для исследования свойств природных и искусственных регуляторных элементов в клетках данного организма.
- Создание охарактеризованной библиотеки промоторов для оптимизации экспрессии генов P. ananatis.
Перед исследователями, занимающимися метаболической инженерией, нередко возникает проблема оптимизации экспрессии того или иного гена, когда есть основания полагать, что низкий уровень экспрессии не обеспечивает достаточного выхода целевого продукта, а слишком высокий уровень может явиться токсичным для клетки. Возможность плавно и в широких пределах варьировать уровень экспрессии интересующих генов важна и при проведении фундаментальных исследований клеточного метаболизма, таких как изучение перераспределения потоков углерода при изменении уровней ключевых ферментативных активностей.
Ранее в нашей лаборатории был разработан метод, позволяющий путем одноактной Red-интеграции созданного in vitro набора фрагментов ДНК, получать представительные выборки клонов E. coli с широким спектром уровней экспрессии интересующего цистрона/оперона (Каташкина Ж. И., 2003; Каташкина Ж. И. и др, 2005). Изменение уровня экспрессии целевого гена обеспечивалось рандомизацией четырех внутренних нуклеотидов области «-35» канонического Ptac промотора. Преимущество рандомизации именно области «-35» состоит в том, что замены в ней, вероятно, не приводят к изменению старта транскрипции, по крайней мере, для промоторов с канонической областью «-10». В этом случае мРНК, транскрибируемые с разных промоторов библиотеки, имеют идентичные последовательности и уровень активности репортерного белка прямо пропорционален «силе» промотора.
Данный подход был применен для получения коллекции Ptac-подобных промоторов, обеспечивающих разные уровни инициации транскрипции в P. ananatis. За узнавание областей «-10» и «-35» промотора отвечают -субъединицы РНК-полимеразы. Сравнение аминокислотных последовательностей 70-субъединиц E. coli и P. ananatis выявило высокий уровень гомологии между этими белками (степень идентичности АК последовательностей 91%). При этом участки белков, непосредственно взаимодействующие с областями «-10» и «-35» промотора, в этих организмах не различаются. Поэтому мы предположили, что гибридный канонический для E. coli промотор Ptac будет достаточно сильным и в клетках P. ananatis. Это предположение было подтверждено в результате эксперимента по замене природной промоторной области lacZ в хромосоме P. ananatis на Ptac промотор. В результате гибридный промотор Ptac обеспечивал уровень активности -галактозидазы как минимум в 15 раз превышающий уровень, обеспечиваемый природным промотором (Таблица№ 2).
Таблица №2. Сравнение уровней экспрессии гена lacZ P. ananatis, обеспечиваемых природным промотором и гибридным промотором Ptac. Для измерения активности -галактозидазы штаммы растились до ОД=0,8-1.0 на LB среде c добавлением 1 мМ ИПТГ.
| Штамм | Активность -галактозидазы, ед. Миллера |
| SC17(0) | 500±10 |
| SC17(0) PtaclacZ | 8300±460 |
Первым этапом создания библиотеки было конструирование in vitro набора специальных интегративных кассет, включающих промотор с мутантной областью «-35», вырезаемый маркер устойчивости к канамицину (ген kan, фланкированный attL/attR сайтами фага ) и участки гомологии (40 п.н.) с планируемым местом интеграции. Полученная in vitro смесь интегративных кассет была интегрирована в хромосому штамма SC17(0) в присутствии плазмиды-помощника pRSFRedTER. В результате Red-зависимой рекомбинации происходила замена области, исходно находящейся левее гена lacZ и содержащей возможные участки инициации транскрипции, на промоторы библиотеки (Рис. 8). При этом после интеграции в полученных конструкциях имеются два возможных участка связывания лактозного репрессора: О1 E. coli, входящий в состав промоторов, и О2’ P. ananatis, локализованный в структурной части гена lacZ. Поэтому экспрессия гена lacZ в полученных клонах могла быть подвержена репрессии как со стороны LacI репрессора E. coli, чей ген локализован в составе плазмиды-помощника pRSFRedTER, так и со стороны идентифицированного LacI репрессора P. ananatis. Для предварительного отбора вариантов, обеспечивающих различные уровни транскрипции репортерного гена, отобранные интегранты были излечены от плазмиды-помощника pRSFRedTER и перепечатаны на индикаторную среду с добавлением X-gal и ИПТГ. В качестве контроля был использован штамм, несущий в хромосоме ген lacZ под контролем Ptac промотора.

Рисунок 8. Схема замены природной регуляторной области генов lacZY на Ptac промотор или Ptac-подобные промоторы с рандомизированной областью «-35».
Для 30 колоний, имевших различную интенсивность окрашивания на среде с X-gal и ИПТГ и контрольного Ptac промотора, была измерена удельная активность -галактозидазы. Для 14 из 30 промоторов, давших различающиеся уровни активности, были определены нуклеотидные последовательности. Результаты измерения активности -галактозидазы и нуклеотидные последовательности области «-35» соответствующих промоторов представлены в Таблице №3.
Таблица №3. Зависимость уровня активности -галактозидазы P. ananatis от последовательности области «-35» Ptac-подобных промоторов библиотеки.
| Промотор | Нуклеотидная последовательность области «-35» | Активность -галактозидазы, ед. Миллера |
| ИПТГ, 1мМ | ||
| Ptac | TTGACA | 6000 |
| Ptac52 | TTGCTA | 2800 |
| Ptac84 | TTTGCA | 2000 |
| Ptac65 | TTGTGA | 1250 |
| Ptac49 | TTGTAA | 1200 |
| Ptac47 | TTGAGA | 1000 |
| Ptac60 | TTTCAA | 770 |
| Ptac27 | TTGGAA | 730 |
| Ptac11 | TTGGAA | 590 |
| (спейсер 15 п.н.) | ||
| Ptac61 | TTTATA | 380 |
| Ptac22 | TAGTGA | 160 |
| Ptac8 | TGAAGA | 150 |
| Ptac82 | TCGCGA | 100 |
| Ptac25 | TCCGGA | 80 |
| Ptac21 | TCTCGA | 70 |
Полученный набор промоторов обеспечивает плавное изменение уровня активности -галактозидазы от нескольких десятков ед. Миллера до 6000 ед. Миллера (Рис. 8). Промотор Ptac является самым «сильным» промотором библиотеки. Интересно отметить, что у большинства промоторов, обеспечивающих достаточно высокий уровень активности -галактозидазы (не менее 10% от уровня, обеспечиваемого Ptac промотором) вторая и третья позиции области «-35» оказываются гораздо менее вариабельными, чем остальные рандомизированные нуклеотиды: в этих позициях, как правило, расположены тимин и гуанин соответственно. Ранее в аналогичных экспериментах c E. coli такая закономерность не наблюдалась (Каташкина Ж. И., 2003; Каташкина Ж.И. и др, 2005).
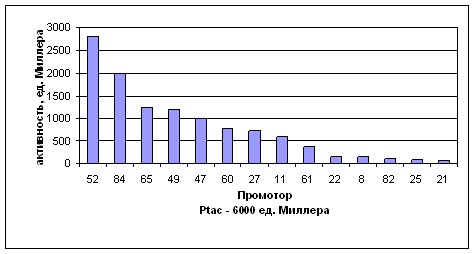
Рисунок 8. Диаграмма, иллюстрирующая плавное изменение активности -галактозидазы P. ananatis, обеспеченное использованием промоторов библиотеки.
Измерение активности репортерного гена является косвенным методом оценки «силы» промоторов библиотеки. Поэтому для трех штаммов, несущих разные промоторы, методом ПЦР в реальном времени было определено относительное количество мРНК гена lacZ, присутствующей в клетках. В качестве реперного гена был использован ген recB P. ananatis. Одновременно в этих же культурах клеток была измерена активность -галактозидазы. Из Таблицы №4 видно, что соотношения сил промоторов библиотеки, определенные разными методами, хорошо коррелируют между собой. Таким образом, активность -галактозидазы действительно отражает уровень мРНК гена lacZ в клетках P. ananatis в широком диапазоне изменения его величины.
Таблица№4. Описание свойств промоторов библиотеки с помощью двух различных методов: измерение активности репортерного белка -галактозидазы и определение относительного количества мРНК репортерного гена lacZ методом ПЦР в реальном времени.
| Промотор | ИПТГ, 0 мМ | |||
| Активность -галактозидазы, ед. Миллера | Отношение сил промоторов, Atac/AtacN | Относительное количество мРНКlacZ | Отношение сил промоторов, мРНКlacZ(Ptac)/ мРНКlacZ (PtacN) | |
| Ptac | 6700 | 1 | 53900 | 1 |
| Ptac52 | 550 | 12 | 3500 | 15 |
| Ptac65 | 160 | 42 | 940 | 57 |
Полученная библиотека Ptac-подобных промоторов, узнаваемых E70 P. ananatis, была использована для оптимизации экспрессии генов в штамме-продуценте глутаминовой кислоты, созданном на базе P. ananatis, что помогло существенно улучшить его свойства.
Выводы.
- Выявлен токсический эффект от экспрессии генов Red-системы в клетках P. ananatis, выражающийся в остановке роста бактерий. Отобран штамм SC17(0), способный к росту в условиях индукции экспрессии генов Red-системы. Показано, что при использовании штамма SC17(0) в качестве реципиента частота Red-зависимой интеграции линейных фрагментов ДНК с короткими плечами гомологии в хромосому P. ananatis сопоставима с частотой, получаемой в аналогичных экспериментах с E. coli К12.
- Разработан эффективный генетический инструментарий, позволяющий последовательно вводить множественные модификации в геном P. ananatis, получая штаммы, не содержащие в геноме маркеров устойчивости к антибиотикам. Его основными элементами являются:
- метод введения маркированных мутаций в геном штамма SC17(0) с помощью Red-системы фага ;
- метод переноса маркированных мутаций между штаммами P. ananatis с помощью электропорации геномной ДНК;
- Xis/Int-зависимое удаление использованных селективных маркеров.
- Разработана двухстадийная процедура получения немаркированных точечных замен в хромосоме P. ananatis, основанная на использовании двойного селективного/контрселективного маркера и метода Red-зависимой интеграции двухцепочечных фрагментов ДНК или Bet-зависимой интеграции олигонуклеотидов. Эффективность проведения такой модификации в модельных экспериментах достигала 25%.
- Осуществлено конструирование библиотеки искусственных Ptac-подобных промоторов, обеспечивающих различающиеся в диапазоне двух порядков величины уровни транскрипции целевого гена P. ananatis.
Основное содержание диссертации отражено в следующих печатных работах:
1. Голубева Л.И., Куваева Т.М., Каташкина Ж.И. Использование Red-зависимой системы рекомбинации фага для получения библиотек промоторов в Enterobacteriaceae. Материалы международной школы-конференции молодых ученых «Биотехнология будущего» в рамках международного симпозиума «ЕС-Россия: перспективы сотрудничества в области биотехнологии в 7-ой Рамочной Программе». Санкт-Петербург, 2006.
2. Joanna I Katashkina, Tatiana M Kuvaeva, Irina G Andreeva, Alexandra Yu Skorokhodova, Irina V Biryukova, Irina L Tokmakova, Lubov I Golubeva and Sergey V Mashko.Construction of stably maintained non-mobilizable derivatives of RSF1010 lacking all known elements essential for mobilization. BMC Biotechnology, 2007, 7:80.
3. Каташкина Ж.И., Голубева Л.И., Куваева Т.М., Гайденко Т.А., Гак Е.Р., Машко С.В. Способ конструирования рекомбинантных бактерий, принадлежащих к роду Pantoea, и способ продукции L-аминокислот с использованием бактерий, принадлежащих к роду Pantoea. Заявка на изобретение RU 2006134574, 2008.
4. Joanna I Katashkina, Yoshihiko Hara, Lyubov I Golubeva, Irina G Andreeva, Tatiana M Kuvaeva and Sergey V Mashko. Use of the Red-recombineering method for genetic engineering of Pantoea ananatis. BMC Molecular Biology, 2009, 10:34.

