Действие биферментного конъюгата супероксиддисмутаза-хондроитинсульфат-каталаза в условиях модельного окислительного стресса in vitro и in vivo
На правах рукописи
ВАВАЕВ
Александр Владимирович
ДЕЙСТВИЕ БИФЕРМЕНТНОГО КОНЪЮГАТА СУПЕРОКСИДДИСМУТАЗА-ХОНДРОИТИНСУЛЬФАТ-КАТАЛАЗА
В УСЛОВИЯХ МОДЕЛЬНОГО ОКИСЛИТЕЛЬНОГО СТРЕССА
IN VITRO И IN VIVO
Специальность 03.01.04 – биохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва - 2011
Работа выполнена в лаборатории биохимической инженерии Института Экспериментальной Кардиологии ФГБУ «Российский Кардиологический Научно-Производственный Комплекс» Минздравсоцразвития РФ
Научный руководитель: доктор биологических наук, профессор
Максименко Александр Васильевич
Официальные оппоненты: академик РАМН,
доктор биологических наук, профессор
Егоров Алексей Михайлович
доктор биологических наук, профессор
Ланкин Вадим Зиновьевич
Ведущая организация: ГУРАН Институт физиологически активных веществ РАН
Защита состоится «____» ____________ 20___ г. в _____ часов на заседании диссертационного совета Д 208.073.01 по присуждению ученой степени кандидата биологических наук в ФГБУ «Российский Кардиологический Научно-Производственный Комплекс» Минздравсоцразвития РФ по адресу: 121552, Москва, 3-я Черепковская ул., д. 15А.
С диссертацией можно ознакомиться в библиотеке
ФГБУ «РКНПК» Минздравсоцразвития РФ.
Автореферат разослан _______________ 2011 года
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор В.Е. Синицин
Общая характеристика работы
Актуальность темы диссертационной работы обусловлена клинической необходимостью поиска и разработки новых антиоксидантных препаратов, позволяющих эффективно предотвращать окислительный стресс. Хорошо известно, что окислительный стресс сопровождает развитие многих патологий, в том числе сердечно-сосудистых, таких как инфаркт миокарда, атеросклероз и др. [Ланкин В.З. и др., 2004]. Перспективным представляется использование средств на основе нативных ферментных антиоксидантов, ограниченно представленных в плазме крови человека и действующих на 4-5 порядков быстрее витаминных антиоксидантов [Scibior D., Czeczot H., 2004].
Ковалентное связывание супероксиддисмутазы (СОД) и каталазы (КАТ) с хондроитинсульфатом (ХС), гликозаминогликаном присутствующим в сосудистой стенке, позволило получить биферментный конъюгат (СОД-ХС-КАТ), представляющий инновационную надмолекулярную структуру двух антиоксидантных ферментов сочетанного действия. В проведенных ранее исследованиях на модели артериального тромбоза у крыс СОД-ХС-КАТ показал выраженную антитромботическую активность, уменьшая массу образующегося тромба и увеличивая время наступления окклюзии сосуда, вероятно за счет изменения структуры и проницаемости образующего тромба. Отмеченные эффекты были наилучшими по сравнению с нативными СОД, КАТ, ХС и их различными сочетаниями [Maksimenko A.V. et al., 2004]. Обнаружение новых эффектов потребовало проведения дополнительных исследований для выяснения свойств и особенностей действия препарата, вероятно связанных с его надмолекулярной структурой.
Цель и задачи исследования. Целью диссертационной работы было исследование свойств биферментного конъюгата СОД-ХС-КАТ в условиях развития в организме окислительного стресса, моделируемого введением H2O2. Были поставлены следующие задачи:
• исследовать антиоксидантную и антиагрегантную активность СОД-ХС-КАТ на тромбоцитах в контроле, на фоне индуцированной агрегации и в условиях окислительного стресса;
• выяснить действие биферментного конъюгата СОД-ХС-КАТ на тонус кольцевого фрагмента аорты крысы при окислительном стрессе;
• изучить влияние биферментного конъюгата СОД-ХС-КАТ на показатели гемодинамики кроликов и крыс при модельном окислительном стрессе in vivo;
• оценить переносимость, токсичность и мутагенность биферментного конъюгата СОД-ХС-КАТ.
Научная новизна. В работе подтвердилось исходное предположение, что сложная структура может проявлять новые качества, которые не сводятся к сумме свойств составляющих ее компонентов. Нами впервые показано, что СОД-ХС-КАТ эффективнее, чем нативная КАТ снимает действие H2O2 на агрегацию тромбоцитов. Обнаружено, что биферментный конъюгат СОД-ХС-КАТ существенно ингибирует спонтанную и индуцированную агрегацию тромбоцитов, вызванную классическими индукторами агрегации (АДФ, серотонин, TRAP), в отличие от нативной КАТ.
Показано, что на кольцевом фрагменте брюшной аорты крысы биферментный конъюгат СОД-ХС-КАТ имеет сходную с нативной КАТ и СОД эффективность антиоксидантного действия.
Впервые показано наличие профилактического и острого защитного действия биферментного конъюгата СОД-ХС-КАТ при существенных нарушениях системной гемодинамики крыс и кроликов in vivo, вызванных внутривенным введением H2O2.
Практическая значимость. Выявлена низкая острая токсичность и хорошая переносимость биферментного конъюгата СОД-ХС-КАТ, определенные в тестах на животных. Показано отсутствие у СОД-ХС-КАТ мутагенных свойств в тесте Эймса. Совокупность полученных результатов является надежной основой для дальнейшей биомедицинской разработки биферментного конъюгата СОД-ХС-КАТ как потенциального терапевтического средства и указывает универсальный подход для разработки ферментных коньюгатов различного медицинского назначения.
Апробация работы. Материалы диссертационной работы были представлены на нескольких научных конференциях: Всероссийская конференция «Тромбозы, геморрагии, ДВС-синдром. Современные достижения», 12-14 октября 2005 года, г. Ярославль; Четвертый московский международный конгресс «Биотехнология: состояние и перспективы развития», 12-16 марта 2007 года, г. Москва; Московская международная конференция «Биотехнология и Медицина», март 2006 и 2009 годов, г. Москва; 4-я, 5-я, 6-я и 7-я Национальная научно-практическая конференция с международным участием «Активные формы кислорода, оксид азота, антиоксиданты и здоровье человека», сентябрь 2005, 2007, 2009 и 2011 годов, соответственно, г. Смоленск, на межлабораторном семинаре НИИ экспериментальной кардиологии ФГУ РКНПК Минздравсоцразвития РФ 23 июня 2011 г.
Публикации. По материалам диссертационной работы опубликовано 15 печатных работ (7 статей и 8 тезисов конференций), 6 из которых в изданиях, рекомендованных ВАК.
Структура и объем работы. Диссертационная работа имеет стандартную структуру и состоит из следующих разделов: введение, обзор литературы, цель и задачи исследования, материалы и методы работы, результаты и их обсуждение, заключение, выводы, список цитируемой литературы, содержащий 179 ссылок. Работа изложена на 130 страницах машинописного текста, проиллюстрирована 25 рисунками и 6 таблицами.
ОСНОВНОЕ содержание работы
Объект и методы исследования. Объектом исследования был биферментный конъюгат СОД-ХС-КАТ, синтез которого проводили по ранее разработанной методике [Максименко А.В., Тищенко Е.Г., 1997]. Весовое содержание белка в препарате СОД-ХС-КАТ составляло 4-6%, удельная (специфическая) активность СОД – 60 Е/мг препарата, КАТ – 140 Е/мг препарата. Содержание белка в препаратах определяли по методу Бредфорд. Ферментативную активность СОД измеряли спектрофотометрически по ингибированию восстановления нитротетразолия синего в системе ксантин-ксантиоксидаза, pH 7,8, а КАТ – спектрофотометрически по уменьшению светопоглощения раствора H2O2 и КАТ при длине волны 240 нм (pH 7,0, комнатная температура) [Максименко А.В., Тищенко Е.Г., 1997].
Приготовление конъюгата СОД-ХС-КАТ с необратимо инактивированными ферментами осуществляли по ранее разработанной методике [Максименко А.В., Тищенко Е.Г., 1997]. СОД и КАТ предварительно инактивировали инкубацией с 0,3 М раствором H2O2 (pH 7,0, 0,02 М фосфатный буфер, комнатная температура, 3 часа) и при pH 11,8 - 12,0 (0,05 М NaOH, комнатная температура, 2 часа), соответственно.
В работе были использованы следующие основные методы: агрегатометрия, сканирующая электронная микроскопия (СЭМ), измерение изометрического сокращения изолированного кольцевого фрагмента сосуда, измерение показателей гемодинамики (артериальное давление /АД/, частота сердечных сокращений /ЧСС/, электрокардиограмма /ЭКГ/) in vivo, токсикологические методы определения острой токсичности и мутагенности.
В исследованиях агрегации и адгезии тромбоцитов использовали кровь здоровых добровольцев, взятую натощак самотеком из кубитальной вены в пластиковую пробирку с 0,13 М цитратом натрия (pH 7,3). Обогащенную тромбоцитами плазму (ОТП) получали центрифугированием крови при 180g в течение 15 минут. Агрегацию тромбоцитов регистрировали используя лазерный двухканальный анализатор агрегации «БИОЛА», позволяющий в разных режимах регистрировать образование как малых (от 3 до 100 тромбоцитов), так и крупных (свыше 100 тромбоцитов) агрегатов. Исследование проводили не позднее 2 часов после взятия крови.
Адгезию тромбоцитов к стеклу и влияние на нее ферментных препаратов оценивали с помощью СЭМ. В ОТП (15 мкл) добавляли H2O2, КАТ или СОД-ХС-КАТ, наносили ее на стекло, инкубировали 15 минут при комнатной температуре в закрытом бюксе, осторожно отмывали в физиологическом растворе, и фиксировали в 2,5% глутаровом альдегиде 1,5 часа. По окончании фиксации образец обезвоживали и готовили для СЭМ. Подсчет тромбоцитов различной формы осуществляли на 25 полях сканирования при увеличении х2500 в сканирующем электронном микроскопе «PHILLIPS PSEM 550х» и выражали в процентах к общему количеству клеток.
Исследования тонуса сосудистого фрагмента проводили на кольцевых фрагментах (длиной 3 мм) брюшной аорты крысы линии Wistar. Кольцевой фрагмент надевали на иголки, одна из которых была соединена с тензодатчиком, и погружали в раствор Кребса-Хэнсиляйта, продуваемый карбогеном при 37 С и pH 7,4. Окислительный стресс моделировали введением в инкубационный раствор H2O2 на фоне преконстрикции, вызванной 0,1 мкМ норадреналина (NA). Изменение тонуса сосуда оценивалось относительно величины сокращения в ответ на NA. Производные антиоксидантных ферментов вводились за 10 минут до введения H2O2.
В экспериментах in vivo защитное действие производного СОД-ХС-КАТ против окислительного стресса, вызванного внутривенным введением H2O2, было изучено при регистрации ЧСС, АД и ЭКГ самцов кроликов (n=29) весом 3,65±0,10 кг и самцов крыс линии Wistar (n=13) весом 427±7 г. Все эксперименты проводились на животных анестезированных кетамином.
Кроликам катетеризировали центральную артерию одного уха и краевые вены левого и правого уха. В одну из вен болюсно вводили физиологический раствор или раствор СОД-ХС-КАТ, а также 0,8% раствор H2O2, инфузией со скоростью 0,4 мл/мин в течение 3-х минут 2 раза с перерывом в 20 минут. Суммарное количество H2O2, полученное кроликами за весь период эксперимента, составляло 0,15 мкмоль/кг. В вену другого уха по необходимости проводилась инфузия кетамина. В центральную артерию вводился катетер регистрации АД с помощью дачика Statham pb23 (США). Регистрация ЭКГ во втором отведении и ЧСС проводилась на приборе BIOGRAF-4 с компьютеризированной записью данных и их последующей обработкой программой анализа физиологических сигналов (Е.В. Лукошкова).
Крысы линии Wistar были наркотизированы внутрибрюшинным введением кетамина. Катетер для регистрации АД вживляли в сонную артерию, в яремную вену вводили H2O2 и СОД-ХС-КАТ. H2O2 вводили в течение 5 минут (на 2 минуты дольше, чем в экспериментах на кроликах), чтобы получить сходные эффекты на параметры гемодинамики. Суммарная доза H2O2, полученная крысами за весь период эксперимента, составила 2,2 мкмоль/кг.
Изучение острой токсичности СОД-ХС-КАТ при однократном внутрибрюшинном введении разных доз (в диапазоне 120-10700 мг/кг) было проведено на 80 мышах линии BALB/c (самцы, самки, масса тела 18-20 г) и 40 мышах-гибридах F1(CBAxC57Bl6) (самцы, самки, масса тела 18-20 г). Длительность наблюдения за подопытными животными после введения препарата составляла 14 дней. Мутагенность определяли по тесту Эймса. В качестве индикаторных микроорганизмов использовали ауксотрофные по гистидину штаммы Salmonella typhimurium TA98, ТА100, ТА1537. Переносимость СОД-ХС-КАТ оценивали по влиянию увеличивающихся доз препарата на АД, ЧСС и ЭКГ крыс и кроликов.
Статистическую обработку полученных результатов, представленных как среднее значение±ошибка среднего (M±m), n – количество экспериментов, вели при сравнении данных двух групп с применением двухстороннего критерия Стьюдента (статистическая значимость различий при p<0,01). Если групп сравнения было более двух, статистическую обработку вели методом ANOVA (p<0,01).
Результаты и их обсуждение
Исследование тромбоцитов. При исследовании дозозависимости действия H2O2 в диапазоне 15 – 2000 мкМ на агрегацию тромбоцитов было установлено, что H2O2 начинает индуцировать агрегацию в концентрации около 50 мкМ. Дозы выше 2 мМ H2O2 не использовались, поскольку в ОТП наблюдалось образование пузырьков кислорода, препятствующих регистрации агрегации. После анализа дозозависимости для дальнейших экспериментов была выбрана концентрация 300 мкМ H2O2, вызывающая субмаксимальный эффект (рис. 1). В исследованиях других авторов по влиянию H2O2 на агрегацию тромбоцитов использовались схожие концентрации [Ikeda H. et al., 1994; Лойко Е.Н. и др., 2004].
Вызванная H2O2 агрегация характеризуется увеличением среднего размера агрегатов, достигающего пика к 1 минуте процесса с последующей частичной дезагрегацией, выражающейся в уменьшении среднего размера агрегатов. Методами СЭМ показано, что на максимуме агрегационного ответа, вызванного H2O2, центральная часть образующихся агрегатов состоит из плотно связанных тромбоцитов, а периферическая имеют рыхлую структуру (рис. 1-Б). К пятой минуте процесса размер агрегатов уменьшался, их структура становилась настолько плотной, что не удавалось различить отдельные клетки (рис. 1-В). Уменьшение размеров агрегатов происходило как за счет диссоциации слабо связанных с агрегационным центром периферических тромбоцитов, так и благодаря уплотнению центрального «ядра» агрегатов.
Добавленная за 2 минуты нативная КАТ в дозе 3000 Е практически полностью снимает агрегационный эффект H2O2 (табл. 1). Конъюгат СОД-ХС-КАТ вызывает схожий эффект уже в дозе 400 Е КАТ активности.
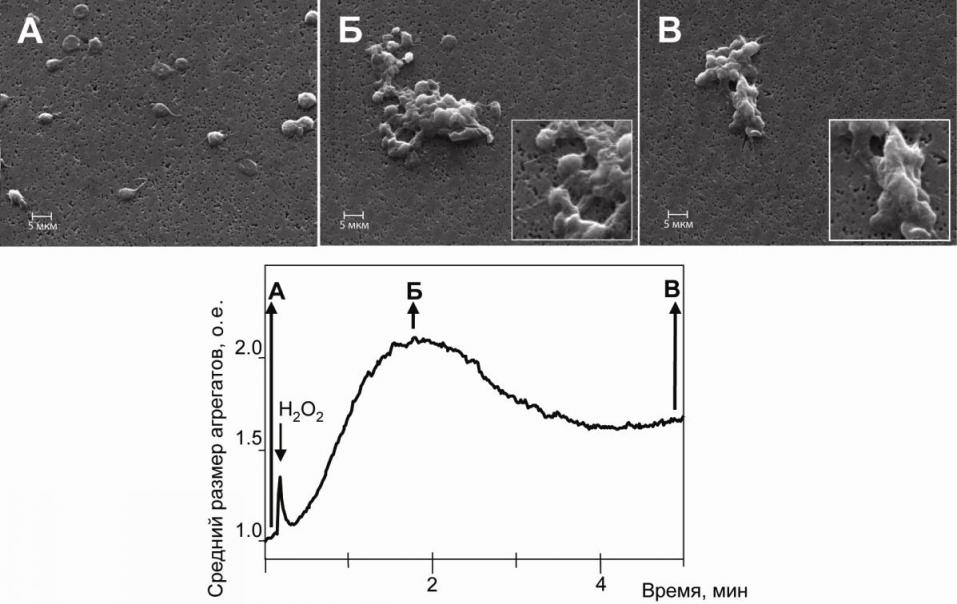
Рисунок 1. Типичная кривая агрегации тромбоцитов, индуцированная 300 мкМ H2O2, и структура тромбоцитарных агрегатов на разных стадиях их образования.
Таблица 1. Средние значения агрегации, вызванной разными индукторами без и в присутствии КАТ (3000 Е) или биферментного коньюгата СОД-ХС-КАТ (400 Е). Данные получены с помощью метода оценки среднего размера агрегатов в относительных единицах (о.е.) на первой минуте измерения, когда наблюдается пик агрегации и достигается ее максимальный уровень.
| Основной стимул | + 300 мкМ H2O2 | |||||
| контроль | КАТ | СОД-ХС-КАТ | контроль | КАТ | СОД-ХС-КАТ | |
| без СПА | 1,1±0,03 | - | - | 1,8±0,1 | 1,4±0,1 | 1,6±0,1 |
| СПА | 1,6±0,2 | 1,5±0,1 | 1,4±0,1 | 1,8±0,2 | 1,5±0,1 | 1,6±0,1 |
| 0,5 мкМ АДФ | 2,2±0,1 | 2,1±0,2 | 1,7±0,1 | 3,3±0,3 | 2,1±0,3 | 2,1±0,2 |
| 0,5 мкМ серотонин | 2,3±0,1 | 3,0±0,5 | 1,6±0,2 | 3,2±0,4 | 2,9±0,9 | 2,4±0,7 |
| 1 мкМ TRAP | 2,3±0,3 | 2,3±0,4 | 1,9±0,1 | 3,0±0,4 | 3,0±0,8 | 2,4±0,3 |
Среднее значение ± стандартная ошибка среднего.
Было показано, что H2O2 усиливает активацию тромбоцитов, вызванную разными по механизму действия индукторами агрегации – АДФ, серотонином и TRAP (рис. 2). СОД-ХС-КАТ и в этом случае был на порядок более эффективен, чем нативная КАТ (кривые 5 и 4 на рис. 2-А, Б, В, соответственно). Таким образом, СОД-ХС-КАТ значительно эффективнее, чем нативная КАТ снижал агрегацию, вызванную H2O2 или классическими индукторами совместно с H2O2.
Также было обнаружено, что СОД-ХС-КАТ имеет выраженный ингибирующий эффект на спонтанную и вызванную классическими индукторами агрегацию тромбоцитов (табл. 1, рис. 3), тогда как нативная КАТ в используемом нами концентрационном диапазоне не оказывала такого действия. Подобный эффект СОД-ХС-КАТ возможно обусловлен перехватом активных форм кислорода, которые генерируются активированными тромбоцитами и влияют на процесс агрегации [Krotz F. et al., 2004]. Можно также предположить, что влияние СОД-ХС-КАТ на агрегацию не сводится исключительно к его антиоксидантной активности. Для выяснения особенностей влияния надмолекулярной структуры СОД-ХС-КАТ на процесс агрегации были синтезированы ферментные производные разной формы инактивации (рис. 4). Инактивация одного из ферментов в составе СОД-ХС-КАТ полностью не устраняла ингибирующий эффект СОД-ХС-КАТ, а снижала его примерно на половину (кривые 4 и 5 в сравнении с кривыми 1 и 2 на рис. 4). Ингибирующий эффект СОД-ХС-КАТ полностью не снимался инактивацией обоих антиоксидантных ферментов. Таким образом, эффект СОД-ХС-КАТ не может быть объяснен только суммой его антиоксидантных активностей, а связан и с его приобретенной надмолекулярной структурой. Вклад структуры СОД-ХС-КАТ в этот эффект подчеркивался отсутствием влияния сходной с конъюгатом по молекулярной массе -галактозидазы, использованной в эквимолярных по белку концентрациях.

Рисунок 2. Влияние Н2О2, КАТ и СОД-ХС-КАТ на агрегацию тромбоцитов, вызванную индукторами 0,5 мкМ АДФ (А), 0,5 мкМ серотонина (Б) и 1 мкМ TRAP (В). 1 - агрегация тромбоцитов в присутствии индуктора, 2 – в присутствии 300 мкМ Н2О2, 3 – в присутствии индуктора и 300 мкМ Н2О2, 4 – в присутствии индуктора и 300 мкМ Н2О2 на фоне превентивно введенной 3000 Е КАТ, 5 - в присутствии индуктора и 300 мкМ Н2О2 на фоне превентивно введенных 400 Е КАТ активности СОД-ХС-КАТ. Представлены типичные кривые агрегатограмм. По оси абсцисс указано время (мин), по оси ординат средний размер агрегатов (в отн. ед.).

Рисунок 3. Влияние биферментного конъюгата СОД-ХС-КАТ (400 Е КАТ активности, кривая 2) на агрегацию тромбоцитов, индуцированную (кривая 1): 0,5 мкМ (А) и 5,0 мкМ (Г) АДФ; 0,5 мкМ (Б) и 5,0 мкМ (Д) серотонина; 1 мкМ (В) и 6 мкМ (Е) TRAP.
Представлены типичные кривые агрегатограмм, по оси абсцисс указано время (мин), по оси ординат средний размер агрегатов (в отн. ед., А-В, Д) или степень светопропускания (в %, Г и Е).
 | Рисунок 4. Влияние биферментных производных разной формы инактивации на агрегацию тромбоцитов, индуцированную 0,5 мкМ АДФ. Кривые агрегации в ответ на 0,5 мкМ АДФ (1), и превентивно введенных в эквимолярных концентрациях по белку, соответствующих 400 Е КАТ активности конъюгата СОД-ХС-КАТ: СОД-ХС-КАТ (2), СОДинакт-ХС-КАТинакт (3), СОД-ХС-КАТинакт (4), СОДинакт-ХС-КАТ (5). Представлены типичные кривые агрегации, по оси абсцисс указано время (мин), по оси ординат средний размер агрегатов (в отн. ед.). |
Распластывание тромбоцитов на адгезивной поверхности является одной из важных стадий гемостаза, индуцирующих каскад реакций, ведущих к формированию тромба. Адгезионные свойства тромбоцитов оценивали по способности к распластыванию на стекле (рис. 5). В присутствии H2O2 в ОТП количество распластанных тромбоцитов возрастало (фото 2 на рис. 5), но при предварительном добавлении конъюгата СОД-ХС-КАТ на стекло (фото 3 на рис. 5) или в ОТП (фото 4 на рис. 5) распластанные тромбоциты в образце полностью отсутствовали. Сходная картина наблюдалась при нанесении ОТП с СОД-ХС-КАТ на стекло, с предварительно нанесенным H2O2 (фото 5 на рис. 5). При добавлении ОТП с КАТ количество распластанных тромбоцитов значительно сокращалось, которые все же иногда встречались (фото 6 на рис. 5). Вероятно, такой эффект СОД-ХС-КАТ связан с его адгезивными и антиоксидантными свойствами, позволяющими ему, с одной стороны, снижать адгезионные свойства поверхностей, а с другой активно нейтрализовывать H2O2, который усиливает адгезию и распластывание тромбоцитов на стекле.
Полученные результаты указывают на выраженное антиоксидантное и антиагрегантное действие биферментного конъюгата СОД-ХС-КАТ по сравнению с КАТ. Антиагрегационная активность конъюгата СОД-ХС-КАТ достоверно выше таковой для составляющих его нативных ферментов. Также наши данные свидетельствуют, что совокупность свойств СОД-ХС-КАТ обусловлена не только антиоксидантными свойствами входящих в его состав ферментов, а связана с его надмолекулярной структурой.

Рисунок 5. Электрономикроскопическая картина адгезии тромбоцитов на стекле (СЭМ PHILLIPS PSEM 550х, увеличение х2500). Адгезия тромбоцитов на стекле с добавлением к ОТП: физиологического раствора (1), Н2О2 (2), СОД-ХС-КАТ (4). Адгезия тромбоцитов на стекле, предварительно обработанным: СОД-ХС-КАТ, а затем нанесение ОТП с Н2О2 (3); Н2О2, затем нанесение ОТП с СОД-ХС-КАТ (5) или ОТП с КАТ (6).
Исследования на изолированном кольцевом фрагменте брюшной аорты крысы. Пероксид водорода в диапазоне концентраций 10 мкМ – 1 мМ вызывал дозозависимое сокращение фрагмента сосуда (рис. 6). При концентрации 10 мкМ H2O2 наблюдалось небольшое (10-12%) и длительное увеличение тонуса, при 100 мкМ H2O2 оно возрастало (48-50%) с последующим возвращением к исходному уровню (расслабление 0-3%). При концентрации 1 мМ H2O2 отмечалось быстрое сокращение артериального фрагмента (88-90%), которое сменялось фазой расслабления (на 68-70%) (рис. 6-А).
После трехкратной отмывки и 15-минутного периода покоя фрагмент сосуда повторно сокращали добавлением NA, и снова добавляли H2O2 в тех же концентрациях, что и в первом случае. Апмлитуда повторного сокращения на NA зависела от добавленной ранее концентрации H2O2 (рис. 6-А). При высоких концентрациях (1 мМ) амплитуда повторного ответа уменьшалась до 24-26% от исходного значения (рис. 6-В). Повторное сокращение на H2O2 при всех используемых концентрациях было всегда меньше по сравнению с первым ответом (рис. 6-Б). Величина повторного ответа на NA и H2O2 использовалась для оценки сохранности функционального состояния сосуда.
Мы использовали 100 мкМ H2O2 для оценки сравнительной эффективности защитного действия КАТ и конъюгата СОД-ХС-КАТ (рис. 7). Производные КАТ использовались в одинаковых концентрациях по каталазной активности (Е/мл). Нативная КАТ и конъюгат СОД-ХС-КАТ в равной степени влияли на сохранность функционального состояния при повторном введении NA (рис. 7-В). В концентрационном интервале 25-100 Е/мл КАТ активности нативная КАТ и СОД-ХС-КАТ проявляли сходный по величине защитный эффект против действия 100 мкМ H2O2 (рис. 7-Б, Г). При концентрации 500 Е/мл конъюгат СОД-ХС-КАТ более эффективно, чем КАТ снижал амплитуду ответа на H2O2 (рис. 7-Б, Г). Более выраженное защитное действие СОД-ХС-КАТ, по сравнению с КАТ может быть связано с его сродством к сосудистой стенке (благодаря ХС в его составе [Maksimenko A.V., 2005]) или присутствием СОД в составе биферментного конъюгата.
Достаточно выраженным оказалось действие СОД-ХС-КАТ на тонус фрагмента сосуда на фоне NA преконстрикции (рис. 8). В концентрации 10 Е/мл СОД-ХС-КАТ вызывал заметное (20%) расслабление сосуда (рис. 8-Б), которое не наблюдалось при добавлении КАТ. Добавление СОД в эквимолярном количестве вызывало сходное с СОД-ХС-КАТ расслабление (рис. 8А). Очевидно, что вазодилатационный эффект СОД-ХС-КАТ связан с наличием в его составе СОД, которая увеличивает биодоступность эндогенного NO.
Экспериментальным подтверждением этому послужило введение на фоне NA преконстрикции ингибитора NO-синтазы – L-NNA, вызывающее увеличение тонуса сосуда (рис. 8-В), обусловленное снижением синтеза эндогенного NO. Отсутствие выраженного ответа на ацетилхолин (активатор эндотелиальной NO-синтазы) свидетельствует о блокировании NO-синтазы. СОД на фоне L-NNA не вызывала расслабления, подчеркивая роль эндогенного NO в наблюдаемом ранее расслаблении. Введение донора NO – SNP вызывало
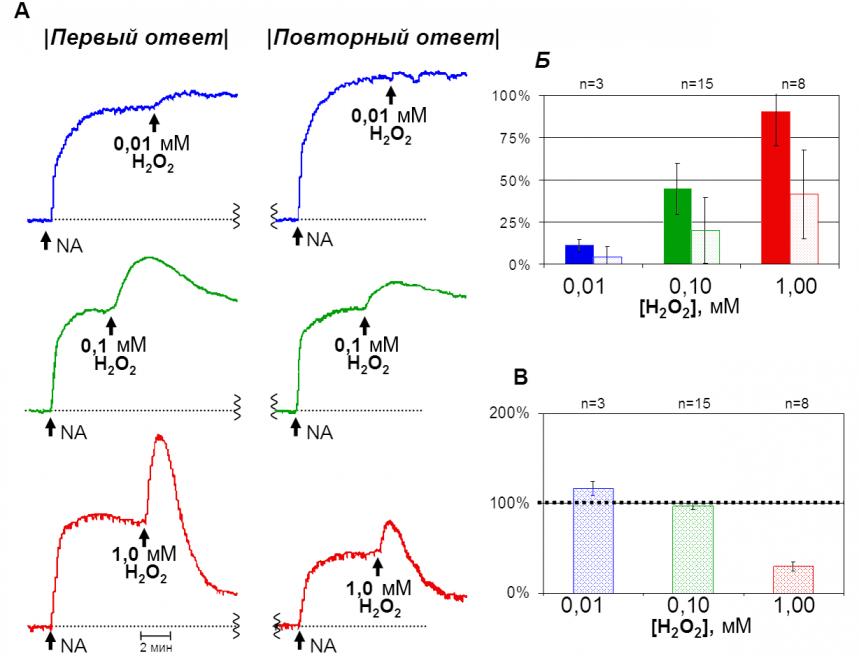
Рисунок 6. Первичный и повторный ответы на H2O2 и NA. А: оригинальные треки первого и повторного ответа. Б: величина первого (закрашенные столбцы) и повторного (незакрашенные столбцы) сокращения, вызванного разными концентрациями H2O2. В: величина повторного ответа на норадреналин (за 100% принята величина первого сокращения на NA).

Рисунок 7. Сравнительные эффекты защитного действия КАТ и СОД-ХС-КАТ против 100 мкM H2O2. А: оригинальные треки. Б: сокращения фрагмента аорты при первом ответе на 100 мкM H2O2 в присутствии указанных концентраций КАТ (оранжевые столбцы) и СОД-ХС-КАТ (синие столбцы) по КАТ активности (Е/мл) В: величина повторного ответа на NA после добавления разных концентраций КАТ (оранжевые столбцы) и СОД-ХС-КАТ (синие столбцы), одинаковых (в паре) по КАТ активности. Г: сокращения фрагмента аорты при повторном ответе на 100 мкM H2O2 в присутствии указанных концентраций КАТ (оранжевые столбцы) и СОД-ХС-КАТ (синие столбцы) по КАТ активности (Е/мл) при первом добавлении H2O2.
дилятацию артериального фрагмента, показывая, что сосуд не потерял способность расслабляться под действием NO. Наличие в биферментном конъюгате СОД способствует увеличению биодоступности NO, что может повышать эффективность вазопротекторного действия биферментного конъюгата.
Таким образом, биферментный конъюгат СОД-ХС-КАТ достоверно проявляет свои вазопротекторные свойства, благодаря активности его обоих ферментных компонентов и не уступает по эффективности действия использованию нативных форм СОД и КАТ, а в ряде случаев (при 500 Е/мл КАТ активности) более эффективно снимает действие H2O2, чем нативная КАТ.
Вазопротекторные свойства конъюгата СОД-ХС-КАТ in vivo. Введение H2O2 интактным кроликам (рис. 9-А, кривая 1) вызывало резкое снижение АД (до 60% от первоначального уровня), которое в течение десяти минут восстанавливалось в контрольной и опытной группе до 90% (рис. 9-А, кривая 2).
ЭКГ у кроликов после первого введения H2O2 существенно не изменялась, хотя в контрольной группе наблюдалось некоторое снижение ST сегмента. При повторном введении H2O2 отмечались наибольшие подъемы ST интервала, особенно при затрудненном дыхании. На 5-8 мин наблюдалась желудочковая экстрасистолия с одиночными или групповыми экстрасистолами. Если одышка отмечалась уже после первого введения H2O2, то при повторном введении наблюдалось затрудненное дыхание, бронхоспазмы, более выраженные в контрольной группе.
Болюсное введение СОД-ХС-КАТ не изменяло показатели центральной гемодинамики у кроликов. Повторное введение H2O2 на фоне СОД-ХС-КАТ приводило к гораздо меньшим нарушениям параметров гемодинамики (АД, ЧСС), по сравнению с контролем.
Профилактическое введение СОД-ХС-КАТ за трое суток до эксперимента с H2O2 достоверно предупреждало падение АД и ЧСС уже при первом

Рисунок 8. Влияние СОД активности на тонус артериального фрагмента. Оригинальные кривые введения 10 Е/мл нативной СОД (А) или СОД-ХС-КАТ (Б) на фоне NA преконстрикции. В: изменение сосудистого тонуса при введении NA, L-NNA, ацетилхолина, нативной СОД и SNP.
добавлении H2O2, и значительно снижало их при повторном введении H2O2 (рис. 9-А, Б кривая 3). В профилактической группе происходило полное восстановление параметров гемодинамики к 80 минуте эксперимента, чего не проиходило в двух других группах.
У крыс первое введение H2O2 вызывало первоначальное кратковременное (не более 1 минуты) повышение АД на 3-5% с его последующим снижением на 15% и полным восстановлением в течение 10 минут (рис. 10-А). В этих условиях ЧСС снижалась на 3-5% и в течение 10 минут восстанавливалась до уровня 96-98% (рис. 10-Б, кривые 1 и 2). ЭКГ у крыс в период эксперимента существенно не менялась, хотя количество отдельных желудочковых экстрасистол возрастало в обеих группах животных, особенно при повторном введении H2O2.
Введение СОД-ХС-КАТ не изменяло параметров гемодинамики и ЭКГ у крыс. После болюсного введения СОД-ХС-КАТ и его распределения в течение 10 минут в организме крыс им повторно вводили H2O2, что вызывало более значительные (по сравнению с первой инфузией) изменения АД и ЧСС. Снижение АД доходило до 52% уровня в контрольной группе и до 73% уровня в опытной группе (рис. 10-А, кривые 1 и 2, соответственно, p<0,05). В опытной группе восстановление АД к 50 минуте было практически полным, тогда как в контроле и к 80 минуте не наблюдалось полного восстановления. Статистически значимое различие в восстановлении АД в опытной и контрольной группах наблюдались уже с первых минут эксперимента.
 | Рисунок 9. Изменение АД (А) и ЧСС (Б, оба в % от исходного) у анестезированных кроликов при окислительном стрессе (инфузия 0,8% H2O2) в контрольной (n=12, болюсное введению физиологического раствора, кривая 1) и опытной (n=9, болюсное введение конъгата СОД-ХС-КАТ, кривая 2) группах. Кривая 3 относится к опытной профилактической группе (n=6) кроликов, получавших конъюгат СОД-ХС-КАТ за трое суток до проведения этого эксперимента и после первого введения H2O2. Стрелками показаны моменты начала и окончания инфузии H2O2 и болюсного введения физиологического раствора или конъюгата СОД-ХС-КАТ (1,5 мг/кг). |
Таким образом, биферментный конъюгат СОД-ХС-КАТ обладал достоверной способностью нормализовывать нарушения гемодинамики, вызываемые H2O2 на двух видах животных, использованных в исследовании. Конъюгат СОД-ХС-КАТ успешно противодействовал прямому влиянию H2O2 на гладкомышечные и сердечные клетки [Капелько В.И., 2004], вероятно, за счет нейтрализации как супероксид-радикала, так и H2O2. Действие СОД-ХС-КАТ достоверно проявлялось при повторном введении H2O2, когда антиоксидантная защита организма, вероятно, была уже ослаблена первым введением H2O2.
Профилактическое введение высоких доз конъюгата СОД-ХС-КАТ за 3 дня до острого опыта значительно эффективнее предотвращало вызванные H2O2 нарушения гемодинамики по сравнению с другими группами и способствовало полному восстановлению АД и ЧСС, не наблюдавшемуся в других группах.
Высокая эффективность СОД-ХС-КАТ может быть связана с несколькими причинами. Участки раннего атеросклеротического поражения сосудов накапливают на своей поверхности гликозамингликан эндотелиального гликокаликса – ХС [Wight T.N., Merriless M.J., 2004]. Он содержится в синтезированном нами конъюгате СОД-ХС-КАТ и может способствовать его накоплению на таких участках благодаря свойствам распределения гликозамингликанов по внутрисосудистой поверхности. Эндотелиальный гликокаликс, как известно, может адгезировать и удерживать на клеточной
 | Рисунок 10. Изменение АД (А) и ЧСС (Б, оба в % от исходного) у анестезированных крыс. Стрелками показаны моменты начала и окончания внутривенной инфузии 0,8% H2O2 (окислительный стресс) и болюсного введения физиологического раствора (n=6, контрольная группа, кривая 1) или конъюгата СОД-ХС-КАТ (n=7, опытная группа, кривая 2). |
поверхности гликопротеины [Bohm T. et al., 1996]. Структура СОД-ХС-КАТ оказывается по составу сходной с внеклеточной СОД, которая является гликопротеином. Наличие гепаринсвязывающего домена у внеклеточной СОД позволяет ей связываться с гликозаминогликаном гепарансульфатом на поверхности эндотелия и проникать в интиму, создавая антиоксидантную защиту внутри сосудистой стенки [Onry T. et al., 1996]. Возможно, что СОД-ХС-КАТ может схожим образом адгезировать к эндотелиальной поверхности и проникать внутрь сосудистой стенки. Реализация такого процесса, предположительно, развивается во времени и более эффективна при профилактическом введении, когда имеется достаточный интервал времени для распределения и проникновения СОД-ХС-КАТ в интиму сосуда. Все это способствует более длительному удержанию СОД-ХС-КАТ в организме и сохранению его антиоксидантной активности. Однако для проверки значимости этого процесса необходимо провести целый ряд дополнительных исследований, в частности оценить фармакокинетику СОД-ХС-КАТ.
Токсикологические исследования. Внутривенное болюсное введение кроликам разных доз (1,5-15 мг белка/кг) конъюгата СОД-ХС-КАТ не вызывало существенных изменений параметров гемодинамики (АД, ЧСС). Отклонения не превышали 4% от средних значений у интактных наркотизированных животных. На ЭКГ кроликов не обнаружено изменений ST-интервала, нарушений ритма, проводимости и других показателей даже при максимальной дозе. В дозе СОД-ХС-КАТ 1,3-1,6 мг белка/кг массы крыс линии Wistar не обнаружено изменений параметров гемодинамики и ЭКГ. Это свидетельствует о хорошей переносимости конъюгата СОД-ХС-КАТ организмом животных.
Определение острой токсичности при однократном внутрибрюшном введении СОД-ХС-КАТ мышам линии BALB/c и мышам-гибридам F1(CBAxC57B16) обнаружило низкую острую токсичность конъюгата (табл. 2). При исследовании мутагенности в тесте Эймса СОД-ХС-КАТ не проявил мутагенных свойств.
Отсутствие отрицательных эффектов СОД-ХС-КАТ в токсикологических исследования позволяет проводить дальнейшую биомедицинскую разработку данного препарата как потенциального фармакологического средства.
Таблица 2. - Показатели токсичности биферкона при внутрибрюшинном введении мышам линии BALB/c и мышам-гибридам F1(CBAxC57Bl6).
| Вид и пол мышей | Показатели токсичности, мг/кг | ||
| ЛД 16 | ЛД 50±m | ЛД 84 | |
| BALB/c самцы | 3395 | 4100±143 | 4840 |
| BALB/c самки | 3260 | 3965±176 | 4705 |
| F1(CBAxC57Bl6) самцы | 2680 | 3050±160* | 3640 |
| F1(CBAxC57Bl6) самки | 2560 | 2930±146* | 3520 |
Заключение
Действие биферментного конъюгата СОД-ХС-КАТ было исследовано в нескольких системах in vitro и in vivo. На всех уровнях СОД-ХС-КАТ оказывал положительный эффект при моделировании окислительного стресса.
СОД-ХС-КАТ на порядок более эффективно, чем нативная КАТ снижал агрегацию, вызванную H2O2 или классическими индукторами совместно с H2O2.
Кроме того СОД-ХС-КАТ имел выраженный ингибирующий эффект на спонтанную и вызванную классическими индукторами разного механизма действия агрегацию тромбоцитов, тогда как нативная КАТ в используемом нами концентрационном интервале не оказывала такого действия.
Полученные на тромбоцитах данные свидетельствуют, что эффект СОД-ХС-КАТ не связан только с антиоксидантной активностью, а обусловлен его сложной надмолекулярной структурой.
На фрагменте сосуда СОД-ХС-КАТ проявлял защитное антиоксидантное действие при моделировании окислительного стресса, не уступающее по эффективности нативным формам СОД и КАТ и при высоких концентрациях превосходил КАТ по эффективности.
СОД-ХС-КАТ предотвращал существенные нарушения параметров гемодинамики у крыс и кроликов in vivo, вызванные внутривенным введением H2O2, что было особенно выраженно при его предварительном введении.
Полученные положительные и выраженные на разных уровнях эффекты СОД-ХС-КАТ наряду с отсутствием отрицательных результатов при токсикологических исследованиях дают основания для дальнейшей биомедицинской разработки и продвижения СОД-ХС-КАТ как потенциального средства антиоксидантной терапии.
В литературе отмечены положительные эффекты перорального [Suzuki Y. et al., 2008] и ингаляционного [Tanaka K.I. et al., 2010] применения модифицированной формы СОД в снижении окислительного стресса при различных патологиях. Это позволяет считать целесообразным разработку пероральных форм СОД-ХС-КАТ конъюгата для нужд клинической антиоксидантной терапии.
Выводы
- Биферментный конъюгат СОД-ХС-КАТ снимает индуцирующее действие H2O2 на агрегацию тромбоцитов в концентрациях на порядок меньше, чем нативная КАТ.
Биферментный конъюгат СОД-ХС-КАТ также достоверно ингибирует агрегацию тромбоцитов, индуцированную совместным действием H2O2 и традиционных индукторов.
- Биферментный конъюгат СОД-ХС-КАТ ингибирует спонтанную и вызванную классическими индукторами агрегацию тромбоцитов. Этот антиагрегационный эффект не сводятся исключительно к антиоксидантной активности СОД-ХС-КАТ и обусловлен надмолекулярной структурой.
- Биферментный конъюгат СОД-ХС-КАТ не уступает по эффективности защитного действия СОД и КАТ и в дозе 500 ед. кат. акт. вызывает более выраженный эффект в условиях модельного окислительного стресса на кольцевых фрагментах брюшной аорты крысы.
- Биферментный конъюгат СОД-ХС-КАТ в дозах 1,5 - 2,0 мг/кг предупреждает и нормализует существенные нарушения гемодинамики (АД и ЧСС), вызванные H2O2 in vivo у крыс и кроликов.
- Биферментный конъюгат СОД-ХС-КАТ обладает низкой острой токсичностью и хорошей переносимостью, определенной в тестах на мышах, крысах и кроликах, и не проявляет мутагенных свойств в тесте Эймса.
РЕКОМЕНДАЦИИ
Полученные положительные и выраженные на разных уровнях эффекты СОД-ХС-КАТ наряду с отсутствием отрицательных результатов при токсикологических исследованиях дают основания рекомендовать СОД-ХС-КАТ для дальнейшей биомедицинской разработки и продвижения его как потенциального средства антиоксидантной терапии, а также указывают универсальный подход для разработки ферментных коньюгатов различного медицинского назначения.
Список работ, опубликованных по теме диссертации
- Vavaev A.V., Bouryachkovskaya L.I., Tischenko E.G., Uchitel I.A., Maksimenko A.V. The antioxidant and antiaggregant effects of the covalent bienzyme superoxide dismutase – chondroitin sulfate – catalase conjugate on platelets // Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry, 2011, vol.5, №2, pp.163-170.
- Maksimenko A.V., Vavaev A.V., Tischenko E.G. Enzymatic antioxidants: next phase of pharmacological effort to fight oxidative stress? // The Open Conference Proceedings Journal, 2010, vol.1, №1, pp.219-223.
- Максименко А.В., Ваваев А.В., Бурячковская Л.И., Мох В.П., Учитель И.А., Лакомкин В.Л., Капелько В.И., Тищенко Е.Г. Биофармакология ферментных конъюгатов: вазопротекторная активность супрамолекулярного производного супероксиддисмутаза-хондроитинсульфат-каталаза // Acta Naturae, 2010, том 2 № 4 (7), С.90-103.
- Ваваев А.В., Тищенко Е.Г., Бурячковская Л.И., Голубых В.Л., Максименко А.В. Сосудистая стенка: оксидативное поражение и внеклеточная защита антиоксидантными ферментами // Кардиологический Вестник, 2007, том II (XIV), №1, С.41-45.
- Ваваев А.В., Лакомкин В.Л., Тищенко Е.Г., Капелько В.И., Максименко А.В. Вазопротекторное действие конъюгата супероксиддисмутаза-хондроитинсульфат-каталаза при профилактическом и остром применении на вызванные пероксидом водорода изменения гемодинамики // Технологии живых систем, 2010, том 7, №7, С.15-21.
- Ваваев А.В., Максименко А. В. Ферментные антиоксиданты на пути к практической медицине // Кардиологический Вестник, 2009, том IV (XVI), №2, С.66-70.
- Ваваев А.В., Тищенко Е.Г., Мох В.П., Максименко А.В. Влияние перекиси водорода на тонус артериального фрагмента сосуда крысы и его антиоксидантная защита производными каталазы и супероксиддисмутазы // Технологии живых систем, 2009, том 6, №3, С.26-32.
- Ваваев А. В., Тищенко Е. Г., Бурячковская Л. И., Мох В. П., Учитель И. А., Лакомкин В. Л., Капелько В. И., Максименко А. В. Вазопротекторные эффекты биферментного конъюгата супероксиддисмутаза-хондроитинсульфат-каталаза // 7-я Национальная научно-практическая конференция с международным участием «Активные формы кислорода, оксид азота, антиоксиданты и здоровье человека»
14-18 сентября 2011 г., Смоленск, «Материалы конференции», С.41-42. - Vavaev A.V., Moch V.P., Tischenko E.G. and Maksimenko A.V. The research of oxidation reaction regulation on arterial fragment tonus with bienzyme conjugate // 6-th National Scientific practical conference with international participation «Reactive oxygen species, nitric oxide, antioxidants and human health». September 14-18, 2009, Smolensk, Conference book, pp. 77-78.
- Maksimenko A.V. Vavaev A.V., Tischenko E.G. Extracellular protection of vascular wall with the covalently connected antioxidant enzymes against oxidative damage // J. Biotechnol., 2008, 136S, p.87 [Abstract of the Thirteenth International Biotechnology Symposium and Exhibition, October 12-17, 2008, Dalian, China, I3-P-034].
- Максименко А.В., Тищенко Е.Г., Ваваев А.В., Лакомкин В.Л., Капелько В.И. Белковый конъюгат сопряженного ферментного действия для антитромботической защиты сосудистой стенки // IV съезд Российского общества биохимиков и молекулярных биологов. 11-15 мая 2008 года. Новосибирск, С. 308 (537).
- Максименко А.В., Ваваев А.В., Тищенко Е.Г., Турашев А.Д., Сергиенко В.Б. Фармакологическая регуляция состояния сосудистой стенки модифицированными ферментными производными // Первый Российский регулярный научно-практический семинар «Новые технологии – инновационному бизнесу», 1-16 февраля 2007 года, Москва, С. е-88.
- Ваваев А.В. Влияние перекиси водорода и производных каталазы на тонус фрагмента артерии крысы in vitro // Четвертый московский международный конгресс «Биотехнология: состояние и перспективы развития», 12-16 марта 2007г., Москва – Материалы конгресса, часть 1, С. 151-152.
- Maksimenko A.V. Tischenko E.G., Vavaev A.V. Biotechnology of supramolecular protein structure: bienzyme covalent superoxide dismutase-chondroitin sulfate-catalase conjugate for antithrombotic protection of vascular wall // Proceedings. International conference «Chemistry, chemical engineering and biotechnology», 11-16 september 2006, Tomsk, Russia, Vol.2, P. 397-399.
- Vavaev A.V., Tischenko E.G., Maksimenko A.V. Supramolecular protein structure for extracellular antithrombotic protection of vascular wall // Abstracts. 3-rd annual symposium of the American heart association council on basic cardiovasculas sciences – Translation of basic insights into clinical practice. July 31 – August 3, 2006, Keystone, Colorado, USA, P. 59.
Сокращения
АД артериальное давление
АДФ аденозиндифосфат
КАТ каталаза
ОТП обогащенная тромбоцитами плазма
СОД супероксиддисмутаза
СОД-ХС-КАТ биферментный конъюгат супероксиддисмутаза-хондроитинсульфат-каталаза
СПА спонтанная агрегация тромбоцитов
СЭМ сканирующая электронная микроскопия
ХС хондроитинсульфат
ЧСС частота сердечных сокращений
L-NNA N-нитро-L-аргинин (ингибитор NO-синтазы)
NA норадреналин
SNP нитропруссид натрия (донор NO)
TRAP пептидный агонист тромбинового рецептора

