Новые технологии иммунодиагностики и механизмы иммунных нарушений при урогенитальных инфекциях у женщин репродуктивного возраста
На правах рукописи
Афанасьев Максим Станиславович
НОВЫЕ ТЕХНОЛОГИИ ИММУНОДИАГНОСТИКИ И МЕХАНИЗМЫ ИММУННЫХ НАРУШЕНИЙ ПРИ УРОГЕНИТАЛЬНЫХ ИНФЕКЦИЯХ У ЖЕНЩИН РЕПРОДУКТИВНОГО ВОЗРАСТА
14.03.09 – клиническая иммунология, аллергология,
03.02.03 – микробиология
Автореферат
диссертации на соискание учёной степени
доктора медицинских наук
Москва – 2011
Работа выполнена в ГОУ ВПО Первый Московский государственный медицинский университет имени И.М. Сеченова Минздравсоцразвития России
Научный консультант:
| Доктор медицинских наук, член-корреспондент РАМН, профессор | Караулов Александр Викторович |
Официальные оппоненты:
| Доктор медицинских наук, профессор, заслуженный деятель науки РФ | Винницкий Леонид Ильич |
| Доктор медицинских наук, профессор | Дидковский Николай Антонович |
| Доктор медицинских наук, профессор | Михайлова Наталья Александровна |
Ведущая организация: ГОУ ВПО Российский государственный медицинский
университет Росздрава
Защита состоится « » ___________2011 года. в ______часов на заседании диссертационного совета Д 208.040.08 при ГОУ ВПО Первый МГМУ имени И.М. Сеченова Минздравсоцразвития России по адресу: 119991, Москва, ул. Трубецкая, д. 8, стр. 2.
С диссертацией можно ознакомиться в ГЦНМБ ГОУ ВПО Первый МГМУ
имени И.М. Сеченова Минздравсоцразвития России по адресу: 117998, Москва,
Нахимовский проспект, д. 49.
Автореферат разослан « » _____________ 2011 г.
| Ученый секретарь Диссертационного Совета Д 208.040.08 доктор медицинских наук, профессор | Миронов Андрей Юрьевич |
Акутальность проблемы
Масштабность распространения сексуально-трансмиссивных инфекций продолжает оставаться актуальной во всем мире (Фидров А.А. и др., 2006; Donatella et al., 2008). Инфекционно-воспалительные заболевания репродуктивной сферы, несмотря на достижения современной медицины, лидируют в структуре гинекологической заболеваемости и остаются традиционно значимыми на протяжении последних лет. По данным ВОЗ в мире ежегодно регистрируется более 330 млн. урогенитальных инфекций, среди которых число заражений хламидиозом достигает 100 млн. человек. Ежегодно в мире регистрируется около 90 млн. новых случаев хламидийной инфекции. Ureaplasma urealyticum является одним из ведущих этиологических агентов воспалительных заболеваний женской половой сферы (цервицитов, эндометритов, сальпингоофоритов, хореоамнео-нитов) и неонатальных инфекций. Частота выявления U. urealiticum у женщин репродуктивного возраста достигает 46%, а при наличии хронического воспалительного процесса в различных отделах половой системы достигает 70%. Наблюдается широкое распространение уреаплазм среди клинически здоровых женщин. Патогенный потенциал хламидий и уреаплазм определяется их концентрацией в организме, наличием других, в том числе патогенных бактерий и вирусов (гонококки, трихомонады, хламидии, микоплазмы, вирус простого герпеса I и II типа, ЦМВ др.), изменением физиологического и иммунного статуса, соматическими заболеваниями и другими факторами.
Клинические варианты течения хламидийной и уреаплазменной инфекций в наибольшей степени определяются выраженностью изменений, вызываемых возбудителем в месте своей локализации. Слизистые содержат элементы биотопа (эпителиальные клетки, лейкоциты), являющиеся элементами конституцио-нальной рецепторной системы организма, и в комплексе с другими гуморальными и клеточными факторами мукозального иммунитета определяют эффективность колонизационной резистентности слизистых макроорганизма (один из важных интегральных компонентов местного иммунитета). Способность микрофлоры данного биотопа и макроорганизма, кооперативно взаимодействуя, защищать экосистему от патогенной микрофлоры, в литературе обозначают как «колонизационную резистентность».
При инфекциях, недостаточно или чрезмерно агрессивный, воспалительный ответ хозяина обусловливает тяжесть патологического процесса, степень выраженности клинических проявлений и осложнений инфекционного заболевания. Выраженное воспаление при инфицирование урогенитального тракта Ch. trachomatis приводит к воспалению фаллопиевых труб, рубцеванию и бесплодию. Сниженный или недостаточный иммунный ответ способствует развитию инфекционного процесса путем распространения и сохранения возбудителя в различных тканях и органах. Пути распространения хламидийной инфекции могут реализоваться только при условии несостоятельности защитно-биологических барьеров организма, регулируемых врожденной иммунной системой. Рецепторы врождённого иммунитета рассматриваются как потенции-альные регуляторы ответа организма на возбудителей инфекционных заболеваний и на хламидии, в частности, TLR-4 и TLR-2- одни из наиболее важных рецепторов, не только весьма интенсивно вовлеченные в антимикробную защиту хозяина, но и гены которых способны активироваться при инфицировании Ch. trachomatis (Darville T. et al., 2003; Pioli P.A. et al., 2004).
Детальное изучение жизненного цикла хламидий и уреаплазм, фенотипических признаков, особенностей структуры генома возбудителей, влияния последних как монопатогенов, так и в ассоциации с условно-патогенными микроорганизмами, на формирование вторичного иммунодефицита на организменном и мукозальном уровнях необходимо для установления новых патофизиологических и иммунологических патогенетических механизмов развития этих инфекций. Тем самым, сократится колоссальный разрыв между фундаментальными исследованиями биологии и морфологии хламидий и уреаплазм и клиническими исследованиями заболеваний, которые они вызывают, в ряде случаев позволит объяснить отсутствие симптоматики, возможность атипичных проявлений, бессимптомного течения инфекции. Кроме того, это открывает новые возможности совершенствования и повышения информативности методов диагностики, лечения и профилактики, а также создания фармпрепаратов, воздействующих губительно на все формы цикла развития хламидий и уреаплазм, и новых иммуномодулирующих препаратов, вакцин с целью наиболее эффективного лечения и профилактики этих заболеваний.
Цель исследования
Целью исследования явилось установление роли организменного и местного иммунитета в патогенетических механизмах и клинических проявлениях при урогенитальных хламидийной и уреаплазменной инфекциях у женщин репродуктивного возраста.
Задачи исследования
1.Провести сравнительную оценку вторичного иммунодефицита, осложняющего хламидийную и уреаплазменную инфекции.
2.Выявить патогенетический, диагностический и прогностический потенциал микробиоценозов урогенитального тракта женщин при хламидийной и уреаплазменной инфекциях.
3.Оценить роль рецепторов врождённого иммунитета в патогенезе, а также диагностическое и прогностическое значение регистрации показателей их уровней при урогенитальной хламидийной инфекции женщин.
4.Изучить колонизационную резистентность слизистой цервикального канала при урогенитальной хламидийной инфекции.
5.Установить клинико-диагностические и прогностические возможности выявления фенотипических и генотипических (серологических) особенностей возбудителя при урогенитальной хламидийной инфекции.
Научная новизна работы
Впервые показано, что выраженный длительный вторичный иммунодефицит является неотъемлемой частью патологических проявлений при урогенитальных хламидийной и уреаплазменной инфекциях, на организменном уровне проявляющийся повышенной восприимчивостью к бактериальным и вирусным агентам, высокой частотой выявления воспалительных процессов гениталий; на местном уровне (слизистые) – относительно слабо выраженной воспалительной реакцией, дисбаллансом в цитокиновом и иммуноглобулиновом звеньях, угнетением нормофлоры (лактобациллы и бифидобактерии), сниженной реакцией на условно-патогенную микрофлору, что в сочетании способствует нарушению колонизационной резистентности слизистых как основного компонента мукозального иммунитета.
Впервые комплексно оценена просветная и пристеночная микрофлора влагалища и показатели иммуноглобулинов секрета влагалища клинически здоровых женщин и пациенток с уреаплазменной микст-инфекцией. Выявлено резкое снижение колонизационной резистентности, характеризующееся появлением и/или значительным увеличением в просветной и пристеночной областях ассоциаций условно-патогенных факультативно (стрептококки, стафилококки, энтерококки, энтеробактерии, кандида)- и облигатно-анаэробных микрооганизмов (пептострептококки, пептококки, гарднереллы, бактероиды, фузобактерии) и изменением показателей иммуноглобулинов секрета влагалища у пациенток с уреаплазменной микст-инфекцией, по сравнению с клинически здоровыми.
При хламидийной инфекции микроорганизмы, попадая на слизистые УГТ, взаимодействуют с рецепторами врождённого иммунитета и запускают воспалительную реакцию. Различные уровни активации рецепторов TLR-2 и TLR-4 зависят от качественного состава микробных сообществ, присутствующих на слизистой оболочке УГТ. Показатели уровней обсеменённости УПМ Цк, Ур и Вл прямо коррелировали с показателями уровней экспрессии генов TLR-2 и TLR-4. Низкие уровни экспрессии генов TLR-4 при осложненном инфекционном процессе свидетельствуют о переключении TLR-4 типа иммунного ответа на TLR-2. Повышение экспрессии генов TLR-2 и TLR-4, как в Цк, так и в Ур, коррелирует с тяжестью клинических проявлений, зависящей как от хламидий, так и от ассоциатов (возбудителей ИППП и УПМ). Во Вл имеет место экспрессия генов TLR-2 и TLR-4 в ответ на УПМ, а в Цк и Ур – на УПМ и ИППП. Активация экспрессии генов TLR-2 и TLR-4 происходит более выраженно в ответ на УПМ и менее выражено при контакте с нормофлорой.
Впервые установлена определяющая роль TLR-2 и TLR-4 слизистых нижних отделов урогенитального тракта в ответе макроорганизма на инфицирование хламидиями при урогенитальном хламидиозе. Естественная или приобретённая супрессия генов TLR-2 и TLR-4 обусловливает хроническое течение УГХ. При воспалении шейки матки/уретры более чем у половины женщин с хроническим рецедивирующим течением УГХ наблюдается снижение экспрессии генов TLR-2 и TLR-4 (в полтора-два раза ниже значений у клинически здоровых пациентов), сопровождаемое уменьшением лейкоцитарной реакции. Как про-, так и антиапоптозная активности хламидий определяют характер развития инфекции: продуктивная инфекция либо персистенция.
Выявленные однотипные изменения показателей уровня экспрессии TLR-2 и TLR-4 в Цк и Ур пациенток с хронической формой хламидийной инфекции указывают на развитие "феномена рецепторной депрессии", сопровождающегося дисбалансом между развитием инфекционного процесса и воспалительной реакции. Уровни экспрессии генов TLR-2 и TLR-4 служат критериями оценки выраженности хламидийной инфекции и наличия воспалительного процесса у больных, а при выздоровлении их снижение может свидетельствовать об эрадикации возбудителя. При острой хламидийной инфекции выявление низких уровней TLR-2 и TLR-4 указывает на возможность начала хронизации инфекционного процесса.
Впервые выявлена при УГХ в УГТ взаимосвязь рецепторов врождённого иммунитета TLR-2 и TLR-4 (контролируют запуск цитокинового каскада местной антиинфекционной резистентности, через который запускаются иммуноглобулиновое звено и воспалительная реакция) с микрофлорой биотопа (в том числе, с нормофлорой) определяет колонизационную резистентность слизистых и характеризует течение инфекционного процесса, выраженность клинических и лабораторных проявлений и исход заболевания (излечение, хронизация), а оценка их уровней носит диагностический и прогностический характер.
При хламидийной инфекции впервые выявлена зависимость выраженности патологического процесса и клинических проявлений от наличия и сочетания отдельных патогенетических факторов (плазмиды, функциональное состояние гена IncA, принадлежность штамма хламидий к конкретному генотипу, одновременное инфицирование штаммами хламидий с разными генотипами и возможность обменивания между ними генетической информацией с появлением другой разновидности хламидийного штамма).
Теоретическая значимость работы
Впервые показано, что взаимодействие микробиоценозов слизистых урогенитального тракта и макроорганизма носит динамический характер, обеспечивает жизненно необходимый оптимальный уровень реактивности макроорганизма. Тем самым, достоверно подтверждена роль микроорганизмов в обучении защитных систем макроорганизма в динамике онтогенеза. Формирование вторичного иммунодефицита является неотъемлемым патогенетическим фактором инфекционного процесса, обусловливающего, в конечном счёте, прогноз и исход заболевания.
Впервые выявлено, что взаимодействие микроорганизмов биотопов слизистых, а также возбудителей инфекционных заболеваний с рецепторами врождённого иммунитета является необходимым фактором запуска инфекционного процесса.
Впервые представлена колонизационная резистентность как неотъемлемая часть мукозального иммунитета.
Впервые показано влияние фенотипических и генотипических свойств возбудителя на выраженность патогенетического процесса, клинических проявлений при хламидийной урогенитальной инфекции.
Практическая значимость работы
Получен патент РФ «Способ оценки микробиоценоза влагалища» № 2249821. Зарегистрирован 10.04.2005. Предложена новая медицинская технология «Оценка микробиоценоза влагалища при инфекционных и других заболеваниях женской половой сферы», утверждена Минздравсоцразвитием: Разрешение на применение новой медицинской технологии. Серия АА. № 0001997. ФС № 2009/187 от 17.07.2009. Разработаны и предложены лабораторные критерии диагностики урогенитального хламидиоза с установлением острой и хронической рецидивирующей формы заболевания, защищённые Патентом РФ «Способ диагностики хронического урогенитального хламидиоза» №2327995. Зарегистрирован 27.06.2008 г. На разработаный способ мультиплексной ПЦР диагностики хламидийной инфекции обезьян, вызванной видом Chlamydophila pneumoniae и Chlamydia trachomatis, и способ мультиплексной ПЦР диагностики плазмидных и бесплазмидных штаммов вида Chlamydia trachomatis, получен Патент РФ «Способ диагностики хламидийной инфекции человека или обезьян и набор для его осуществления» № 2385946, зарегистрирован 10.04.2010, (награждён Федеральной службой по интеллектуальной собственности, патентам и товарным знакам Дипломом в номинации «100 лучших изобретений России») и Патент РФ «Способ прогнозирования манифестной или стертой формы хламидийной инфекции человека или обезьян и набор для его осуществления» № 2385945, зарегистрирован 10.04.2010 (награждён Федеральной службой по интеллектуальной собственности, патентам и товарным знакам Дипломом в номинации «100 лучших изобретений Росси»).
Положения, выносимые на защиту
Хламидийная и уреаплазменная инфекции сопровождаются развитием длительного вторичного иммунодефицита. Последний наиболее выражен при урогенитальном хламидиозе и проявляется на местном уровне относительно слабо выраженной воспалительной реакцией при остром и обострении хронического хламидиоза, угнетением нормофлоры (лактобацилл и бифидобактерий), сниженной реакцией на условно-патогенную микрофлору, а в дальнейшем развитием у переболевших кольпита, эрозии шейки матки, сальпингоофорита.
Изменения уровней микробиологических и иммунологических показателей биотопа влагалища отражают патогенетические механизмы при хламидийной и уреаплазменной микст-инфекциях и могут быть диагностическими и прогностическими показателями течения инфекционного процесса.
Впервые установлена диагностическая и прогностическая значимость оценки уровней экспрессии генов TLR-2 и TLR-4 при урогенитальном хламидиозе у женщин. Воспалительная реакция и реакция слизистых урогенитального тракта на условно-патогенную микрофлору и нормофлору, колонизационная резистентность координируются TLR-2 и TLR-4.
Впервые описан алгоритм запуска колонизационной резистетности слизистой цервикального канала: TLR слизистых реагируют на условно-патогенную микрофлору и нормофлору, через цитокиновую систему запускают местную воспалительную реакцию, определяют уровни IgG, sIgA и секреторного компонента (sc), что в комплексе и определяет колонизационную резистентность.
Впервые доказана связь генотипических и фенотипических свойств возбудителей с патогенетическими механизмами и особенностями клинического течения урогенитальной хламидийной инфекции.
Внедрение результатов работы в практику
Результаты исследований и разработок используются в научных исследованиях кафедры клинической аллергологии и иммунологии Первого Московского государственного медицинского университета имени И.М. Сеченова.
Апробация работы
Материалы исследования и основные положения работы доложены на заседании совместной научной конференции кафедры клинической иммунологии и аллергологии факультета последипломного профессионального образования врачей и кафедры микробиологии, вирусологии и иммунологии медико-профилактического факультета Первого Московского государственного медицинской университета им. И.М. Сеченова 25 февраля 2011 года, на XIII Российском Национальном Конгрессе «Человек и лекарство» (Москва, 3-7 апреля 2006 г.), на XIV Российском Национальном Конгрессе «Человек и лекарство» (Москва, 16-20 апреля 2007 г.), на XV Российском национальном конгрессе «Человек и лекарство» (Москва, 14-18 апреля 2008г.), IV международной конференции, посвященной 85-летию Санкт-Петербурского НИИЭМ имени Пастера и 120-летию Парижского института Пастера "Идеи Пастера в борьбе с инфекциями" (Санкт-Петербург, 2-4 июня 2008г.), Всероссийской научно-практической конференции «Современные представления об иммунокоррекции» (Пенза, 2-3 октября 2008г.), XVI Российском национальном конгрессе «Человек и лекарство» (Москва, 6-10 апреля 2009г.), Научно-практической конференции молодых ученых и специалистов «Биологическая безопасность в современном мире» (Оболенск, 21-22 апреля 2009г.), The 3rd Congress of European Microbiologists «Microbes and Man – interdependence and future challenges» (Gothenburg, Sweden, June 28-July 2, 2009), XVIII Российском национальном конгрессе «Человек и лекарство» (Москва, 11-15 апреля 2011г.).
Личный вклад автора
Автору принадлежит ведущая роль в выборе направления исследования, анализе и обобщении полученных результатов. В работах, выполненных в соавторстве, автором лично проведено моделирование процессов, мониторинг основных параметров, аналитическая и статистическая обработка, научное обоснование и обобщение полученных результатов. Вклад автора является определяющим и заключается в непосредственном участии на всех этапах исследования: от постановки задач, их экспериментально-теоретической клинико-иммунологической и клинико-бактериологической реализации до обсуждения результатов в научных публикациях и докладах и их внедрения в практику.
Публикации
По теме диссертации опубликовано 48 научных работ, из них 24 публикации в ведущих рецензируемых научных журналах и изданиях, определённых ВАК, 4 патента РФ на изобретения.
Структура и объём диссертации
Работа изложена на 230 страницах текста, иллюстрирована 23 таблицами, 16 рисунками, состоит из введения, обзора литературы, главы с описанием материалов и методов исследования, четырёх глав собственных исследований, заключения, выводов, практических рекомендаций, списка литературы, содержащего 355 источников, в том числе 131 отечественных и 224 зарубежных.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Проведено комплексное клинико-лабораторное обследование 50 женщин в возрасте 18-36 лет, с установленной уреаплазменной моно- и микст-инфекцией. U. urealiticum выявлялась у всех больных в диагностическом титре более чем 104 КОЕ/мл. Контрольная группа (группа сравнения) включала 40 клинически здоровых женщин.
Клинико-анамнестические и лабораторные данные 228 больных с УГХ позволили отобрать 100 пациенток и 32 клинически здоровых женщин, которые были разбиты на 4 группы. Группу I составила 41 пациентка. Положительные результаты ПИФ, ПЦР и культурального посева подтверждали наличие Ch. trachomatis в УГТ. В сыворотке крови данных больных в ИФА определялись IgG-Ат в титре 1:50-100. Повторный лабораторный анализ на наличие антител (через 2-3 недели) показал появление IgМ-Ат (в титре 1:50 и выше), что свидетельствовало о первичном инфицировании больных и острой стадии инфекционного заболевания. Пациентки отрицали наличие ранее перенесенного хламидиоза. Группу II составляли 29 пациенток. В сыворотке крови определялись стойкие титры IgА-Ат (1:100-1:200) и IgG-Ат (1:100-1:200), концентрация которых не изменялась на протяжении длительного периода. Длительность заболевания составляла от 3 до 5 лет. Положительные результаты ПИФ, культурального посева и ПЦР свидетельствовали о лабораторно подтверждённом рецидиве УГХ. Схожесть клинических проявлений и наличие двух эпизодов обострения заболевания в течение предшествующих 12 месяцев свидетельствовали о хроническом течении хламидийной инфекции. Рецидивы отмечались с частотой 1 раз в полгода. Все больные неоднократно получали антибактериальную терапию, однако не наблюдалось стойкого клинического и бактериологического положительного эффекта. В группу III (группа сравнения) вошли 30 пациенток, в анамнезе которых ранее диагностировался УГХ. Отсутствие IgА-Ат и низкие, не меняющиеся во времени титры IgG-Ат (1:50) свидетельствовали о давно перенесённой хламидийной инфекции. Об этом свидетельствовали и IgG-Ат в титрах 1:100-200, уровни которых снижались в течение 12 месяцев. Маркёры хламидий в УГТ не выявлялись ни одним из использованных методов диагностики в течение одного года. В группу IV (контрольная, группа сравнения) включили 32 клинически здоровые женщины. Клинико-лабораторное обследование подтвердило отсутствие признаков хламидийной инфекций и ИППП, а также наличия гинекологической патологии. Возраст обследованных пациенток варьировал от 20 до 39 лет.
Дополнительно проведено клинико-лабораторное обследование 99 пациентов с подозрением на хламидиоз и 39 клинически здоровых пациентов.
По возрасту, общему соматическому статусу, репродуктивному состоянию, выраженности клинических проявлений, социальному положению и уровню образования пациентки всех групп были сопоставимы.
Диагноз УГХ устанавливался на основании результатов стандартных клинико-инструментальных методов обследования (Воробьев А.А., 2004; Савичева А.М. и др., 2004): исследования клинического мазка из Цк, соскобного материала световой микроскопией проб с последующей обработкой флуоресцентными моноклональными Ат к Ch. trachomatis и методом ПЦР, выделения хламидий на культуре клеток McCoy. Дополнительным критерием служил анализ уровней титров IgG-Ат, IgA-Ат в сыворотке крови методом ИФА (medac Diagnostika Gmbh, Германия). Обследование проводили на первой и третьей неделе после первичного обращения; повторные исследования проводились спустя один-два месяца после антибактериальной терапии. Критерием излеченности считали отсутствие маркеров Ch. trachomatis в УГТ.
Проведено комплексное клинико-лабораторное обследование 50 женщин в возрасте 18-36 лет, с установленной уреаплазменной моно- и микст-инфекцией. Выявление, определение титра и антибиотикочувствительности уреаплазм проводили с использованием тест-систем «MYCOPLASMA DUO» (BIO-RAD, Франция), позволяющих получить пороговые концентрации возбудителя в клинической пробе. Диагноз подтверждён обнаружением у всех больных возбудителя в исследуемом материале в титре более чем в 104 КОЕ/мл, что свидетельствало о наличии выраженного инфекционного процесса.
Инфицированность возбудителями ИППП: ВПЧ, ВПГ, ЦМВ, микоплазмами, уреаплазмами, токсоплазмами, кандидами – устанавливалась общепринятыми методами ПЦР, а микоплазмами, уреаплазмами – дополнительно ИФА методом. Инфицирование ВПГ, ВПЧ и ЦМВ подтверждали дважды.
Микроскопическое исследование мазков со слизистых УГТ
Материалам для микроскопического исследования служили уретральные, вагинальные и цервикальные мазки (Савичева А.М. и др., 2004) с последующей окраской по Романовскому-Гимзе для характеристики лейкоцитарной реакции и клеточного состава, а другой- по Граму- для характеристики микрофлоры. Материал забирали стерильными ватными тампонами из Цк, Вл и Ур и наносили на обезжиренные предметные стекла.
Микробиологические исследования
Материал с поверхности заднего свода влагалища собирали до мануального исследования после введения зеркал. Для оценки состояния просветной флоры забор материала производился стерильным ватным тампоном, а для оценки состояния пристеночной флоры- с помощью урогенитальных зондов, позволя-ющих получить при соскобе со слизистой слой поверхностных эпителиальных клеток. Полученный материал помещали в коллекторы с транспортной средой «Amies», содержащей фармакологический активированный уголь, для доставки в лабораторию. С Цк и Ур забирали мазки-соскобы с помощью урогенитальных зондов. Согласно экспериментальным данным количество исследуемого матери-ала при заборе тампоном составляло 0,5 г, урогенитальным зондом- 0,2 г. Бактериологическое исследование отделяемого цервикального канала, уретры и влагалища проводили общепринятым методами в соответствии с Приказом МЗ СССР № 535.
Оценка выраженности нарушений микробиоценоза влагалища.
Проводилась в соответствии с предложенной нами и утверждённой Минздравсоцразвитием новой медицинской технологией:
нормоценоз влагалища определяется при наличии на поверхности эпителиоцитов менее 25 бактериальных клеток, представленных грамположи-тельными палочками, при количестве лейкоцитов менее 10 в поле зрения, при отсутствии ключевых клеток (I степень чистоты мазка), при содержании в отделяемом 6-8 lg КОЕ/г лактобацилл, при содержании в соскобном материале 7-10 lg КОЕ/г лактобацилл, при отсутствии в отделяемом и в соскобном материале условно-патогенной факультативно-анаэробной и облигатно-анаэробной микрофлоры и при концентрации в смыве IgA 0 мкг/мл, sIgA 10 мкг/мл, IgM 0 мкг/мл, свободного секреторного компонента 10 мкг/мл;
промежуточный тип микробиоценоза влагалища при наличии на поверхности эпителиоцитов 25-50 бактериальных клеток, представленных грамположительными палочками, единичными грамположительными кокками и грамотрицательными палочками, при количестве лейкоцитов 10-20 в поле зрения, при отсутствии ключевых клеток (II степень чистоты мазка), при содержании в отделяемом 4-5 lg КОЕ/г лактобацилл, 3-4 lg КОЕ/г условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры и/или при содержании в соскобном материале 5-6 lg КОЕ/г лактобацилл, 1-2 lg КОЕ/г условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры и при концентрации в смыве IgA 10 мкг/мл, sIgA 11-15 мкг/мл, IgM 10 мкг/мл, свободного секреторного компонента 10-25 мкг/мл;
дисбиоз влагалища при наличии на поверхности эпителиоцитов 50-100 бактериальных клеток, представленных грамположительными палочками, грамположительными кокками и грамотрицательными палочками, при количестве лейкоцитов 20-40 в поле зрения, при наличии ключевых клеток менее 5 в поле зрения (III степень чистоты мазка), при содержании в отделяемом 1-3 lg КОЕ/г лактобацилл, 5-7 lg КОЕ/г условно-патогенной факультативно-анаэробной микрофлоры и 3-4 lg КОЕ/г условно-патогенной облигатно-анаэробной микрофлоры и/или при содержании в соскобном материале 3-4 lg КОЕ/г лактобацилл, 3-4 lg КОЕ/г условно-патогенной факультативно-анаэробной микрофлоры и 5-7 lg КОЕ/г условно-патогенной облигатно-анаэробной микрофлоры и при концентрации в смыве IgA 11-15 мкг/мл, sIgA 16-30 мкг/мл, IgM 11-20 мкг/мл, свободного секреторного компонента 26-50 мкг/мл;
бактериальный вагинит при наличии на поверхности эпителиоцитов не менее 100 бактериальных клеток, представленных единичными грамположительными палочками и обильной грамотрицательной и грамположительной палочковой и кокковой флорой, при количестве лейкоцитов не менее 40 в поле зрения, при количестве ключевых клеток не менее 5 в поле зрения (IV степень чистоты мазка), при отсутствии в отделяемом лактобацилл, при содержании в отделяемом 5-6 lg КОЕ/г монокультуры условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры и/или при содержании в соскобном материале 1-3 lg КОЕ/г лактобацилл, 6-8 lg КОЕ/г монокультуры условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры и при концентрации в смыве IgA > 15 мкг/мл, sIgA > 30 мкг/мл, IgM > 20 мкг/мл, свободного секреторного компонента > 50 мкг/мл.
Штаммы микроорганизмов
В качестве положительных контрольных образцов возбудителей хламидиоза выступали референс штаммы Chlamydophila pneumoniae – «B» и Chlamydia trachomatis – «Бурхан», полученные из Государственной Коллекции Вирусов (ГКВ) ГУ НИИ Вирусологии им. Д.И. Ивановского РАМН. Штаммы Ch. trachomatis и Chl. pneumoniae, полученные от пациентов сохранялись в жидком азоте для дальнейшего изучения свойств.
Молекулярно-генетические методы исследования
Определения экспрессии генов TLR-2 и TLR-4. Исследования проводили по предложенной оригинальной методике. Материалом для исследования служили мазки-соскобы со слизистой соответствующих участков УГТ, содержащие элементы биотопа (эпителиальные клетки, лейкоциты), являющиеся элементами конституциональной рецепторной системы организма (Sandor F., Buc M., 2005). В день обследования у женщины забирали мазки-соскобы со слизистых Вл, Цк и Ур с помощью стерильного урогенитального зонда, позволяющие получить со слизистой слой поверхностных эпителиальных клеток. Согласно экспериментальным данным количество исследуемого материала при заборе урогенитальным зондом составляло – 0,2 г. Содержимое зондов тщательно суспендировали в забуференном физиологическом растворе в пробирках типа "Эппендорф" с последующим определением количества всех клеточных элементов с помощью слайд-планшета (Плива-Лахема, Чехия). Конечная концентрация клеток в образце составляла не более 1105 клеток в мл. Полученный материал суспендировали в растворе EverFresh RNA (ЗАО "Силекс", г. Санкт-Петербург) в соотношении объемов суспензии клеток к раствору, равному 1:5. Уровень экспрессии генов TLR определялся методом ПЦР в режиме реального времени (РВ), совмещенной с обратной транскрипцией с использованием специфических праймеров к TLR-2 (TLR2-F1 – CCTTCACTCAGGAGCAGCAAGC; TLR2 – R1-TGGAAACGGTGGCACAGGAC) и TLR-4 (TLR4-F6 – GAAGGGGTGCCTCCATTTCAGC; TLR4-R6 – TGCCTGAGCAGGGTCTTCTCCA). Уровни экспрессии mRNA TLR контролировали (стандартизировали) по гену GAPTAH (GAPDH-F1 – TGCMTCCTGCACCACCAACT; GAPDH-F2 – YGCCTGCTTCACCACCTTC) за счет сходной экспрессии этого гена среди тканей человеческого репродуктивного тракта. Из исследуемого материала выделяли тотальную RNA согласно протоколу к наборам для выделения тотальной RNA на магнитных частицах SiO2 – бесфенольное выделение для микроанализа (ЗАО "Силекс", г. Санкт-Петербург). Синтез первой цепи кDNA проводили согласно указаниям инструкции «Набора для синтеза первой цепи кDNA (базовый)» (ЗАО "Силекс", г. Санкт-Петербург). Амплификацию с последующим определением уровня экспрессии TLR проводили методом ПЦР с детекцией накопления продуктов реакции в режиме реального времени (Real-Time PCR, USA) с помощью детектирующего амплификатора АМК-32 ("Синтол", Россия) и специфических праймеров к TLR-2 и TLR-4 ("Синтол", Россия). Праймеры для последовательностей к TLR-2, TLR-4 и были подобраны с помощью программы Vector NTI. Последовательности mRNA TLR-2, TLR-4 и GAPDH взяты в GenBank и синтезированы фирмой Синтол (Москва). Количество исследуемых кDNA в образцах рассчитывали путем определения пороговых циклов ПЦР в РВ на образцах серийных разведений очищенного ПЦР-продукта в качестве матрицы. Нормализация количества изучаемых транскриптов к общему количеству кDNA в пробе проводилась с помощью отношений TLR2/GAPDH и TLR4/GAPDH. Экспрессию генов TLR оценивали в относительных единицах (ОЕ).
ПЦР диагностика хламидийной инфекции
В работе использовали основной молекулярно-генетический метод – ПЦР. Экстракцию DNA проводили с помощью набора для выделения DNA из мазков-соскобов «DNA-сорб-АМ» (НИИ Эпидемиологии Роспотребнадзора, г. Москва, регистрационное удостоверение №ФСР 2007/00183). Для ПЦР амплификации DNA Ch. trachomatis использовали набор реагентов «АмплиСенс Chlamydia trachomatis-EPh» (НИИ Эпидемиологии Роспотребнадзора, г. Москва, регистраци-онное удостоверение № ФСР 2007/00683). Анализ продуктов амплификации проводили разделением фрагментов DNA в 2% агарозном геле. Все этапы выполнялись согласно инструкции производителя.
Для видовой мультиплексной детекции и идентификации Ch. trachomatis и Chl. pneumoniae впервые применены подобранные оригинальные универсальные праймеры на фрагмент гена 16S rRNA: для Chlamydia trachomatis – Ctr: 5'-TGCCGGTATGTGGGCAACC-3', для Chlamydophila pneumoniae Cpn: 5'-CGGAATAACGACTTGAGTTG-3', общий реверс праймер для обоих видов R: 5'-CTCGTTTACCTGGGACGCAC-3'. Размер продукта амплифицируемого фрагмента гена 16S рРНК для Chl. pneumoniae – 440 пар нуклеотидов, для Ch. trachomatis – 334 пары нуклеотидов. Для детекции штаммов Ch. trachomatis, несущих плазмиду и свободных от нее, была впервые предложена следующая оригинальная комбинация праймеров: Ctr: 5'-TGCCGGTATGTGGGCAACC-3' и R: 5'-CTCGTTTACCTGGGACGCAC-3' для амплификации фрагмента16S rRNA гена (334 пары нуклеотидов); PLf: 5'-TTCGAGGCGAGTAACGAAGA-3' и PLr: 5'-AAGCAACGCGCGCGATAGGT-3' для амплификации участка криптической плазмиды Ch. trachomatis (241 пара нуклеотидов). Молекулярно-генетическое типирование штаммов
Таблица 1. Предлагаемые оригинальные праймеры для генотипирования штаммов Ch. trachomatis
| Генотипы | Олигонуклеотидные праймеры | Размер продукта |
| Группа генотипов B (генотипы: B, Ba, D, Da, E, L1, L2, L2a) | BGr1 f 5'-GCTTAATCAATCTGGCTGTTGA-3' BGr1 r 5'-TCCAGACTTGTGGATAGTAAAC-3' | 191 п.н. |
| Группа генотипов С (генотипы: A, C, H, I, Ja, J, K и L3) | CGr f 5'-AACTAAGTGGGCTTATTAGGAA-3' CGr r 5'-TCAAGTAGAGAGCTAGACCA-3' | 107 п.н. |
| промежуточная группа (генотипы: F, G, Ga) | FI 5'-CTGGGATGGAACTGTATACA-3' RI 5'-TACAACTCAGGGTAGGTCAA-3' | 274 п.н. |
| Генотип C | Comp f 5'-AAGGAAGTGTGGGATCTGACG-3' Comp r 5'-AAATATACAATGATTAGCACC-3' | 221 п.н. |
| Генотип Е | Eomp f 5'-AGACGGATACCGCCTTATCTTG-3' Eomp r 5'-CTGGCTTGCCACTCAGGCTAAT-3' | 265 п.н. |
| Генотип J | Jomp f 5'-ATATTTTGCCTAAGACTGCT-3' Jomp r 5'-TTTAGGGTTAGATAGAGAAT-3' | 152 п.н. |
| Генотип Ja | Jaomp f 5'-TAGTGTCGGCGACGTAGCAG-3' Jaomp r 5'-TCCTAGATATTTAATGCCAT-3' | 135 п.н. |
| Генотип H | Fh 5'-ATCTTCTGAGTATAATACAGC-3' Rh 5'-ACGTTACGTTTAAATTGAGCA-3' | 177 п.н. |
| Генотип F | Ff 5'-ACGAAACGTGCTGCAAATA-3' Rf 5'- TAGCCAATCATTGTAAACA-3' | 321 п.н. |
| Генотип D | Domp f 5'-ATAATGAGAATCTAAAGACG-3' Domp r 5'-TAGAATGAGCATATTGGCAA-3' | 174 п.н. |
| Генотип K | Komp f 5'-TGTTCTTAACACAGCTTTGGA-3' Komp r 5'-AGGTATAGATTGAGCGTATTGG-3' | 150 п.н. |
| Генотип G | Gomp f 5'-AGAGTAGTCGCAGCGAAC-3' Gomp r 5'-ACTGTAACGGCGTATGTG-3' | 146 п.н. |
| Генотип A | Aomp f 5'-AATACAGTATTCTGGCTTAGAT-3' Aomp r 5'-TGACTGAATGCAGGGTTGGGA-3' | 57 п.н. |
| Генотип B | Bomp f 5'-AGTTCGAGAGTATCTTTGATGTT-3' Bomp r 5'-TCTGCGCTAGTTATCATTATCG-3' | 75 п.н. |
Ch. trachomatis осуществляли с помощью ПЦР, применяя специфические сконструированные оригинальные олигонуклеотидные праймеры, ориентированные к вариабельным участкам VS1–VS4 гена ompA Ch. trachomatis (табл. 1). Первоначально проводили амплификацию с использованием специфических праймеров к группам генотипов, далее с использованием специфических праймеров к определенному генотипу группы.
Анализ антибиотикорезистентности штаммов Ch. trachomatis и Chl. pneumoniae проводили с помощью ПЦР с использованием подобранных оригинальных праймеров с целью выявления генов устойчивости к тетрациклинам (tet-M и tet-O) и макролидам (erm): Tet-f: 5'-AGYTTCCACCGAAYTCCTTTC-3' и Tet-r: 5'-ATACACCGAGCAGGGATTTC-3' (размер продукта амплификации 470 пар нуклеотидов); Erm-f: 5'-AAGCCAYTGCGTCTGACATC-3' и Erm-r: 5'-TGGCGTGTTTCATTGCTTGA-3' (размер продукта амплификации 300 пар нуклеотидов).
Программное обеспечение в молекулярно-генетическом исследовании. Конструирование олигонуклеотидных праймеров проводили с применением биоинформационного анализа комплексом компьютерных программ: Vector NTI Advance 9.0 (PC) (http://www.invitrogen.com/site/us/en/home.html), DNASTAR, BLAST (http:// blast.ncbi.nlm.nih.gov/Blast.cgi/), и данные электронной базы NCBI Gen Bank (http://www.ncbi.nlm.nih.gov/Genbank/).
Цитологический метод (диагностика хламидиоза)
Забранный материал из Цк, Вл, Ур, задней стенки глотки в виде мазков-соскобов наносили на обезжиренные предметные стекла, высушивали на воздухе и фиксировали не менее 15-ти минут в 96 этиловом спирте для последующей окраски и микроскопии. Окраску мазков проводили по Романовскому-Гимзе и раствором Люголя, согласно общепринятой методике (Савичева А.М., 2004). Учет результатов осуществляли на световом микроскопе «Микмед 5» при увеличениях 100, 400, 1000. Проводили также окрашивание меченными моноклональными антителами (тест-система CeLLabs, Австралия) для выявления антигенов Ch. trachomatis и Chl. pneumoniae в реакции ПИФ (для Ch. trachomatis) и НИФ (для Chl. pneumoniae). Учет результатов осуществляли на люминесцентном микроскопе «Micros» (Австрия) при увеличении 600. Хламидии в препаратах выявлялись в виде характерных цитоплазматических включений, окрашенных в соответствующий методу цвет. Мазки-соскобы также исследовали ПЦР-методом.
Серологический метод (диагностика хламидийной инфекции)
Выявление Ат к Ch. trachomatis осуществляли в сыворотке крови человека и обезьян с помощью ИФА (Бакулев А.Л. и др., 2008; Савичева А.М., 2002). Выявление Ат иммуноглобулинов (Ig) классов IgA и IgG к Ch. trachomatis проводилось на тест-системах Ch. trachomatis-IgA-pELISA medac и Ch. trachomatis-IgG-pELISA medac (Германия). Положительным результатом считали содержание IgA-Ат 1:50, IgG-Ат 1:50. Выявление Ат к белку теплового шока (БТШ) проводилось с использованием иммуноферментного тест-набора для определения IgG-Ат к хламидийным белкам теплового шока 60 cHSP60-IgG-ELISA medac (Германия). Положительный результат оценивался при содержании IgG-Ат 1:50. Постановку реакций проводили в соответствии с инструкциями по применению, прилагаемых производителем.
Культуральный метод (диагностика хламидиоза)
Соскобным материалом, полученным из УГТ, инокулировали суточную культуру клеток McCoy, выращенную на покровных стеклах, помещенных в лунки 24-луночных планшет (Савичева А.М., 2002; Савичева А.М., 2004). Центрифугирование после инокуляции проводили при 1000 об/мин в течение 1 часа. Контроль развития хламидийной инфекции осуществляли путем микроскопирования клеток в инвертированном микроскопе «ЛОМО» (Россия). Покровные стекла окрашивали по Романовскому-Гимзе, раствором Люголя или меченными моноклональными антителами для выявления антигенов хламидий в реакции ПИФ и непрямой иммунофлуресценции НИФ (тест-система CeLLabs, Австралия). Титрование хламидий осуществляли стандартным методом по цитопатическому действию (Павлович С.А., 2008). Детекцию возбудителя в инфицированных клетках культуры проводили также с помощью ПЦР.
Иммунологические методы исследования
Забор ЦС проводили с помощью стерильного урологического зонда. Зонд немедленно погружали в пробирку типа «Эппендорф», содержащую 0,5 мл физиологического раствора. К каждому образцу после взвешивания добавляли равное весовое количество физиологического раствора, после чего смесь тщательно перемешивали в течение 10 минут на шейкере. Образцы хранили при температуре минус 50°С не более трёх месяцев. Определение общего белка проводили согласно инструкции к «Набору по определению общего белка в моче ФС» ("Диакон Диагностика", г. Москва).
Смыв со стенок влагалища проводили следующим образом: 5,0 мл 6,0% раствора полиглюкина вливали во влагалище, оставляли на 10 минут, затем проводили аспирацию всей жидкости из влагалища. Полученный секрет тщательно перемешивали и затем помещали в пробирки типа «Эппендорф». Образцы хранили при температуре минус 50 °С.
Определение иммуноглобулинов в ЦС и смыве из Вл женщин
Иммунологическое исследование включало определение концентрации в ЦС IgG, IgМ, IgА, sIgА и свободного sc методом радиальной иммунодиффузии РИД (Чернохвостова Е. В. И др., 1987).
Определение цитокинов в ЦС женщин
Содержание в слизи Цк IL-1, IL-4, IL-6, IL-8, IL-9, IL-10, IL-12, IFN-, TNF-, ГМ-КСФ цитокинов оценивали методом проточной флюориметрии на двух лучевом лазерном автоматизированном анализаторе ("Bio-plex Protein Assay System", Bio-Rad, USA) с использованием коммерческих тест-систем 10-Plex (определяемый динамический диапазон 2-32000 пкг/мл) в соответствии с инструкцией фирмы-производителя.
Статистическая обработка полученных данных
Математическую обработку полученных данных проводили в рамках параметрической и непараметрической базовой статистики с использованием критерия Стьюдента, метода 2, коэффициента ранговой корреляции Спирмена (при rs 0,7 связь считали сильной; при 0,5rs<0,7 связь являлась средней; при rs <0,5 связь считали слабой; при rs=0 – линейная связь отсутствует), применяя стандартный пакет статистических программ Microsoft Excel 2007.
Морфологический, культуральный, серологический, микробиологический, иммуноцитологический, молекулярно-генетические методы исследования проводились на лабораторной базе ФГУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора. Молекулярно-генетическое типирование штаммов хламидий проводилось на базе Государственного научного центра прикладной микробиологии и биотехнологии (г. Оболенск, Московской области).
РЕЗУЛЬТАТЫ РАБОТЫ И ИХ ОБСУЖДЕНИЕ
Исследованием на наличие уреаплазм выявлен высокий титр возбудителя – > 104 КОЕ/мл – у 100% больных. Установлены у 6 больных уреаплазменная моноинфекция и у 44 больных – сочетанный характер инфицирования. При микст-инфекциях наблюдалось образование 2-7-компонентных ассоциаций патогенных агентов.
Таблица 2. Нарушение микробиоценоза влагалища в группе больных уреаплазмозом до лечения (50 пациенток)
| Показатели | Степень нарушения микробиотопа влагалища | |||
| Промежуточный тип, n=5* | Дисбиоз, n=22** | Бактериальный вагинит, n=64*** | ||
| Номера столбцов | 1 | 2 | 3 | 4 |
| Степень чистоты мазка: | II, n=5 | III, n=22 | III, n=5 | IV, n=18 |
| Морфология мазка: | ||||
| обсеменённость эпителиоцитов | 38,2+8,2 | 78,2+14,3 | 90,4+20,3 | 154,7+27,2 |
| лейкоциты | 16,2+2,4 | 34,6+4,2 | 39,8+7,2 | 52,6+7,4 |
| ключевые клетки | 0 | 3,2+0,3 | 5,2+1,3 | 5,8+0,6 |
| Микрофлора, lgКОЕ/г: | ||||
| лактобациллы | 4,3+0,2/5,8+0,4 | 3,45+0,65/4,95+0,3 | 1,7+0,8 / 3,5+0,7 | |
| бифидобактерии | 3,2+1,2/4,2+0,8 | 0/0 | 0/0 | |
| условно-патогенная: | ||||
| факультативные анаэробы: | 3,8+0,2/2,3+0,4 | 5,2+1,2/3,8+0,2 | 7,8+2,4 / 6,4+1,8 | |
| облигатные анаэробы: | 3,2+0,6/4,5+0,4 | 4,2+0,6/5,8+1,6 | 6,2+1,4 / 8,2+1,2 | |
| Иммуноглобулины, мкг/мл: | ||||
| IgM | 6,8±0,5 | 19,6+1,4 | 32,3+9,6 | |
| IgG | 38,1+2,7 | 65,5+12,3 | 234,38+32,7 | |
| IgА | 6,7+0,3 | 12,3+2,7 | 24,6+4,2 | |
| sIgА | 12,6+0,8 | 26,8+2,7 | 38,4+6,8 | |
| Sc | 16,2+1,4 | 36,3+4,2 | 76,3+12,7 | |
Примечания: в числителе показатели просветной микрофлоры, а в знаменателе – пристеночной; n – количество пациенток в группе, достоверность различий показателей в столбцах 1 и 2, 2 и 3 p<0,05, 1 и 3 - p<0,01.
Наиболее часто при уреаплазменной микст-инфекции выявлялись пептострептококки, стрептококки, энтерококки, стафилококки и грибы рода Candida – от 42% до 56% (табл. 2). Частота выявления -гемолитических стрептококков составляла 4%, пептококков, пропионибактерий, коринебакте-рий, кишечной палочки, бактериодов и фузобактерий находилась в пределах 8-20%, гарднереллы выявлялись у 22% обследованных. Содержание лактобацилл у больных достоверно ниже по сравнению с промежуточным типом (II тип микробиоценоза) при дисбиозе (III тип) при р<0,05, вагините (IV тип) при р<0,01, а по сравнению с типом III при вагините при р<0,05. Содержание условно-патогенной флоры достоверно выше по сравнению с типом II при типе III (р<0,05) и типе IV (р<0,01), а по сравнению с типом III при типе IV (р<0,05). Содержание факультативных анаэробов достоверно выше в просветной области (p<0,05), а облигатных анаэробов достоверно выше в пристеночной области (p<0,05).
Таким образом, при дисбиотических нарушениях биотопа влагалища у больных с уреаплазмозом наблюдалось доминирование факультативно-анаэробной флоры в просветной области или облигатно-анаэробной флоры в пристеночной области влагалища при общем снижении уровня протективной флоры – лактобацилл по сравнению с нормоценозом.
При одинаковой степени воспалительного процесса, у больных выявлялись более выраженные изменения микроэкологии влагалищного биотопа по сравнению с контрольной группой. При бактериальном вагините у больных выявлялись 3-х и более компонентные ассоциации УПМ. Ассоциации, вызывающие выраженные дисбиотические нарущения влагалищного биотопа, были представлены энтеробактериями и энтерококками, стрептококками, стафилококками и грибами рода Candida, облигатно-анаэробными бактериями. Наблюдалось преобладание факультативных анаэробов в просветной области и облиганых анаэробов в пристеночной области влагалища.
Корреляционный анализ микробиологических и иммунологических показателей с учетом типа влагалищного микробиоценоза (табл. 3) у здоровых
Таблица 3. Корреляция микробиологических и иммунологических характеристик биотопа влагалища здоровых женщин и больных с уреаплазменной инфекцией при различных типах микробиоценоза
| Показатели | Нормоценоз | Промежуточный тип | Дисбиоз | Вагинит |
| Содержание УПМ, lg КОЕ/г: | ||||
| 2,15±0,25/2,35±0,3 | 3,5±0,3/3,25±0,4 | 4,7±0,9/5,1±0,4 | 6,4±1,8/8,2±1,4 | |
| Содержание иммуноглобулинов, мкг/мл: | ||||
| IgA | 0 | 6,7±0,3 | 12,3±2,7 | 24,6±4,2 |
| sIgA | 6,3±0,4 | 12,6±0,8 | 26,8±2,7 | 38,4±6,8 |
| IgM | 0 | 6,8±0,5 | 19,6±1,4 | 32,3±9,6 |
| IgG | 7,6±0,8 | 38,1±2,7 | 65,5±12,3 | 234,38±32,7 |
| Sc | 8,2±0,6 | 16,2±1,4 | 36,3±4,2 | 76,3±12,7 |
| Корреляция (r) содержания УПМ и изотипа иммуноглобулина: | ||||
| r IgA | - | 0,17/0,14 | 0,58/0,62 | 0,72/0,74 |
| r sIgA | 0,14/0,12 | 0,24/0,22 | 0,69/0,63 | 0,86/0,92 |
| r IgM | - | 0,23/0,21 | 0,74/0,76 | 0,78/0,82 |
| r IgG | 0,17/0,19 | 0,19/0,20 | 0,63/0,64 | 0,86/0,94 |
| r sc | 0,23/0,21 | 0,21/0,23 | 0,65/0,67 | 0,75/0,76 |
Примечания: – в числителе показатели просветной микрофлоры, а в знаменателе – пристеночной; -r- при p<0,05; УПМ – условно-патогенные микроорганизмы
женщин и больных уреаплазмозом показал, что при нормоценозе и промежуточном типе микробиоценоза влагалища не наблюдалось достоверной корреляционной зависимости между количеством УПМ просветной и пристеночной и показателями гуморального иммунитета (r < 0,3). Вместе с тем, у больных с дисбиозом и бактериальным вагинитом наблюдалась выраженная корреляция содержания условно-патогенных микроорганизмов просветной и пристеночной локализации и уровней иммуноглобулинов классов М, А и G, а также sIgА и sc в секрете влагалища (r > 0,5). У больных с сочетанной уреаплазменной инфекцией значительно возрастало содержание в вагинальном отделяемом IgG, уровень которого при бактериальных вагинитах уреаплазменной этиологии достоверно превышал контрольные значения нормоценоза более чем в 30 раз.
Таким образом, разработанная новая технология оценки микробиоценоза влагалища позволяет судить о выраженности инфекционного процесса и прогнозировать его течение, а также оценивать колонизационную резистетность слизистых как неотъемлемой части мукозального иммунитета.
Нами изучена связь уровней экспрессии генов TLR-2 и TLR-4 с изменениями микробиоценоза УГТ при УГХ у женщин.
У 17,1% (7 пациенток) больных I группы выявлена хламидийная моноинфекция, а у 82,9% (34 пациенток)- в сочетании с другими возбудителями ИППП: уреаплазмами, микоплазмами, ВПЧ, ВПГ, ЦМВ, трихомонадами и токсоплазмами. Выявлено одновремённое доминирование двух биоваров U. urealyticum Parvo и Т-960, что значительно усугубляло течение УГХ. У 31,7% установлено наличие ВПЧ низкой онкогенности (типы 6 и 11), и у 9,8% человек ВПЧ с ЦМВ или сразу несколько типов ВПЧ (16, 18 и 35) с высокой онкогенной способностью. Наличие УПМ установлено в I группе в Цк у 61,0% пациенток (12 родов микроорганизмов), Ур- у 48,8% (7 родов микроорганизмов), во Вл- у 51,2% пациенток (11 родов микроорганизмов). Причем у большинства больных наблюдался сочетанный характер инфицирования возбудителями ИППП и УПМ (2-7-компонентные ассоциации патогенов). Исследования во II группе на наличие возбудителей ИППП и УПМ в Цк выявили у 37,9% больных хламидийную моноинфекцию, у остальных – сочетанный характер инфицирования различными бактериальными агентами. УПМ в Цк выявлялись у 37,9% больных (6 родов микроорганизмов), в Ур- у 62,1% больных (5 родов микроорганизмов) и во Вл – у 48,3% (5 родов микроорганизмов). При микстинфекциях регистрировались 2-5-компонентные ассоциации инфекционных агентов. В III группе у 30,0% женщин из УГТ выделялись УПМ в Цк (5 родов микроорганизмов), из Ур- у 23,3% обследованных (4 рода микроорганизмов), из Вл – у 36,6% женщин (4 рода микроорганизмов). Регистрировалось формирование 2-3 компонентных ассоциаций патогенов. В IV группе ни одним из использованных способов (ПЦР, ИФА) не были выявлены ИППП. УПМ выявлялись у двух пациенток в Цк (3 рода микроорганизмов), у трех пациенток- в Ур (3 рода микроорганизмов) и Вл (4 рода микроорганизмов), соответственно.
По частоте выявляемости УПМ в Цк достоверные различия выявлены (табл. 4, рис. 1) между I и III группами (2=5,470, р<0,01), I и IV группами (2=20,800, р<0,001), II и IV группами (2=7,310, р<0,001), III и IV (2=4,460, р<0,01), а между I и II, II и III группами различия не достоверны. При этом имела место в I группе средняя корреляционная связь между УПМ и TLR-2 и приближалась к средней между УПМ и TLR-4 и между TLR-2 и TLR-4; во II группе между УПМ и TLR-2, УПМ и TLR-4, TLR-2 и TLR-4- слабая корреляционная связь; в III группе сильная корреляционная связь между УПМ и TLR-2 и приближалась к средней между УПМ и TLR-4, между TLR-2 и TLR-4- слабая корреляционная связь; в IV группе между УПМ и TLR-2, УПМ и TLR-4, TLR-2 и TLR-4- слабая корреляционная связь. По частоте выявляемости УПМ в Ур достоверные различия выявлены между I и IV группами (2=13,480, р<0,001), II и III группами (2=6,670, р<0,01), II и IV группами (2=19,050, р<0,001), а между группами I и II, I и III, III и IV различия не достоверны. При этом имела место в I группе средняя обратная корреляционная связь между УПМ и TLR-2, между УПМ и TLR-4 и слабая пряма корреляционная связь между TLR-2 и TLR-4; во II группе между УПМ и TLR-2, УПМ и TLR-4, TLR-2 и TLR-4 корреляционной связи не выявлено; в III группе между УПМ и TLR-2, УПМ и TLR-4, TLR-2 и TLR-4 корреляционной связи не выявлено; в IV группе между УПМ и TLR-2- средняя корреляционная связь, а между УПМ и TLR-4, TLR-2 и TLR-4 корреляционной связи не выявлено. По частоте выявляемости УПМ во Вл достоверные различия выявлены между I и II группами (2=7,540, р<0,01), I и III группами (2=13,240, р<0,001), I и IV группами (2=27,010, р<0,001), II и III группами (2=4,940, р<0,01), II и IV группами (2=20,530, р<0,001), III и IV группами (2=5,120, р<0,01), а между группами I и II различия не достоверны. В I группе
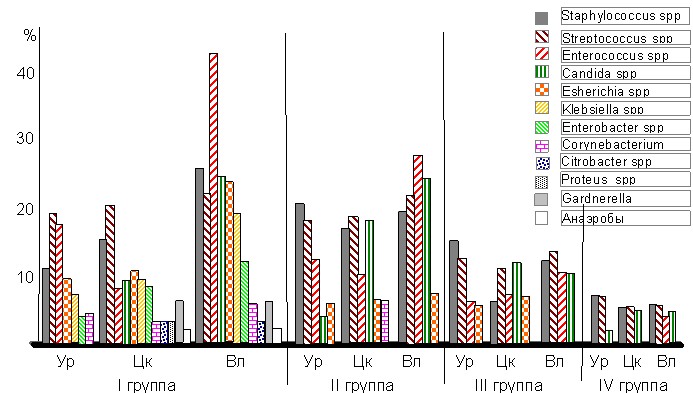
Рисунок 1. Процент встречаемости микрофлоры в уретре (Ур), цервикальном канале (Цк) и влагалище у пациенток с хламидийной инфекцией и женщин групп сравнения
по сравнению с IV группой дополнительно выявлена достоверно высокая инфицированность Candida spp (2=3,889, р<0,05), Streptococcus spp (-гемолитический)- I и IV группами 2=3,913, р<0,05, Enterococcus spp. (2=20,557, р<0,001), Esherichia coli (2=13,550, р<0,001), Klebsiella spp (2=8,460, р<0,001), Enterobacter spp (2=5,132, р<0,01). При этом имела место в I группе слабая корреляционная связь между УПМ и TLR-2 и средняя между УПМ и TLR-4, между TLR-2 и TLR-4; во II группе между УПМ и TLR-2 слабая, между УПМ и TLR-4, TLR-2 и TLR-4 приближалась к средней корреляционной связи; в III группе средняя корреляционная связь между УПМ иTLR-2 и между УПМ и TLR-4, между TLR-2 и TLR-4- слабая корреляционная связь; в IV группе между УПМ и TLR-2, между УПМ и TLR-4- сильная, между TLR-2 и TLR-4- средняя корреляционная связь.
По частоте выявляемости УПМ во II группе установлены различия показателей инфицированности между Вл и Ур (2=4,150 при р<0,01 и 2=4,340 при р<0,01); в остальных случаях (I и II группа) наблюдалась корреляционная зависимость выявления УПМ между Вл и Цк, Цк и Ур (rs0,5).
Таким образом, показатели уровней обсеменённости УПМ Цк, Ур и Вл коррелировали с оказателями уровней экспрессии генов TLR-2 и TLR-4: наиболее высокие уровни экспрессии генов Toll-like рецепторов соответствовали более высокой степени обсеменённости. Во Вл имела место экспрессия генов TLR-2 и TLR-4 в ответ на УПМ, а в Цк и Ур – на УПМ и ИППП.
Во Вл корреляционной связи между УПМ и нормофлорой в группах не выявлено. Обратная корреляционная зависимость между УПМ и лактобациллами Вл (rs=-0,7) определялась только во II группе. Не установлено корреляционной зависимости показателей уровней лактобацилл и бифидобактерий (нормофлора) с показателями уровней экспрессии генов TLR.
Различные уровни активации рецепторов TLR-2 и TLR-4 зависят от качественного состава микробных сообществ, присутствующих на слизистой оболочке УГТ. Активация экспрессии генов TLR-2 и TLR-4 происходит более выражено в ответ на УПМ и менее выражено при контакте с нормофлорой.
Повышение экспрессии TLR-2 и TLR-4, как в Ур, так и в Цк ккоррелировало с проявлениями УГХ, зависящей как от возбудителя, так и от ассоциатов (возбудителей ИППП и УПМ). При хламидийной инфекции не осложненной и осложненной наличием ассоциатов воспалительный процесс в УГТ характеризуется разными типами ответов в отношении экспрессии генов рецепторов. При остром урогенитальном хламидиозе наблюдается более высокий всплеск экспрессии TLR-2 и TLR-4 в Цк и Ур. При хроническом (длительном) течении хламидийной инфекции экспрессия генов TLR-2 и TLR-4 находится на уровне, намного ниже нормы. Повышение уровня экспрессии генов TLR коррелирует не только с патогенностью ассоциатов, но и тяжестью клинических проявлений воспалительного процесса, что позволяет использовать данный показатель для определения степени активности клеточного звена иммунитета и воспалительного ответа. Различные уровни активации TLR-2 и TLR-4 зависят от качественного состава микробных сообществ, присутствующих на слизистой оболочке УГТ. TLR-4 и TLR-2 запускают развитие воспалительной реакции УГТ.
Таблица 4. Уровни TLR в зависимости от микробиологической и морфологической характеристики биотопа урогенитального тракта (УГТ) при урогенитальном хламидиозе женщин
| Группы | Отдел УГТ | Усредненное содержание | Корреляция между столбцами ( rs ) | ||||||||
| Лейкоциты | УПМ, Lg КОЕ/мл | TLR-2 | TLR-4 | 1-2 | 1-3 | 1-4 | 2-3 | 2-4 | 3-4 | ||
| 1 | 2 | 3 | 4 | ||||||||
| I | Цк Ур Вл | 42,8±6,2 32,4±4,6 18,2±2,1 | 3,7±1,56 4,2±0,51 8,1±0,37 | 57,0±9,95 37,3±7,02 37,72±2,4 | 34,8±1,72 16,28±2,82 16,68±2,36 | 0,54 -0,35 0,525 | 0,68 0,82 0,59 | 0,41 0,65 0,72 | 0,62 -0,48 0,3 | 0,46 -0,6 0,49 | 0,46 0,37 0,52 |
| II | Цк Ур Вл | 14,8±1,4 6,7±1,4 12,5±1,94 | 3,8±0,27 2,3±0,5 4,58±1,01 | 5,71±1,07 3,45±1,46 35,3±6,74 | 8,01±1,08 2,0±0,83 14,37±1,96 | 0,34 0,21 -0,45 | 0,74 0,82 0,73 | 0,68 0,72 0,65 | 0,35 0,14 0,35 | 0,26 0,08 0,44 | 0,24 0,10 0,42 |
| III | Цк Ур Вл | 8,1±1,8 5,2±1,9 8,6±1,7 | 1,36±0,37 2,5±0,83 2,5±1,2 | 18,67±2,39 13,46±1,8 31,8±3,3 | 13,5±0,93 9,0±1,98 12,34±2,26 | -0,34 -0,36 0,28 | 0,58 0,41 0,7 | 0,74 0,362 0,88 | 0,86 0,34 0,59 | 0,42 -0,16 0,62 | 0,21 0,34 0,39 |
| IV | Цк Ур Вл | 4,0±1,52 3,3±1,7 5,1±2,0 | 1,94±0,73 1,32±0,37 2,74±0,94 | 17,02±2,1 11,9±1,8 36,82±3,56 | 13,8±1,9 7,8±1,03 12,1±1,63 | 0,042 0,05 0,082 | 0,78 0,55 0,74 | 0,45 0,30 0,68 | 0,36 0,6 0,87 | 0,28 -0,14 0,72 | 0,2 0,01 0,52 |
Примечания: при rs 0,7 связь считали сильной (0,001<p<0,01); при 0,5 rs <0,7 связь являлась средней (0,01<p<0,05);
при rs <0,5 связь считали слабой (p>0,05). Если rs=0 - линейная связь отсутствует; УПМ- условно-патогенные микробы.
Нами изучен микробиотоп влагалища и его патогенетическая роль при уреаплазмозе и хламидиозе.
При анализе ассоциаций патогенных агентов при остром уреаплазмозе и остром хламидиозе (табл. 5), включая обострение хронического процесса, выявлено, что из всех верифицированных патогенных агентов достоверно (по сравнению с группой переболевших хламидиозом пациентов) наиболее часто при уреаплазмозе регистрировались хламидии (2=5,540, р<0,05), микоплазмы (2=5,540, р<0,05), цитомегаловирус (2=4,002, р<0,05) и вирус простого герпеса (2=4,002, р<0,05), при остром хламидиозе – уреаплазмы (2=4,471, р<0,05), микоплазмы (2=7,098, р<0,01), вирус папилломы человека (2=6,012, р<0,05), при хроническом- вирус папиломы человека (2=4,023, р<0,05). У пациентов с острым уреаплазмозом частота встречаемости вируса папилломы человека достоверно ниже по сравнению с пациентами при остром хламидиозе (2=12,032, р<0,001), при обострении хронического хламидиоза (2=7,221, р<0,01) и не отличалась
Таблица 5. Встречаемость патогенных агентов при уреаплазмозе и хламидиозе
| Патогены | Острый уреаплазмоз 50 пациентов | Острый хламидиоз 41 пациент | Обострение хронического хламидиоза 29 пациентов | Пациенты, переболевшие хламидиозом 30 человек |
| Трихомонада | 2,04% | 4,8% | 0 | 0 |
| Токсоплазма | 2,04% | 4,8% | 0 | 0 |
| Уреаплазма | 34,1% | 20,7% | 13,3% | |
| Уреаплазма (моноинфекция) | 12,20% | - | - | - |
| Хламидия | 20,40% | - | - | - |
| Хламидия (моноинфекция) | - | 17,1% | 37,9% | 0 |
| Микоплазма | 20,40% | 24,3% | 10,3% | 0 |
| ВПЧ | 10,20% | 41,5% | 37,9% | 12,55% |
| ЦМВ | 16,30% | 4,8% | 0 | 0 |
| ВПГ | 16,30% | 6,5% | 3,4% | 0 |
Примечания: – исследования не проводились; ВПЧ – вирус папилломы человека; ЦМВ – цитомегаловирус; ВПГ– вирус простого герпеса.
от переболевших хламидиозом. При остром хламидиозе отмечено одновременное доминирование двух биоваров U. urealyticum Parvo и Т-960, что значительно усугубляло его течение (чаще встречались эрозии шейки матки). Наиболее частое выявление ВПЧ при хламидиозе (остром и обострении хронического хламидиоза) также являлось неблагоприятным патогенетическим фактором, определяющим неблагоприятный прогноз течения хламидийной инфекции – возможности малигнизации тканей, особенно, если учесть превалирование при хламидиозе нескольких типов ВПЧ (16, 18 и 35) с высокой онкогенной способностью. При уреаплазмозе чаще определялись ВПЧ низкой онкогенности (6 и 11 типы).
Количество лейкоцитов как показателя выраженности воспалительной реакции во влагалище составило в поле зрения при остром уреаплазмозе 44,9±6,6, при остром хламидиозе 18,2±2,1, при обострении хронического хламидиоза 12,5±1,9, у переболевших хламидийной инфекцией 8,6±1,7, у клинически здоровых пациентов 5,1±2,0. Различия достоверны между пациентами с острым уреаплазмозом и хламидиозом острым и хроническим при р<0,05, между пациентами с острым уреаплазмозом и переболевшими хламидиозом и клинически здоровыми при р<0,05, между пациентами с острым хламидиозом и переболевшими хламидиозом и клинически здоровыми при р<0,05; между пациентами с острым и хроническим вариантами течения хламидийной инфекции различия не достоверны. Следовательно, установлено достоверное угнетение выраженности воспалительной реакции слизистой генитального тракта женщин при остром и обострении хронического хламидиоза по сравнению с острым уреаплазмозом, что может косвенно свидетельствовать о нарушении (угнетении) местного врождённого иммунитета (в частности, нарушена функция TLR-рецепторов).
При остром уреаплазмозе у 10% больных определялся промежуточный тип нарушения микробиоценоза влагалища, у 44% больных – дисбиоз и у 46% больных- бактериальный вагинит; при остром хламидиозе у 56,1% больных – дисбиоз и у 43,9% больных- бактериальный вагинит; при обострении хронического хламидиоза у 72,5% больных- дисбиоз и у 27,5% больных- бактериальный вагинит. По частоте встречаемости типов нарушений микробиоценоза влагалища при уреаплазмозе и хламидиозе, а также между ними, различия не достоверны.
При уреаплазмозе интенсивность колонизации пристеночной зоны влагалища лактобациллами достигала 4,2±0,5 lg КОЕ/г. Определялись у 100% больных и по частоте встречаемости они достоверно не отличались по сравнению с клинически здоровыми пациентами, по сравнению с пациентами при остром хламидиозе (выявлялись у 56,1% пациентов, 6,5±1,0 lg КОЕ/г; 2=24,667, р<0,001) и при обострении хронического хламидиоза (2=12,466, р<0,001) различия достоверны, а также с переболевшими хламидиозом (2=4,491, р<0,05). Бифидобактерии не определялись. При хламидиозе обнаружено достоверное снижение частоты выявления (2=16,353, р<0,001) лактобацилл у больных острым хламидиозом (выявлялись у 56,1% пациентов, 6,5±1,0 lg КОЕ/г) по сравнению с клинически здоровыми пациентами, также достоверно различие по сравнению с пациентами при обострении хронического хламидиоза (выявлялись у 72,41%, 6,2±1,0 lg КОЕ/г; 2=4,272, р<0,05) и переболевшими (выявлялись у 87,00%, 7,2±0,6 lg КОЕ/г; 2=6,200, р<0,05). Бифидобактерии не выявлялись. У обследованных с обострением хронического хламидиоза частота выявления лактобацилл (72,41%, 6,2±1,0 lg КОЕ/г) достоверно (2=7,880, р<0,01) отличалась от таковой у клинически здоровых пациентов. Различия с переболевшими не достоверны. Бифидобактерии выявлялись у двух пациентов. У переболевших и клинически здоровых пациентов – у 87,00% (7,2±0,6 lg КОЕ/г) и 100% пациентов (7,5±1,5 lg КОЕ/г), соответственно, выявлены лактобациллы; различия между группами пациентов не достоверны. У 26,6% переболевших и у 50% клинически здоровых пациентов бифидобактерии выделялись в количестве 5,2±0,7 lg КОЕ/г и 6,1+0,9 lg КОЕ/г, соответственно; различия между группами не достоверны. Следовательно, хламидийная инфекция в сопоставлении с уреаплазменной инфекцией сопровождается наиболее выраженными нарушениями (уменьшении) в содержании лактобацилл на слизистых гениталий женщин.
УПМ при остром уреаплазмозе регистрировались в количестве 6,2±1,2 lg КОЕ/мл, при остром хламидиозе- 8,1±0,4 lg КОЕ/мл, при обострении хронического хламидиоза – 4,6±1,0 lg КОЕ/мл, у переболевших – 2,5±1,2 lg КОЕ/мл, у клинически здоровых пациентов – 2,74±0,94 lg КОЕ/мл. Уровни вывления УПМ не различались при остром уреаплазмозе и остром хламидиозе, но они достоверно (при р<0,05) отличались от таковых других сравниваемых групп пацинтов. При уреаплазмозе и хламидиозе дисбиотические нарушения во влагалище сопровождались повышением частоты встречаемости семи условно-патогенных микроорганизмов с наиболее частой высеваемостью при остром уреаплазмозе (табл. 6). Причём при уреаплазмозе высевались достоверно чаще Staphylococcus spp. по сравнению с острым хламидиозом (2=8,436, р<0,01), обострением хронического хламидиоза (2=4,997, р<0,05), переболевшими пациентами (2=8,837, р<0,01) и клинически здоровыми пациентами (2=14,370, р<0,001); Streptococcus spp. по сравнению с острым хламидиозом (2=17,365, р<0,001), обострением хронического хламидиоза (2=7,456, р<0,05), переболевшими пациентами (2=14,044, р<0,001) и клинически здоровыми пациентами (2=20,562, р<0,001); были не достоверны
Таблица 6. Встречаемость условно-патогенных микроорганизмов при уреаплазмозе и хламидиозе
| Условно-патогенные микроорганизмы | Острый уреаплазмоз 50 пациентов, % | Острый хламидиоз. 41 пациент,% | Обострение хронического хламидиоза 29 пациентов, % | Пациенты, перенёсшие хламидиоз 30 человек,% | Клинически здоровые пациенты, 32 человека, % |
| Staphylococcus spp. | 46,0 | 17,5 | 20,1 | 12,5 | 6,0 |
| Streptococcus spp. | 56,0 | 17,5 | 22,9 | 13,5 | 6,0 |
| Enterococcus spp. | 42,0 | 51,2 | 26,9 | 3,3 | 3,0 |
| Candida spp. | 48,0 | 29,3 | 31,0 | 6,7 | 4,0 |
| Esherichia coli spp. | 10,0 | 6,0 | 7,4 | 0 | 0 |
| Corynebacterium spp. | 12,0 | 6,0 | 0 | 0 | 0 |
| Gardnerella vaginalis | 22,0 | 5,5 | 0 | 0 | 0 |
различия показателей высеваемости стрептококков и стафилококков между острым хламидиозом и обострением хронического хламидиоза, а также между указанными группами больных по сравнению с переболевшими и клинически здоровыми пациентами. Пациенты с острым уреаплазмозом, острым хламидиозом и обострением хронического хламидиоза по высеваемости Enterococcus spp. и Candida spp. не различались; частота высеваемости Enterococcus spp. и Candida spp. у пациентов с уреаплазмозом была достоверно выше по сравнению с переболевшими пациентами (2=12,188 при р<0,001 и 2=12,779 при р<0,001, соответственно) и клинически здоровыми (2=14,838 при р<0,001 и 2=16,484 при р<0,001, соответственно); высеваемость Enterococcus spp. у больных острым хламидиозом достоверно выше чем при обострении хронического хламидиоза (2=3,854, р<0,05), у переболевших (2=16,405, р<0,001) и клинически здоровых (2=17,527, р<0,001), а при обострении хронического хламидиоза достоверно выше по сравнению с переболевшими (2=4,964, р<0,05) и клинически здоровыми пациентами (2=5,423, р<0,05); уровни показателей высеваемости Candida spp. у больных острым хламидиозом и обострением хронического хламидиоза достоверно не разлчались, однако они достоверно выше чем у переболевших хламидиозом (2=4,254 при р<0,05 и 2=4,278 при р<0,05, соответственно) и у клинически здоровых пациентов (2=6,701 при р<0,01 и 2=6,730 при р<0,01, соответственно). Частота высеваемости Gardnerella vaginalis достоверно выше при уреаплазмозе по сравнению с хламидиозом (2=4,086, р<0,05). При уреаплазмозе и при хламидийной инфекции с одинаковой частотой высевались энтерококки и грибы рода Кандида, которые обусловливают внутрибольничную инфекцию на фоне снижения иммунологической реактивности и колониза-ционной резистентности слизистых макроорганизма. Следовательно, наблюдается относительно сниженная реакция на условно-патогенную микрофлору.
По сравнению с уреаплазмозом при хламидийной инфекции регистрируется развитие более выраженного длительного вторичного иммунодефицита. При этом на местном уровне отмечаются относительно слабо выраженная воспалительная реакция при остром и обострении хронического хламидиоза, угнетение нормофлоры (лактобациллы и бифидобактерии), сниженная реакция на условно-патогенную микрофлору, что в сочетании способствует нарушению колони-зационной резистентности слизистых как основного компонента мукозального иммунитета, а на организменном уровне- развитие у переболевших кольпита, эрозии шейки матки, сальпингоофорита и возможная малигнизация тканей.
Суммируя результаты проведённого анализа полученных данных можно заключить, что взаимодействие микробиоценозов слизистых урогенитального тракта женщин и макроорганизма носит динамический характер, обеспечивает жизненно необходимый оптимальный уровень реактивности макроорганизма. В ряде случаев, биологические особенности возбудителя инфекционного заболе-вания и УПМ слизистых наряду с выраженными клиническими проявлениями способствуют формированию стойкого вторичного иммунодефицита, обусловливающего, в конечном счёте, прогноз и исход заболевания.
Нами установлена роль врождённого иммунитета слизистых урогенитального тракта женщин в патогенезе хламидийной инфекции.
У пациентов I группы оценена корреляционная связь между уровнями экспрессии генов TLR-2, TLR-4 и степенью выраженности воспалительной реакции, в частности – количеством лейкоцитов. При световой микроскопии мазков из «трех точек» Цк, Вл и Ур пациентов выявлено обилие полиморфноядерных лейкоцитов: 42,8±6,2, 18,2±2,1, 32,4±4,6 лейкоцитов в поле зрения, соответственно. Причем уровень лейкоцитоза в Цк и Ур коррелировал с высоким уровнем TLR-2 (57,00±9,95 ОЕ и 37,30±7,02 ОЕ, соответственно, при r>0,6. Уровень экспрессии генов TLR-2 в Цк и Ур пациентов I группы в 7-8 раз превышал показатели II группы (р<0,01). Средняя корреляционная связь (r>0,5) выявлена между уровнем экспрессии TLR-2 и количеством лейкоцитов во Вл: 37,72±2,40 ОЕ при 18,2±2,1 лейкоцитов в поле зрения. У пациентов выявлена высокая, по сравнению с контролем, экспрессия генов TLR-4, уровни которого в Цк, Ур и Вл составляли 34,80±1,72 ОЕ (корреляция с лейкоцитами слабая), 16,28±2,82 ОЕ (корреляция с лейкоцитами сильная) и 16,68±2,36 ОЕ (корреляция с лейкоцитами сильная), соответственно. Представленные данные свидетель-ствуют об особенностях инфекционного процесса хламидийной этиологии, так как в большинстве случаев реакция хозяина на первичное заражение хламидиями приводит к развитию местного воспаления и носит преходящий характер, не сопровождающийся тканевыми повреждениями (Фидров А.А. и др., 2006). При этом конституционная экспрессия генов TLR свидетельствует не только о постоянной готовности лейкоцитов и других клеток макроорганизма к встрече и распознаванию патогенов, но и сохранению возможности усиления иммунного ответа.
У пациенток группы II практически во всех случаях наблюдалось снижение показателя воспаления – содержания лейкоцитов, по сравнению с группой I. Количество лейкоцитов в Цк, Ур составляло 14,8±1,4 и 6,7±1,4, соответственно. Средний уровень TLR-2 в Цк и Ур – 5,71±1,07 ОЕ и 3,45±1,46 ОЕ, соответственно. Воспалительная реакция соответствовала наличию 15,4±4,3 лейкоцитов в поле зрения. Анализ показателей экспрессии TLR-2 во Вл не выявил существенных отличий от показателей других групп: значение экспрессии TLR-2 и лейкоцитов равно 35,3±6,74 ОЕ и 12,5±1,94 клеток в поле зрения, соответственно. Невысокое содержание лейкоцитов (менее 15) в различных отделах УГТ пациентов II группы, наблюдавшееся в 87,2% случаев, свидетельствует о том, что при воспалении шейки матки/уретры более чем у половины женщин с хроническим течением хламидиоза наблюдается снижение лейкоцитарной реакции, связанное с низким уровнем экспрессии генов TLR-2: максимальный уровень данного рецептора не превышал 16,3 ОЕ, и для группы в целом был равен 5,71±1,1 ОЕ. Максимальный уровень экспрессии генов TLR-4 не превышал 14,47 ОЕ; составлял для Цк, Ур и Вл 8,0±1,1, 2,0±0,83 и 14,37±1,96 ОЕ, соответственно.
Следовательно, у большинства больных хроническим УГХ в Ур и Цк имеется иммунодефицит, при котором доминирующим фактором является дисбаланс между развитием инфекционного процесса и воспалительной реакции, что подтверждается данными литературы (Якубович А.И., Корепанов А.Р., 2007; Donatella et al., 2008). Выявленные однотипные изменения показателей уровня экспрессии TLR-2 и TLR-4 в соскобах из Цк и Ур пациенток с хронической формой хламидиоза указывают на развитие так называемого "феномена рецепторной депрессии", свидетельствующего о высоком риске хронизации процесса и рецидива заболевания после проведенного лечения. Во Вл у пациентов не регистрировались выраженные изменения, при этом большинство показателей были близки к физиологической норме. Состояние напряженности, характеризу-емое увеличением лейкоцитов, можно рассматривать как один из вариантов взаимодействия защитных механизмов клетки хозяина с УПМ, так как известно, что размножение хламидий в клетках плоского эпителия происходит незначительно или не происходит вовсе (Савичева А.М. и др., 2002).
При оценке уровней экспрессии TLR-2 и лейкоцитарного ответа в различных отделах УГТ обследованных III и IV групп (табл. 4) выявлено незначительное повышение количества лейкоцитов в группе III по сравнению с контролем (p<0,05). Содержание лейкоцитов в Цк, Ур и Вл обследованных III группы составляло: 8,1±1,8, 5,2±1,9, 8,6±1,7 клеток в поле зрения, в IV группе – 4,0±1,52, 3,3±1,7 и 5,1±2,0, соответственно. Уровни экспрессии TLR-2 в Цк, Ур и Вл обследованных III группы были сопоставимыми с группой IV и составляли для Цк 17,02±2,1 ОЕ и 13,8±1,9 ОЕ, Ур 11,9±1,8 ОЕ и 7,8±1,03 ОЕ, Вл 36,82±3,56 ОЕ и 12,1±1,63 ОЕ, соответственно. В III и IV группах отмечено достоверное двухкратное уменьшение показателей уровня экспрессии TLR-4 в Цк и Ур по сравнению с показателями больных I группы.
В целом влияние инфекционных агентов на состояние факторов местного иммунитета заключалось в активации TLR, участвующих в воспалении. Уровни TLR-2 и TLR-4 могут служить критериями оценки выраженности урогенитальной инфекции, ассоциированной с Ch. trachomatis и наличия воспалительного процесса у больных. При этом наиболее важным и единственным свидетельством выздоровления больного урогенитальным хламидиозом является эрадикация возбудителя- Ch. trachomatis. В отдельных случаях, когда до лечения лабораторно возбудитель не выявлялся, а диагноз пациенту был поставлен по другим маркерам, косвенно свидетельствующим о его заражении хламидиозом, об эрадикации возбудителя можно судить по изменению уровня TLR-2 и TLR-4. Усиление защитной реакции в очаге поражения всегда сопровождается повышенной активацией TLR-2 и TLR-4.
Низкие уровни TLR-2 и TLR-4 свидетельствуют о хроническом течении инфекции или о возможности начала хронизации инфекционного процесса. Определение необходимости и срока начала повторного курса лечения может также основываться на изучении уровней TLR-2 и TLR-4 в разные периоды заболевания. Вероятнее всего, снижение уровня данных рецепторов произойдет тогда, когда новые интактные клетки урогенитального эпителия заменят контаминированные возбудителем эпителиоциты. Эти данные не только позволяют правильно подобрать иммунокорригирующую терапию данному больному, но и определить возможный исход текущего заболевания с подбором антибактериальной терапии при хронизации инфекционного процесса.
Таким образом, инфекционные агенты активизируют TLR УГТ, запускающие воспалительную реакцию. Естественная или приобретённая супрессия генов TLR-2 и TLR-4 обусловливает хроническое течение УГХ. При воспалении шейки матки/уретры более чем у половины женщин с хроническим рецедивирующим течением УГХ наблюдается снижение экспрессии генов TLR-2 и TLR-4 (в полтора-два раза ниже значений у клинически здоровых пациентов), сопровождаемое уменьшением лейкоцитарной реакции. Как про-, так и антиапоптозная активности хламидий определяют характер развития инфекции: продуктивная инфекция либо персистенция. Выраженность воспалительной реакции обусловлена и активацией экспрессии генов TLR-2 и TLR-4 в эпителии слизистых УГТ, и дополнительной активации TLR-2 и TLR-4 лейкоцитов. Низкие уровни экспрессии генов TLR-4 при осложненном инфекционном процессе свидетельствуют о переключении TLR-4 типа иммунного ответа на TLR-2. Уровни TLR-2 и TLR-4 могут служить диагностическими критериями УГХ, характеризовать выраженность инфекционного процесса.
Мы изучили колонизационную резистентность слизистых цервикального канала как неотъемлемую составляющую местного иммунитета.
Клинические варианты течения хламидийной инфекции в наибольшей степени определяются выраженностью изменений, вызываемых возбудителем в месте своей локализации, и эффективностью колонизационной резистентности слизистых. Слизистые УГТ содержат элементы биотопа (эпителиальные клетки, лейкоциты), являющиеся элементами конституциональной рецепторной системы организма, в кооперации с другими гуморальными и клеточными факторами мукозального иммунитета, микрофлорой биотопа определяют эффективность колонизационной резистентности слизистых макроорганизма (Бакулев А.Л. и др., 2008), защищающей экосистему от патогенной микрофлоры.
При анализе ассоциаций патогенных агентов при хламидиозе (табл. 5) выявлено, что из всех верифицированных возбудителей ИППП достоверно (по сравнению с группой переболевших хламидиозом пациентов) наиболее часто при остром хламидиозе встречались уреаплазмы (2=4,471, р<0,05), микоплазмы (2=7,098, р<0,01), ВПЧ (2=6,012, р<0,05), при хроническом хламидиозе- ВПЧ (2=4,023, р<0,05). При остром хламидиозе отмечено одновременное доминирование двух биоваров U. urealyticum Parvo и Т-960. При хламидиозе
Таблица 7. Уровни иммуноглобулинов у больных с различными формами УГХ и клинически здоровых женщин
| Показатели | Параметры иммунитета, (M±m) | ||||||
| Обследованные группы | Уровень достоверности различий показателей между группами, Р<0,05 | ||||||
| I ( n=41) Острый УГХ | II (n=29) Хронический УГХ | III (n=30) Переболевшие УГХ | IV (n=32) Клинически здоровые, контроль | ||||
| TLR-2 | ОЕ | 57,00±9,95 | 5,71±1,07 | 18,67±2,39 | 17,02±2,10 | II<I и IV; I>II и III | |
| TLR-4 | 34,80±1,72 | 8,01±1,08 | 13,50±0,93 | 13,8±1,9 | I>II; II<IV | ||
| Лейкоциты | 42,8±6,2 | 14,8±1,4 | 8,1±1,8 | 4,00±1,52 | IV< I, II и III | ||
| УПМ, Lg КОЕ/мл | 3,70±1,56 | 3,80±0,27 | 1,36±0,37 | 1,94±0,37 | I >III и IV; II>III и IV | ||
| Белок г на мл пробы | 1,40±0,92 | 1,67±0,78 | 0,41±0,33 | 0,35±0,26 | II>I, III и IV | ||
| IgM* | мкг Ig на г белка | 31,01±4,07 | 0 | 0 | 0 | 0 | |
| IgG | 32,41±4,41 | 41,81±3,56 | 11,30±2,47 | 6,67±1,25 | I >III и IV; II>III и IV | ||
| IgA** | 12,50±3,54 | 17,39±0,83 | 0 | 0 | 0 | ||
| sIgA | 36,30±2,63 | 22,35±2,66 | 12,60±1,45 | 5,64±0,62 | IV<I, II и III | ||
| sc | 43,19±5,47 | 29,25±3,39 | 16,2±2,48 | 7,23±0,98 | IV< I, II и III | ||
Примечание: УГХ - урогенитальный хламидиоз; ОЕ- относительные единицы; УПМ- условно-патогенные микроорганизмы;*- IgМ встречался у 4 из 41 пациентов I группы; **- IgА встречался у 2 из 41 пациента I группы и 7 из 29 пациентов II группы.
превалировали нескольких типов ВПЧ (16, 18 и 35) с высокой онкогенной способностью. По частоте выявляемости УПМ в Цк (табл. 4) достоверные различия выявлены между I и III группами (2=5,470, р<0,01), I и IV группами (2=20,800, р<0,001), II и IV группами (2=7,310, р<0,001), III и IV (2=4,460, р<0,01), а между I и II, II и III группами различия не достоверны.
В Цк (табл. 7) выявлены достоверные различия уровней экспрессии генов TLR-2 между I и II, III и IV группами (p0,05), II и III, IV группами (p0,05), а уровней экспрессии генов TLR-4 – между I и II, III и IV группами (p0,05), II и III, IV группами (p0,05). У пациенток группы II регистрировалось достоверное снижение уровней экспрессии генов TLR-2 и TLR-4 в 2 и 2,5 раза, соответственно, относительно показателей группы I, а также они достоверно ниже таковых в группе IV. По выраженности лейкоцитарной реакции достоверные различия выявлены между I и IV группами (p0,001), II, III группами (p0,01), II и IV (p0,01).
Нами определена роль цитокинов цервикального канала вколонизационной резистетности слизистых.
Известно, что характер воспаления и исход взаимодействия между патогеном и механизмами противомикробной защиты хозяина в значительной мере зависят от спектра и уровня продуцируемых цитокинов. Представляется оправданным исследование полного местного цитокинового статуса с последующим выяснением роли его отдельных компонентов в течении УГХ. Уровни IL-8 в ЦС (табл. 8) у больных группы I (3780,16±421,89 пкг/мг белка) достоверно (р<0,01) выше показателей групп III (511,72±195,44 пкг/мг белка), IV (134,04±31,76 пкг/мг белка); с группой II (2781,62±676,33 пкг/мг белка) различия не достоверны (табл. 3). В группе II выявлено достоверное повышение уровней IL-8 в 3,8 раза по сравнению с таковыми пациентов группы IV. В группах III и IV показатели уровней IL-8 достоверно не различались. У больных группы I (952,1±149,13 пкг/мг белка) выявлены достоверно высокие концентрации IL-6 по сравнению с группами II (154,82±73,20 пкг/мг белка), III (43,28±12,40 пкг/мг белка) и IV (5,31±2,79 пкг/мг белка). У больных группы II показатель уровня IL-6 в ЦС достоверно выше такового в группе IV и не отличался от такового группы III. В группе III уровень IL-6 был в 8 раз выше, чем в группе IV. У больных группы I наблюдался достоверно повышенный уровень IL-1 (1515,9±364,8 пкг/мг белка) по сравнению с пациентками групп II (117,64±69,45 пкг/мг белка), III (24,67±3,81 пкг/мг белка) и IV (2,18±1,69 пкг/мг белка). В группе II в ЦС наблюдалась относительно невысокая концентрация IL-1 (достоверно отличалась от показателей пациенток групп III и IV, р<0,05). У пациенток группы I (141,29±10,30 пкг/мг белка) установлено достоверно более высокое содержание TNF- в ЦС, чем в группах II (25,63±7,75 пкг/мг белка), III (7,24±2,13 пкг/мг белка) и IV (2,63±1,30 пкг/мг белка). В группе II уровень TNF- достоверно выше чем в группе III, в 9 раз превышал значения показателей в группе IV. У пациентов групп III и IV отмечались низкие значения TNF- в ЦС, которые достоверно не различались между собой. Уровни IFN- в ЦС (415,66±159,90 пкг/мг белка) у больных группы I статистически значимо (р<0,05) отличались от таковых у пациенток групп II (26,69±9,50 пкг/мг белка), III (4,47±1,61 пкг/мг белка) и IV (3,13±1,35 пкг/мг белка). В группе II уровни IFN- были достоверно выше таковых в группах III и IV. Содержание IFN- в группах III и IV было на низком уровне и статистически не различалось. Показатели концентраций IL-4 ЦС в группе I (24,83±18,44 пкг/мг белка) достоверно выше показателей у пациенток групп III (6,2±1,56 IV пкг/мг белка) и IV (3,98±1,38 пкг/мг белка); с группой II различия не достоверны. Не установлено достоверной динамики показателей уровней экспрессии IL-4 в группах II и III по сравнению с группой IV.
В I группе наблюдалась средняя корреляционная связь (r=0,62) между УПМ и TLR-2, между УПМ и TLR-4 (r=0,46), между TLR-2 и TLR-4 (r=0,54). Установлена сильная корреляционная связь между уровнем лейкоцитоза и уровнем TLR-2 (r=0,68) и средняя с уровнем TLR-4 (r=0,41). Показатели уровней экспрессии генов TLR-2 и TLR-4 сильно коррелировали с содержанием цитокинов IL-8 (r=0,88 и r=0,82, соответственно), IL-6 (r=0,75 и r=0,72, соответственно), IL-1 (r=0,78 и r=0,79, соответственно); регистрировалась средняя корреляционнаясвязь с уровнями цитокина TNF- (r=0,69 и r=0,62, соответственно), IFN- (r=0,52 и r=0,48, соответственно); достоверной взаимосвязи между содержанием IL-4 и уровнями экспрессии генов TLR-2 и TLR-4 выявлено не было. Наиболее значительное повышение уровней IL-8, TNF- и IL-1 в ЦС наблюдалась у впервые инфицированных пациенток, то есть с ранним сроком заболевания. Выявлена слабая корреляционная зависимость между уровнем белка и уровнями экспрессии генов TLR-2 и TLR-4 r=0,3 (р<0,05), между уровнем белка и секреторным иммуноглобулином – sIgA, секреторным компонентом – sc (r=0,35 и r=0,39, соответственно); средняя между уровнем белка и IgG (r=0,42), между уровнем IgG и уровнями экспрессии генов TLR-4 (r=0,49),
Таблица 8. Уровень экспрессии генов TLR и изучаемых цитокинов в
слизистой цервикального канала женщин с урогенитальным хламидиозом
| Группы пациентов, n | Уровень экспрессии, ОЕ | Уровень цитокинов, пкг/мг белка, M±m | ||||||||||
| TLR-2 | TLR-4 | IL-8 | TNF- | IL -6 | IL -12 | IL -9 | IL -4 | IL -1 | IFN- | IL -10 | GM-CSF | |
| I, 41 | 57,0± 9,95 | 34,8± 1,72 | 3780,16± 421,89 | 141,29± 10,30 | 952,10± 149,13 | 2,96± 1,22 | 28,58± 13,36 | 24,83± 18,44 | 1515,9± 364,8 | 415,66± 159,90 | 7,55± 2,99 | 13,76± 5,66 |
| II, 29 | 5,71± 1,07 | 8,01± 1,08 | 2781,62± 676,33 | 25,63± 7,75 | 154,82± 73,20 | 1,78± 0,39 | 32,74± 3,76 | 17,6± 10,83 | 117,64± 69,45 | 26,69± 9,50 | 9,56± 8,33 | 16,39± 8,94 |
| III, 30 | 18,67± 2,39 | 13,5± 0,93 | 511,72± 195,44 | 7,24± 2,13 | 43,28± 12,40 | 2,83± 0,95 | 31,53± 3,21 | 6,20± 1,56 | 24,67± 3,81 | 4,47± 1,61 | 3,86± 1,15 | 5,30± 4,71 |
| IV, 32 | 17,02± 2,10 | 13,8± 1,9 | 134,04± 31,76 | 2,63± 1,30 | 5,31± 2,79 | 2,61± 0,76 | 22,69± 10,47 | 3,98± 1,38 | 2,18± 1,69 | 3,13± 1,35 | 2,49± 1,22 | 4,62± 2,74 |
Примечания: I-IV- группы пациентов; n- количество пациентов в группе.
не выявлено корреляционной связи между IgG и TLR-2 (r<0,10), а также между уровнем белка и цитокинами, между уровнями иммуноглобулинов и цитокинами. После лечения установлена сильная корреляционная связь между количеством IL-8 в ЦС и уровнем экспрессии генов TLR-2 и TLR-4 в группе I (rs > 0,8) средняя – в группах II и III (rs = 0,7 и rs = 0,6, соответственно) и слабая корреляционная связь в группе IV (rs = 0,35).
При остром хламидиозе в ответ на высокую инфекционную нагрузку (хламидии в виде моно- или микстинфекции с возбудителями ИППП и/или с УПМ) повышаются уровни экспрессии генов TLR-2, TLR-4, запускающие в Цк выраженную продукцию IL-8, TNF- и IL-1, приводящих, в свою очередь, к увеличению содержания лейкоцитов, белка и Ig у пациенток, что можно расценивать как выраженную местную (преимущественно по клеточному типу) иммунологическую реакцию макроорганизма, отражающую остроту инфекционного процесса и способствующую развитию воспалительной реакции и локализации распространения инфекции за пределы шейки матки, а также стимуляции продукции дополнительных цитокинов соседними неинфицированными клетками. В ЦС нарастание уровней IgG связано с местным синтезом и экссудацией, а выявление sIgA и sc обусловлено их синтезом in situ.
В группе II (табл. 4, 7, 8) в Цк между УПМ и TLR-2 (r=0,35), УПМ и TLR-4 (r=0,26), TLR-2 и TLR-4 (r=0,34) установлена слабая корреляционная связь, уровень лейкоцитоза сильно коррелировал с уровнем TLR-2 (r=0,74) и уровнем TLR-4 (r=0,68). Показатели уровней экспрессии генов TLR-2 и TLR-4 сильно коррелировали с IL-8 (r=0,71 и r=0,69, соответственно); средняя корреляционная связь выявлена между уровнями IL-6 и экспрессией генов TLR-2 (r=0,62) и TLR-4 (r=0,61), между IL-1 и уровнями экспрессии генов TLR-2 и TLR-4 (r=0,63 и r=0,58, соответственно); уровень TNF- обратно коррелировал с уровнем экспрессии генов TLR-2 и TLR-4 (r=-0,63 и r=-0,58, соответственно); определялась средняя корреляционная связь уровней IFN- с показателями экспрессии генов TLR-2 (r=48) и слабая с TLR-4 (r=0,32); достоверной взаимосвязи между содержанием IL-4 и уровнями экспрессии генов TLR-2 и TLR-4 выявлено не было. Только в группе II выявлена достоверная средняя корреляционная связь между IL-8 и УПМ (r>0,53), между IL-6 и УПМ (r=0,49). Установлены средняя корреляционная зависимость между содержанием белка и IgG (r=0,51) и её отсутствие с sIgA и sc. Показатели sIgA и sc коррелировали с уровнями экспрессии генов TLR-2 (r=0,77) и TLR-4 (r=0,29), а показатели содержания IgG – с TLR-2 и TLR-4 (r=0,48 и r=0,32, соответственно), УПМ – с IgG- r=0,73. Таким образом, при хроническом хламидиозе в ответ на высокую инфекционную нагрузку (хламидии в виде моно- или микстинфекции с другими возбудителями ИППП и/или УПМ) уровни экспрессии генов TLR-2 и TLR-4 не повышаются (ниже уровней у переболевших и клинически здоровых пациентов), что свидетельствует о дисфункции врождённого иммунитета. Сочетание сниженной экспрессии генов TLR-2 и TLR-4 с подавлением активности локального синтеза IL-8, IL-6, TNF-, относительно слабо выраженной лейкоцитарной реакцией, пониженными уровнями sIgA и sc, повышенным содержанием общего белка и IgG, обусловливает хронический, вялотекущий воспалительный процесс, способствует прогрессирующему характеру течения инфекционного процесса и свидетельствуют о дисфункции механизмов мукозального иммунитета Цк, дисбалансе в процессах деструкции и репарации, сопутствующих воспалению. В ЦС нарастание уровней IgG связано, в основном, с местным синтезом и в меньшей степени с экссудацией через слизистую сыворотки крови, а выявление sIgA и sc обусловлено их пониженным местным синтезом.
В III группе (табл. 4, 7, 8) установлены сильная корреляционная связь между УПМ и TLR-2 (r=0,86), средняя (r=0,42) между УПМ и TLR-4, между TLR-2 и TLR-4 (r=-0,34) обратная слабая корреляционная связь. Выявлена средняя корреляционная связь между уровнем лейкоцитоза и уровнем экспрессии генов TLR-2 (r=0,58) и сильная с уровнем TLR-4 (r=0,74). Установлена средняя корреляционная связь между IL-8 и уровнем экспрессии генов TLR-2 и TLR-4 (r>0,61 и r=0,52, соответственно); слабая корреляционная связь- между TLR-2, TLR-4 и уровнем IL-6 (r=0,32 и r=0,29, соответственно), между TLR-2, TLR-4 и уровнем TNF- (r=0,44 и r=0,38, соответственно), между TLR-2, TLR-4 и уровнем IFN- (r=0,32 и r=0,28, соответственно). Достоверной взаимосвязи между содержанием IL-1 и IL-4 и уровнями экспрессии генов TLR-2 и TLR-4 выявлено не было. Средняя корреляционная связь установлена между содержанием белка и уровнями экспрессии генов TLR-2 и TLR-4 (r=0,40), sIgA (r=0,49). Следовательно, у больных после излечения от хламидийной инфекции в Цк инфекционная нагрузка резко снизилась и, соответственно, уменьшилась экспрессия генов TLR-2 и TLR-4, но продолжают регистрироваться остаточные проявления воспалительной реакции (несколько повышенные уровни лейкоцитов, IgG и sIgA- синтезируются местно).
В IV группе (табл. 4, 7, 8) между УПМ и TLR-2 (r=0,36), УПМ и TLR-4 (r=0,28) выявлена слабая корреляционная связь, между TLR-2 и TLR-4 корреляционной связи не выявлено. Установлена сильная корреляционная связь между уровнем лейкоцитоза и уровнем TLR-2 (r=0,78) и средняя- с уровнем TLR-4 (r=0,45). Имела место слабая корреляционная связь между IL-8 и уровнем экспрессии генов TLR-2 и TLR-4 (r>0,48 и r=0,35, соответственно), между IL-6 и уровнем экспрессии генов TLR-2 и TLR-4 (r=0,26 и r=0,24, соответственно), между TNF- и уровнем экспрессии генов TLR-2 и TLR-4 (r=0,32 и r=0,28, соответственно), между IFN - и уровнем экспрессии генов TLR-2 и TLR-4 (r=0,24 и r=0,23, соответственно). Достоверной взаимосвязи между содержанием IL-1, IL-4 и уровнями экспрессии генов TLR-2 и TLR-4 выявлено не было. Средняя корреляционная связь установлена между содержанием белка и уровнями экспрессии генов TLR-2 и TLR-4 (r=0,40), IgG (r=0,46). Невысокие концентрации IgG в ЦС клинически здоровых женщин (без гинекологической патологии и генитальной инфекции) объясняются небольшой антигенной стимуляцией поступающими извне микроорганизмами.
Таким образом, при УГХ в Цк взаимосвязь рецепторов врождённого иммунитета TLR-2 и TLR-4 (контролируют запуск цитокинового каскада местной антиинфекционной резистентности, через который запускаются иммуноглобулиновое звено и воспалительная реакция) с микрофлорой биотопа определяет колонизационную резистентность слизистых (рис. 2) и характеризует

Рисунок 2. Взаимодействие факторов, определяющих колонизационную резистентность
течение инфекционного процесса, выраженность клинических и лабораторных проявлений и исход заболевания (излечение, хронизация), а оценка их уровней носит диагностический и прогностический характер. Колонизационная резистетность выступает как неотъемлемая часть мукозального иммунитета. Её угнетение способствует персистированию возбудителя в организме и хронизации инфекционного процесса, что в свою очередь, создаёт предпосылки для повышения онкогенного потенциала микрофлоры биотопа. При выраженной острой или хронической воспалительной реакции в Цк уровень IgG определяется не только местным синтезом, но проникновением IgG из крови за счёт повышения проницаемости слизистой Цк.
Нами исследована связь фенотипических свойств возбудителя с клиническими проявлениями при урогенитальном хламидиозе.
Проведено обоснование создания быстрой и надежной тест-системы мультиплексной ПЦР-детекции возбудителей хламидиозов человека видов Chl. pneumoniae и Ch. trachomatis, а также мультиплексной системы, для универсальной ПЦР-детекции плазмидных и бесплазмидных штаммов вида Ch. trachomatis.
Для детекции штаммов Ch. trachomatis, несущих плазмиду и свободных от нее, была впервые предложена следующая оригинальная комбинация праймеров: форвард праймер Ctr: 5'-TGGCGATATTTGGGCATCC-3' и реверс праймер R: 5'-CTTCTTTACCTGGTACGCTC-3' для амплификации фрагмента (334 пары нуклеотидов) 16S rRNA гена Ch. trachomatis; форвард праймер PLf: 5'-TCCGGAGCGAGTTACGAAGA-3' (XO6707 Gene Bank) и реверс праймер PLr: 5'-AATCAATGCCCGGGATTGGT-3' (AM886279 Gene Bank) для амплификации участка гена криптической плазмиды (241 пара нуклеотидов) Ch. trachomatis.
Материалом для исследования служили 21 штамм Ch. trachomatis и 1 штамм Chl. pneumoniae, верифицированных в мазках соскобах, а также на культуре клеток McCoy, зараженных клиническим материалом, полученным от человека с патологией органов репродуктивного тракта и органов дыхания с подозрением на хламидийную инфекцию. Идентификацию хламидий проводили окрашиванием по Романовскому-Гимзе, согласно общепринятой методике, и меченными FITC моноклональными антителами для выявления антигенов Ch. trachomatis и Chl. pneumoniae в реакции прямой иммунофлуоресценции (тест-система CeLLabs, Австралия). В препаратах инфицированных клеточных культур хламидии выявлялись в виде характерных цитоплазматических включений, окрашенных в соответствующий методу цвет.
Из 21 штамма Ch. trachomatis, полученных из урогенитального тракта человека, при культивировании в культуре клеток (37 °C), 6 штаммов образовывали множественные внутриклеточные хламидийные включения, что свидетельствовало об отсутствии экспрессии гена incA на уровне белка, обусловливающего включения такого характера. У остальных 15 штаммов и референс штамма Ch. Trachomatis- «Бурхан» в культуре клеток выявлялись хламидийные включения в виде одного общего включения. Отсутствие экспрессии белка IncA приводит к замедлению деления РТ хламидий в клетке. Штаммы Ch. trachomatis, которые не экспрессируют данный белок, продуцируют множественные включения в клетке и вызывают субклиническую картину течения хламидийной инфекции (Rurangirwa F.R. et al., 1999). Pannekoek Y. et al. (2005) показали, что в генах IncA разных штаммов существуют различного рода мутации и это напрямую связано с фенотипом, однако зависимость экспрессии гена от мутаций выявлено не было. Следовательно, о вирулентности можно судить не только по наличию или отсутствию плазмиды но и по характеру включения: множественные включения указывают на сниженную вирулентность, возможность хронизации инфекционного процесса. Установлено довольно частое (3,7% из 27 случаев) выяление плазмидо негативных штаммов. Плазмидо негативный штамм вызывал вялое течение инфекционного процесса.
При патологии органов репродуктивного тракта человека на культуре клеток был выделен 21 штамм Ch. trachomatis, что подтверждено ПЦР с коммерческим набором и с предлагаемой системой для видовой верификации. Благодаря предлагаемой системе для верификации плазмид установлено наличие плазмид у данных штаммов (табл. 9).
Таблица 9. Детекция плазмидных и бесплазмидных штаммов хламидий у человека.
| Номер п/п | Место выделения | Плазмидные | Бесплазмидные | «АмплиСенс Ch. trachomatis-FL» |
| 1 | уретра | + | - | + |
| 2 | цервикальный канал | + | - | + |
| 3 | цервикальный канал | + | - | + |
| 4 | цервикальный канал | + | - | + |
| 5 | уретра | + | - | + |
| 6 | уретра | + | - | + |
| 7 | уретра | + | - | + |
| 8 | уретра | + | - | + |
| 9 | цервикальный канал | + | - | + |
| 10 | уретра | + | - | + |
| 11 | уретра | + | - | + |
| 12 | уретра | + | - | + |
| 13 | уретра | + | - | + |
| 14 | уретра | + | - | + |
| 15 | цервикальный канал | + | - | + |
| 16 | цервикальный канал | + | - | + |
| 17 | цервикальный канал | + | - | + |
| 18 | уретра | + | - | + |
| 19 | уретра | + | - | + |
| 20 | уретра | + | - | + |
| 21 | уретра | + | - | + |
| 22 | Ch. trachomatis-«Бурхан» | + | - | + |
Примечания: + - положительный результат; - - отрицательный результат.
Апробацию чувствительности системы видовой верификации хламидий и системы по обнаружению плазмиды проводили также на клиническом материале мазков-соскобов, полученных из уретры, цервикального канала, носоглотки у 15 человек. У 6 из 15 пациентов обнаружена DNA плазмидных штаммов Ch. trachomatis в соскобном материале из урогенитального тракта и у 1 пациента из носоглотки (табл. 10). Бесплазмидных штаммов не было обнаружено. У одного пациента из носоглотки системой видовой верификации обнаружена DNA Chl. pneumoniae. У 7 пациентов хламидии обнаружены не были.
Таким образом, предлагаемые ПЦР-тест-системы для детекции и дифферен-циации Сhl. pneumoniae и Ch. trachomatis позволяют одновременно не только верифицировать возбудителей у человека (в большем проценте случаев по
Таблица 10. Апробация предлагаемых ПЦР-тест-систем на клиническом материале
| п/н | Место выделения | Система видовой верификации | Предложенная система для верификации плазмид | |
| Ch. trachomatis | Chl. pneumoniae | |||
| 1 | цервикальный канал | + | - | + |
| 2 | цервикальный канал | - | - | - |
| 3 | цервикальный канал | + | - | + |
| 4 | цервикальный канал | + | - | + |
| 5 | цервикальный канал | - | - | - |
| 6 | цервикальный канал | - | - | - |
| 7 | цервикальный канал | + | - | + |
| 8 | уретра | + | - | + |
| 9 | уретра | + | - | + |
| 10 | уретра | - | - | - |
| 11 | уретра | - | - | - |
| 12 | уретра | - | - | - |
| 13 | уретра | - | - | - |
| 14 | носоглотка | - | + | - |
| 15 | носоглотка | + | - | + |
Примечания: + - положительный результат; - – отрицательный результат.
сравнению с коммерческими ПЦР-тест-системами), но и осуществлять дифферен-циацию хламидий, оценивать их вирулентность (плазмидные и бесплазмидные штаммы, характер включений) благодаря специально подобранным праймерам для мультиплексного видового обнаружения возбудителей. Предлагаемые ПЦР-тест-системы могут применяться для прямой диагностики хламидий Сhl. pneumoniae и Ch. trachomatis в образцах клинического материала и в культуре клеток (повышение диагностической значимости культурального метода).
Проведенное генетическое типирование штаммов Ch. trachomatis позволил сгруппировать их в 5 групп:
1- штаммы, наиболее близкие к штаммам генотипа К (46,2%);
2- штаммы, наиболее близкие к штаммам генотипа G (23,1%);
3- штаммы, наиболее близкие к штаммам генотипа Е (19,2%);
4- штаммы, наиболее близкие к штаммам генотипа F (7,7%);
5- штаммы, наиболее близкие к штаммам генотипа J (3,8%).
Генотипирование с использованием сконструированных олигонуклеотид-ных праймеров в реакции ПЦР осуществлялось в два этапа без привлечения ферментативных реакций в присутствии рестриктаз как в ПДРФ-анализе. Первоначально проводили ПЦР с использованием специфических праймеров к группам генотипов. Далее, при положительной ПЦР с праймерами одной из групп, проводили ПЦР с генотипоспецифичными праймерами, тем самым определяя генотип штамма Ch. trachomatis. Установлено, что у трех пациентов выявилось инфицирование урогенитального тракта сразу двумя генотипами. Причем, в ассоциации всегда присутствовал генотип К и все случаи заболевания носили острый характер. При установлении встречаемости различных генотипов, в зависимости от пола пациента, выявлена следующая картина: у мужчин – генотип G (14%), генотип E (21%), генотип J (7%), генотип F (14%), генотип K (44%); у женщин – генотип G (37,5%), генотип E (19%), генотип K (43,5%). Установлено, что генотип G у женщин встречается чаще, чем у мужчин, генотипы K и E- распределены в равных долях, а генотипы F и J встречались в нашем эксперименте исключительно у мужчин.
Анализ штаммов, выделенных от людей (табл. 11), на чувствительность к антибиотикам показал наличие tet-гена у 1 (3,8%) из 26 штаммов, erm-гена у 4 (15,4%). Одновременное наличие детерминант устойчивости к тетрациклинам и макролидам было выявлено у 3 штаммов (11,5%). Штаммы, выделенные от людей, являлись носителями криптической плазмиды, не зависимо от определяемого генотипа; выделен один бесплазмидный штамм. Анализ данных проведенных исследований в сопоставлении с полученными ранее результатами позволяет выявить зависимость между генотипом и клиническими проявлениями хламидийной инфекции, вызванной штаммом с конкретным генотипом. Анализ данных исследования штаммов Ch. trachomatis, выделенных от людей, не показал связи наличия генов устойчивости к тетрациклинам и макролидам в штаммах с клиническими проявлениями заболевания. При анализе данных частоты встречаемости определенных генотипов у пациентов с различной степенью проявления клинических симптомов инфекционного процесса показано, что у пациентов с ярко выраженной симптоматикой генотип F встречается в 6,0% случаев, генотип E- в 11%, генотип G- в 22%, генотип К- в 61%. У пациентов со стертой клинической картиной результаты были следующими: генотип F встречается в 12,5% случаев, генотип E- в 37,5%, генотип G- в 25%, генотип К- в 12,5%, генотип J- в 12,5%. При оценке значимости штаммов определённых генотипов для клинических проявлений инфекционного процесса с помощью 2- критерия Пирсона показано, что генотипы G, J, E и F следует считать незначимыми(2 < 2 05, р > 0,05); они с одинаковой частотой определяют выраженность клинической симптоматики (острая или стёртая форма). А генотип К- значим (2 > 2 05, р < 0,05), чаще всего определяет острое течение инфекции. Наблюдается взаимозависимость клинических проявлений с генотипами штаммов, утративших свойство экспрессии гена incA (является одним из факторов вирулентности). Так, отсутствие экспрессии регистрировалось у генотипа E, полученного от людей с хроническим воспалительными заболеваниями носоглотки. В работах, посвященных исследованию взаимозависимости урогенитальных серовариантов (генотипов) Ch. trachomatis с выраженностью клинических проявлений инфекции, представлены противоречивые результаты, что можно объяснить частично географическими вариациями, а также различиями в объёме исследований и популяционном составе. Не исключено, что данные различия могут быть связаны с определенными штаммами, которые нельзя различить на уровне серовариантов. Геномные сравнения серотипов помогают осветить неясные факты. Установление циркуляции определенных генотипов у человека, а также изучение антибиотикорезистентности штаммов Ch. trachomatis позволяет установить связь между клиникой проявления хламидийной инфекции и генотипом, определить оптимальный алгоритм лечения заболеваний урогенитального тракта.
Таблица 11. Генотипы и гены устойчивости к антибиотикам у штаммов Ch. trachomatis.
| п/п | Генотип Ch. trachomatis | Носительство плазмиды | Определение генов устойчивости к антибиотикам | Выраженность клинических проявлений | |
| Tet* | Erm* | ||||
| 1 | G | + | - | - | Острый уретрит, цервицит. Обильные выделения, жжение при мочеиспускании |
| 2 | E | + | - | + | Хронический уретрит. Дизурия. |
| 3 | G | + | - | + | Острый уретрит, цервицит. Обильные выделения, жжение при мочеиспускании |
| 4 | G | + | - | - | Острый цервицит. Обильные выделения. |
| 5 | G | + | - | - | Хронический уретрит. Дизурия. |
| 6 | F | + | - | - | Острый уретрит, цервицит. Обильные выделения, жжение при мочеиспускании |
| 7 | К | + | + | + | Острый уретрит, цервицит. Обильные выделения, жжение при мочеиспускании |
| 8 | G | + | + | - | Хронический цервицит. |
| 9 | К | + | - | + | Хронический цервицит. |
| 10 | G | + | - | - | Острый уретрит, жжение при мочеиспускании, выделения. |
| 11 | К | + | - | - | Острый уретрит, жжение при мочеиспускании, выделения. |
| 12 | F | + | - | - | Хронический уретрит. Дизурия. |
| 13 | J | + | - | - | Хронический уретрит. Дизурия. |
| 14 | E | + | + | + | Хронический цервицит. |
| 15 | К | + | + | + | Острый цервицит. Обильные выделения. |
| 16 | К | + | - | - | Острый уретрит, жжение при мочеиспускании, выделения. |
| 17 | К | + | - | - | Острый цервицит. Обильные выделения. |
| 18 | К | + | - | + | Острый цервицит. Обильные выделения. |
| 19 | К | + | - | - | Острый уретрит, жжение при мочеиспускании, выделения. |
| 20 | К | + | - | - | Острый цервицит. Обильные выделения. |
| 21 | К | + | - | - | Острый уретрит, жжение при мочеиспускании, выделения. |
| 22 | К | + | - | - | Острый уретрит, жжение при мочеиспускании, выделения. |
| 23 | К | + | - | - | Острый уретрит, жжение при мочеиспускании, выделения. |
| 24 | E | + | - | - | Хронический цервицит. |
| 25 | E | + | - | - | Острый уретрит, цервицит. Обильные выделения, жжение при мочеиспускании |
| 26 | E | + | - | - | Острый уретрит, цервицит. Обильные выделения, жжение при мочеиспускании |
Примечания:+- положительный результат;- – отрицательный результат; Tet*- ген устойчивости к тетрациклинам; Erm*- ген устойчивости к макролидам.
Таким образом, фенотипические свойства хламидий оказывают влияние на выраженность патогенетического процесса, клинических проявлений. При этом их воздействие определяется наличием и сочетанием отдельных патогенетических факторов (присутствие плазмиды, функциональное состояние гена IncA, принадлежность штамма хламидий к конкретному генотипу, одновременное инфицирование штаммами хламидий разными генотипами и возможность обменивание между ними генетической информацией с появлением другой разновидности хламидийного штамма).
Выводы:
1.Вторичный иммунодефицит при урогенитальной хламидийной инфекции на организменном уровне проявляется повышенной восприимчивостью к бактериальным (микоплазмы, доминирование двух биоваров уреаплазм) и вирусным агентам (к онкогенным типам вируса папилломы человека, ВПГ), высокой частотой выявления воспалительных процессов гениталий. На местном уровне (слизистые) отмечаются относительно слабо выраженная воспалительная реакция при остром и обострении хронического хламидиоза, угнетение нормофлоры (снижение частоты выявляемости и количественного содержания лактобацилл и бифидобактерий), сниженная реакция на условно-патогенную микрофлору, что в сочетании способствует нарушению колонизационной резистентности слизистых.
2.При остром урогентальном уреаплазмозе вторичный иммунодефицит на организменном уровне проявляется повышенной восприимчивостью к бактериальным (микоплазмы, уреаплазмы- преимущественно одного биовара, хламидии) и вирусным агентам (цитомегаловирусу, вирусам простого герпеса, вирусам папилломы человека), высокой частотой выявления воспалительных процессов гениталий. На местном уровне (слизистые) отмечаются угнетение нормофлоры (снижение количественного содержания лактобацилл и бифидобактерий), повышенная реакция на условно-патогенную микрофлору.
3.Уреаплазменная микст-инфекция сопровождается достоверным изменением микробиоценоза влагалища в зависимости от выраженности инфекционного процесса: снижением уровня протективной микрофлоры - лактобацилл, увеличением содержания условно-патогенных факультативно-анаэробных микроорганизмов в просветной области и облигатно-анаэробных микроорганизмов в пристеночной области влагалища.
4.При оценке микробиотопа влагалища больных уреплазмозом установлена достоверная корреляционная зависимость между изменением показателей микрофлоры влагалища, содержанием в вагинальном отделяемом IgG, IgA, sIgA, IgM и sc и выраженностью клинических проявлений.
5.При хламидийной инфекции установлено, что выявление в соскобном материале из уретры уровня экспрессии генов TLR-2 более 14 ОЕ и TLR-4 более 10 ОЕ, а в соскобном материале из цервикального канала TLR-2 более 19 ОЕ и TLR-4 более 14 ОЕ указывает на острый урогенитальный хламидиоз; выявление в соскобном материале из уретры уровня экспрессии генов TLR-2 не более 5 ОЕ и TLR-4 не более 5 ОЕ, а в соскобном материале из цервикального канала TLR-2 не более 6 ОЕ и TLR-4 не более 9 ОЕ указывает на хронический урогенитальный хламидиоз или начало хронизации инфекционного процесса.
6.Приведён механизм функционирования колонизационной резистентности слизистых: TLR слизистых через цитокиновую систему запускают местную воспалительную реакцию, определяют уровни IgG, sIgA и секреторного компонента (sc) и в купе с микрофлорой биотопа определяют колонизационную резистентность слизистых как части мукозального иммунитета.
8.Разработанные мультиплексные ПЦР-тест-системы для видовой дифференциации штаммов Chl. pneumoniae и Ch. trachomatis, для детекции плазмидных и бесплазмидных штаммов, а также праймеры для ПЦР-генотипирования штаммов Ch. trachomatis позволяют одновременно не только верифицировать возбудителей хламидиозов, но и осуществлять дифференциацию хламидий, оценивать вирулентность штаммов.
9.Установлено, что из 5 генотипов циркулирующих в Московском регионе штаммов Ch. trachomatis (К- 46,2%, G- 23,1%, Е- 19,2%, F- 7,7%, J- 3,8%) у женщин чаще встречаются генотип G (37,5%), генотип E (19%), генотип K (43,5%). При остром хламидиозе генотип G определяется в 22%, генотип E- в 11%, генотип К- в 61% случаев; при хроническом хламидиозе генотип G- в 25%, генотип E- в 37,5%, генотип К- в 12,5% случаев. В ассоциации всегда присутствует генотип К.
Практические рекомендации
1.При диагностике и установлении прогноза течения инфекционных заболеваний гениталий женщин необходимо и целесообразно оценить выраженность дисбиотических нарушений влагалища и цервикального канала как интегрального показателя местной антиинфекционной резистентности применяя предложенную оригинальную новую медицинскую технологию. Последняя позволяет судить о выраженности колонизационной резистентности слизистых как неотъемлемой части мукозального иммунитета.
2.При урогенитальном хламидиозе женщин количественная оценка экспрессии генов TLR-2 и TLR-4 по оригинальному разработанному способу позволяет судить о состоянии врождённого иммунитета и выявлять его нарушения, дополняет и повышает информативность, диагностическую и прогностическую значимость алгоритма верификации хламидийной инфекции.
3.Общепринятый алгоритм верификации возбудителя хламидийной инфекции необходимо расширить за счёт включения предложенных оригинальных мультиплексных ПЦР-тест-систем на одномоментное дифференцирование Chlamydia trachomatis и Chlamydophila pneumoniaе, одномоментное дифференцирование плазмидосодержащих и плазмидонегативных штаммов Chlamydia trachomatis, а также ПЦР-тест-системы с предложенными оригинальными праймерами на генотипы Chlamydia trachomatis и ПЦР-тест-системы для выявления антибиотикорезистетности штаммов хламидий.
Список работ, опубликованных по теме диссертации
1. Воропаева Е.А., Афанасьев С.С., Кудрявцева М.В., Алешкин В.А., Воробьев А.А., Несвижский Ю.В., Филатова Н.Г., Афанасьев М.С., Матвеевская Н.С. -Микроэкология и показатели гуморального иммунитета влагалища женщин с неспецифическими воспалительными заболеваниями гениталий // Журнал микробиологии, эпидемиологии и иммунобиологии.-2005.-№ 3.-С. 65-69.
2. Алёшкин В.А., Воропаева Е.А., Афанасьев С.С., Афанасьев М.С. - Микробиология и иммунология дисбиозов респираторного и урогенитального трактов // Аллергология и иммунология.- 2005.- Т. 6, № 3.- С. 354-355.
3. Воропаева Е.А., Афанасьев С.С., Алёшкин В.А., Кудрявцева М.В., Афанасьев М.С., Калмыков А.А., Денисов А.К., Мигранова О.М. - Применение Кипферона при лечении уреаплазмоза у женщин // Фарматека.-2006.-№ 10-С. 48-53.
4.Алёшкин В.А., Афанасьев С.С., Воропаева Е.А., Кудрявцева М.В., Афанасьев М.С., Байракова А.Л. - Чувствительность микрофлоры влагалища к антибиотикам при уреаплазмозе у женщин // Сборник материалов XIII Российского национального конгресса “Человек и лекарство”.-М., 2006.-С. 51.
5. Афанасьев С.С., Алёшкин В.А., Воропаева Е.А., Кудрявцева М.В., Афанасьев М.С., Матвеевская Н.С., Панурина Р.Л. - Иммуноглобулины влагалища при уреаплазмозе у женщин // Сборник материалов XIII Российского национального конгресса “Человек и лекарство”.-М., 2006.-С. 56-57.
6. Кудрявцева М.В., Воропаева Е.А., Афанасьев С.С., Алёшкин В.А., Афанасьев М.С., Матвеевская Н.С. - Лечение уреаплазмоза с применением иммуномодуляторов // Сборник материалов XIII Российского национального конгресса “Человек и лекарство”.-М., 2006.-С. 184-185.
7. Воропаева Е.А., Афанасьев С.С., Алёшкин В.А., Кудрявцева М.В., Афанасьев М.С. Микробиоценоз влагалища – критерий эффективности терапии // Сборник материалов XIII Российского национального конгресса “Человек и лекарство”.-М., 2006.-С. 96.
8. Воропаева Е.А., Афанасьев С.С., Алёшкин В.А., Воробьёв А.А., Матвеевская Н.С., Несвижский Ю.В., Афанасьев М.С., Кудрявцева М.В., Панурина Р.Л. - Микробиологические и иммунологические характеристики дисбиотических нарушений биотопов слизистых оболочек респираторного и урогенитального трактов // Вестник Российской академии медицинских наук.-2006.-№ 1.-С. 3-5.
9. Воропаева Е.А., Афанасьев С.С., Алешкин В.А., Воробьев А.А., Кудрявцева М.В., Несвижский Ю.А., Афанасьев М.С., Матвеевская Н.С., Панурина Р.Л. -Микробиологические и иммунологические критерии оценки эффективности лечения уреаплазмоза женщин // Журнал микробиологии, эпидемиологии и иммунобиологии.-2007-№ 2.-С. 65-70.
10. Макаров О.В., Алёшкин В.А., Савченко Т.Н., Афанасьев С.С., Воропаева Е.А., Ганковская Л.В., Хашукоева А.З., Бахарева И.В., Каюкова С.И., Протопопова Л.О., Афанасьев М.С., Гиммельфарб Е.И., Новикова Л.И. - Инфекции в акушерстве и гинекологии. Монография. // М., «МЕДпресс-информ».- 2007.- 464 с.
11. Алешкин В.А., Воропаева Е.А., Афанасьев С.С., Кудрявцева М.В., Афанасьев М.С., Матвеевская Н.С., Панурина Р.Л. - Уровни иммуноглобулинового профиля влагалища как прогностический тест при уреаплазмозе у женщин // Сборник материалов XIV Российского национального конгресса «Человек и лекарство».-М., 2007.-С. 45.
12. Воропаева Е.А., Афанасьев С.С., Алешкин В.А., Афанасьев М.С., Кудрявцева М.В. - Анализ лечения уреаплазмоза с применением иммуномодуляторов в динамике // Сборник материалов XIV Российского национального конгресса «Человек и лекарство».-М., 2007.-С. 74.
13. Воропаева Е.А., Афанасьев С.С., Алешкин В.А., Кудрявцева М.В., Афанасьев М.С., Калмыков А.А., Денисов А.К., Кондрашин Ю.И. - Об эффективности лечения хронического уреаплазмоза у женщин с использованием нового иммунологического препарата Кипферон // Трудный пациент.-2007.-Т. 5, № 1.-С. 28-33.
14. Воропаева Е.А., Алёшкин В.А., Макаров О.В., Афанасьев С.С., Савченко Т.Н., Протопопова Л.А., Несвижский Ю.В., Байракова А.Л., Матвиевская Н.С., Егорова Е.А., Метельская В.А., Гречишникова О.Г., Афанасьев М.С., Панурина Р.Л., Хашукоева А.З. - Микрофлора биотопов влагалища, ротоглотки и кишечника женщин с угрозой прерывания беременности на ранних сроках // Вестник РАМН.-2008.-№ 2.-С. 6-12.
15. Байракова А.Л., Воропаева Е.А., Афанасьев С.С., Алешкин В.А., Кафарская Л.И., Ефимов Б.А., Шкопоров А.Н., Гречишникова О.Г., Метельская В.А., Афанасьев М.С., Егорова Е.А. - Уровень экспрессии генов TLR-2 и TLR-4 как прогностический критерий излеченности при урогенитальном хламидиозе // Человек и лекарство: сборник материалов XV Российского национального конгресса.– М., 2008.-С. 387-388.
16. Гречишникова О.Г., Воропаева Е.А., Афанасьев С.С., Алешкин В.А., Метельская В.А., Байракова А.Л., Слободенюк В.В., Афанасьев М.С., Егорова Е.А. -Лабораторная база диагностики хламидиоза // Человек и лекарство: сборник материалов XV Российского национального конгресса.– М., 2008.-С. 430-431.
17. Байракова А.Л., Воропаева Е.А., Афанасьев С.С., Алешкин В.А., Кафарская Л.И., Ефимов Б.А., Шкопоров А.Н., Гречишникова О.Г., Метельская В.А., Афанасьев М.С., Егорова Е.А. - Уровни экспрессии генов TLR-2 и TLR-4 как показатели динамики патогенетических изменений при урогенитальном хламидиозе // Идеи Пастера в борьбе с инфекциями. Материалы четвертой международной конференции. – СПб, 2008. – С. 53.
18. Байракова А.Л., Воропаева Е.А., Афанасьев С.С., Егорова Е.А., Метельская В.А., Гречишникова О.Г., Афанасьев М.С., Рубальский О.В. - Роль и биологическое значение Толл-подобных рецепторов в антиинфекционной резистентности организма // Вестник РАМН. – 2008. – № 1. – С.45-54.
19. Караулов А.В., Афанасьев М.С., Байракова А.Л., Воропаева Е.А., Афанасьев С.С., Алешкин В.А., Кафарская Л.И., Шкопоров А.Н., Несвижский Ю.В., Леваков С.А. Прогностическая значимость экспрессии генов TLR-2 и TLR-4 при урогенитальном хламидиозе у женщин // Российский иммунологический журнал. – 2008. – Т. 2, № 2-3. – С. 178.
20. Алешкин В.А., Воропаева Е.А., Караулов А.В., Байракова А.Л., Афанасьев С.С., Кафарская Л.И., Несвижский Ю.В., Ефимов Б.А., Шкопоров А.Н., Гречишникова О.Г., Леваков С.А., Метельская В.А., Афанасьев М.С., Егорова Е.А., Слободенюк В.В., Фандеева Е.В. - Уровни экспрессии генов TLR-2 и TLR-4 как критерий оценки эффективности алгоритмов терапии при хламидиозе // Современные представления об иммунокоррекции. Материалы Всероссийской научно-практической конференции. – Пенза, 2008. – С.8-10.
21. Воропаева Е.А., Караулов А.В., Байракова А.Л., Афанасьев С.С., Алешкин В.А., Кафарская Л.И., Несвижский Ю.В., Ефимов Б.А., Шкопоров А.Н., Гречишникова О.Г., Леваков С.А., Метельская В.А., Афанасьев М.С., Егорова Е.А., Слободенюк В.В., Фандеева Е.В. - Связь уровней экспрессии генов TLR-2 и TLR-4 с изменениями микробиоценоза урогенитального тракта при урогенитальном хламидиозе у женщин // Иммунопатология, Аллергология, Инфектология. –2008 – № 2. – С.68-76.
22. Афанасьев С.С., Байракова А.Л., Воропаева Е.А., Алёшкин В.А., Караулов А.В., Кафарская Л.И., Несвижский Ю.В., Топтыгина А.П., Ефимов Б.А., Шкопоров А.Н., Гречишникова О.Г., Леваков С.А., Кострова О.М., Метельская В.А., Афанасьев М.С., Егорова Е.А., Слободенюк В.В., Фандеева Е.В. - Связь уровней экспрессии генов TLR-2 и TLR-4 с изменениями цитокинового профиля урогенитального тракта при урогенитальном хламидиозе у женщин // Естественные науки. – 2008 – № 4 (25). – С.62-73.
23. Метельская В.А., Алешкин В.А., Зверев В.В., Гречишникова О.Г., Воропаева Е.А., Афанасьев С.С., Несвижский Ю.В., Афанасьев М.С., Байракова А.Л., Егорова Е.А. Современные методы лабораторной диагностики хламидиозов // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2008 – № 4. – С.111-117.
24. Макаров О.В., Алёшкин В.А., Савченко Т.Н., Афанасьев С.С., Воропаева Е.А., Ганковская Л.В., Хашукоева А.З., Бахарева И.В., Каюкова С.И., Протопопова Л.О., Афанасьев М.С., Гиммельфарб Е.И., Новикова Л.И. Инфекции в акушерстве и гинекологии. – Монография, 2-е издание. // М., «МЕДпресс-информ».- 2009.- 464 с.
25. Гречишникова О.Г., Слободенюк В.В., Воропаева Е.А., Алешкин В.А., Афанасьев С.С., Метельская В.А., Байракова А.Л., Афанасьев М.С., Егорова Е.А. -Сравнительная характеристика методов лабораторной диагностики урогенитального хламидиоза у больных в зависимости от остроты клинических проявлений // Человек и лекарство: сборник материалов XVI Росс. Нац. конгресса – М, 6-10 апр. 2009. – С.76.
26. Гречишникова О.Г., Слободенюк В.В., Алешкин В.А., Лапин Б.А., Афанасьев С.С., Ликов В.Ф., Воропаева Е.А., Джикидзе Э.К., Несвижский Ю.В., Воложанцев Н.В., Полещук Н.Н., Светоч Э.А., Дятлов И.А., Афанасьев М.С., Рубальский О.В., Метельская В.А., Байракова А.Л., Рубанин Л.В., Егорова Е.А., Рубальский Е.О., Квачева З.Б., Евсегнеева И.В., Караулов А.В. - Фенотипическая характеристика штаммов хламидий, выделенных от человека и обезьян культуральным методом // Иммунопатология, Аллергология, Инфектология. –2009 – № 3. – С.44-53.
27. Слободенюк В.В., Алешкин В.А., Лапин Б.А., Афанасьев С.С., Кокушков Д.В., Гречишникова О.Г., Воропаева Е.А., Джикидзе Э.К., Несвижский Ю.В., Воложанцев Н.В., Светоч Э.А., Дятлов И.А., Афанасьев М.С., Рубальский О.В., Метельская В.А., Байракова А.Л., Егорова Е.А., Рубальский Е.О., Евсегнеева И.В., Караулов А.В. - ПЦР-детекция и идентификация возбудителей хламидийных инфекций человека и обезьян // Иммунопатология, Аллергология, Инфектология. –2009 – № 3. – С.54-62.
28. Слободенюк В.В., Караулов А.В., Алешкин В.А., Гречишникова О.Г., Афанасьев С.С., Лапин Б.А., Джикидзе Э.К., Несвижский Ю.В., Воложанцев Н.В., Светоч Э.А., Дятлов И.А., Воропаева Е.А., Афанасьев М.С., Метельская В.А., Егорова Е.А., Байракова А.Л. Генотипирование и анализ антибиотикорезистентности штаммов Chlamydia trachomatis, выделенных от человека и обезьян // Иммунопатология, Аллергология, Инфектология. –2009 – № 4. – С.74-81.
29. Слободенюк В.В., Алешкин В.А., Афанасьев С.С., Гречишникова О.Г., Воропаева Е.А., Афанасьев М.С., Метельская В.А., Байракова А.Л., Егорова Е.А., Лапин Б.А., Джикидзе Э.К., Караулов А.В., Несвижский Ю.В., Теплый Д.Л., Рубальский О.В., Рубальский Е.О. - Сравнительная характеристика методов верификации Chlamydia trachomatis у человека и обезьян // Естественные науки. – 2009 – № 1 (26). –С.65-71.
30. Байракова А.Л., Гречишникова О.Г., Алешкин В.А., Воропаева Е.А., Афанасьев С.С., Метельская В.А., Афанасьев М.С. - Уровни экспрессии генов TLR-2 и TLR-4 как способ оценки формы и прогноза течения урогенитальной хламидийной инфекции у женщин // Биологическая безопасность в современном мире. Материалы науч.-практ. конф. 21-22 апреля 2009, ФГУН ГНЦ ПМБ – Оболенск, С.98-100.
31. Афанасьев С.С., Алёшкин В.А., Байракова А.Л., Воропаева Е.А., Несвижский Ю.В., Кафарская Л.И., Егорова Е.А., Афанасьев М.С., Метельская В.А., Гречишникова О.Г., Куракова А.А. - Молекулярные механизмы индукции врождённого иммунитета // Вестник РАМН. – 2009 – № 4. – С.42-49.
32. Алешкин В.А., Караулов А.В., Байракова А.Л., Афанасьев С.С., Воропаева Е.А., Кафарская Л.И., Несвижский Ю.В., Ефимов Б.А., Шкопоров А.Н., Афанасьев М.С., Гречишникова О.Г., Леваков С.А., Метельская В.А., Матвеевская Н.С., Панурина Р.Л., Егорова Е.А., Слободенюк В.В., Фандеева Е.В. - Связь уровней МРНК TLR-2 и TLR-4 с изменениями иммуноглобулинового профиля урогенитального тракта при урогенитальном хламидиозе у женщин // Иммунология. – 2009. – Т. 30, № 3. – С.165-170.
33. Байракова А.Л., Афанасьев С.С., Воропаева Е.А., Алёшкин В.А., Фандеева Е.В., Афанасьев М.С., Гречишникова О.Г., Метельская В.А., Слободенюк В.В. - Экспрессия гена TLR-2 как показатель состояния локального иммунитета у женщин с урогенитальной хламидийной инфекцией // Научное обеспечение противоэпидемической защиты населения: сборник материалов юбилейной Всероссийской науч.-практ. конференции – Нижний-Новгород, 2009. – С.172-173.
34. Воропаева Е. А., Караулов А.В., Афанасьев С.С., Алёшкин В.А., Макаров О.В., Несвижский Ю.В., Афанасьев М.С., Матвеевская Н.С., Савченко Т.Н., Рубальский О.В. - Оценка микробиоценоза влагалища при инфекционных и других заболеваниях женской половой сферы. Разрешение на применение новой медицинской технологии. Серия АА. № 0001997. ФС № 2009/187 от 17.07.2009.
35. Топтыгина А.П., Афанасьев С.С., Байракова А.Л., Воропаева Е.А., Алёшкин В.А., Кафарская Л.И., Афанасьев М.С., Фандеева Е.В. - Особенности индукции местного иммунного ответа у больных урогенитальным хламидиозом // Российский иммунологический журнал.-2009.-Том 3(12), № 2.-С. 171-176.
36. Слободенюк В.В., Караулов А.В., Алешкин В.А., Гречишникова О.Г., Афанасьев С.С., Лапин Б.А., Джикидзе Э.К., Несвижский Ю.В., Воложанцев Н.В., Светоч Э.А., Дятлов И.А., Воропаева Е.А., Афанасьев М.С., Алешкин А.В., Метельская В.А., Егорова Е.А., Байракова А.Л. Изучение генотипов и антибиотикорезистентности штамммов Chlamydia trachomatis, выделенных от человека и обезьян // Человек и лекарство: сборник материалов XVII Росс. Нац. Конгресса, М, 12-16 апр.2010. – С.719.
37. Гречишникова О.Г., Алешкин В.А., Афанасьев С.С., Слободенюк В.В., Караулов А.В., Несвижский Ю.В., Рубальский О.В., Воропаева Е.А., Афанасьев М.С., Метельская В.А., Байракова А.Л., Егорова Е.А., Рубальский Е.О. - Сравнительный анализ прямых методов лабораторной диагностики урогенитального хламидиоза // Астраханский медицинский журнал. – 2010 – Т. 5., № 2. – С.80-86.
38. Байракова А.Л., Воропаева Е.А., Алёшкин В.А., Афанасьев С.С., Караулов А.В., Кафарская Л.И., Несвижский Ю.В., Ефимов Б.А., Шкопоров А.Н., Гречишникова О.Г., Леваков С.А., Метельская В.А., Афанасьев М.С., Егорова Е.А., Слободенюк В.В., Фандеева Е.В. - Уровни экспрессии TLR-2 и TLR-4 как прогностический критерий излеченности при хламидиозе // Эпидемиология и инфекционные болезни.-2010.-№ 4.-С. 35-42.
39. Karaulov Alexander, Aleshkin Vladimir, Slobodenyuk Vladimir, Grechishnikova Olga, Afanasyev Stanislav, Lapin Boris, Dzhikidze Eteri, Nesvizhsky Yuriy, Voropayeva Elena, Afanasyev Maxim, Aleshkin Andrei, Metelskaya Valeria, Yegorova Ekaterina, Bayrakova Alexandra. - Identification of Phylogenetic Position in the Chlamydiaceae Family for Chlamydia Strains Released fromMonkeys and Humans with Chlamydial Pathology // Infectious Diseases in Obstetrics and Gynecology. – Volume 2010, Article ID 130760, 11 pages.
40. Slobodenuk V.V., Aleshkin V.A., Lapin B.A., Karaulov A.V., Afanasiev S.S., Grechishnikova O.G., Voropaeva E.A., Jikidze E.K, Nesvizskii U.V., Afanasiev M.S., Metelskaia V.A., Birakova A.L., Egorova E.A. - The comparative estimation of diagnostic value of laboratory methods for urogenital chlamydiosis in humans and monkeys // FEMS 2009, 3rd Congress of European Microbiologists. Gothenburg, Sweden, June 28-Juli 2, 2009.
41. Афанасьев М.С., Караулов А.В., Алёшкин В.А., Афанасьев С.С., Несвижский Ю.В., Воропаева Е.А. - Роль врождённого иммунитета и микроорганизмов биотопов слизистых оболочек урогенитального тракта женщин в патогенезе хламидийной инфекции // Сеченовский Вестник.- 2010.-№ 2 (2).-С. 64-69.
42. Караулов А.А., Афанасьев М.С., Алёшкин В.А., Афанасьев С.С., Воропаева Е.А. Колонизационная резистентность слизистых цервикального канала как неотъемлемая составляющая местного иммунитета // Иммунология.-2011.-Том 32, № 1.-С. 11-15.
43. Афанасьев М.С., Караулов А.В., Алёшкин В.А., Галимзянов Х.М., Афанасьев С.С., Воропаева Е.А., Несвижский Ю.В., Рубальский Е.О., Егорова Е.А. - Микробиотоп влагалища и его патогенетическая роль при уреаплазмозе и хламидиозе // Астраханский медицинский журнал. – 2011 – Т. 6, № 1. – С. 137-142.
44. Алёшкин В.А., Галимзянов Х.М., Афанасьев С.С., Караулов А.В., Несвижский Ю.В., Воропаева Е.А., Афанасьев М.С. Нарушение микробиоценозов у детей: многоцентровое исследование. Сообщение II. Микробиоценоз и дисбактериоз влагалища у девочек // Астраханский медицинский журнал. – 2011 – Т. 6, № 1. – С. 222-225.
Патенты РФ на изобретение
45. Пат. № 2249821 Российская Федерация МПК G 01 N 33/48. - Способ оценки микробиоценоза влагалища / Е.А. Воропаева, С.С. Афанасьев, В.А. Алешкин, А.А. Воробьев, Ю.В. Несвижский, О.В. Рубальский, Н.Г. Филатова, М.В. Кудрявцева, М.С. Афанасьев, Н.С. Матвеевская; заявитель и патентообладатель ГУ МНИИЭМ им. Г.Н. Габричевского Минздрава РФ.-№ 2004112817; заявл. 27.04.2004; зарег. 10.04.2005.
46. Пат. № 2327995 Российская Федерация. - Способ диагностики хронического урогенитального хламидиоза / А.Л. Байракова, В.А. Алешкин, Е.А. Воропаева, С.С.Афанасьев, Л.И. Кафарская, О.М. Кострова, Ю.В. Несвижский, О.В. Рубальский, О.Г.Гречишникова, В.А. Метельская, А.Н. Шкопоров, Б.А. Ефимов, А.А. Куракова, Е.А. Егорова, К.В. Поздняков, М.С. Афанасьев, А.М. Затевалов, Е.В. Хохлова; заявитель и патентообладатель ФГУН МНИИЭМ им. Г.Н. Габричевского Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. – № 2007123483; заявл. 25.06.2007; опубл. 27.06.2008., Бюл. № 18.-3 с.
47. Пат. № 2385945 Российская Федерация МПК C 12 Q 1/68. Способ прогнозирования манифестной или стертой формы хламидийной инфекции человека или обезьян и набор для его осуществления / В.В. Слободенюк, В.А. Алешкин, С.С.Афанасьев, Б.А. Лапин, Е.А. Воропаева, В.А. Баннов, О.М. Кострова, А.В. Караулов, Э.К. Джикидзе, Н.В. Воложанцев, И.А. Дятлов, Э.А. Светоч, О.Г. Гречишникова, В.А. Метельская, А.Л. Байракова, М.С. Афанасьев, Е.А. Егорова, О.В. Рубальский, Д.С. Афанасьев, Е.О. Рубальский, Ю.Н. Урбан, А.Н. Куракова; заявитель и патентообладатель ФГУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора.-№ 2008151548/13; заявл. 26.12.2008; зарег. во ФГУП «Роспатент» 10.04.2010.
48. Пат. № 2385946 Российская Федерация МПК C 12 Q 1/68. Способ диагностики хламидийной инфекции человека или обезьян и набор для его осуществления / В.В. Слободенюк, В.А. Алешкин, С.С.Афанасьев, Б.А. Лапин, Е.А. Воропаева, В.А. Баннов, О.М. Кострова, А.В. Караулов, Э.К. Джикидзе, Н.В. Воложанцев, И.А. Дятлов, Э.А. Светоч, О.Г. Гречишникова, В.А. Метельская, А.Л. Байракова, М.С. Афанасьев, Е.А. Егорова, О.В. Рубальский, Д.С. Афанасьев, Е.О. Рубальский, Ю.Н. Урбан, А.Н. Куракова; заявитель и патентообладатель ФГУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора.-№ 2008151550/13; заявл. 26.12.2008; зарег. во ФГУП «Роспатент» 10.04.2010.
Список сокращений
ВЗОМТ – воспалительные заболевания органов малого таза
ВИЧ – вирус иммунодефицита человека
ВПГ – вирус простого герпеса
ВПЧ – вирус папилломы человека
ИППП – инфекции, передаваемые половым путем
ИФА – иммуноферментный анализ
КИП – комплексный иммуноглобулиновый препарат
КОЕ – колониеобразующая единица
КР – колонизационная резистентность
КС – антитела - комплементсвязывающие антитела
НГУ – негонококковый уретрит
ПЦР – полимеразная цепная реакция
РСК – реакция связывания комплемента
УЗИ – ультразвуковое исследование
УПМ – условно-патогенная микрофлора
ЦМВ – цитомегаловирус
ЦОЕ – цветообразующая единица
Ig – иммуноглобулин
IgA – иммуноглобулин A
IgG – иммуноглобулин G
IgM – иммуноглобулин M
sc – свободный секреторный компонент
sIgA – секреторный иммуноглобулин А
УГХ – урогенитальный хламидиоз.
ИППП – инфекции, передаваемые половым путём.
УГТ – урогенитальный тракт.
TLR (Toll-like receptor) – Toll-подобные рецепторы.
ЭТ – элементарные тельца.
РТ – ретикулярные тельца.
ПР – промежуточное тельце.
Цк – цервикальный канал.
Ур – уретра.
Вл – влагалище.
ЦC – цервикальный секрет.
IL – интерлейкин.
TNF- – фактор некроза опухолей альфа.
IFN - – интерферон альфа.
IFN - –интерферон гамма.
GM-CSF – гранулоцит макрофаг колониестимулирующий фактор.
PAMP – консервативные молекулярные структуры.
PRR – образ распознающие рецепторы.
НК – нормальные клетки-киллеры.
DC – дендритные клетки.
CD – клеточные рецепторы.
РИФ – реакция прямой иммунофлуоресценции.
РИД – радиальная иммунодиффузия по Манчини.
Ат – антитела.
DNA – дезоксирибонуклеиновая кислота.
LPS – липополисахарид.
ЛЦР – лигазная цепная реакция.
НИФ – реакция непрямой иммунофлуоресценции.
ПДРФ – полиморфизм длины рестрикционных фрагментов.
ПИФ – реакция прямой иммунофлуоресценции.
РНГА – реакция непрямой гемагглютинации.
RNA – рибонуклеиновая кислота.
rRNA – рибосомальная РНК.
МОМР – (major outer membrane protein) – основной белок наружной мембраны.
ORF – (open reading frame) – открытая рамка считывания.

