Влияние базального уровня экспрессии генов эндонуклеаз serratia marcescens и anabaena sp. на свойства рекомбинантных штаммов escherichia coli
На правах рукописи
Крякунова Елена Вячеславовна
ВЛИЯНИЕ БАЗАЛЬНОГО УРОВНЯ ЭКСПРЕССИИ ГЕНОВ
ЭНДОНУКЛЕАЗ SERRATIA MARCESCENS И ANABAENA SP. НА
СВОЙСТВА РЕКОМБИНАНТНЫХ ШТАММОВ ESCHERICHIA COLI
03.02.03 – микробиология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Казань – 2011
Работа выполнена в лаборатории биохимической генетики ФГАОУВПО «Казанский (Приволжский) федеральный университет»
Научный руководитель: кандидат биологических наук, доцент
Гимадутдинов Олег Александрович
Официальные оппоненты: доктор биологических наук, заведующий лабораторией
Коксин Владимир Петрович
кандидат биологических наук, доцент
Вершинина Валентина Ивановна
Ведущая организация: Казанский институт биохимии и биофизики КНЦ РАН.
Защита диссертации состоится 27 октября 2011 г. в 13.00 часов на заседании диссертационного совета Д 212.081.08. при ФГАОУВПО «Казанский (Приволжский) федеральный университет» по адресу: 420008, г. Казань, ул. Кремлевская, 18, главное здание, ауд. 211.
С диссертацией можно ознакомиться в научной библиотеке им. Н. И. Лобачевского при ФГАОУВПО «Казанский (Приволжский) федеральный университет» по адресу: 420008, г. Казань, ул. Кремлевская, 35. e-mail: [email protected]
Автореферат разослан _______________________ 2011 г.

Ученый секретарь
диссертационного совета,
доктор биологических наук З.И. Абрамова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Значительный прогресс в производстве ряда важных для человека белков в промышленных масштабах был достигнут благодаря применению генно-инженерных методов для создания соответствующих рекомбинантных микроорганизмов. Сверхсинтез белка в таких микроорганизмах может осуществляться как в результате повышения количества копий гена в клетке, так и в результате повышения интенсивности его транскрипции. Однако до настоящего времени нет общей теории, позволяющей предсказать уровень экспрессии того или иного гена в гетерологичной клетке, а большинство используемых в настоящее время генно-инженерных конструкций допускают слабую экспрессию клонированного гена даже в присутствии репрессора. В результате такой экспрессии происходит синтез репрессируемого белка в небольших количествах – так называемый базальный уровень экспрессии гена [Bahar et al., 2011].
В последние годы эндонуклеазы Serratia marcescens (NucSma) и Anabaena sp. (NucA) находят широкое применение в биохимии, молекулярной биологии, медицине и сельском хозяйстве. Эти ферменты принадлежат к одному семейству родственных эндонуклеаз, активные сайты которых имеют одинаковую высококонсервативную аминокислотную последовательность, так называемый DRGH-мотив [Pingoud et al., 1999]. К настоящему времени изучено большинство функционально значимых аминокислотных остатков в DRGH-мотиве, описаны пространственная структура и механизм действия данных ферментов [Meiss et al., 1998; Chen et al., 2009]. Хотя на сегодняшний день эндонуклеазам NucSma и NucA приписывается лишь трофическая функция, но известно, что другие представители этого семейства эндонуклеаз принимают участие в репликации, репарации и рекомбинации ДНК [Dake et al., 1988; Ruiz-Carillo et al., 1993; Rangarajan et al., 2002]. Также было показано, что экзогенные ДНКаза I и эндонуклеаза NucSma в малых дозах усиливают пролиферативные процессы в микробной клетке, а именно синтез ДНК и деление клеток [Куприянова-Ашина, 1991]. К настоящему времени гены эндонуклеаз NucSma и NucA проклонированы в клетках Escherichia coli [Ball et al., 1987; Гимадутдинов и др., 1993; Meiss et al., 1998], однако до сих пор не известно, как базальный уровень экспрессии генов эндонуклеаз NucSma и NucA влияет на свойства гетерологичных клеток.
Цель и задачи исследования. Цель настоящей работы – определить влияние базального уровня экспрессии генов исходных и мутантных вариантов эндонуклеаз Serratia marcescens (NucSma) и Anabaena sp. (NucA) на свойства рекомбинантных штаммов Escherichia coli.
В соответствие с данной целью были поставлены следующие задачи:
- Определить наличие базального уровня экспрессии генов исходных и мутантных вариантов эндонуклеаз NucSma и NucA в рекомбинантных штаммах E. coli LK111 и E. coli TGE900.
- Сконструировать референс-плазмиду с известным числом копий для косвенного определения количества содержащихся в рекомбинантных штаммах E. coli LK111 и E. coli TGE900 генов bla по количеству синтезируемой клетками -лактамазы.
- Установить зависимость между количеством генов bla в плазмидах, количеством синтезируемой -лактамазы, уровнем устойчивости к ампициллину и активностью исходных и мутантных вариантов эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов в рекомбинантных штаммах E. coli LK111 и E. coli TGE900.
- Изучить влияние базального уровня экспрессии генов исходных и мутантных вариантов эндонуклеаз NucSma и NucA на выживаемость рекомбинантных штаммов E. coli LK111 и E. coli TGE900.
- Установить влияние базального уровня экспрессии генов исходных и мутантных вариантов эндонуклеаз NucSma и NucA на стабильность наследования плазмид pHisNucSma и pHisNucA в рекомбинантных штаммах E. coli LK111 и E. coli TGE900.
- Установить зависимость уровня устойчивости рекомбинантных штаммов E. coli LK111 и E. coli TGE900 к ингибиторам репликации ДНК от активности исходных и мутантных вариантов эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов.
Научная новизна работы. Впервые показано, что величина базального уровня экспрессии генов исходных и мутантных вариантов эндонуклеаз NucSma и NucA зависит как от клетки-хозяина, так и от плазмиды. Установлено, что базальный уровень экспрессии генов исходных и мутантных вариантов NucSma и NucA оказывает положительное воздействие на выживаемость бактерий. Получена референс-плазмида рЕТсосоAmpCm для косвенного определения количества генов bla по количеству синтезируемой бактериальной клеткой -лактамазы. Установлено, что в клетках рекомбинантных штаммов E. coli LK111 и E. coli TGE900 количество генов bla в плазмидах pHisNucSma и pHisNucA зависит от активности исходных и мутантных вариантов эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов. Впервые показана возможность участия эндонуклеаз NucSma и NucA в репликации плазмидной ДНК в рекомбинантных штаммах E. coli.
Научно-теоретическая и практическая значимость работы. Полученные в работе результаты вносят вклад в понимание способов регуляции экспрессии клонируемого гена в гетерологичной клетке и возможностей достижения сверхсинтеза его продукта. Полученные данные можно использовать для дальнейших исследований в области промышленной микробиологии для оптимизации синтеза эндонуклеаз NucSma и NucA рекомбинантными штаммами. Встраивание под сильный промотор гена клонируемого белка в одну плазмиду с геном исходного варианта эндонуклеазы NucSma в результате их совместной транскрипции в рекомбинантном штамме E.coli TGE900 даст возможность получать данный белок в промышленных масштабах. Сконструированная в данной работе референс-плазмида может использоваться для косвенного определения количества генов bla в клетках микроорганизмов, а, следовательно, и количества копий плазмид, содержащих эти гены. Результаты исследования и примененные в работе методические приемы можно использовать при проведении практических и лекционных занятий по микробиологии и генетике микроорганизмов для студентов-биологов.
Положения, выносимые на защиту:
- Увеличение активности исходных и мутантных вариантов эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов повышает устойчивость рекомбинантных штаммов E. coli LK111 и E. coli TGE900 к ампициллину.
- С увеличением активности исходных и мутантных вариантов эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов увеличивается количество плазмид pHisNucSma и pHisNucA в клетках рекомбинантных штаммов E. coli LK111 и E. coli TGE900.
- Экспрессия генов исходных и мутантных вариантов эндонуклеаз NucSma и NucA на базальном уровне оказывает положительное влияние на выживаемость рекомбинантных штаммов E. coli LK111 и E. coli TGE900.
- С увеличением активности исходных и мутантных вариантов эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов в рекомбинантных штаммах E. coli LK111 и E. coli TGE900 плазмиды pHisNucSma и pHisNucA наследуются более стабильно.
- Увеличение активности исходных и мутантных вариантов эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов повышает устойчивость рекомбинантных штаммов E. coli LK111 и E. coli TGE900 к налидиксовой кислоте.
Апробация работы. Основные положения диссертационной работы были представлены на XII Всероссийской научно-практической конференции «Молодые ученые в медицине» (Казань, 2007); II Международной научно-практической конференции «Постгеномная эра в биологии и проблемы биотехнологии» (Казань, 2008); First Interuniversity Conference on Modern Biology «Building the Future in Biology «Bio-News»» (Kazan, 2008); II Всероссийском с международным участием конгрессе студентов и аспирантов-биологов «Симбиоз Россия 2009» (Пермь, 2009); V съезде вавиловского общества генетиков и селекционеров (Москва, 2009); научно-практической конференции «Становление и достижения биохимической школы Казанского университета» (Казань, 2009); 2-ой Московской международной конференции «Молекулярная филогенетика MolPhy-2» (Москва, 2010); конференции «Наука в информационном пространстве» (Днепропетровск, 2010)
Публикации. По теме диссертации опубликовано 12 научных работ, в том числе 4 статьи, из которых 2 – в журналах, рекомендованных ВАК.
Структура и объем диссертации. Диссертация изложена на 123 страницах и состоит из введения, обзора литературы, описания материалов и методов исследования, результатов исследования и их обсуждения, заключения, выводов и списка литературы. Работа содержит 35 рисунков и 5 таблиц. Список литературы включает 168 источников, из них 135 зарубежных.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования служили плазмиды pHisNucA (содержат ген исходного или мутантных вариантов эндонуклеазы NucA, обладающих следующими нуклеазными активностями: 0% при мутации His124Ala, 1% – Trp159Ala, 10% – Arg122Ala и 100% – wt) [Meiss et al., 2000] и pHisNucSma (содержат ген исходного или мутантных вариантов эндонуклеазы NucSma, обладающих следующими нуклеазными активностями: 0% при мутации His89Ala, 35% – Arg57Ala и 100% – wt) [Friedhoff et al., 1994b]. В качестве клеток-хозяев для данных плазмид использовали штаммы E. coli LK111 (rk-mk+, thi-1, thr-1, leuB6, tonA21, supE44, lacIqYZM15, Hfr, Amps, +) [Friedhoff et al., 1994a], в хромосоме которого находится ген С1-репрессора фага, и E. coli TGE900 (su-1, ilv-1, Amps, bio[c1857BamH1]) [Friedhoff et al., 1994a], содержащий в хромосоме мутантный ген термочувствительного С1857-репрессора фага [Remaut et al., 1981; Valdez-Gruz et al., 2010]. В результате клонирования гена bla в плазмиду pETcocoCm (lacI-pT7lacO-MCS-tT7, RecA–, EndA–, F–, AmpS) [Sektas et al., 2002] была получена референс-плазмида pETcocoAmpCm. Ген bla был получен с помощью ПЦР-реакции из плазмиды pBlueScript SK+ (lacPOZ’, AmpR) фирмы Stratagene [McEvoy et al., 1990]. Хозяином для референс-плазмиды служил штамм E. coli DH5 (80d, lacZM15, endA1, recA1, hsdR17, supE44, thi-1, gyrA, relA1, Amps, F- [lacZYA-argF]) [Gibert et al., 1990].
Клетки рекомбинантных штаммов E. coli LK111 и E. coli TGE900 выращивали на среде LB при температуре культивирования 30°С. Для создания селективных условий в среду добавляли ампициллин в концентрации 100 мкг/мл [Sambrook et al., 1989]. Рекомбинантный штамм E.coli DH5 pETcocoAmpCm выращивали на среде LB с добавлением ампициллина в концентрации 50 мкг/мл и 0,2% D-глюкозы (или 0,01% L-арабинозы). Активности исходных и мутантных вариантов эндонуклеаз NucSma и NucA определяли с помощью индикаторного агара, содержащего толуидиновый голубой и высокомолекулярную ДНК [Meiss et al., 2001].
Трансформацию компетентных клеток плазмидной ДНК проводили методом теплового шока. Плазмиды из рекомбинантных штаммов выделяли методом щелочного лизиса. Содержание плазмидной ДНК в рекомбинантных штаммах оценивалось с помощью электрофореза в агарозном геле. Содержание эндонуклеаз в рекомбинантных штаммах определялось с помощью электрофореза в полиакриламидном геле [Sambrook et al., 1989]. Оптическую плотность суспензии клеток измеряли на ФЭК при длине волны 590 нм. Клетки разрушали на УЗДИ (5 повторностей по 15 с с интервалом 10 с). Концентрацию плазмидной ДНК определяли с помощью спектрофотометра NanoDrop-1000.
Клонирование гена bla из плазмиды pBluescriptSK+ в плазмиду pETcocoCm проводилось по сайту BstZ171 с помощью ПЦР с использованием праймеров, имеющих на концах сайты рестрикции BstZ171. ПЦР-реакцию проводили на приборе «Тэрцик» (ТР4 – ПЦР01) фирмы «ДНК-технология» согласно протоколу фирмы Promega. Фрагменты гена bla очищались с помощью набора Promega Wizard® SV Gel and PCR Clean-Up System, анализировались методом электрофореза в 1% ТВЕ-буфере и затем выделялись из реакционной смеси методом препаративного электрофореза. Рестрикция плазмиды pETcocoCm проводилась по сайту BstZ171 согласно протоколу фирмы «Fermentas». Лигирование гена bla с линейной формой pETcocoCm проводилось по сайтам BstZ171 с помощью набора «DNA Ligation Kit» согласно протоколу фирмы Sigma. Скрининг плазмиды pETcocoAmpCm на наличие гена bla проводился с помощью ПЦР среди устойчивых к ампициллину клонов E.coli DH5 pETcocoAmpCm.
Индукцию экспрессии генов исходных и мутантных вариантов эндонуклеаз NucSma и NucA в рекомбинантных штаммах E.coli TGE900 проводили посредством 4-часового культивирования при 37°С клеток, достигших А590 = 0,5 при температуре выращивания 30°С [Friedhoff et al., 1994a]. Концентрацию жизнеспособных клеток в 1 мл культуры вычисляли по числу выросших на чашках колоний [Белов, 1985]. Определение минимальной ингибирующей концентрации антибиотиков проводилось на градиентных средах по стандартной методике [Barth et al., 1978]. Определение количества -лактамазы в рекомбинантных штаммах проводилось методом йодометрического титрования [Perret, 1954]. Элиминацию плазмид из рекомбинантных штаммов осуществляли при отсутствии ампициллина в среде [Mikesell et al., 1983]. Частоту элиминации рассчитывали по числу колоний, утративших способность расти на средах с ампициллином.
Статистический анализ данных проводился с использованием стандартных математических методов в программах «Statgraphics Plus» и «Microsoft Excel».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
- Экспрессия генов исходных и мутантных вариантов эндонуклеаз в рекомбинантных штаммах E.coli. Для получения рекомбинантных штаммов, содержащих гены исходных и мутантных вариантов эндонуклеаз NucSma и NucA, проводилась трансформация чувствительных к ампициллину штаммов E.coli LK111 и E.coli TGE900 плазмидами pHisNucSma и pHisNucA. После трансформации наличие плазмид в рекомбинантных штаммах E.coli LK111 и E.coli TGE900 было подтверждено с помощью электрофореза плазмидной ДНК, выделенной из приобретших устойчивость к ампициллину клонов.
В дальнейших экспериментах было доказано, что синтез эндонуклеаз NucSma и NucA в рекомбинантных штаммах E.coli TGE900 значительно увеличивается после 4 часов культивирования при 37°С клеток, достигших экспоненциальной фазы роста (рис. 1). В свою очередь, синтез нуклеаз рекомбинантными штаммами E.coli LK111 не индуцировался посредством температуры, так как исходная форма С1-репрессора в данных штаммах, в отличие от мутанта С1857 в клетках E.coli TGE900, не является температурочувствительной.

Рис. 1. Электрофоррограмма белков, выделенных из рекомбинантных штаммов E.coli TGE900: четные полосы – без индукции; нечетные полосы – после индукции (показано по 1 результату для каждого рекомбинантного штамма).
1 – маркерные белки фирмы “Merck IV”; 2, 3 – NucSma His89Ala;
4, 5 – NucSma Arg57Ala; 6, 7 – NucSma wt; 8, 9 – NucA His124Ala;
10, 11 –NucA Trp159Ala; 12, 13 – NucA Arg122Ala; 14, 15 – NucA wt.
Для доказательства наличия базального уровня экспрессии генов исходных и мутантных вариантов эндонуклеаз NucSma и NucA в гетерологичных клетках E.coli методом индикаторных сред определяли нуклеазную активность рекомбинантных штаммов E.coli LK111 и E.coli TGE900, не подвергшихся температурной индукции. Одинаковое количество культур клеток рекомбинантных штаммов E.coli LK111 и E.coli TGE900, предварительно разрушенных ультразвуком, точечно наносили на индикаторный агар и оставляли на сутки. Контролем в эксперименте служили бесплазмидные штаммы E.coli LK111 и E.coli TGE900, не проявляющие на индикаторном агаре нуклеазной активности. В результате эксперимента было установлено, что чем выше активность мутантной нуклеазы, тем большая зона с измененной окраской образуется на индикаторной среде в месте нанесения пробы. Поскольку зоны обесцвечивания наибольшего размера на индикаторной среде образовывали исходные формы эндонуклеаз NucSma и NucA, то активности этих нуклеаз принимали за 100% (рис. 2).




Рис. 2. Размеры зон обесцвечивания, образуемые на индикаторной среде
исходными и мутантными вариантами эндонуклеаз при базальном уровне
экспрессии их генов:
а) NucSma в E. coli LK111; б) NucSma в E. coli TGE900; в) NucA в E. coli LK111; г) NucA в E. coli TGE900.
Таким образом, основываясь на полученных результатах, можно заключить, что в гетерологичных клетках E.coli гены исходных и мутантных вариантов эндонуклеаз NucSma и NucA экспрессируются на базальном уровне.
- Влияние базального уровня экспрессии генов исходных и мутантных вариантов эндонуклеаз на выживаемость клеток-хозяев. Как известно, введение клонированного гена в составе вектора в бактериальную клетку может оказывать как положительное, так и отрицательное влияние на свойства клетки-хозяина и самого вектора. С одной стороны, векторная ДНК сообщает клетке новые свойства, дающие ей селективные преимущества, но, с другой стороны, сверхсинтез продукта чужеродного гена оказывает негативное влияние на скорость роста и деление микробной клетки вследствие увеличения метаболической нагрузки из-за синтеза нового продукта [Goldwin et al., 1979; Su et al., 1990]. Поэтому необходимо было изучить влияние базального уровня экспрессии генов исходных и мутантных вариантов эндонуклеаз NucSma и NucA на выживаемость рекомбинантных штаммов E.coli LK111 и E.coli TGE900. Выживаемость рассчитывалась как количество жизнеспособных клеток (способных образовывать колонии) в 1 мл культуры рекомбинантного штамма относительно количества жизнеспособных клеток соответствующего бесплазмидного штамма (контроль, выживаемость которого принималась за 100%).
В результате проведенных экспериментов было установлено, что при базальном уровне экспрессии гена исходной формы эндонуклеазы NucSma и гена мутантного варианта эндонуклеазы NucSma с 35% нуклеазной активностью (мутация Arg57Ala) количество жизнеспособных клеток в культурах рекомбинантных штаммов E.coli LK111 и E.coli TGE900 увеличивается относительно соответствующих бесплазмидных штаммов, т.е. экспрессия данных генов на базальном уровне оказывает положительный эффект на выживаемость рекомбинантных штаммов (рис. 3). Было показано, что базальный уровень экспрессии генов мутантных эндонуклеаз NucA с 1% и 10% нуклеазной активностью (Trp159Ala и Arg122Ala) также оказывает положительный эффект на выживаемость рекомбинантных штаммов, увеличивая количество жизнеспособных клеток в культуре относительно контроля. В отличие от описанных выше мутантных вариантов NucA, базальный уровень экспрессии гена эндонуклеазы NucA дикого типа отрицательно сказывается на




выживаемости рекомбинантных штаммов E.coli LK111 и E.coli TGE900, что выражается в снижении количества жизнеспособных клеток в культуре относительно контроля на протяжении всего времени культивирования. Подобный эффект, скорее всего, объясняется высокой токсичностью исходной формы эндонуклеазы NucA для синтезирующих ее бактерий [Meiss et al., 1998]. В свою очередь, наблюдаемое снижение количества жизнеспособных клеток в культурах рекомбинантных штаммов E.coli LK111 и E.coli TGE900 относительно контроля при базальном уровне экспрессии генов мутантных вариантов эндонуклеаз NucSma и NucA, не обладающих нуклеазной активностью (мутации His89Ala и His124Ala соответственно), может объясняться негативным последствием дополнительной метаболической нагрузки, оказываемой на клетку при синтезе чужеродного белка [Goldwin et al., 1979; Su et al., 1990]
Таким образом, исходя из полученных результатов экспериментов, можно сделать предположение, что наблюдаемое увеличение количества жизнеспособных клеток в культурах рекомбинантных штаммов E.coli LK111 и E.coli TGE900 при базальном уровне экспрессии генов исходного и мутантных вариантов эндонуклеазы NucSma и мутантных вариантов эндонуклеазы NucA может свидетельствовать о том, что данные нуклеазы стимулируют деление клеток рекомбинантных штаммов, что, скорее всего, связано с возможным участием эндонуклеаз NucSma и NucA в репликации ДНК в бактериальной клетке.
- Определение количества генов bla в рекомбинантных штаммах. Поскольку все используемые в работе плазмиды в качестве селектирующего маркера содержат ген -лактамазы, то необходимо было определить, различаются ли уровни устойчивости к ампициллину у рекомбинантных штаммов E.coli LK111 и E.coli TGE900 в зависимости от того, какой ген – исходного или мутантных вариантов эндонуклеаз NucSma или NucA – экспрессируется в данных клетках на базальном уровне. Результаты экспериментов показали, что с увеличением активности исходных и мутантных вариантов эндонуклеаз NucSma при базальном уровне экспрессии их генов происходит увеличение уровня устойчивости к ампициллину рекомбинатных штаммов E.coli LK111 и E.coli TGE900. Увеличение активности мутантных вариантов эндонуклеазы NucA при базальном уровне экспрессии их генов, в свою очередь, также приводит к увеличению уровня устойчивости к ампициллину, но лишь для рекомбинатных штаммов E.coli LK111. Тогда как для рекомбинантных штаммов E.coli LK111 при базальном уровне экспрессии гена исходной формы эндонуклеазы NucA и E.coli TGE900 при базальном уровне экспрессии генов исходной формы эндонуклеазы NucA и ее мутантных вариантов, обладающих нуклеазной активностью, наоборот, было показано снижение уровня устойчивости к ампициллину по сравнению с соответствующими рекомбинантными штаммами при базальном уровне экспрессии гена мутантного варианта эндонуклеазы NucA с нулевой активностью. Данный эффект, вероятно, объясняется высокой токсичностью эндонуклеазы NucA для клеток-хозяев [Meiss et al., 1998].
Так как в ряде работ было показано, что существует прямая зависимость между дозой (количеством копий) гена bla, обуславливающего устойчивость к ампициллину, и количеством синтезируемого фермента -лактамазы [Uhlin et al., 1977; Бергквист с соав., 1989], а уровень устойчивости клетки к ампициллину зависит от числа копий плазмид, содержащих ген bla [Ely et al., 1981], то обнаруженные различия в уровнях устойчивости к ампициллину у рекомбинантных штаммов E.coli LK111 и E.coli TGE900 при базальном уровне экспрессии генов исходных и мутантных вариантов эндонуклеаз NucSma или NucA могут служить косвенным доказательством изменения количества кодирующих эту устойчивость генов bla.
Вследствие вышесказанного, для определения количества синтезируемой рекомбинантными штаммами E.coli LK111 и E.coli TGE900 -лактамазы, а значит, и косвенного определения количества копий генов bla, необходимо было получить референс-плазмиду, число копий которой можно было бы контролировать. Введение гена bla в плазмиду pETcocoCm позволило решить данную задачу, поскольку количество копий этого вектора можно точно контролировать за счет добавления в среду глюкозы или арабинозы [Friehs, 2004]. Так, при наличии в питательной среде глюкозы репликация плазмиды, которая содержится в клетке в количестве одной копии, инициируется с конститутивной oriS, в то же время репликация с факультативной oriV блокируется репрессором AraC. Добавление в среду арабинозы инактивирует белок-репрессор AraC, в результате чего открывается репликации с oriV и количество копий вектора увеличивается до 35-40 на клетку за счет экспрессии гена-репликатора trfA [Novy et al., 2002].
Для получения рекомбинантного штамма E. coli, содержащего референс-плазмиду, вначале из плазмиды pBluescriptSK+ был получен ген bla, который затем был амплифицирован с помощью ПЦР с использованием 5’- и 3’-праймеров, имеющих на концах сайты рестрикции BstZ171. Далее полученную плазмиду pETcocoAmpCm вводили методом трансформации в клетки E. coli DH5, после чего устойчивые к ампициллину клоны проверяли на наличие гена bla с помощью ПЦР и последующего электрофореза.
В результате проведенных экспериментов было установлено, что при наличии в среде 0,01% L-арабинозы количество синтезируемой -лактамазы и уровень устойчивости к ампициллину у рекомбинантного штамма E. coli DH5 pETcocoAmpCm выше в среднем в 37 раз (соответствует 37 плазмидным копиям), чем при выращивании данного штамма на среде с 0,2% D-глюкозой, когда в клетке содержится одна копия плазмиды. Для подтверждения полученных результатов методом электрофореза и с помощью спектрофотометра NanoDrop определяли количество плазмидной ДНК в клетках данного рекомбинантного штамма. При последующем расчете количества плазмид в рекомбинантных штаммах E.coli LK111 и E.coli TGE900 за одну копию гена bla, а, следовательно, и одну плазмидную копию, принималось то значение количества -лактамазы, которое было определено для рекомбинантного штамма E. coli DH5 pETcocoAmpCm при выращивании на среде с глюкозой. Дополнительным контролем в эксперименте служили бесплазмидные штаммы E.coli LK111 и E.coli TGE900, чувствительные к ампициллину и не синтезирующие -лактамазу.
Впоследствии для рекомбинантных штаммов E.coli LK111 и E.coli TGE900 было установлено увеличение количества синтезируемой клетками -лактамазы и соответственное увеличение уровня устойчивости к ампициллину при повышении нуклеазной активности исходного и мутантных вариантов эндонуклеазы NucSma при базальном уровне экспрессии их генов.
Для рекомбинантных штаммов E.coli LK111 также было установлено увеличение количества синтезируемой -лактамазы и уровня устойчивости к ампициллину с повышением нуклеазной активности мутантных вариантов эндонуклеазы NucA при базальном уровне экспрессии их генов. Однако, у рекомбинантного штамма E.coli LK111 при базальном уровне экспрессии гена исходной формы




эндонуклеазы NucA наблюдалось резкое снижение количества синтезируемой -лактамазы и уровня устойчивости к ампициллину относительно всех рекомбинантных штаммов E.coli LK111, экспрессирующих на базальном уровне гены мутантных вариантов эндонуклеазы NucA. В то же время, для рекомбинантных штаммов E.coli TGE900 было установлено снижение количества синтезируемой -лактамазы и уровня устойчивости к ампициллину с увеличением активности исходного и мутантных вариантов эндонуклеазы NucA при базальном уровне экспрессии их генов. Подобный эффект, скорее всего, также является следствием высокой токсичности для микробной клетки ферментативно активных форм эндонуклеазы NucA [Meiss et al., 1998].
Поскольку количество синтезируемой клеткой -лактамазы и, соответственно, уровень ее устойчивости к ампициллину зависит от количества генов bla, которые в рекомбинантных штаммах E.coli LK111 и E.coli TGE900 находятся в плазмидах в количестве одного гена на плазмиду (подтверждается результатами электрофореза), то увеличение количества генов bla в клетках может происходить только за счет увеличения количества плазмидных копий (рис. 4). Так как увеличение количества плазмид в исследуемых штаммах происходит с повышением нуклеазной активности исходных и мутантных вариантов эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов, то данная зависимость, скорее всего, связана с возможным участием эндонуклеаз NucSma и NucA в увеличении количества плазмидной ДНК. Поскольку известно, что oriC E.coli, которая также является точкой ori для плазмид данного микроорганизма, имеет в левой части богатый АТ-парами повтор в 13 п.н., а эндонуклеазы NucSma и NucA предпочтительнее расщепляют А-форму ДНК [Meiss et al., 1995], которая характерна для АТ-богатых последовательностей, то проявление эндонуклеазами NucSma и NucA активности в этом участке oriC могло привести к инициации цикла репликации ДНК. Таким образом, экспрессируясь в гетерологичной клетке E. coli на базальном уровне, эндонуклеазы NucSma и NucA могли сменить свою биологическую функцию и вместо выполнения трофической функции [Franke et al., 1999] стали принимать участие в репликации. Возможность изменения биологической функции нуклеазы в гетерологичной системе клетки уже была отмечена в некоторых работах [Куприянова-Ашина, 1991; Xiao et al., 2007; Balasundaram et al., 2009].
- Определение стабильности наследования плазмид pHisNucSma и pHisNucA в рекомбинантных штаммах. Как говорилось ранее, введение клонированного гена в составе вектора в бактериальную клетку оказывает негативное влияние на ее физиологические и метаболические процессы, из-за чего излишний генетический материал в процессе деления клетки неминуемо утрачивается [Goldwin et al., 1979]. Поэтому необходимо было определить, насколько стабильно наследуются плазмиды pHisNucSma и pHisNucA в ряду клеточных поколений в отсутствие селективных условий (так называемая спонтанная элиминация). Так как процесс элиминации затрагивает распределение плазмид из родительской клетки в дочерние, то чем больше плазмидных копий содержится в клетке, тем медленнее они будут элиминировать, т.е. стабильнее наследоваться [Миллер, 1976].




Рис. 5. Частота элиминации плазмид из клеток рекомбинантных штаммов:
а) pHisNucSma из E. coli LK111; б) pHisNucSma из E. coli TGE900;
в) pHisNucA из E. coli LK111; г) pHisNucA из E. coli TGE900.
Изучение спонтанной элиминации плазмид pHisNucSma и pHisNucA показало увеличение стабильности их наследования в клетках E. coli LK111 и E. coli TGE900 с повышением активности исходных и мутантных вариантов эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов (рис. 5). Низкая стабильность наследования плазмид с геном исходной формы эндонуклеазы NucA, вероятнее всего, также связана с высоким токсическим эффектом, который данная нуклеаза оказывает на клетку-хозяина [Meiss et al., 1998]. Отсутствие плазмидной ДНК в клетках, утративших устойчивость к ампициллину в процессе элиминации, было доказано с помощью электрофореза. Утрата устойчивости клеток к ампициллину подтверждает отсутствие транспозиции гена bla из плазмиды в хромосому, а выявленное посредством электрофореза отсутствие изменений в размерах плазмид при выращивании рекомбинантных штаммов в селективных условиях доказывает отсутствие амплификации гена bla внутри этих плазмид.
Таким образом, обнаруженное в ходе выполнения работы увеличение стабильности наследования плазмид в рекомбинантных штаммах E.coli LK111 и E.coli TGE900 с повышением нуклеазной активности исходных и мутантных вариантов эндонуклеазы NucSma и мутантных вариантов эндонуклеазы NucA при базальном уровне экспрессии их генов согласуется с ранее выдвинутым предположением о возможном участии данных эндонуклеаз в увеличении количества плазмидных копий в клетке, а, следовательно, и в репликации ДНК.
5. Определение устойчивости рекомбинантных штаммов к антибиотикам – ингибиторам репликации ДНК. Поскольку ранее было выдвинуто предположение о возможном участии эндонуклеаз NucSma и NucA в репликации ДНК в гетерологичных клетках E. coli, то необходимо было изучить влияние ингибиторов репликации ДНК на рекомбинантные штаммы E. coli LK111 и E. coli TGE900. В качестве ингибиторов ферментов, участвующих в репликации, использовали налидиксовую кислоту и новобиоцин. Контролем служили бесплазмидные штаммы E. coli LK111 и E. coli TGE900, не синтезирующие эндонуклеазы NucSma и NucA.
Как известно, налидиксовая кислота ингибирует А-субъединицу ДНК-гиразы, ответственную за связывание фермента с ДНК и образование разрывов (так называемых «ников»), в результате чего блокируется продвижение репликационно вилки [Hiasa et al., 1996; Fong et al., 2008]. Связывание налидиксовой кислоты с ДНК

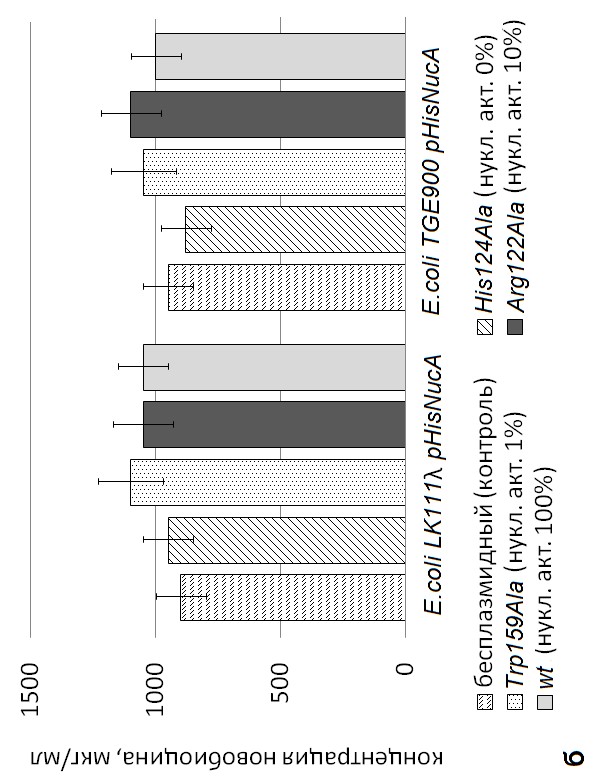


приводит к формированию тройного комплекса «налидиксовая кислота-топоизомераза-ДНК» [Hiasa et al., 1996], что происходит до появления разрыва в ДНК [Hooper, 1999]. В результате проведенных экспериментов было установлено, что чем выше нуклеазная активность исходных и мутантных вариантов эндонуклаз NucSma и NucA при базальном уровне экспрессии их генов, тем выше устойчивость рекомбинантных штаммов E. coli LK111 и E. coli TGE900 к налидиксовой кислоте (рис. 6). Известно, что при прикреплении фермента, в частности топоизомеразы, к ДНК ее локальная конформация соответствует А-форме ДНК [Lipps et al., 1983], которую предпочтительнее распознают эндонуклеазы NucSma и NucA [Meiss et al., 1995]. Вероятно, при ингибировании топоизомеразной активности ДНК-гиразы эндонуклеазы NucSma и NucA инициируют в области ori образование «ников» неподалеку от тройного комплекса, что ведет к его удалению и восстановлению репликации.
Новобиоцин, как известно, ингибирует АТФ-зависимую B-субъединицу ДНК-гиразы, которая участвует в восстановлении конформации фермента [Gellert et al., 1976]. При экспрессии рекомбинантными штаммами E. coli LK111 и E. coli TGE900 генов исходных и мутантных вариантов эндонуклеаз NucSma и NucA на базальном уровне статистически значимых различий в устойчивости клеток-хозяев к новобиоцину не было выявлено (рис. 7), поскольку участие нуклеаз в восстановлении исходной конформации фермента невозможно.
Таким образом, представленные в данной работе результаты дают возможность предположить, что эндонуклеазы NucSma и NucA могут принимать участие в репликации ДНК в рекомбинантных штаммах E. coli.
ВЫВОДЫ:
- Рекомбинантные штаммы E. coli LK111 и E. coli TGE900 обладают способностью к экспрессии генов исходных и мутантных вариантов эндонуклеаз NucSma и NucA на базальном уровне.
- Получена референс-плазмида pETcocoAmpCm со строгим контролем количества копий, которая может использоваться для определения количества копий плазмид, содержащих ген bla.
- Установлена зависимость между количеством плазмид pHisNucSma и pHisNucA в рекомбинантных штаммах E. coli LK111 и E. coli TGE900, количеством синтезируемой -лактамазы, уровнем устойчивости к ампициллину и активностью исходных и мутантных вариантов эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов.
- Показано, что базальный уровень экспрессии генов эндонуклеаз NucSma и NucA (за исключением токсичной эндонуклеазы NucA дикого типа) оказывает положительное воздействие на выживаемость рекомбинантных штаммов E. coli LK111 и E. coli TGE900.
- Установлена обратная зависимость между активностью исходного и мутантных вариантов эндонуклеазы NucSma при базальном уровне экспрессии их генов и стабильностью наследования плазмид pHisNucSma. Среди плазмид pHisNucA наиболее стабильно наследуются плазмиды, содержащие гены мутантных вариантов эндонуклеазы NucA с 1% и 10% нуклеазными активностями.
- Установлена зависимость между уровнем устойчивости рекомбинантных штаммов E. coli LK111 и E. coli TGE900 к налидиксовой кислоте и активностью исходных и мутантных вариантов эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов. Статистически значимых отличий в уровне устойчивости рекомбинантных штаммов E. coli LK111 и E. coli TGE900 к новобиоцину в зависимости от активности эндонуклеаз NucSma и NucA при базальном уровне экспрессии их генов не было выявлено.
СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ
- Гимадутдинов, О.А. Влияние базального уровня экспрессии эндонуклеазы Ser-ratia marcescens на стабильность и копийность плазмид pHisNucSma в рекомбинантных штаммах Escherichia coli / О.А. Гимадутдинов, Е.В. Крякунова, Р.Г. Хамидуллина, Б.И. Барабанщиков // Ученые записки Казанского государственного университета. – 2008. – Т. 150. – кн. 1.– С. 106-119.
- Крякунова, Е.В. Референс-плазмида для определения копийности плазмид, содержащих bla-ген / Е.В. Крякунова, Р.Г. Хамидуллина, Б.И. Барабанщиков, О.А. Гимадутдинов // Ученые записки Казанского государственного университета. – 2010. – Т. 152. – кн. 1. – С. 127-135.
- Крякунова, Е.В. Поведение плазмид pHisNucSma в рекомбинантных штаммах Escherichia coli / Е.В. Крякунова, Р.Г. Хамидуллина, Б.И. Барабанщиков, О.А. Гимадутдинов // Альманах современной науки и образования. – 2008. – № 5. – С. 76-78.
- Gimadutdinow, O. Effects of basal level Serratia marcescens endonuclease on the stability and pHisNucSma plasmid copy number in Escherichia coli recombinant strains / O. Gimadutdinow, R. Gudino, E. Kryakounova, M. Malisheni, R. Khamidullina // American-Eurasian J. Agric. & Environ. Sci. – 2009. – Vol. 6. – P. 294-297.
- Крякунова, Е.В. Стабильность плазмид pHisNucSma в рекомбинантных штаммах Escherichia coli / Е.В. Крякунова // XII Всероссийская научно-практическая конференция «Молодые ученые в медицине». – Казань: изд-во КГМУ, 2007 – С. 106.
- Крякунова, Е.В. Участие эндонуклеаз Serratia marcescens и Anabaena sp. в репликации плазмидной ДНК / Е.В. Крякунова, Р.М. Гудино-Каррило, М. Малишени, Е.Н. Макулова, Р.Г. Хамидуллина, О.А. Гимадутдинов // II Международная научно-практическая конференция «Постгеномная эра в биологии и проблемы биотехнологии». – Казань, изд-во КГУ, 2008 – С. 216-217.
- Malisheni, M. Dose variation of bla gene in relation to the activity of S. marcescens endonuclease / M. Malisheni, E.V. Kryakounova, R. Gudino, E.N. Makulova, R.G. Khamidullina // I Interuniversity Conference on Modern Biology «Building the Future in Biology «Bio-News»». – Казань, изд-во КГУ, 2008. – С. 52-53.
- Kryakounova, E.V. Variation of pHisNucSma plasmid copy number under the influence of Serratia marcescens endonuclease / E.V. Kryakounova, R. Gudino, E.N. Makulova, M. Malisheni, O.A. Gimadutdinow, R.G. Khamidullina // II Всероссийский с международным участием конгресс студентов и аспирантов-биологов «Симбиоз Россия 2009». – Пермь, изд-во ПГУ, 2009 – С. 160-161.
- Крякунова, Е.В. Изменение копийности плазмид pHisNucSma в зависимости от активности эндонуклеазы Serratia marcescesns / Е.В. Крякунова, Р.Г. Хамидуллина, О.А. Гимадутдинов // V съезд вавиловского общества генетиков и селекционеров. – Москва, изд-во МГУ, 2009. – Часть 1. – С. 31.
- Крякунова, Е.В. Конструирование референс-плазмиды для определения копийности плазмид, содержащих bla-ген / Е.В. Крякунова // Научно-практическая конференция «Становление и достижения биохимической школы Казанского университета». – Казань, изд-во КГУ, 2009. – С. 68-70.
- Kryakounova, E.V. Functional comparison of mitochondrial endonuclease EndoG and prokaryotic Serratia marcescens and Anabaena sp. endonucleases / E.V. Kryakounova, R.G. Khamidullina, O.A. Gimadutdinow // 2-ая Московская международная конференция «Молекулярная филогенетика MolPhy-2». – Москва, изд-во Университета им. М.В. Ломоносова, 2010. – С. 153.
- Крякунова, Е.В. Поведение эндонуклеаз S.marcescens и Anabaena sp. в гетерологичных системах E.coli / Е.В. Крякунова, Р.Г. Хамидуллина, О.А. Гимадутдинов // VI Международная научно-практическая конференция «Наука в інформаційному просторі». – Днепропетровск, изд-во Видавець Біла К.О., 2010. – Т. 1. – С. 13-16.

