Лександр в ладимирович иммунохимические показатели в клинической оценке черепно-мозговой и скелетной травмы
Диссертационный совет Д 208.072.01 при ГОУ ВПО «Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» направляет сведения о предстоящей защите диссертации и автореферат диссертации Коханова Александра Владимировича
Отправитель: Ученый секретарь диссертационного совета профессор Платон Харитонович Джанашия.
АВТОРЕФЕРАТ ДИССЕРТАЦИИ
На правах рукописи
Коханов Александр Владимирович
ИММУНОХИМИЧЕСКИЕ показатели
В КЛИНИЧЕСКОЙ ОЦЕНКЕ
черепно-мозговой и скелетной травмы
03.00.04. Биохимия
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Москва 2009
Работа выполнена в государственном образовательном учреждении высшего профессионального образования «Астраханская государственная медицинская академия Федерального агенства по здравоохранению и социальному развитию»
Научный консультант:
член-корреспондент РАМН, Терентьев
доктор медицинских наук, профессор Александр Александрович
Официальные оппоненты:
доктор медицинских наук, профессор Шевченко
ФГУ «НИИ трансплантологии Ольга Павловна
и искусственных органов Росздрава».
доктор медицинских наук, профессор Тогузов
ГОУ ВПО РГМУ Росздрава Руслан Тимофееевич
доктор медицинских наук, профессор Сучков
ГОУ ВПО МГМСУ Росздрава Сергей Викторович
Ведущая организация: – ФГУ «Научно-исследовательский институт физико-химической медицины Федерального агенства по здравоохранению и социальному развитию» Адрес: 119992, Москва, ул. Малая Пироговская, д. 1а.
Защита диссертации состоится «____» _________2009 г. в ____ часов на заседании Диссертационного Совета Д.208.072.01 при ГОУ ВПО «Российский государственный медицинский университет Федерального агенства по здравоохранению и социальному развитию» по адресу:
117997, Москва, ул. Островитянова, 1.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО РГМУ по адресу:
117997, ул. Островитянова, 1)
Автореферат разослан «____» ____________2009 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук,
профессор П.К. Джанашия
Общая характеристика работы
Актуальность проблемы. За последние 5 лет летальность от дорожно-транспортных происшествий в РФ увеличилась на 65% и число погибших, по данным ГИБДД, достигает 33-35 тыс. человек в год [Багненко С.Ф. и соавт., 2008; Соколов В.А. и соавт., 2008]. Травма, особенно черепно-мозговая (ЧМТ) и политравма, остаётся одной из ведущих причин смертности и инвалидизации населения [Шапот Ю.Б. и соавт., 2002; Агаджанян В.В., 2003; Гаврилин С.В. и соавт., 2006], а у лиц, не достигших 40 лет, тяжелая сочетанная травма занимает первое место среди причин смерти [Краснов А.Ф., Соколов В.А., 1995; Бондаренко А.В. и соавт., 2004; Соколов В.А., 2006].
Отдельной проблемой социального и медицинского характера является высокая взаимосвязь травматизма с состоянием алкогольной интоксикации пострадавших [Шабанов П.Д., Калишевич С.Ю., 1998; Демин А.К., Демина И.А., 2000; Пауков В.С. и соавт., 2001; Ельский А.В. и соавт., 2003; Цивинский А.Д. и соавт., 2003; Соколов В.А., 2006]. Интоксикация этанолом, обнаруживаемая у 35% пострадавших [Цеймах Е.А. и соавт., 2003], существенно утяжеляет течение травматической болезни и ухудшает ее прогноз.
Наиболее распространенным сочетанием при политравмах остается комбинация повреждений опорно-двигательного аппарата и головного мозга [Цеймах Е.А. и соавт., 2003; Соколов В.А., 2006]. Даже в случае изолированной ЧМТ легкой степени, на долю которой в структуре нейротравмы приходится от 60 до 80%, все более ощутимой становится ее социальная и экономическая цена [Лихтерман Л.Б. и соавт., 2000; Лебедев В.В., Крылов В.В., 2000; Куршакова И.В., 2006; Царенко С.В., 2006].
Несмотря на очевидные успехи медицинской науки по спасению и реабилитации контингента ранее обреченных больных, сохраняется высокий процент смертности и осложнений после тяжелых изолированных, множественных и сочетанных травм [Неговский В.А., Мороз В.В., 2000; Гуманенко Е.К., Сингаевский А.Б., 2004; Гаврилин С.В. и соавт.,2006; Царенко С.В., 2006].
Отсутствие заметного прогресса в лечении этой группы пострадавших привело в 90-х годах к пересмотру взглядов на патогенез травмы и возникновению концепции травматической болезни [Дерябин И.И., Насонкин О.О., 1987; Котельников Г.П., Чеснокова И.Г., 2002; Вашетко Р.В., 2003; Калинкин О.Г., Калинкин А.О, 2003; Селезнев С.А., Шапот Ю.Б., Багненко С.Ф., 2003]. Суть ее в том, что вызываемые травмой нарушения витальных функций и параметров гомеостаза носят закономерный пролонгированный характер и характеризуются однотипностью первичных аварийных регуляторных реакций и адаптационных синдромов, независимо от локализации повреждения [Флорикян А.К., 1999; Немченко Н.С. и соавт., 2001; Зайчик А.Ш., Чурилов Л.П., 2005; Астраков С.В., 2007; Кудлай Д.А., 2007].
С другой стороны известно [Шапот Ю.Б. и соавт., 1995; Лейдерман И.Н. и соавт., 1997; Соколов В.А., 2006; Царенко С.В., 2006], что изменения многих показателей аварийного метаболизма при ЧМТ отличаются от первичных аварийных регуляторных реакций, характерных для травмы другой локализации, в частности, опорно-двигательного аппарата (ОДА).
Для решения вопроса о клиническом значении сходства и различий аварийного метаболизма при ЧМТ и травме ОДА полезную информацию можно получить, применив чувствительные методы иммунохимического анализа [Зильбер Л.А., 1968; Петров Р.В., 1987; Нго Т., Ленхофф Г., 1988; Егоров А.М. и соавт., 1991], которые пока не находят распространения в ургентной медицине.
Исследования роли иммунохимических показателей в остром периоде травмы должны получить добавочный импульс еще и в силу того, что появление нанотехнологий уже привело к созданию новых экспресс-методов анализа [Биосенсоры, 1992; Дзантиев Б.Б. и соавт., 2003; Гвоздев А.Р., Гвоздев Р.И. 2003; Ермолов А.С. и соавт., 2008; Заседателев А.С. и соавт., 2008; Меньшиков В.В., 2008; Рупперт Й., Кузьмина Н. 2008; Morgan C.L. et al., 1996; Vikinge T.P. et al., 1998] (иммуносенсоры, иммуночипы, количественные и качественные иммунохроматографические тесты, основанные на методах «сухой» химии), отвечающих потребностям медицины критических состояний [Зильбер А.П., 1995; Неговский В.А., Мороз В.В., 2000].
Однако, на сегодняшний день спектр иммунохимических тестов, диагностически и прогностически значимых для острого периода ЧМТ и травмы ОДА и пригодных для мониторирования состояния больных, не систематизирован [Немченко Н.С. и соавт., 2001; Верховский А.И. и соавт., 2003; Черный и соавт., 2003].
Неравномерно исследованы взаимосвязи отдельных белков со степенью выраженности основных синдромов травматической болезни (гипоксия, системный воспалительный ответ, коагулопатия, токсемия и т.д.) [Гуманенко Е.К. и соавт., 1999; Верховский А.И. и соавт., 2003; Куршакова И.В. и соавт., 2003; Мустафин Р.Д., 2004; Гаврилин С.В. и соавт., 2006; Матюшичев В.Б., Шамратова В.Г., 2006; Соколов В.А., 2006], не проводилось комплексного изучения взаимосвязи уровня и спектра белков сыворотки с количественной оценкой (в баллах) степени тяжести состояния пострадавших.
Вместе с тем, давно существует и постоянно пополняется широкий выбор маркерных белков для иммунохимического контроля воспалительных и иммунных реакций, септических осложнений, повреждения тканей и органной недостаточности [Долгов В.В., Шевченко О.П., 1997; Чехонин В.П. с соавт., 1999; Мороз В.В. и соавт., 2000; Назаров П.Г., 2001; Черешнев В.А., Гусев Е.Ю., 2001; Назаренко Г.И., Кишкун А.А., 2002; Галстян Г.М. и соавт., 2003; Лисков Л.В., 2003; Симбирцев А.С., 2004; Титов В.Н., 2004; Шевченко О.П. и соавт., 2005; Наджар М.X. и соавт., 2007; Brunkhorst F.M. et al., 2000].
Роль других белков, таких как СБАГ, транскортин или ПЩФ, в патогенезе травмы практически не исследована, очевидно, по причине отсутствия на эти белки коммерческих тест-систем [Зорин Н.А. и соавт., 2006; Сухарев А.Е. и соавт., 2006; Безрукавникова Н.В., 2008]. Для восполнения этого пробела становится актуальной проблема их выделения, очистки и конструирования моноспецифических тест–систем для их количественного анализа.
Систематизация значимых имунохимических индикаторов состояния постравматического аварийного метаболизма актуальна и для диагностики и прогнозирования осложнений, и для оценки результатов оперативного и консервативного лечения. В том числе такого перспективного метода немедикаментозного лечения, как транскутанная электростимуляция головного мозга (ТКЭС), эффективной при лечении сопутствующей травме алкогольной интоксикации [Кацнельсон Я.С., 1985; Гриненко А.Я. и соавт., 1988; Крупицкий Е.М. и соавт., 1988; Герасимова Л.И. и соавт., 1997; Бураков А.М. и соавт., 1999; Кораблева Н.Н., 1999; Демичев Н.П. и соавт., 2002; Суринков Д.Б., 2004].
Цель исследования.
Улучшение диагностики и мониторинга состояния пострадавших с травмами головного мозга и опорно-двигательного аппарата путем включения в программу клинико-лабораторного обследования иммунохимических показателей.
Задачи исследования.
- Изучить физико-химические свойства альфа-фетопротеина (АФП), плацентарной щелочной фосфатазы (ПЩФ), связанного с беременностью альфа2-гликопротеина (СБАГ), транскортина (ТК) и сывороточного альбумина (СА).
- Разработать методы выделения и очистки СБАГ, ТК, АФП и ПЩФ и сконструировать иммунохимические тест-системы различной чувствительности для определения СБАГ, ТК и ПЩФ.
- Определить связь этих и других белков крови со степенью тяжести травматического эндотоксикоза, гипоксии, системного воспалительного ответа, комы и других патологических синдромов острого периода черепно-мозговой травмы (ЧМТ) и травмы опорно-двигательного аппарата (ОДА).
- Разрабатывать иммунохимические тесты для количественной оценки эндогенной интоксикации, гипоксии, кровопотери и других синдромов.
- Проанализировать в динамике травматической болезни взаимосвязь уровней иммунохимических, биохимических и гематологических показателей между собой и с количественной оценкой тяжести повреждения, общего состояния пострадавшего, выраженности алкогольной интоксикации при поступлении, характера последующих осложнений и метода лечения, в том числе транскутанной электроимпульсной стимуляции головного мозга.
- Используя методы статистического анализа отобрать диагностически и прогностически значимые лабораторные и иммунохимические показатели, общие и различные для травмы головного мозга и перелома длинных костей.
Научная новизна исследования.
На основании изучения физико-химических характеристик сывороточных белков, связывающих гидрофобные лиганды, разработан новый общий метод выделения и очистки альфа-фетопротеина (АФП), связанного с беременностью альфа2-гликопротеина (СБАГ), транскортина (ТК) и сывороточного альбумина (СА), основанный на принципах гидрофобной, высаливающей и аффинной хроматографии.
Впервые обнаружена корреляция уровней СБАГ, ТК и СА как со степенью выраженности интоксикационного синдрома (значения МСМ и ЛИИ), так и со степенью выраженности SIRS. Показано, что белки с транспортной функцией в большей степени коррелируют со степенью интоксикационного синдрома, и в меньшей — с SIRS. Для СРБ и других БОФ, не выполняющих транспортную функцию наблюдаются противоположные корреляционные отношения.
Впервые в сыворотках крови больных с выраженным травматическим эндотоксикозом обнаружено явление нарастания термостабильной фракции сывороточного альбумина (ТСА), пропорционально степени выраженности эндотоксикоза. Разработан и внедрен в клиническую практику новый иммунохимический способ определения связывающей емкости альбумина по отношению к низкомолекулярным веществам различного происхождения, являющийся иммунохимическим способом количественной оценки степени эндогенной интоксикации.
Проведен многомерный статистический анализ уровней изученных биохимических, гематологических показателей и содержания острофазовых, сывороточных и онкофетальных белков в сыворотках у больных в группах с изолированной и сочетанной ЧМТ и травмой ОДА с количественной оценкой тяжести травмы и общего состояния пострадавших при поступлении и в динамике травматической болезни, в том числе с учетом сопутствующей алкогольной интоксикации (АИ) при поступлении.
Впервые определена диагностическая и прогностическая эффективность определения у больных с изолированной и сочетанной ЧМТ и переломами длинных костей отдельных иммунохимических показателей, а также их комбинаций и отношений (диагностических коэффициентов). С помощью многомерного факторного анализа из числа острофазовых, сывороточных и органоспецифических белков отобраны маркеры, эффективные для оценки степени выраженности гипоксии, интоксикации, SIRS, септических осложнений на ранних и поздних стадиях ЧМТ, травмы ОДА и политравмы.
Впервые определена взаимосвязь каждого из отобранных антигенов со степенью выраженности основных патологических синдромов, сопутствующих изолированной и сочетанной ЧМТ и травме ОДА.
Впервые с биохимических и иммунохимических позиций нашел подтверждение синдром взаимного отягощения при сочетанной травме и у пострадавших с СГМ и диафизарными переломами длинных костей на фоне алкогольной интоксикации (АИ) при поступлении. Обнаружены изменения сывороточных уровней железосодержащих белков ферритина и лактоферрина, в сочетании с некоторыми биохимическими параметрами (глюкоза и рО2) перспективные в дифференциальной диагностике этиологии комы.
Впервые для оценки степени гипоксии при тяжелой нейро- и скелетной травме использован иммунохимический тест на фетальный гемоглобин, введен новый информативный показатель: коэффициент отношения HbF/HbA.
Впервые с иммунохимических позиций подтверждена эффективность применения у больных с СГМ и диафизарными переломами длинных костей разновидность транскраниальной электростимуляции мозга — МДМ-терапии.
Практическая значимость работы.
Предложенные схемы выделения и очистки белков с помощью хроматографии на аффинных и гидрофобных носителях позволяют получать очищенные препараты ПЩФ, СБАГ и ТК для конструирования иммунохимических тест-систем.
Установлено, что тяжелая изолированная и сочетанная ЧМТ и травма ОДА сопровождаются эндогенной интоксикацией, пропорциональной степени тяжести повреждения. Отмечено повышение в крови тяжелых больных термостабильной фракции сывороточного альбумина в 1,5-2,5 раза. Это факт реализован в «способе определения связывающей емкости альбумина человека», который может быть использован как для исследования межмолекулярных взаимодействий типа «лиганд-альбумин» в эксперименте, так и для диагностики степени интоксикации в клинической практике.
По результатам исследований разработан и внедрен ряд диагностических тестов для иммунохимической оценки степени интоксикации и системного воспалительного ответа, степени тяжести политравмы, степени гипоксии при ЧМТ, степени травматического повреждения головного мозга, а также способ оценки эффективности МДМ-терапии при травматической болезни. Для нужд экспериментальной хирургии разработан новый иммуноферментный тест на АФП кролика для оценки послеоперационных репаративных процессов в паренхиматозных органах.
Предложен иммунохимический «способ оценки адаптационных реакций у травматологических больных» по результатам определения и последующего вычисления соотношения острофазовых белков (СРБ и СБАГ) и онкомаркеров (АФП и ПЩФ).
Иммунохимические экспресс-тесты на СБАГ, HbF, АФП, ПЩФ, ферритин, лактоферрин, 2-макроглобулин, продукты деградации фибриногена могут найти применение в качестве критериев эффективности лечения травматической болезни мозга и ОДА.
Внедрение результатов исследования в практику.
Разработанные в диссертации методики и полученные результаты внедрены в практическую деятельность отделения анестезиологии и реанимации, нейрохирургического, травматологического отделений МУЗ «Городская клиническая больница №3» г.Астрахани, МНТК «Экологическая медицина» «Астраханьгазпрома», МУЗ «Станция скорой медицинской помощи» г.Астрахани, отделения реанимации МУЗ «Клинический родильный дом» г.Астрахани.
Материалы научных исследований используются в научных разработках и в педагогическом процессе на всех факультетах на кафедрах биологии, биохимии с курсом клинической лабораторной диагностики, патологической физиологии, нервных болезней, травматологии и ортопедии Астраханской государственной медицинской академии.
Положения, выносимые на защиту:
1. Хроматографические характеристики альбумина, АФП, ПЩФ, СБАГ и ТК на гидрофобных и аффинных сорбентах зависят от ионной силы элюэнта, концентрации и свойств лигандов, что позволяет подбирать условия для их выделения и очистки. Характеристика очищенных препаратов АФП, ПЩФ, СБАГ и ТК и иммунохимических тест-систем для их определения.
2. Термостабильность транспортных белков сыворотки изменяется в присутствии лигандов, в том числе эндотоксинов известного и неизвестного составов. Это явление повышения термостабильности альбумина может быть использовано как тест для диагностики степени эндогенной и экзогенной интоксикации в клинической практике.
3. Уровни острофазовых, сывороточных и органоспецифических белков в сыворотках пострадавших, биохимические и гематологические показатели крови в динамике острого периода изолированной травмы головного мозга и переломов длинных костей в зависимости от степени тяжести травмы и степени тяжести состояния пострадавших при поступлении. Особенности изучаемых показателей в остром периоде нейро- и скелетной травмы на фоне алкогольной интоксикации при поступлении и во взаимосвязи с характером оперативного лечения и проводимой МДМ-терапией.
4. Взаимосвязь изучаемых иммунохимических показателей пострадавших с данными биохимических и гематологических исследований в динамике острого периода изолированной и сочетанной ЧМТ и травмы ОДА. Иммунохимические показатели, эффективные для оценки основных патологических синдромов травматической болезни: маркеры степени выраженности гипоксии, интоксикации, SIRS, репаративных процессов, осложнений травмы ОДА и ЧМТ.
Апробация работы.
Основные положения диссертации доложены на заседаниях кафедры биохимии с курсом клинической лабораторной диагностики, научно-практических конференциях сотрудников медицинской академии (Астрахань, 2000-2008); на заседаниях Астраханского областного научного общества травматологов-ортопедов (Астрахань, 2000-2005) и областного научного общества врачей скорой помощи (Астрахань, 2004-2007); на заседании проблемной комиссии ГОУ ВПО АГМА «Теоретическое и практическое изучение белков маркеров патологических состояний», 2004.
Материалы диссертации были представлены на Всероссийской конференции «Влияние антропогенных факторов на морфогенез и структурные преобразования органов», Астрахань, 1991; международной конференции «Структурные преобразования органов и тканей на этапах онтогенеза человека в норме и при воздействии антропогенных факторов. Экология и здоровье населения. Актуальные проблемы биологии и медицины», Астрахань, 2000, 2007; на V научной конференции с международным участием «Дни иммунологии в Санкт-Петербурге 2001»; на III съезде биохимического общества РАН, Санкт-Петербург, 2002; на VII съезде травматологов-ортопедов Белоруссии, Гомель, 2002; на 2-й и 3-й научно-практической конференции и школе-семинаре для молодых ученых с международным участием «Белки-маркеры патологических состояний», Астрахань-Москва, 2001, 2003; на научно-практической конференции с международным участием «Современные достижения фундаментальных наук в решении актуальных проблем медицины», Астрахань-Москва, 2004, Астрахань-Волгоград-Москва, 2006; на VIII Международной научной конференции «Эколого-биологические проблемы бассейна Каспийского моря», Астрахань, 2005; Всероссийской конференции, посвященной 85-летию Астраханского областного научного общества хирургов (Астрахань, 2006); на научно-практическом Симпозиуме "Национальные дни лабораторной медицины России" (Москва, 2007, 2008) и Объединенном Иммунологическом Форуме (Санкт-Петербург, 2008).
Публикации.
По материалам диссертации опубликовано 55 научных работ, в том числе, 13 в рецензируемых научных изданиях, рекомендуемых ВАК.
Структура и объем работы.
Диссертация изложена на 310 страницах текста, иллюстрирована 49 таблицами, 37 рисунками, состоит из введения, обзора литературы, главы методов исследования, характеристики обследованных больных, трех глав результатов исследования и их обсуждения, заключения, выводов, практических рекомендаций, указателя литературы, включающего 319 отечественных и 144 зарубежных источника.
Личное участие автора в получении результатов исследования
Основной материал, представленный в диссертации, получен, обработан и проанализирован лично автором.
В работу вошли результаты исследований, проведенных совместно с представителями клинических кафедр и научных лабораторий АГМА, РГМУ, других учебных и научных учреждений. Автор выражает благодарность всем коллегам, в соавторстве с которыми были опубликованы работы.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Объектом биохимического исследования являлась группа сывороточных и ассоциированных с беременностью белков, обладающих сродством к стероидным гормонам: альбумина, АФП, ТК и СБАГ (сыворотки крови пуповинной крови и беременных третьего триместра при нормально протекающей беременности и с гестозом), ПЩФ (экстракт плаценты). Образцы препаратов белка исследовались методами ионообменной, гидрофобной, высаливающей и аффинной хроматографии. Очищенные препараты белков ТК и СБАГ получали из сывороток беременных, АФП— из абортивного материала, ПЩФ — из экстракта доношенной плаценты по схемам, разработанным самостоятельно.
Для качественной и количественной характеристики исходных препаратов, фракций и очищенных препаратов ТК, СБАГ и ПЩФ использовали иммунохимические, электрофоретические и хроматографические и другие методы очистки белков (Л.А.Зильбер, ред., 1968; Г.Детерман, 1970; Г.Маурер, 1971; Э.Руослахти, 1979; Л.А.Остерман, 1983,1985; Э.Гааль и соавт., 1982; X. Фримель, ред., 1987; О.Микеш, ред., 1982; Р.Скоупс, 1985; А.М.Егоров и соавт., 1991). Использовали диск- (Davis 1964; Ornstein 1964) и SDS-электрофорез (Laemmli, 1970), электрофорез в градиенте концентраций (5-40%) ПААГ (Kopperschlander et al. 1969) и градиенте мочевины (0-8М), двухмерные системы (фингерпринты); препаративный электрофорез. Идентификацию полученных препаратов проводили методами иммунохимического анализа. Содержание общего белка в экстрактах и фракциях определяли по O.H.Lowry et al. (1951) или спектрофотометрически при 280 и 260 нм по Варбургу. Всего протестировано свыше 3000 образцов биоматериала.
Антисыворотки к ТК, ПЩФ и СБАГ получены нами самостоятельно путем гипериммунизации кроликов очищенными антигенами по общепринятым схемам. Верификацию моноспецифических тест-систем проводили с референтными наборами на эти антигены из банка тест-систем кафедры биохимии АГМА.
Клинический материал представлен 472 больными с изолированными и сочетанными черепно-мозговыми травмами и переломами длинных (трубчатых) костей нижних конечностей мужского и женского пола в возрасте от 19 до 70 лет обследованными в период с 1996 по 2007 годы (табл.1).
Больные с травмами опорно-двигательного аппарата (ОДА) в зависимости от степени тяжести повреждений были распределены на три группы (табл.1). В первую группу (ОДА I) вошли 143 больных (59 женщин и 84 мужчины) с закрытыми переломами диафиза берцовой кости или дистального отдела костей голени (одной лодыжки). Шокогенность травмы по Цибину 0,1 балла, тяжесть повреждений по AIS и ISS — 2 балла. Все больные находились в удовлетворительном клиническом состоянии; влияющих на исход травмы сопутствующих заболеваний у них не обнаружено.
Во вторую группу (ОДА II) были включены 82 больных (40 женщин и 42 мужчины) с закрытыми переломами диафиза и проксимального отдела бедра, осложненные непродолжительным периодом шока I степени, обеих костей голени, множественными, открытыми или оскольчатыми переломами костей голени. Шокогенность травмы по Цибину не выше 2-х баллов, тяжесть повреждений по AIS — 2-3 балла (2,5±0,06). Больные находились в клиническом состоянии средней тяжести.
Таблица 1
Распределение обследованных больных по характеру повреждений
| Характер повреждений | Число больных | в % | Тяжесть травмы | |
| AIS | ВПХ-П | |||
| Травма: | 472 | 100 | ||
| Переломы длинных костей нижн. конечностей | 265 | 56,1 | 2,4 | 1,6 |
| диафиза большеберцовой кости закрытый | 102 | 21,6 | 2 | 0,1 |
| диафиза обеих костей голени | 20 | 4,2 | 2 | 2 |
| дистального отдела костей голени | 41 | 8,7 | 2 | 0,1 |
| диафиза бедренной кости закрытый | 18 | 3,8 | 3 | 2 |
| вертельной области | 21 | 4,4 | 3 | 2 |
| шейки бедра | 23 | 4,9 | 2 | 2 |
| диафиза бедра открытый + шок I-II | 11 | 2,3 | 3 | 6 |
| множественные и о/переломы + шок II-III | 29 | 6,1 | 4 | 6 |
| Всего по группе ОДА I: | 143 | 30,3 | 2 | 0,1 |
| Всего по группе ОДА II: | 82 | 17,4 | 2,5 | 2 |
| Всего по группе ОДА III: | 40 | 8,5 | 3,7 | 6 |
| Множ. травмы ОДА + шок II-III (ОДА III) | 142 | 30,1 | 3,4 | 4,7 |
| Изолированная ЧМТ: | 30 | 6,4 | 2 | 2 |
| СГМ | 22 | 4,7 | 3 | 5 |
| УГМ легкой степени | 41 | 8,7 | 4 | 5 |
| УГМ средней степени | 49 | 10,4 | 4 | 6 |
| УГМ тяжелой степени | 52 | 11,0 | 2,4 | 3,3 |
| Всего по группе ЧМТ I: | 90 | 19,1 | 4,0 | 5,5 |
| Всего по группе ЧМТ II: | 65 | 13,7 | 6,8 | 6,5 |
| ЧМТ, сочетанная с травмой ОДА | 143 | 30,3 | 2 | 0,1 |
| в том числе: | ||||
| ЧМТ II + ОДА I | 27 | 5,7 | 6 | 5 |
| ЧМТ II + ОДА II | 26 | 5,5 | 7 | 7 |
| ЧМТ II + ОДА III | 12 | 2,5 | 8 | 9 |
| Доноры | 68 | |||
| ВСЕГО | 540 | |||
В третью группу (ОДА III) вошли 40 больных (12 женщин и 28 мужчин) с закрытыми и открытыми диафизарными переломами бедра и с множественными переломами длинных костей нижних конечностей, осложненными шоком II-III степени тяжести. Шокогенность травмы по Цибину до 6 баллов, тяжесть повреждений по AIS 3-4 балла (3,7±0,07).
Диагноз СГМ ставили в соответствии с принятой единой классификацией острой ЧМТ [Коновалов А.Н., 1992]. Больные с ЧМТ условно были разделены на две группы (табл.1).
В группу пациентов с легкой черепно-мозговой травмой (ЧМТ I) были включены больные с сотрясением головного мозга — 30 человек (8 женщин и 22 мужчины) и ушибом головного мозга легкой степени — 22 человека (5 женщин и 17 мужчин). В этой группе больных у 5 пациентов было диагностировано субарахноидальное кровоизлияние, перелом свода черепа — у 5, и переломы костей лицевого черепа — у 8, средняя оценка по шкале комы Глазго на момент поступления в клинику составила 13,7±0,09 балла и 2,4±0,07 балла по международной шкале повреждений AIS. Клиническая симптоматика поражения нервной системы носила нестойкий характер, характеризовалась наличием рассеянной микроорганики и симптомами вегетативной дисфункции.
Группу с тяжелой черепно-мозговой травмой (ЧМТ II) составили 90 пациентов, из которых 41 пациент с ушибом головного мозга средней степени тяжести (5 женщин и 36 мужчин) и 49 с тяжелым ушибом и сдавлением головного мозга (8 женщин и 41 мужчина), у 45 пациентов из этой группы было диагностировано субарахноидально-паренхиматозное кровоизлияние, у 8 — эпидуральная гематома, у 10 — субдуральная гематома, у 1 пациента внутримозговая гематома, переломы свода черепа были выявлены у 19 пострадавших, основания черепа у 10, переломы лицевого черепа — у 5, средняя оценка по шкале комы Глазго на момент поступления в клинику составила 8,0±0,19 и колебалась от 11 до 5-4 баллов по шкале AIS.
Группа пациентов с сочетанной ЧМТ (табл.2) включала 65 больных, из них 36 пациентов — с диагнозом ушиб головного мозга средней степени тяжести (балл ЧМТ по AIS—4) и 29 больных с диагнозом тяжелый ушиб головного мозга (AIS—4) в сочетании с переломами бедра (AIS—3-4) и костей голени (AIS—2). Пострадавшие с ЧМТ, сочетанной с травмой нижних конечностей легкой степени, соответствующей 1 баллу по системе AIS (ушибы, ссадины, растяжения связок) квалифицировались как пострадавшие с изолированной ЧМТ. Пострадавшие с сочетанными травмами других областей тела в обследование не включались. Средняя балльная оценка тяжести повреждений в группе пациентов с сочетанной ЧМТ составила по шкале AIS — 6,8±0,09 баллов (из них 4 балла — вклад ЧМТ), по шкале тяжести политравм ISS — 22,6±0,76 и по шкале комы Глазго — 7,3±0,20, что соответствует тяжелой сочетанной травме [Соколов В.А.,2006]. У большинства больных с тяжелой сочетанной черепно-мозговой травмой выявлялись очаговые симптомы базально-стволового уровня, в ряде случаев поражение внутренней капсулы.
Структура политравмы в этой группе такова: сочетания ЧМТ II с ОДА I выявлено у 27 из 65 больных, с ОДА II — у 26 из 65, с ОДА III— у 12 пострадавших.
По возрасту и полу больные распределились следующим образом (табл.2). Средний возраст всех пациентов с изолированной и сочетанной ЧМТ и переломами нижних конечностей составил 43,8±0,62 года (женщин 45,4±1,11 года и мужчин 43,0±0,75 года), ОДА I – 42,1±1,08 года, ОДА II – 53,2±1,59 года, ОДА III – 43,1±1,66 года, ЧМТ I – 41,3±1,85 года, ЧМТ II – 43,1±1,37 года, сочетанная ЧМТ+ОДА II – 39,1±1,44 года.
Повышенные цифры среднего возраста больных в группе ОДА II связаны с тем, что по степени тяжести травмы в эту группу вошли пациенты с переломами шейки бедра, средний возраст которых составил 63,3±1,45 года.
Таблица 2
Распределение обследованных пострадавших с изолированной и сочетанной ЧМТ и травмой ОДА и по полу, возрасту и наличию алкогольной интоксикации (АИ) при поступлении
| ЧМТ | Переломы длинных костей н/конечностей | Сочетанная травма | |
| Мужчины Из них с АИ: 15-39 лет 40-59 лет 60 лет и старше | 116 33 (28,4%) 49 56 11 | 154 47 (30,5%) 58 69 27 | 43 16 (37,2%) 25 16 2 |
| Женщины Из них с АИ: 15-39 лет 40-59 лет 60 лет и старше | 26 6 (23,1%) 12 11 3 | 111 21 (18,9%) 36 42 33 | 22 8 (36,4%) 9 12 1 |
| Всего Из них с АИ: | 142 39 (27,5%) | 265 68 (25,6%) | 65 24 (36,9%) |
Как видно из табл.2, большинство больных составляли лица молодого и среднего возраста, тогда как пациентов старше 60 лет было 16,3%. У лиц молодого и среднего возраста преобладали ЧМТ, переломы голени и бедра, частое наличие сопутствующей алкогольной интоксикации (рис.1), а в возрасте 60 лет и старше – переломы вертельной области и шейки бедренной кости.
Среди мужчин переломы голени встречались чаще, чем у женщин почти в 2 раза, диафиза бедра и ЧМТ — более, чем в 3 раза. Среди женщин преобладали переломы шейки бедренной кости (более чем в 2 раза чаще, чем у мужчин).
Ни в одной группе обследованных больных в период наблюдения летальных исходов не зафиксировано. Больные с сопутствующей соматической патологией исключены из исследования. Больные с кранио-абдоминальной сочетанной травмой, имеющих высокую госпитальную летальность (Шапот Ю.Б., 2002), а также пострадавшие с ретроспективно установленной политравмой более двух систем в данное исследование не включены.
Оценивались следующие клинические параметры, необходимые для балльной оценки тяжести травмы и общего состояния: характер, локализация и степень повреждений (AIS, ISS, шкала Цибина), степень тяжести шока (индекс Альговера), комы (по шкале ком Глазго — SCG) и общего состояния (шкала ВПХ-СП, APACHE-II — у пострадавших и больных, находящихся в ОРИТ, отдельно три параметра SIRS лейкоцитоз, температуру, частоту сердечных сокращений в баллах, взятых из шкалы APACHE-II). Наличие и степень алкогольной интоксикации (АИ) при поступлении определялось по записи в истории болезни о концентрации этанола в крови. Учитывались следующие характеристики больных: возраст, пол, характер предпринимавшегося оперативного вмешательства и последующих физиотерапевтических воздействий и вид посттравматических осложнений (нагноения, пневмонии).
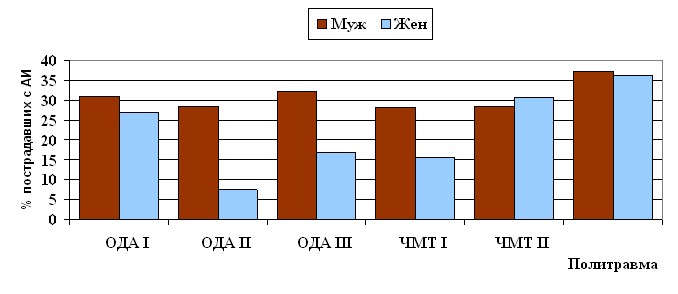
Рис.1. Частота наблюдения алкогольной интоксикации у пострадавших в зависимости от степени тяжести изолированной травмы опорно-двигательного аппарата (ОДА), изолированной ЧМТи политравмы (ЧМТ + скелетная травма)
Всем больным проводилось подробное клиническое обследование, включая в зависимости от характера травмы методы инструментальной (ЭКГ, ЭЭГ и др), рентгенологической (рентгенография, в том числе рентгеноскопия, КТ, ангиография). У тяжелых больных в реанимационном отделении мониторовались параметры, необходимые для количественной оценки тяжести состояния по угрозометрическим шкалам. Всем больным с изолированной и сочетанной ЧМТ, травмой ОДА проводилась адекватная соответстующая терапия и необходимые оперативные вмешательства.
Кровь с антикоагулянтом (трилон Б) и сыворотку крови для гематологических, биохимических и иммунохимических исследований в соответствии с требованиями этического комитета забиралась на 1-3, 5-7 и при возможности на 14-19 сутки после травмы. У некоторой части больных удавалось провести дополнительный 4-й забор крови на 21-28 сутки. Общее количество проанализированных с 2000 по 2007 годы образцов крови и сыворотки от 472 пациентов и 68 доноров составило 1773.
Результаты анализа крови пострадавших включали СОЭ и следующие параметры, определенные на автоматическом гематологическом анализаторе МАХ (Франция): WBC (лейкоциты), RBC (эритроциты), HGB (гемоглобин), HCT (гематокрит), MCV (средний объем эритроцита), MCH (среднее содержание гемоглобина в эритроците), MCHC (средняя концентрация гемоглобина в эритроците), RDW (анизоцитоз), PLT (тромбоциты), NEU%#, LYM%#, MON%# или MXD%# (соответственно % и абсолютное количество нейтрофилов, лимфоцитов, моноцитов или смеси моноцитов, эозинофилов и базофилов).
Лейкоцитарный индекс интоксикации (ЛИИ) рассчитывали по формуле Кальф-Калифа, С.Ф.Хомич в модификации А.Л.Костюченко и соавт. (2000):
 ,
,
У больных, находящихся после тяжелой травмы в реанимационном отделении, помимо шкалы комы Глазго (SCG), точнее ее обратной величины (15 — SCG), двух гематологических показателей HCT и WBC, креатинина в сыворотке, дополнительно учитывались еще 8 параметров, необходимых для балльной оценки по системе APACHE-II: температура тела, среднее АД [(2АДдиаст+АДсист)/3], ЧСС (частота сердечных сокращений), ЧДД (частота дыхательных движений), рО2 или раО2, рН артериальной крови или содержание Na+, K+ и бикарбоната в сыворотке, сыворотки.
Триада клинических показателей: гипертермия, тахикардия и лейкоцитоз считаются клиническими проявлениями SIRS. Признаками напряженности SIRS служили повышение температуры более 38,5°С, ЧСС более 90 в мин и лейкоцитоз свыше 12109/л — параметры, которые включены в шкалу APACHE-II. Исходя из этой системы, SIRS в баллах оценивали следующим образом: температура – 38,5-38,9°С (1 балл), 39-40,9°С (3 балла), >41°С (4 балла), пульс –110-139 (2 балла), 140-179 (3 балла), >180 (4 балла), лейкоциты, 109/л – 15-19,9 (1 балл), 20-39,9 (2 балла), >40 (4 балла).
Из биохимических показателей крови, определенных одномоментно на автоматическом анализаторе "Hitachi 911" (Австрия) с использованием реактивов фирмы «Олвекс» (г.Санкт-Петербург) или на анализаторе «HUMAN» с наборами реактивов фирмы «HUMAN» (Германия) и «LACHEMA» (Чешская Республика), в исследование включены следующие параметры: уровень глюкозы, общего белка, альбумина, ферментов (АСТ, АЛТ, ГГТ, ЛДГ, КК и ЩФ), мочевины, мочевой кислоты и креатинина.
Содержание молекул средней массы (МСМ) в сыворотке крови определяли скрининг-методом (Габриэлян Н.И. с соавт.,1985). Уровень МСМ выражали в единицах оптической плотности при длине волны 280 нм.
В динамике травматической болезни мозга и ОДА различными иммунохимическими методами были исследованы сывороточные уровни белков, отражающих влияние травмы на иммунный и системный воспалительный ответ — иммуноглобулины трех классов (IgG, IgM, IgA), острофазовые белки: лактоферрин (ЛФ), СРБ, связанный с беременностью 2-гликопротеин (СБАГ), 2-макроглобулин (МГ), на окислительный стресс— церуллоплазмин (ЦП), на систему гемостаза — продукты деградации фибриногена (ПДФ), повреждение тканей — ферритин (Фр), и органоспецифические белки: миоглобин (MG), тропонины Т и I (TrТ, TrI), креатинфосфокиназа (КФК), костная кислая фосфатаза (ККФ), костная щелочная фосфатаза (КЩФ), нейроспецифический белок S-100 (S-100), репаративную регенерацию — онкомаркеры альфа-фетопротеин (АФП), раковоэмбриональный антиген (РЭА) и щелочную фосфатазу плацентарного типа (ПЩФ).
В этих же сыворотках больных иммунохимическими методами исследовалась концентрации транспортных сывороточных белков сывороточного альбумина (СА), его термостабильной фракции (ТСА), транскортина (ТК), соотношению уровней субфракций альбумина и содержание МСМ, а в крови этих же больных иммунохимическими методами исследовалась концентрации HbF.
Количественное определение HbF проводили в гемолизированной сапонином или гипотоническим шоком крови методом радиальной иммунодиффузии по Манчини с использованием кроличьих антисывороток к HbF из банка иммунохимических тест-систем Астраханской медицинской академии.
Количественное определение СБАГ, СРБ и ПДФ, а также идентификация тканевых и сывороточных белков в период конструирования моноспецифических тест-систем проводилась двойной радиальной иммунодиффузией (РИД) в агаре по Ouchterlony в модификации Н.И. Храмковой и Г.И. Абелева (1961), концентрации ТСА, МГ, ЦП и ПДФ, иммуноглобулинов IgG, IgA, IgM — методом радиальной иммунодиффузии в геле по Mancini (1970) на готовых планшетах или с применением тест-систем и моноспецифических антисывороток фирм-изготовителей (Нижегородского, Санкт-Петербургского НИИВС; Берингверке, ФРГ; Sebia, Франция; Corning, Великобритания). СА, ТСА, ТК и МГ — методом метод «ракетного» иммуноэлектрофореза по Laurell et al. (1972), ПЩФ, частично ЛФ и Фр в экстрактах тканей — методом встречного иммуноэлектрофореза по Kohn (1970)., ККФ, КЩФ определяли в единицах Боданского денситометрией диск-электрофореграмм после инкубации с ингибиторами и субстратами. ПЩФ и оксидазную активность ЦП после специального окрашивания иммунопреципитатов. Определение высокочувствительного С-реактивного белка (hsCRP) проводили на автоматическом анализаторе Cobas С (Швейцария), идентификацию КФК, миоглобина и тропонинов Т и I — методом иммунохромато-графического анализа (Прогрессивные медицинские технологии, Россия; ACON, США; Hoffman La Rochе, Россия—Швейцария).
РЭА, кортизол, частично АФП и Фр определяли методом РИА с реактивами фирм (Hechst, Германия; Cis Bio International, Франция; рио-РЭА-125J–М, Беларусь). Радиометрию результатов РИА осуществляли на радиоизотопном анализаторе "Гамма-1" и "Гамма-800". В основном антигены (АФП, ЛФ, Фр, ЦП, S-100, МГ) определялись количественно методом ИФА в различных модификациях с использованием коммерческих тест-наборов (ЗАО «Вектор-Бест», Новосибирск; «Spinreact S.А.», Испания) в соответствии с требованиями фирм-поставщиков реагентов.
Молекулярные массы очищенных белков определяли методом диск-электрофореза в SDS- и градиенте концентраций ПААГ, на колонке с сефадексом G-100 и G-200 с использованием как минимум пяти соответствующих маркеров с известной молекулярной массой (Sigma): ферритина (440 kDa), сывороточного альбумина быка или человека (67 kDa), овальбумина (45 kDa), трипсина (23 kDa), тропонинов T, I, C (38; 24; 18,5 kDa), цитохрома С (12 kDa).
Для изучения влияния мезодиэнцефальной модуляции (МДМ) на лабораторные показатели крови с первых суток после получения травмы 77 пациентам с переломами длинных костей нижних конечностей из групп ОДА I и II и 33 пациентам с сотрясением и ушибом головного мозга легкой степени из группы ЧМТ I в схему лечения были включены сеансы МДМ по 12 процедур модулированной частотой 70–90 Гц, длительностью импульса 3,0-5,0 мс, продолжительность воздействия - 30 минут. Остальные больные служили контрольной группой, которых лечили по традиционной схеме. Для проведения данной процедуры использовался аппарат МДМ – 101. Электроды накладывались в саггитальной плоскости, один из которых располагался в области лба, второй в проекции затылочного отверстия. Сила тока зависела от индивидуальной чувствительности пациентов и колебалась от 0,5 до 2,5 мА. Сеансы мезодиэнцефальной модуляции хорошо переносились больными. Пострадавшие, имевшие на голове раны и другие дефекты кожного покрова входили в контрольную группу больных, не получавших МДМ-терапию.
Для статистической обработки и анализа полученных результатов исследования, а также построения графиков на полученных данных был использован лицензионный пакет прикладных программ статистического анализа Excel-98 (Microsoft), Statistica 6.0 (StatSoft. Inc.).
Для каждой выборки вычисляли средние величины (М), среднее квадратичное отклонение (), среднюю ошибки средней арифметической (m). Оценку нормальности распределений проводили с использованием коэффициентов асимметрии и эксцесса.
С целью определения значимости (достоверности) р различий сопоставляемых средних величин применялся критерий t Стьюдента и однофакторный дисперсионный анализ с вычислением критерия F Фишера. Разницу средних величин считали достоверной при р < 0,05.
Статистические взаимосвязи между показателями оценивались применением корреляционного, регрессионного анализа и методов многомерной статистики (Гланц С., 1999).
Результаты исследования и их обсуждение
Среди иммунохимических маркеров, представляющих интерес для оценки травматической болезни, для трех белков (СБАГ, ТК, ПЩФ) по разным причинам, отсутствовали доступные коммерческие наборы для их определения.
Для конструирования иммунохимических тест-систем на связанный с беременностью альфа2-гликопротеин (СБАГ), транскортин (ТК), плацентарную щелочную фофатазу (ПЩФ) предварительно исследовали их поведение на гелях для ионообменной (КМ- и ДЕАЕ-целлюлоза), гидрофобной (фенил-сефароза), амфифильной (агароза) и аффинной хроматографии (эстрадиол-сефароза и голубая сефароза). Параллельно изучались хроматографические характеристики еще двух белков — сывороточного альбумина (СА) и альфа-фетопротеина (АФП). Для иммунохимической идентификации белков во фракциях на данном этапе исследования применяли тест-системы для РИД по Оухтерлони, любезно предоставленные д.м.н. Сухаревым А.Е. (ПЩФ), к.м.н. Безрукавниковой Н.В. (ТК), к.м.н. Никулиной Д.М. (СБАГ) и антисыворотки НИИВС им. И.И.Мечникова (АФП и поливалентные к белкам сыворотки человека).
Акцент на методы гидрофобной хроматографии и аффинной элюции сделан в связи с общей особенностью всех пяти белков связываться или изменять свою активность (ПЩФ) в присутствии стероидных гормонов и триазиновых красителей.
Ионообменная хроматография. Установлено, что АФП, ПЩФ, ТК и ЧСА не адсорбируются на катионообменнике СМ-сефадексе С-50 (Pharmacia, Швеция) при трех значениях рН (8,0; 6,6; 5,8) 0,02М фосфатного и рН 4,6 0,02М ацетатного буферов. СБАГ довольно прочно связывается с катионообменным гелем в нейтральной и слабощелочной среде (рН 6,6 и 8,0).
Нами проанализирован характер элюции белков с этих анионообменников в зависимости от значения рН буферных систем (табл.3). Пробы в колонку вносились из расчета 20 мг белка на 1 мл геля. Хроматографию сывороток и экстрактов на колонке с ДЕ-52 целлюлозой проводили стартовым 0,01 М фосфатным или ацетатным буфером с линейным градиентом NaCl от 0 до 0,3М.
Все белки связываются с анионообменной целлюлозой DЕ-52 (Watman, США) при низкой ионной силе (0,02 М) стартового буфера в диапазоне рН 5–9.
Установлено, что при рН 5,1 ацетатного буфера все белки слабо связывались с анионообменником и легко десорбировались уже 0,05М NaCl. При всех остальных значениях рН первым из пяти белков элюируется ПЩФ при концентрации NaCl 0,10М. Альбумин десорбируется с хроматографической колонки широким пиком при ионной силы NaCl от 0,12 до 0,21М независимо от рН элюирующего буфера в диапазоне от 5,8 до 8,0. В отличие от альбумина пик АФП с уменьшением рН элюэнта десорбируется все более высокими концентрациями NaCl (табл.3). Этот факт может быть использован для отделения АФП от основной массы СА как один из этапов выделения и очистки АФП. Параметры десорбции ТК близки к таковым для СА (табл.3) и не позволяют отделять его от остальных сывороточных белков.
Повышенную «липкость» проявляет СБАГ и к анионообменному сорбенту (табл.3). При рН 8,0-6,4 белок элюируется более высокими концентрациями NaCl, чем все остальные рассматриваемые белки. СБАГ также как и СА десорбируется достаточно широким пиком, в связи с чем, применение ионообменной хроматографии в классическом виде для очистки СБАГ не дает определенных преимуществ. Вместе с тем, возможности анионообменной хроматографии могут быть расширены за счет использования аффинной элюции и гидрофобных свойств ионообменников на основе целлюлозы.
Таблица 3.
Условия десорбции (начальная и конечная молярной концентрации элюирующего буфера) белков с анионообменной целлюлоза ДЕ-52
| рН буфера | СА | АФП | ПЩФ | СБАГ | ТК |
| 8,0 | 0,13 - 0,21 | 0,14 - 0,18 | 0,10 - 0,15 | 0,15 - 0,25 | 0,15 - 0,21 |
| 7,2 | 0,13 - 0,21 | 0,15 - 0,20 | 0,11 - 0,18 | 0,18 - 0,25 | 0,13 - 0,20 |
| 6,4 | 0,12 - 0,20 | 0,17 - 0,22 | 0,12 - 0,18 | 0,13 - 0,20 | 0,13 - 0,20 |
| 5,8 | 0,12 - 0,21 | 0,20 - 0,23 | 0,13 - 0,18 | 0,08 - 0,11 | 0,11 - 0,18 |
| 5,1 | 0,05 - 0,11 | 0,11 - 0,20 | 0,08 - 0,09 | — | 0,05 - 0,09 |
Гидрофобная хроматография. Поскольку макромолекулы АФП, ПЩФ, ТК, СБАГ и ЧСА имеют на своей поверхности гидрофобные области, необходимые для осуществления их транспортной и (или) каталитической функции (Чегер С.И., 1975; Луйк А.И., Лукьянчук В.Д., 1984; Терентьев А.А., 1990; Розен В.В., 1994; Кривенцев Ю.А., 1999; Сухарев А.Е. и соавт., 2006), мы сочли целесообразным применение гидрофобной хроматографии для изучения их поведения на гидрофобных гелях, их разделения и очистки.
В качестве гидрофобного сорбента мы использовали фенилсефарозу CL-4В. Активацию геля проводили в колонке последовательным промыванием 1% тритоном Х-100 на 0,02М фосфатном буфере рН 7,2, 20%, 50%, 96% этанолом, бутанолом, этанолом в обратной последовательности, фосфатным буфером и буфером с добавлением 0,5 М NaCl или 2 М (NH4)2SO4.
Смесь белков из расчета 50 мг на мл геля в 2М сульфате аммония после центрифугирования при 8000 g и удаления осадка при комнатной температуре наносили на колонку, заполненную фенилсефарозой. В случае хроматографии сывороток беременных, содержащих СБАГ, проба и колонка с агарозой содержали 1 моль/л соли. Результаты хроматографических экспериментов представлены в табл.4.
В варианте хроматографии нисходящим линейным градиентом сульфата аммония забуференного до рН 7,2 СА начинал десорбироваться 0,8М солью и его широкий пик заканчивался при 0,15М концентрации соли, но следы ЧСА содержались и в последних фракциях. АФП более прочно связывался с сорбентом и незначительно элюировался заключительным объемом градиентного буфера, начиная с 0,13 М (NH4)2SO4, но основная фракция АФП продолжал десорбироваться после дополнительного промывания колонки 0,02 М стартовым буфером. ПЩФ элюировался с фенилсефарозы раньше АФП, начиная с 0,5М (NH4)2SO4, и его пик заканчивался при 0,1М концентрации соли. Пик ТК десорбировался после СА.
СБАГ прочно связывался с гидрофобной колонкой и не десорбировался промыванием стартовым буфером. Для его элюции требовалось дополнительная обработка колонки неионным детергентом. Таким образом, применение простого солевого градиента позволило нам отделить АФП, ТК и СБАГ от основной массы альбумина.
Таблица 4.
Условия десорбции (начальная и конечная молярной концентрации элюирующего буфера) белков с фенил-сефарозы CL-4B
| СА | АФП | ПЩФ | СБАГ* | ТК | |
| Сульфат аммония градиент 2М - 0 М | 0,8М – –0,15М | 0,13М – – 0 М | 0,5М – – 0,1М | Не десор- -бируется | 0,35М – – 0 М |
| Сульфат аммония 1М Тритон X-100 0 -1% | 0,1% – – 0,5% | 0,2% – – 0,4% | 0,1% – – 0,3% | 0,4% – – 1% | 0,2% – – 0,5% |
| Сульфат аммония 1М Глицерин 0 -75% | 25%– – 75% | Не десор- -бируется | 25%– – 75% | Не десор- -бируется | 50%– – 75% |
| Сульфат аммония 2М-0 М Тритон X-100 0–0,5% | 1,2 - 0,7М 0,2 -0,33% | 1,0 - 0,6М 0,25-0,35 | 1,2 - 0,6М 0,2-0,35% | 0,6 - 0,3М 0,35-0,42 | 1,0 - 0,6 М 0,25-0,35 |
| Сульфат аммония 2М-0 М Глицерин 0 -75% | 1,2 - 0,5 М 29 - 57 % | 0,8 - 0,3М 45 - 65% | 1,0 - 0,6 М 38 - 50% | 0,3 - 0М 65 - 75% | 0,9 - 0,3М 34 - 65% |
* — линейный градиент сульфата аммония 1М - 0 М
Десорбция связанных с фенилсефарозой белков ускорялась снижением полярности 0,02 М фосфатного буфера добавлением 0,1% тритона X-100, но не глицерина. Дополнительное введение в элюирующий буфер гидрофобных лигандов (спиртовых растворов билирубина, стероидных гормонов) с целью создания эффекта аффинной элюции было невозможно из-за их нерастворимости в солевых растворах высокой концентрации.
Как видно из табл.4, при изменении полярности с помощью детергента и глицерина на фоне неизменной 1М концентрации сульфата аммония, сходные по электрофоретической подвижности белки ведут себя по разному: тритон хорошо десорбирует ПЩФ (0,1-0,3%), СА (0,1-0,5%), ТК (0,2-0,5%), и АФП (0,2-0,4%) пики которых полностью накладываются друг на друга. СБАГ в присутствии сульфата аммония десорбируется с гидрофобной колонки только высокими концентрациями тритона Х-100. Глицерин частично вымывает СА и ПЩФ, начиная с 25% концентрации вплоть до последней фракции (75%), начиная с 50% элюирует ТК и не элюирует АФП и СБАГ на фоне такой ионной силы, задаваемой сульфатом аммония.
В последующих опытах (табл.4) нарастающий градиент тритона или глицерина добавлялся к понижающемуся градиенту концентрации соли (ножницы). Применение таких комбинаций получило в гидрофобной хроматографии особенно широкое распространение (Туркова Я., 1979; Скоупс Р., 1985; Ochoa J.L. 1978).
Обе комбинации ножниц (табл.4) давали приблизительно сходные картины элюции белков: сначала вымывался альбумин, затем ПЩФ, ТК и АФП, причем, их пики частично перекрывались. Последним элюировался СБАГ. Таким образом, целенаправленно изменяя в циклах гидрофобной рехроматографии концентрацию соли, детергента и неполярного растворителя в элюирующей буферной системе, можно подобрать условия для их выделения и очистки.
Амфифильная (высаливающая) хроматография. Обнаружено, что замещенные целлюлозы способны эффективно адсорбировать белки при высокой концентрации соли (Скоупс Р., 1985). Еще в большей степени, чем у ДЕАЕ-целлюлозы гидрофобные свойства выражены у агарозы. Благодаря своей амфифильной природе эти матрицы (частично гидрофобные и частично гидрофильные) подходят для адсорбции белков при высоких концентрациях соли, чем чисто гидрофобные материалы (Von der Haar F., 1976).
Белки, связанные с такими целлюлозными и агарозными матрицами, можно элюировать раствором с такой же высокой концентрацией соли, которая используется для их адсорбции, добавив в раствор вещества, ослабляющие водородные связи, — глицерин, сахарозу, мочевину или этанол (Fujita T. et al., 1980).
Таким образом высаливающая хроматография на агарозном геле может использовать как принципы гидрофобной, так и аффинной хроматографии. Важным ограничением амфифильной хроматографии по сравнению с аффинной является то, что лиганд должен сохранять способность связываться с белком при высокой концентрации соли.
В качестве амфифильного сорбента мы использовали агарозу (Serva, США). Активацию геля проводили в колонке по схеме для фенилсефарозы и уравновешивали 2М (NH4)2SO4. В случае хроматографии сывороток беременных, содержащих СБАГ, проба и колонка с агарозой содержали соли в 2 раза меньше (1 моль/л).
Смесь белков из расчета 10 мг на мл геля в 2М или 1М сульфате аммония после центрифугирования при 8000 g и удаления осадка наносили на колонку, заполненную агарозой при комнатной температуре.
Установлено что в присутствии 2М сульфата аммония, растворимые при такой концентрации белки (ПЩФ, ТК, СА, АФП) адсорбируются на геле агарозы, снижение концентрации соли до 1,8-1,5М вызывает их десорбцию с колонки. Нерастворимый в 2М (NH4)2SO4 СБАГ удерживается на агарозе при 1-0,5М концентрации соли и элюируется при более низких концентрациях сульфата аммония в буфере. При постоянной 1М концентрации сульфата аммония десорбцию СБАГ с агарозы можно осуществлять 0,1% тритоном Х-100, солевым 5-15% раствором глицерина или 1-2М мочевины.
Аффинная хроматография. Из аффинных сорбентов для исследования хроматографичекого поведения белков мы применяли голубую сефарозу (Pharmacia, Швеция), представляющую собой коммерческий конъюгат сефарозы 4В с ковалентно присоединенным красителем цибакроновым синим, и два варианта иммобилизованного эстрадиола.
Конъюгат эстроген-бензидин-сефароза был синтезирован и любезно предоставлен канд. хим. наук Р.3.Алиевым (Астраханская медакадемия) и представлял собой иммобилизованный на сефарозе через бифункциональный бензидиновый спейсер эстрадиол, ковалентно присоединенный по кольцу А. Второй сорбент — эстрадиол-С-17-триазинхлорид-сефароза был приготовлен на кафедре биохимии РГМУ и любезно предоставлен член–корр. РАМН, профессором А.А.Терентьевым.
На этапе получения высокоочищенных препаратов АФП, ТЩФ, ТК и СБАГ мы применили аффинные сорбенты, в которых использовались иммобилизованные различными методами антитела (негативные и позитивные иммуносорбенты).
Результаты изучения поведения белков на двух типах неантительных аффинных сорбентов, лиганды которых, эстрадиол и триазиновый краситель — цибакроновый синий, по литературным сведениям имеют сродство к исследуемым белкам (Иванов В.Б.,1982; Скоупс Р., 1985) представлены в табл.5.
На подготовленную к работе голубую сефарозу наносили диализованные против стартового 0,02 М трис-солянокислого буфера рН 7,4 растворы белка из расчета 10 мг белка на 1 мл влажной суспензии. Хроматографию проводили стартовым буфером в объеме 160 мл со скоростью 10 мл/час линейным от 0 до 2М градиентом NaCl. Собранные фракции иммунохимически тестировались на изучаемые белки.
Установлено что на голубой сефарозе сорбируется альбумин, но не ПЩФ, АФП и ТК. Основной пик ЧСА обнаруживается во фракциях, содержащих 0,8-1М NaCl, однако альбумин частично вымывается стартовым буфером и загрязняет фракции АФП. СБАГ частично связывается с голубой сефарозой и элюируется 0,07-0,12 М NaCl на 0,02 М, трис-солянокислом буфере, другая часть этого белка элюируется стартовым буфером.
Таким образом, АФП и альбумин отличаются по их поведению на голубой сефарозе — ЧСА связывается с красителем, АФП — нет. Полученные данные обосновывают применение на одном из этапов очистки АФП негативной хроматографии на сорбенте с триазиновыми красителями — голубой сефарозе. Что касается адсорбции СБАГ на голубой сефарозе, то учитывая физико-химические свойства этого белка, можно предположить о катионообменном, а не об аффинном механизме его связывания с окрашенным гелем.
Хроматографию белков на сорбентах эстрадиол-бензидин-сефарозы и эстрадиол–С-17-сефарозы проводили в двух режимах (табл.5).
Смесь белков, диализованная против солевого фосфатного буфера наносилась на колонку с эстрадиол-сефарозой, промывалась стартовым буфером и элюировалась ступенчатым градиентом NaCl до 1М на том же буфере. Последние ступени кроме соли содержали 2% тритона или эстрон в 20% диоксане.
Для хроматографии на эстрадиол-сефарозе в гидрофобном режиме проба в стартовом фосфатном буфере рН 7,2 с добавлением 1М сульфата аммония элюировалась нисходящим линейным градиентом этой соли.
В первом режиме на колонку наносилась диализованная против стартового буфера смесь исследуемых белков, при этом все белки вымывались со свободным объемом, не связываясь с сорбентом. Дополнительная последовательная элюция через колонку буферного раствора со ступенчатым градиентом NaCl до 2М, 1% тритона Х-100 и или эстрона на 20 % водном растворе диоксана не обнаружила в этих фракциях исследуемых белков.
Таблица 5.
Условия десорбции (начальная и конечная молярной концентрации элюирующего буфера) белков с с аффинных сорбентов
| Сорбент Стартовый буфер Линейный градиент | СА | АФП | ПЩФ | СБАГ* | ТК |
| Голубая сефароза 0,02 М, рН 7,4 трис-НCl 0 - 2 М NaCl | 0,6 – - 1,1 М NaCl | Старто-вым буфером | Старто-вым буфером | 0,07 – - 0,12М NaCl | Старто-вым буфером |
| Эстрадиол-бензидин-сефароза 0,02 М, рН 7,2 фосфатный | Старто-вым буфером | Старто-вым буфером | Старто-вым буфером | Старто-вым буфером | Старто-вым буфером |
| Эстрадиол-бензидин-сеф 0,02 М, рН 7,2 фосфатный 1 - 0 М (NН4)2SO4 | 0,5 – 0 М (NН4)2SO4 | 0,2 - 0 М (NН4)2SO4 | 0,3 - 0 М (NН4)2SO4 | 0,05 - 0 М (NН4)2SO4 | 0,15 - 0 М (NН4)2SO4 |
| Эстрадиол-С-17-сефароза 0,02 М, рН 7,2 фосфатный | Старто-вым буфером | Старто-вым буфером | Старто-вым буфером | Не десор- -бируется | Старто-вым буфером |
| Эстрадиол-С-17-сефароза 0,02 М, рН 7,2 фосфатный 1 - 0 М (NН4)2SO4 | 0,5 - 0 М (NН4)2SO4 | 0,2 - 0 М (NН4)2SO4 | 0,2 - 0 М (NН4)2SO4 | Старто-вым буфером | 0,1 - 0 М (NН4)2SO4 |
Так как белки при низкой ионной силе буферного раствора не связывались с иммобилизованным на сефарозе через бензидиновый спейсер по бензольному кольцу эстрадиолом, что совпадает с известными данными (Терентьев А.А., 1990), мы попытались сорбировать белки на этой колонке в гидрофобном режиме, при высокой молярности стартового буфера (табл.5.).
Установлено, что все белки связывались с эстрадиол-бензидин-сефарозой как с гидрофобным сорбентом в 1М сульфате аммония, (если на 1 мл аффинного геля наносилось не более 10 мг белка) и десорбировались с колонки при уменьшении концентрации соли в последовательности: СА => АФП => ПЩФ => ТК => СБАГ (табл.5).
Аффинный сорбент эстрадиол-С-17-триазинхлорид-сефароза, созданный для выделения эстрогенсвязывающих белков при хроматографии стартовым буфером не связывал СА, АФП, ТК и ПЩФ, так как имеет слишком короткий триазиновый спейсер (Терентьев А.А., 1990), однако в данном режиме на нем адсорбировался СБАГ, который потом элюировался при добавлении в стартовый буфер 1 М NaCl или водонасыщенного бутанола на этом буфере.
Разработка технологии получения препарата СБАГ и транскортина из сыворотки беременных. Обнаруженные нами особенности поведения СБАГ и ТК на хроматографических носителях легли в основу разработанных нами методов одновременного выделения этих белков из пула (500 мл) сыворотки крови беременных III триместра (табл.6 и 7). Метод для обоих белков включает последовательную высаливающую, ионообменную, гидрофобную и аффинную хроматографию и не требует промежуточных этапов диализа и концентрирования.
Таблица. 6
Характеристика препарата СБАГ на этапах выделения.
| Этап очистки | Cодержание белка, мг | Cодержание целевого продукта % | Степень очистки | Выход (%) | |
| общий | СБАГ | ||||
| Исходный материал | 31200 | 26,8 | 0,09% | 1 | 100 |
| Осаждение (NH4)2SO4 40% насыщения (осадок) | 6736 | 28,0 | 0,42% | 4,5 | 97 |
| Высаливающая хроматография | 1855 | 19,0 | 1,01% | 11,1 | 66,0 |
| Хроматография на ДЕ-52 целлюлозе | 872 | 15,3 | 1,8% | 19,0 | 53,1 |
| Гель-фильтрация на Сефадексе G-200 | 373 | 14,2 | 3,8% | 41,2 | 49,3 |
| Хроматография на фенил-сефарозе CL-4B | 194,7 | 12,5 | 6,4% | 69,6 | 43,2 |
| Хроматография на голубой сефарозе | 82,5 | 9,5 | 11,5% | 125 | 33,0 |
| Хроматография на эстрадиол С-17-сефарозе | 8,0 | 6,7 | 83,8% | 907 | 7,81 |
Характеристика очищенного СБАГ представлена на рис.2, а очищенного транскортина вместе с маркерами молекулярной массы на рис.3.
Полученный нами препарат СБАГ не взаимодействовал с антисыворотками против сывороточных белков донора и против сывороточного альбумина и давал единственную дугу преципитации с поливалентной антисывороткой, полученной иммунизацией кроликов сывороткой беременных.
Методом диск-электрофореза препарат СБАГ выявлял только одну окрашенную полосу в зоне макроглобулинов (рис.2), а электрофорез полоски полиакриламидного геля во втором направлении с антисывороткой к сывороточным белкам беременной выявил единственный пик иммунопреципитата, принадлежащий СБАГ (рис.2).
По результатам SDS-ПААГ электрофореза препарат транскортина выявлял только одну окрашенную полосу в зоне между БСА (65 кД) и овальбумином (45 кД), соответствующую молекулярной массе 50-55 кД (рис.3).
Таблица. 7
Характеристика препарата транскортина на этапах выделения.
| Этап очистки | Cодержание белка, мг | Cодержание целевого продукта % | Степень очистки | Выход (%) | |
| общий | ТК | ||||
| Исходный материал | 31200 | 26,0 | 0,08% | 1 | 100 |
| Надосадок (NH4)2SO4 40% насыщения | 24400 | 25,0 | 0,10% | 1,2 | 96 |
| Высаливающая хроматография | 4530 | 15,5 | 0,34% | 4,1 | 60 |
| Хроматография на ДЕ-52 целлюлозе | 688 | 10,7 | 1,56% | 18,7 | 41,2 |
| Осаждение (NH4)2SO4 60% насыщения (осадок) | 79,3 | 9,2 | 11,6% | 139,2 | 35,4 |
| Хроматография на фенил-сефарозе CL-4B | 18,1 | 8,5 | 47% | 583 | 32,7 |
| Хроматография на голубой сефарозе | 5,3 | 4,2 | 79% | 950 | 16,2 |
Оба препарата не проявляет иммунохимической активности при взаимодействии с антителами к ТБГ, ПЩФ, АФП и с большинством коммерческих антисывороток к белкам плазмы человека, а их антисыворотки не дает перекрестных линий преципитации между собой (рис.4).

Для выделения и очистки ПЩФ гомогенат зрелой плаценты, полученой в родах и освобожденной от плодных оболочек, смешивали с тремя объемами 0,02М трис-HCl буфера рН 8,6, троекратно замораживали при –6-8°С, оттаивали и добавляли один объем холодного бутанола.
Моноспецифические антисыворотки на СБАГ, транскортин и ПЩФ использованы для получения иммунодиффузионных и иммуноферментных наборов для их количественного определения при изучении роли иммунохимических показателей в оценке состояния пострадавших с изолированной и сочетанной ЧМТ и травмы ОДА. Смесь перемешивали на магнитной мешалке, центрифугировали и в делительной воронке собирали нижнюю (водную) часть, содержащую ПЩФ.

Рис. 3. Характеристика очищенного препарата транскортина методом SDS-ПААГ электрофореза в сопоставлении с маркерами молекулярной массы

В отличие от известных способов получения ПЩФ (Lehman et al., 1974; Сухарев А.Е. с соавт., 2006), в основе предлагаемого нами способа, лежит обнаруженный нами феномен относительной устойчивости ПЩФ к некоторым ионам тяжелых металлов (кадмий) при прогревании.
К плацентарному экстракту добавляли сульфат кадмия до конечной концентрации 0,14% и раствор прогревали при 65°С в течение 1-3 минут до образования осадка, который отделяли центрифугированием (табл.8). В супернатант добавляли сульфат аммония до 40% насыщения и после удаления осадка проводили с супернатантом дальнейшие хроматографические этапы, которые отражены в таблице 8.
Степень очистки ПЩФ по данному способу превышала 1000 раз, а чистота препарата достигала 98% (табл.8). Удельная активность фермента при его концентрации 10 мг/л составляла 8-10 тыс нмоль/сек/л (МЕ).
Так как в иммунохимическом анализе у пострадавших с травмами применялась коммерческая тест-система на АФП, данные по его хроматографической очистке не приводятся.
Таблица. 8
Характеристика препарата ПЩФ на этапах выделения.
| Этап очистки | Cодержание белка, мкг | Cодержание целевого продукта % | Степень очистки | Выход (%) | |
| общий | ПЩФ | ||||
| Бутанольный экстракт плаценты (1 литр) | 4400000 | 4000 | 0,10% | 1 | 100 |
| 0,14% CdSO4 65°С 1-3 мин | 250000 | 2500 | 1,0% | 11 | 63 |
| Надосадок (NH4)2SO4 40% насыщения | 200000 | 2400 | 1,2% | 13,2 | 60 |
| Высаливающая хроматография | 120000 | 1800 | 1,5% | 16,5 | 45 |
| Хроматография на ДЕ-52 целлюлозе | 16000 | 1200 | 7,5% | 82,5 | 30 |
| Осаждение (NH4)2SO4 60% насыщения (осадок) | 4000 | 880 | 22% | 242 | 22 |
| Хроматография на фенил-сефарозе CL-4B | 360 | 320 | 89% | 980 | 8,0 |
| Хроматография на голубой сефарозе | 285 | 280 | 98,2% | 1080 | 7,0 |
Тепловая денатурация белков. Отношение к температуре — одна из важных физических характеристик белка. Термостабильность белков может варьировать в определенных пределах в зависимости от целого ряда факторов: природы белка, рН, ионной силы раствора, присутствия различных низкомолекулярных лигандов. На примере транспортного белка — сывороточного альбумина, обладающего сродством к большому количеству гидрофильных и гидрофобных лигандов нами исследована возможность регулировать такой параметр как термическая устойчивость.
Выбор СА в качестве экспериментальной модели связан не только с его биологической ролью в организме как главного неспецифического транспортного белка сыворотки, но и с удобством его иммунохимической регистрации даже при тысячекратном снижении концентрации (рис.5)
Для сравнительной оценки влияния лигандов на температуру денатурации СА в качестве низкомолекулярных лигандов использовали спиртовые растворы билирубина и эстрадиола (Merck, ФРГ), водонасыщенный бутанол, растворы глицерина, сульфата аммония и хлорида натрия различной концентрации (Реахим, Россия). Кроме того, исследовали комбинацию неизвестных низкомолекулярных лигандов в составе смывов гипертоническим раствором (1M NaCl) с медицинских угольных сорбентов «СНК», «СКК» и «СУГС» после сеанса гемосорбции у больных с интоксикационным синдромом различной этиологии (рис.6), полученными из отделения гемодиализа НПК «Экологическая медицина» Газпрома (г. Астрахань).
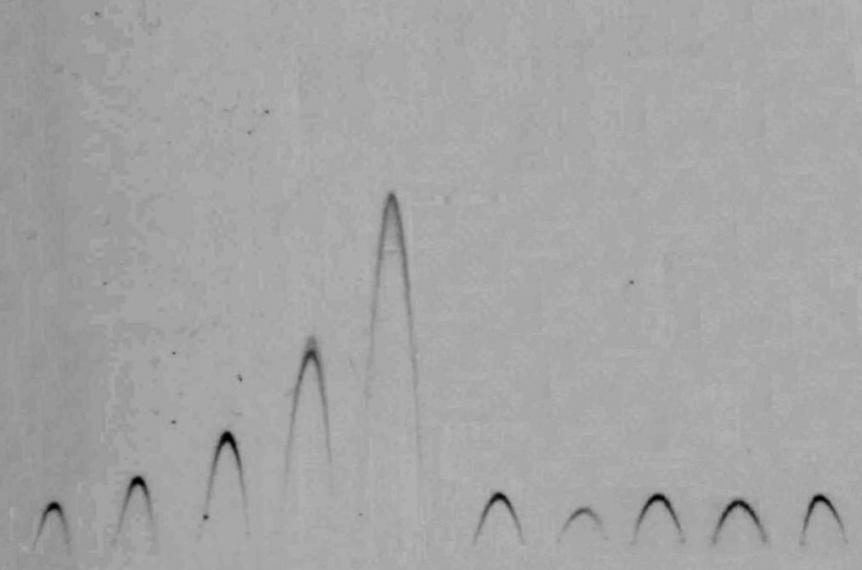

Рис.6. Кривые денатурации альбумина в присутствии различных лигандов
В качестве препаратов СА использовали сыворотки крови доноров, беременных, больных с выраженным эндотоксикозом, пуповинной крови и кристаллический СА человека фирмы BDH (США). Перед прогреванием готовили 0,5% растворы СА, а сыворотки разводили в 10 раз для профилактики гелеобразования.
Препараты СА с добавлением лигандов прогревали в стеклянных пробирках на водяной бане при следующих режимах 50° 1 час, 60° 1 час, 70° 15 мин, 80° 15 мин, 90° 10 мин или 100° 10 мин.
Установлено, что СА переносит без денатурации температуру до 70°С, сохраняется на четверть при 80°С и на 2-3% при 100°С. Высокие концентрации глицерина (20%) и солей (1М) предохраняют белок от денатурации при кипячении на 20-40%. Незначительное (до 2-3 раз) увеличение термостабильной фракции альбумина (ТСА) при 100°С наблюдается под влиянием гидрофобных лигандов (эстрадиола и билирубина).
Способность повышать концентрацию ТСА выявлена также у смеси токсинов элюированных с гемосорбента «СУГС» от больных перитонитом (рис.6).
В серии экспериментов иммунохимическими методами в индивидуальных разбавленных сыворотках здоровых лиц и больных с различной патологией, сопровождающейся эндотоксикозом, до и после обработки активированным углем определяли концентрации альбумина (ракетный иммуноэлектрофорез) (рис.5). Достоверно отличающиеся концентрации белков в параллельных пробах до и после обработки активированным углем выявлены у больных с выраженным токсикозом.
Предложен новый подход оценки степени выраженности эндогенной интоксикации (заявка на изобретение№ 2007146077, приоритет от 11.12.2007) при помощи количественной оценки термостабильной фракции сывороточного альбумина (ТСА). Способ заключается в одномоментном измерении уровня альбумина в одной микропробе кипяченой и некипяченой разбавленной крови методом иммунохимического анализа.
Результаты определения ТСА, СА, отношения ТСА/СА и обратного отношения (СА/ТСА100%) коррелируют с другими лабораторными данными (общий анализ крови; ЛИИ, СМП254) — маркерами интоксикации (r = +0,99 между ССА и МСМ, r = +0,95 между ССА и ЛИИ, r = +0,97 между ЛИИ и МСМ, r = -0,87 между ЛИИ и ОССА, r = -0,94 между ОССА и МСМ, r = -0,96 между ОССА и ССА).
Сравнительная характеристика чувствительности различных методов оценки интоксикации в% к контролю предсталена на рис.7.
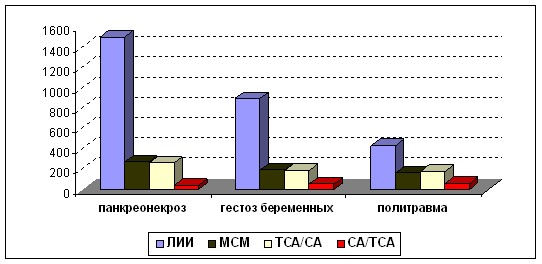
Рис.7. Сравнительна характеристика чувствительности тестов количественной оценки степени интоксикации в % к контролю (доноры)
Иммунохимический мониторинг и лабораторные показатели
в динамике изолированной и сочетанной ЧМТ и травмы ОДА
Клинические показатели при изолированной и сочетанной ЧМТ и травме ОДА. Средний балл тяжести травмы по шкале AIS у травматологических больных (табл.9) составил 2,4±0,04, по шкале ISS — 4,9±0,29, по ВПХ-П(МТ) — 0,8±0,07 балла. Между шкалами AIS и ВПХ-П(МТ) у больных с травмами ОДА имеется тесная прямая корреляция (r=0,88).
Таблица 9
Интегральные показатели степени повреждения и тяжести состояния при поступлении у больных с изолированной и сочетанной ЧМТ
и с переломами нижних конечностей
| Тяжесть повреждения | Тяжесть состояния | ||||
| AIS | ISS | ВПХ-П (МТ) | ВПХ-СП | Шкала Глазго | |
| ОДА I (n = 143) | 2 | 2 | 0,1 | 12,4±0,08 | 14,7±0,05 |
| ОДА II (n = 82) | 2,5±0,05 | 5,3±0,39 | 2 | 13,3±0,20 | 14,7±0,07 |
| ОДА III (n = 40) | 3,7±0,07 | 14,1±0,50 | 6 | 19,6±0,45 | 14,2±0,14 |
| ЧМТ+ОДА (n = 65) | 6,8±0,09 | 22,6±0,76 | 6,5±0,18 | 21,2±0,24 | 7,3±0,20 |
| ЧМТ II (n = 90) | 4 | 16 | 5,5±0,05 | 19,9±0,28 | 8,0±0,19 |
| ЧМТ I (n = 52) | 2,4±0,07 | 5,0±0,48 | 3,3±0,21 | 14,4±0,36 | 13,7±0,09 |
Степень тяжести состояния пострадавших с травмой ОДА по шкале комы Глазго (SCG) обычно соответствовала норме — 15 баллов. Однако в связи с тем, что определенная часть (25,6%) пострадавших поступала в стационар в состоянии алькогольного интоксикации (АИ) с признаками угнетения сознания, балл SCG снижался вплоть до 11, и в среднем по группе пострадавших с изолированной травмой ОДА составил 14,7±0,05 балла.
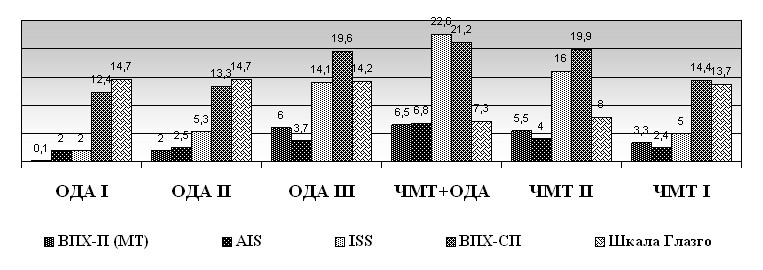
Рис. 8. Средние баллы тяжести травмы при поступлении пострадавших в стационар в шести обследованных группах.
Применение МДМ-терапии позволило значительно улучшить показатели лечения и у больных с переломами (ОДА I и II) и у больных с ЧМТ I. В группе больных, лечившихся скелетным вытяжением и получавших мезодиэнцефальную модуляцию (34 больных) средний срок скелетного вытяжения составил 17,8 дней (табл.10). В контрольной группе (25 больных) -21,6 дня.
Таблица 10
Длительность основных этапов лечения больных с переломами длинных костей (группы ОДА I и II), леченных консервативно (в днях)
| Группа | Этапы лечения | |||
| Скелетное вытяжение | Сращение перелома | Реабили-тация | Общий срок лечения | |
| МДМ-терапия | 17,8 | 94,5 | 13,5 | 108,0 |
| Контрольная | 21,6 | 107,4 | 14,0 | 121,4 |
В первую неделю после поступления больных в стационар наиболее частым осложнением была гипостатическая пневмония, особенно у лиц пожилого возраста или страдающих алкогольной болезнью. Использование мезодиэнцефальной модуляции позволило снизить количество гипостатических пневмоний с 3,6% в группе больных, не получавших МДМ-терапию, до 1,9% у больных ее получавших, гнойных осложнений в 3,4 раза – с 6,1% до 1,8% соответственно.
Раннюю гипостатическую пневмонию следует дифференцировать от похожих клинически осложнений 3-4 суток после перелома — жировой эмболии легочной артерии и синдрома «шокового легкого» (Соколов В.А.,2006). В этой ситуации показана оценка иммунохимических маркеров, характеризующих свертывающую систему и степень инфузионной гемодилюции.
Гематологические показатели при изолированной и сочетанной ЧМТ и травме ОДА. У больных с переломами длинных костей из группы ОДА I степень выраженности анемии была незначительной, так как наблюдались больные с повреждением одного сегмента, поэтому, не потребовалось назначения антианемических лекарственных средств. У больных с переломами длинных костей из группы ОДА II-III, в первую неделю после травмы отмечается нарастание анемии, что проявляется снижением числа эритроцитов, гемоглобина, гематокрита и среднего содержания гемоглобина в эритроцитах. Такая динамика согласуется с исследованиями других авторов (Селезнев С.А., Худайбергенов Г.С., 1984, Takahashi, Henmi, Yaraki с соавт., 1983).
У больных с изолированной и сочетанной ЧМТ тяжелой степени такие лабораторные показатели красной крови как количество эритроцитов (RBC), гемоглобин (HGB), гематокрит (НСТ) достоверно снижены с первых дней после травмы. Через 5-7 суток после травмы продолжают снижаться: эритроциты (4,5±0,121012/л и 4,4±0,091012/л) и гемоглобин (136±2,82 г/л и 134±3,53 г/л соответственно). Среднее содержание гемоглобина в эритроците (МСН) достоверно снижается только в 1-3 сутки (32,7±0,79 пг и 31,2±0,83 пг) и имеет достоверную тенденцию к снижению и к 21 суткам до 31,7±1,39 пг. Гематокрит падает с 42,2±0,40 до 38,7±1,58 к 5-7 суткам, остается сниженным и на 14-16 сутки – 41,4±1,93% с намечающейся тенденцией к повышению на 21 день. Таким образом, у больных с изолированной и сочетанной ЧМТ тяжелой степени, несмотря на отсутствие выраженной кровопотери, в первую неделю после травмы отмечается нарастание анемии, что проявляется снижением числа эритроцитов, гемоглобина, гематокрита и среднего содержания гемоглобина в эритроцитах.
На фоне показателей анемизации у больных тяжелой черепно-мозговой травмой обнаружено достоверное (р<0,01) снижение уровня HbF. Начиная с 3-й недели при изолированной травме ОДА и при сочетанной с ЧМТ травме ОДА, отмечается повышение абсолютного (г/л) и относительного (HbF/Hb в %) уровней фетального гемоглобина, чего не наблюдается у больных с тяжелой ЧМТ, видимо в результате нарушения центральных механизмов адаптации.
Показатели крови у больных из групп с травмами ОДА I-II и ЧМТ I на фоне мезодиэнцефальной модуляции восстанавливаются до исходного уровня примерно на одну неделю раньше, чем в соответствующей контрольной группе, что свидетельствует о выраженном положительном эффекте данного метода на организм пострадавших, в том числе у больных, поступивших в состоянии алкогольной интоксикации. Улучшение лабораторных показателей красной крови и иммунитета к 5-7 суткам в группе больных, получавших МДМ-терапию, по сравнению с контрольной группой (только на 14-19 сутки) создавало более благоприятные условия для оперативного лечения, способствовало снижению числа осложнений в раннем и позднем послеоперационном периоде.
Анализ полученных результатов показал, что через 5-7 суток после легкой травмы (ЧМТ I, ОДА I) наблюдалось максимальное увеличение числа лейкоцитов до 11,8±0,6 тыс. в 1 мкл, видимое сохранение на уровне нормы абсолютного числа лимфоцитов до 11,8±0,6 тыс в 1 мкл (26±0,6 %) и в дальнейшем восстановление их до нормы к третьей неделе.
Биохимические и иммунохимические показатели сыворотки при изолированной и сочетанной ЧМТ и травмы ОДА. К наиболее лабильным биохимическим показателям, отражающим даже легкую травму следует отнести кортизол, изменяющимся даже в течение суток. Менее лабильная, но также цикличная для травмы легкой и средней тяжести характерна для транскортина (ТК). Уровень мочевины достоверно повышается через 5 – 7 суток после травмы до 6,37±0,86 ммоль/л (р 0,05). Это, по нашему мнению, свидетельствует о выраженности дезадаптационных процессов, являющихся результатом стрессовой реакции, а так же следствием непрямого воздействия механической травмы на обменные процессы в организме. К 14–19 суткам уровень мочевины снижается до 4,40±0,64 ммоль/л, что несколько ниже, чем содержание мочевины в сыворотке крови при поступлении.
Результаты биохимических исследований крови больных с изолированной ЧМТ тяжелой степени (ЧМТ II) показали, что в восстановительном периоде изолированной ЧМТ нормализация уровней основных обменных процессов наступает достаточно быстро к 5-7 дню.
В динамике травматической болезни головного мозга достоверное увеличение активности ферментов наблюдается в 1-3 сутки ЧМТ, что свидетельствует об активизации катаболических процессов у пострадавших в этот период. Нормализация катаболических процессов у больных с изолированной ЧМТ тяжелой степени происходит в пределах 5-7 суток, однако активность обеих трансаминаз (АСТ и АЛТ) сохраняется повышенной до двух-трех недель.
Полученные данные подтверждают, что первый период травматической болезни мозга, характеризует эти изменения метаболизма как «пожар обмена» (Ромоданов А.П., 1990).
Применение МДМ с первых суток после травмы позволяет ускорить процесс восстановления механизмов неспецифической резистентности организма и устранить иммунодепрессию уже на 5–7 сутки, о чем свидетельствует нормальное содержания иммуноглобулинов в сыворотке крови больных из групп ОДА I-II и ЧМТ I, нормальные цифры содержания лейкоцитов к 5–7 суткам, а также восстановление показателей уровня белков острой фазы в эти же сроки, в то время как в контрольной группе возврат к исходному уровню происходит лишь на 14–19 сутки.
В 1-3 сутки, то есть до или в самом начале сеансов МДМ-терапии лабораторные и иммунохимические показатели в эспериментальной (77 больных с переломами нижних конечностей и 20 больных с ЧМТ I) и контрольной (42 и 18 больных соответственно) подгруппах, сформированных случайным образом, практически не отличались между собой, поэтому в точке «1-3 день» их значения объединены в одну группу (табл.11).
Вслед за резким подъемом в крови уровня белков острой фазы (БОФ) в течение первых 24-48 часов после травмы ОДА и ЧМТ формируются характерные для каждого реактанта кривые экспрессии и нормализации уровня белка. Усредненные данные для пяти БОФ у больных из групп ОДА I-II и ЧМТ I, получавших и не получавших МДМ-терапию, представлены в табл. 11.
СРБ на 5-7 сутки в контрольной группе снижается с 6,3±1,08 мг/л (485%) до 3,6±0,98 мг/л (277%) и незначительно возрастает до уровня 3,9±0,73 мг/л (300% от референтного значения) к 14–19 суткам (табл.10). В группе больных, получавших мезодиэнцефальную модуляцию, сохраняется приблизительно аналогичный уровень 3,4±0,52 мг/л белка через 5-7 суток после травмы (262%) и наблюдается тенденция к более ранней нормализации содержания СРБ до 2,1±0,48 мг/л (162%) к 14 – 19 суткам.
Для СБАГ характерно медленное нарастание с 3,9±0,54 мг/л (260%) до 4,3±1,06 мг/л (287%) с максимальным содержанием 6,4±1,19 мг/л (427% от референтного значения) к 14–19 суткам.
Для лейкоцитарного лактоферрина (ЛФ) характерно возрастание в контрольной группе на 5–7 сутки с 2,8±0,51 мг/л (187%) до 3,4±0,91 мг/л (227%) (обе группы достоверно отличаются от доноров по данному белку) со снижением к 14–19 суткам (2,1±0,62 мг/л или 140%). В группе МДМ снижение носит более выраженный характер (2,2±0,65 мг/л или 147%) на 5-7 сутки и восстановление показателей к 14–19 суткам на 67% от донорского уровня 1,0±0,42 мг/л (различие достоверно, р<0,05).
Наименее выраженные изменения наблюдались при изучении 2-макроглобулина. После кратковременного снижения до 82% от донорского уровня, уровень МГ нарастает до максимального на 5-7 сутки и постепенному снижается к 19 суткам.
Таблица 11
Усредненная динамика восстановления уровней некоторых белков острой фазы в крови у больных с легкой и средней изолированной ЧМТ
и у больных с переломами нижних конечностей (ЧМТ I + ОДА I-II)
| Группа | Показатели | ||||
| СРБ мг/л | СБАГ мг/л | МГ г/л | ЛФ мг/л | Фр нг/мл | |
| Контроль (доноры) | 1,30±0,53 | 1,50±1,31 | 1,70±0,65 | 1,5±0,10 | 115±20,5 |
| 1-3 сутки | 6,30±1,08* | 3,90±0,54* | 1,40±0,34 | 2,80±0,51* | 222±33,7* |
| 5-7 сутки | 3,60±0,98 | 4,30±1,06 | 2,30±0,92 | 3,40±0,91 | 247±25,3* |
| 14-19 сутки | 3,90±0,73 | 6,40±1,19 | 2,0±0,88 | 2,10±0,62 | 196±21,2* |
| 5-7 сутки МДМ | 3,40±0,52 | 4,50±0,65 | 2,70±0,80* | 2,20±0,65* | 166±16,7* |
| 14-19 сутки МДМ | 2,10±0,48* | 2,70±0,60* | 1,90±0,73 | 1,00±0,42* | 178±12,3* |
* — достоверные (р<0,05) различия с контрольной группой доноров
Полное снижение уровней БОФ у больных с переломами коррелирует с выявляемыми биомеханически и рентгенологически конечными этапами консолидации перелома — редукцией пери- и эндостального регенерата с параллельным развитием интермедиарной мозоли, определяющей собственно сращение перелома.
Уровни феритина (Фр) (табл. 10) при лечении переломов длинных костей без включения метода МДМ-терапии достоверно повышаются в 1,5–2 раза, начиная с первых 5-7 дней после перелома и незначительно снижаются, сохраняясь на достоверно высоком по сравнению с контролем уровне на 14-19 сутки. Под влиянием МДМ-терапии проискодит более быстрое снижение содержания Фр в крови, начиная с 5-7 дня.
При сопоставлении травмы ОДА и ЧМТ уровень Фр достоверно (p<0,01) повышается в сыворотке пациентов с тяжелой и сочетанной травмой, у больных с изолированной ЧМТ, но сохраняется на относительно низком уровне в остром периоде при закрытых переломах длинных костей.
Средние значения Фр у пострадавших с ЧМТ на фоне алкогольной интоксикации выше, чем значения у трезвых пострадавших равной степени тяжести повреждения. Обнаружены противоположно направленные изменения биохимических показателей у пострадавших в первые сутки после тяжелой ЧМТ: на фоне алкогольной интоксикации уровень глюкозы в крови (4,4±0,57 ммоль/л) достоверно ниже (р<0,02), а ферритина (185±29,3 нг/мл) достоверно выше (р<0,05), чем у пострадавших с равной степенью тяжести ЧМТ по шкале комы, но без признаков алкогольной интоксикации (6,8±0,75 ммоль/л и 134±26,4 нг/мл соответственно).
Таким образом, коэффициент ферритин/глюкоза при ЧМТ на фоне алкогольной интоксикации в 2 раза выше (42,0 и 19,7 соответственно), чем у пострадавших с ЧМТ без признаков алкогольной интоксикации. Данная зависимость может представлять интерес в плане дифференциальной диагностики токсической и травматической комы.
Кроме СРБ, СБАГ, МГ, Фр и ЛФ в первые три дня изолированной и сочетанной ЧМТ II пропорционально степени выраженности состояния пострадавших по шкале AIS и SCG в крови увеличиваются концентрации ЦП, ТК, ПЩФ. В результате повреждения головного мозга у всех больных независимо от вида и исхода мозгового повреждения на 1-10 сутки формируются неспецифические посттравматические реакции. Наиболее обязательными ее проявлениями являются SIRS, синдром гемостазиологических нарушений (тромбоцитопения, ПДФ), гиперферментемия (АСТ, АЛТ, ЩФ) и интоксикационный синдром (МСМ, ТСА).
В отличие от острофазовых белков концентрация ТСА в сыворотке больных, прошедших МДМ-терапию, не отличалась от контрольной группы, что свидетельствует о невыраженности эндотоксикоза при неосложненных изолированных переломах длинных костей.
Установлено, что кроме ТСА, сильную связь с маркерами интоксикации (МСМ и ЛИИ) при травматическом токсикозе как на фоне тяжелой ЧМТ, так и при травме ОДА демонстрируют АФП, СБАГ и ТК, кортизол, ПДФ, умеренную — СРБ, ЛФ и некоторые другие БОФ.
У больных из групп ОДА III, сочетанной и изолированной и ЧМТ II обнаружена корреляция уровней АФП, СБАГ, ТК и альбумина как со степенью выраженности интоксикационного синдрома, так и со степенью выраженности SIRS в баллах. Показано, что белки с транспортной функцией в большей степени коррелируют со степенью интоксикационного синдрома (r=0,86), и в меньшей с SIRS (r=0,58). Для СРБ и других БОФ, наблюдаются противоположные корреляционные отношения.
Ранними признаками инфекционных посттравматических осложнений является повторное нарастание СРБ, ПДФ и ЛФ. Повышенные уровни белка S-100 пропорциональные степени травмы обнаруживаются не только у пострадавших с ЧМТ, но и при переломах длинных костей, особенно у пострадавших с алкогольной болезнью и после первых сеансов МДМ-терапии. Клиническая эффективность МДМ-терапии коррелирует с нормализацией СРБ, СБАГ и IgM.
Включение в комплекс диагностических мероприятий у больных с переломами длинных костей и ЧМТ клинических (балльная оценка) и иммунохимических маркеров SIRS позволяет повысить точность прогноза осложнений. При отсутствии осложнений инфекционного характера на 3-4-ой неделе посттравматического периода диагностически и прогностически значимыми становятся онкомаркеры АФП и ПЩФ, уровни которых отражают степень консолидации длинных костей и репаративные процессы после ЧМТ.
Анализ полученных данных показал достоверные изменения содержания иммуноглобулинов IgA, IgG, IgM во всех группах в сроки 1-3, 5-7, 14-19 сутки после травмы.
Исследование содержания иммуноглобулинов IgA, IgG, IgM выявило следующие закономерности: IgA на 5-7 сутки в контрольной группе снижается с 1,94±0,09 г/л до 1,78±0,12 г/л и почти восстанавливается до прежнего уровня к 14–19 суткам 1,92±0,08 г/л; в группе больных, получавших мезодиэнцефальную модуляцию, наоборот наблюдается значительное повышение содержания иммуноглобулинов этого класса до 2,09±0,09 г/л через 5-7 суток после травмы с восстановлением данного показателя на несколько более высоком уровне к 14–19 суткам.
Для иммуноглобулинов IgG так же характерно снижение в контрольной группе на 5 –7 сутки с 9,02 ± 0,19 г/л до 8,10±0,09 г/л с восстановлением к 14–19 суткам (9,00±0,08 г/л), в то время как в группе МДМ снижение носит незначительный характер (8,92±0,08 г/л) на 5-7 сутки и восстановление показателей к 19 суткам до прежнего уровня (рис.9).

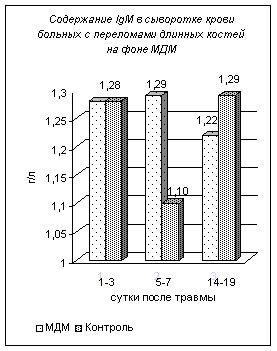
Рис.9. Рис.10.
Динамика содержания иммуноглобулинов класса IgM (рис.10) у больных с переломами длинных костей на фоне проводимой мезодиэнцефальной модуляции и в контрольной группе несколько отличается. Восстановление его до исходного уровня 1,22±0,02 г/л к 14–19 суткам происходит только в группе больных, которым назначена МДМ – терапия. На 5–7 сутки в этой группе повышение их незначительно 1,29 ± 0,05 г/л. В контрольной группе к 14–19 суткам восстановления содержания этих иммуноглобулинов не происходит 1,10±0,02 г/л, а в сроки 5–7 суток после травмы эти значения ниже, чем в МДМ – группе 1,06±0,03 г/л.
Из онкомаркеров альфа-фетопротеина (АФП), раково-эмбрионального антигена (РЭА) и плацентарной щелочной фосфатазы (ПЩФ) последний имел пик на 1-3 день, а не на 5-7-й день, как АФП и РЭА и постепенно снижается до нормы к 21 дню. Содержание АФП и РЭА в 1-3 сутки возрастает в полтора-два раза, достигая максимальных значений в конце первой недели (рис.43), в дальнейшем уровень РЭА снижается до нормы к 21-28 дню, а уровень АФП продолжает оставаться повышенным (рис.11).
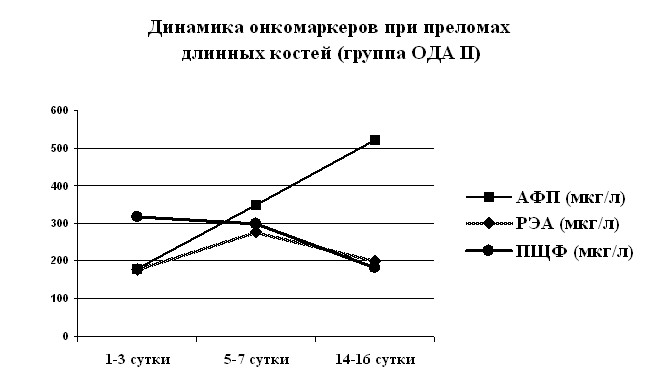
Рис.11. Динамика онкомаркеров при переломах (группа ОДАII) в %
Содержание в сыворотке АФП, ПЩФ в большей степени зависит от тяжести травмы, чем РЭА. Максимальный уровень АФП при тяжелых травмах, осложненных травматическим шоком, возрастает по сравнению с донорами в 10 раз.
Повышенные концентрации ПЩФ при переломах в отдаленные сроки выявляется лишь у части больных с выраженным регенераторным ответом и коррелирует с активной консолидацией перелома. При этом успешно репонированные переломы одной из костей голени и бедра не приводили к появлению повышенных уровней ПЩФ. При вяло текущем заживлении, даже в случаях множественных и открытых переломов с повреждением окружающих тканей, появление ПЩФ было не характерно.
ВЫВОДЫ
- На аффинных (иммобилизованный эстадиол и цибакроновый синий), гидрофобных и амфифильных сорбентах исследованы хроматографические свойства ассоциированных с этими лигандами белков альфа-фетопротеина (АФП), сывороточного альбумина (СА), транскортина (ТК), СБАГ и ПЩФ и установлены факторы, позволяющие управлять их поведением в колонке.
- Разаработаны методы выделения и очистки ТК, СБАГ и ПЩФ, получены моноспецифические антисыворотки на эти белки и сконструированы иммунохимические тест системы для их определения методами иммунодиффузионного и иммуноферментного анализа.
- Установлена обратная корреляционная зависимость между концентрацией гидрофобного и гидрофильного низкомолекулярного лиганда, адсорбированного на поверхности макромолекулы альбумина, и степенью его термической денатурации. Разработан способ количественной оценки эндогенной интоксикации по нарастанию уровня термостабильной фракции сывороточного альбумина.
- Установлена прямая корреляционная зависимость между степенью тяжести повреждения в баллах по шкалам AIS и ВПХ-П и сывороточным уровнем ферритина (Фр), КФК, белка S-100 и кортизола (для ЧМТ) или уровнем Фр, КФК, миоглобина, кортизола и мочевины (для переломов длинных костей). Повышенные уровни белка S-100 обнаруживаются не только у пострадавших с ЧМТ, но и при переломах длинных костей у пострадавших с алкогольной болезнью, а также после первых сеансов МДМ-терапии.
- Средние концентрации Фр при ЧМТ I составили 166±24,7; при ЧМТ II – 222±33,7; при сочетанной ЧМТ – 296±73,9; при травме ОДА I – 103±12,5; при травме ОДА II – 136±24,1; при травме ОДА III – 168±26,5; у доноров – 86±13,2 нг/мл. Повышение уровня Фр в крови выше 150 нг/мл является референтным для ЧМТ и может быть вместе с белком S-100 рекомендовано для качественных экспресс-тестов для догоспитальной диагностики.
- При равной оценке степени тяжести ЧМТ по шкале ком Глазго наличие и отсутствие сопутствующей травме алкогольной интоксикации проявляются разными биохимическими и иммунохимическими профилями. Отношение ферритин/глюкоза достоверно выше (p<00,1) у пострадавших с алкогольной интоксикацией.
- Уровень ЛФ в сыворотке крови достоверно повышается с первых дней травмы только у больных с сочетанной ЧМТ. Увеличение концентрации ЛФ на фоне синдрома взаимного отягощения повреждений указывает на одновременное с процессами деструкции начало активизации факторов специфической иммунной защиты.
- Оценка состояния пострадавшего по шкалам ВПХ-СП, ВПХ-СГ и APASHE-2, после травмы коррелирует с клиническими, биохимическими и иммунохимическими маркерами гипоксии, гиперферментемии (АСТ, АЛТ, ЩФ), гемостазиологических нарушений (тромбоцитопения, ПДФ), травматического токсикоза и синдрома системного воспалительного ответа (ССВО, SIRS).
- Клинические параметры SIRS (лихорадка, лейкоцитоз, тахикардия) входящие в шкалу оценки состояния реанимационных больных APASHE-2 и измеренные в баллах, находятся в тесной взаимосвязи с концентрацией белков острой фазы (СРБ – r=0,97), (СБАГ – r=0,92), (ЦП – r=0,91), (ЛФ – r=0,89), (ПДФ – r=0,81), (МГ – r=0,75), (СА – r=–0,67), (Фр – r=0,65) и в слабой связи (r=0,3-0,4) с транспортными белками и онкомаркерами (ТК, АФП, РЭА, ПЩФ). Ранними признаками инфекционных посттравматических осложнений является повторное нарастание СРБ, СБАГ, ПДФ и ЛФ. Одновременное появление, определяемых иммунодиффузионными методами концентраций СРБ, ПДФ, ПЩФ и подъем уровней ЛФ более 1000 нг/мл и Фр свыше 200 нг/мл характерно для гипостатической или нозокомиальной (внутрибольничной) пневмонии.
- Лабораторные параметры интоксикационного синдрома (МСМ, ЛИИ) демонстрируют сильную связь (r=0,90-0,80) с концентрацией термостабильной фракции альбумина (ТСА), миоглобина, ТК, кортизола, ПЩФ, ЦП, ПДФ, трансаминаз и умеренную связь с другими БОФ (СРБ – r=0,67), (СБАГ – r=0,65), (ЛФ – r=0,44), (МГ – r=0,39), (Фр – r=0,36).
- Лабораторные показатели красной крови свидетельствуют о развитии у больных с тяжелой сочетанной ЧМТ (группа ЧМТ+ОДА), синдрома взаимного отягощения повреждений, проявляющегося более выраженной анемизацией, по сравнению с больными с изолированной ЧМТ II и травмой ОДА III, и об отсутствии симптомов анемизации в группах ЧМТ I и ОДА I. В первые дни после ЧМТ и скелетной травмы обнаружено достоверное снижение в крови уровня фетального гемоглобина HbF. Начиная с 3-й недели во всех группах, отмечается повышение абсолютного (г/л) и относительного (HbF/Hb в %) уровней HbF. Не обнаружено взаимосвязи (r=0,1) между степенью сатурации артериальной крови кислородом (рО2) и содержанием в венозной крови HbF.
- У больных из групп с травмами ОДА I-II и ЧМТ I обнаружена более ранняя нормализация всех показателей в условиях применения неспецифической транскутанной электроимпульсной стимуляции головного мозга методом МДМ-терапии. Использование мезодиэнцефальной модуляции с первых суток после получения травмы позволяет снизить количество гипостатических пневмоний в 1,9 раз, уменьшить число воспалительных местных послеоперационных осложнений в 3,4 раза, количество вялоконсолидирующих переломов и ложных суставов в 3,3 раза.
Практические рекомендации
- Способность стероидсвязывающих и транспортных белков изменять в широких пределах свои хроматографические характеристики в присутствии специфичных и неспецифичных лигандов различной природы позволяет управлять их сорбционными свойствами и добиваться разделения близких по физико-химическим свойствам белков.
- Предлагаемые схемы выделения альбумина, АФП, ПЩФ, СБАГ и транскортина с помощью аффинной, высаливающей и гидрофобной хроматографии дают возможность при минимальных экономических затратах очищать белки для последующего получения на эти белки моноспецифических антисывороток.
- Для определения связывающей емкости альбумина по отношению к низкомолекулярным веществам-токсинам целесообразно применять иммунохимический способ измерения термостабильной фракции сывороточного альбумина (ТСА), с последующим вычислением соотношения ТСА/СА. Этот же иммунохимический метод может быть использован для количественной оценки синдрома эндогенной интоксикации.
- Ранними признаками инфекционных посттравматических осложнений является повторное нарастание СРБ, СБАГ, ПДФ и ЛФ. Одновременное появление, определяемых иммунодиффузионными методами концентраций СРБ, ПДФ, ПЩФ и подъем уровней ЛФ более 1000 нг/мл и Фр свыше 200 нг/мл позволяет для гипостатической пневмонии.
- Коэффициент ферритин/глюкоза при ЧМТ на фоне алкогольной интоксикации в 2 раза выше (42,0 и 19,7 соответственно), чем у пострадавших с ЧМТ без признаков алкогольной интоксикации. Рекомендуется использовать данное отношение для дифференциальной диагностики токсической и травматической комы..
- При оценке тяжести состояния и прогнозировании исходов изолированной и сочетанной ЧМТ и травмы ОДА в острейшем периоде повреждения (1-7 сутки) следует неоднократно в динамике сопоставлять параметрическую оценку состояния пострадавшего в баллах с наиболее значимыми лабораторными показателями (уровни красной и белой крови, БОФ, АСТ, АЛТ, тромбоцитов, HbF, мочевины, глюкозы) для своевременной коррекции интенсивной терапии.
- Для оценки степени гипоксии при тяжелой нейро- и скелетной травме наряду с показателями оксигенации (рО2), кровопотери ( уровень альбумина и гравиметрия крови) и анемии (RBC, HGB, HCT) рекомендуется использовать иммунохимический тест на фетальный гемоглобин и коэффициент HbF/HbA.
- В комплексную терапию всех больных с ЧМТ легкой степени и диафизарными переломами длинных костей, особенно пострадавших с алкогольной интоксикацией при поступлении, необходимо с первых суток включать МДМ-терапию, что позволяет уменьшить вероятность истощения адаптационного потенциала и предотвращает развитие гиперкатаболизма и осложнений раннего периода травматической болезни.
- При оценке тяжести состояния и прогнозировании исходов изолированной и сочетанной ЧМТ и травмы ОДА в острейшем периоде повреждения (1-10 сутки) следует неоднократно в динамике сопоставлять клиническую оценку состояния пострадавшего в баллах (ВПХ, SCG, триада SIRS) с наиболее значимыми лабораторными показателями (уровни иммунохимических маркеров, биохимических и гематологических показателей). Иммунохимические тесты на СРБ, СБАГ, ЦП, ЛФ, МГ, HbF, АФП, ПЩФ, Фр, ТСА, ТК, MG рекомендуются для оценки эффективности лечения и прогноз течения травматической болезни мозга и ОДА.
Список работ, опубликованных по теме диссертации
- Коханов А.В., Ульянов А.А. К вопросу о физиологической роли альфа-фетопротеина: влияние на процессы регенерации и воспаления // Особенности физиологии и патологии детей раннего возраста. - Саратов. - 1984. - С.19-23.
- Коханов А.В. Возможности гидрофобной хроматографии в разделении белков с высокой степенью гомологии // Тезисы докладов 66-й научной конференции Астр.мединститута - Астрахань. - 1985. - С.91-92.
- Мирошников В.М., Резников И.И., Коханов А.В. Сравнительная оценка действия некоторых сывороточных белков на регенерацию тканей // Бюлл. эксперим. биологии. – 1987. - №1. – С. 95 - 97.
- Коханов А.В., Ульянов А.А., Коханов С.В. Четвертьвековой юбилей в иммунодиагностике: некоторые итоги и перспективы изучения первого иммунохимического маркера рака // Пролиферация и рак: медико-биологические проблемы. Сборник научных трудов. - Саратов. - 1988. - С.10-18.
- Мирошников В.М., Коханов А.В. Иммунобиологические особенности регенерации при использованиии официнальных белковых препаратов // Патол. физиология и эксперим. терапия. – 1988. - №4. – С. 54 - 57.
- Коханов А.В., Гайнуллина Л.Х. Белки беременности животных, их диагностическое значение // Сборник научных трудов СГУ. - Саратов. - 1990. - С.20-21.
- Гайнуллина Л.Х., Коханов А.В. Антигены репродуктивной системы млекопитающих и их значение для экологического мониторинга // Влияние антропогенных факторов на морфогенез и структурные преобразования органов. Материалы Всероссийской конференции. Астрахань. - 1991. - С.35-36.
- Коханов А.В., Костина Л.А. Тест на стадиоспецифические белки как дополнительный критерий иммунологической реактивности организма для оценки экзогенных повреждающих факторов // Влияние антропогенных факторов на морфогенез и структурные преобразования органов. Материалы Всероссийской конференции. Астрахань. - 1991. - С..81-82.
- Мамиев О.Б., Коханов А.В. Специфичность аутоантител у женщин в гестационном периоде // Сборник докладов IV съезда врачей и провизоров Калмыцкой АССР. – Элиста. – 1990. – С.91-92
- Гончарова Л.А., Коханов А.В., Корнеев Н.В. Значение иммунохимических исследований в процессе хирургического лечения ортопедических больных // Хирургия на пороге XXI века. Труды АГМА - Астрахань. - 2000. Т.18. - С.157-163.
- Коханов А.В., Костина Л.А., Коханов С.В., Основин С.А. Эмбриональные костно-хрящевые протеины: возможности в диагностике, профилактике и терапии // Структурные преобразования органов и тканей на этапах онтогенеза человека в норме и при воздействии антропогенных факторов. Экология и здоровье населения. Актуальные проблемы биологии и медицины. Материалы международной конференции. Астрахань. - 2000. - С.83-84.
- Коханов А.В., Костина Л.А., Шац Е.И., Корнеев Н.В. Острофазовые белки и аутоантитела к тканевым антигенам как маркеры хронических деструктивно-пролиферативных процессов костной ткани // Хирургия на пороге XXI века. Труды АГМА - Астрахань. - 2000. Т.18. - С. 225-230.
- Коханов А.В., Мирошников В.М., Костина Л.А., Суринков Д.Б. Иммунохимический мониторинг в процессе хирургического лечения травмы опорно-двигательного аппарата // Структурные преобразования органов и тканей на этапах онтогенеза человека в норме и при воздействии антропогенных факторов. Экология и здоровье населения. Актуальные проблемы биологии и медицины. Материалы международной конференции. Астрахань. - 2000. - С. 232-233.
- Безрукавникова Н.В., Никулина Д.М., Коханов А.В., Григорьева Т.А. Иммунохимические маркеры в клинической оценке дисгормональных заболеваний и гормонзависимых опухолей // Материалы пятой научной конференции с международным участием «Дни иммунологии в Санкт-Петербурге 2001». – Медицинская иммунология - С-Пб. – 2001. - Т.3. - №2. – С. 263.
- Коханов А.В., Мирошников В.М., Суринков Д.Б., Коханов С.В. Стадиоспецифические антигены в оценке эффективности лечения больных с переломами длинных костей методом МДМ – терапии // Материалы пятой научной конференции с международным участием «Дни иммунологии в Санкт-Петербурге 2001». – Медицинская иммунология - С-Пб. – 2001. - Т.3. - №2. – С. 323.
- Коханов А.В., Гончарова Л.А., Костина Л.А. Иммунохимические маркеры в оценке и прогнозировании результатов лечения детей с травмами и заболеваниями опорно-двигательного аппарата // Актуальные проблемы педиатрии. Труды АГМА. - Астрахань. - 2001. Т.23. - С.95-97.
- Коханов А.В., Гончарова Л.А., Суринков Д.Б., Костина Л.А. Особенности антигенного и изоферментнорго спектров костной ткани в процессе перинатального остеогенеза. // Материалы 78-й итоговой конференции АГМА - Астрахань. - 2001. Т.22. - С.94-97.
- Суринков Д.Б., Коханов А.В. Маркеры репаративной регенерации, иммунного статуса и адаптационных реакций у больных с переломами длинных костей на фоне мезодиэнцефальной модуляции // Материалы конференции молодых ученых с международным участием «Белки-маркеры патологических состояний». – Астрахань-Москва. – 2001. – С.144-146.
- Асфандияров Р.И., Лазько А.Е., Коханов А.В. Изомеры щелочной фосфатазы и остеогенез // Морфология. – 2002. – Т. 121 - №2-3. – С. 13
- Демичев Н.П., Резаев А.А., Суринков Д.Б., Коханов А.В. Влияние мезодиэнцефальной модуляции на иммунологические показатели крови у больных с переломами длинных костей // Вестник новых медицинских технологий. – 2002. – Т.IX - №2. – С. 46-47.
- Демичев Н.П., Резаев А.А., Суринков Д.Б., Коханов А.В. Коррекция иммунологических нарушений у больных с переломами длинных костей методом мезодиэнцефальной модуляции // Современные технологии лечения и реабилитации повреждений и заболеваний опорно-двигательной системы. Материалы VII съезда травматологов-ортопедов Республики Беларусь, Гомель, 3-5 октября 2002 г. - Минск. - 2002. - С. 159-161.
- Демичев Н.П., Резаев А.А., Суринков Д.Б., Коханов А.В. Мезодиэнцефальная модуляция как метод повышения адаптации больных с переломами длинных костей // Международный медицинский журнал. – 2002. – Т.8 - №3. – С. 94-95.
- Демичев Н.П., Резаев А.А., Суринков Д.Б., Коханов А.В. Содержание мочевины в сыворотке крови больных с переломами длинных костей на фоне мезодиэнцефальной модуляции // Труды АГМА - Астрахань. - 2002. Т.24. - С.199-204.
- Коханов А.В., Мирошников В.М., Суринков Д.Б., Демичев Н.П. Онкомаркеры при физиологической и патологической консолидации переломов длинных костей // Материалы III съезда биохимического общества РАН. С-Пб. – 26 июня - 1 июля 2002. С.180-181.
- Демичев Н.П., Коханов А.В., Суринков Д.Б. Уровни термостабильного альбумина и плацентарной щелочной фосфатазы в процессе консолидации переломов длинных костей // Белки-маркеры патологических состояний - Материалы 3-й научной конференции и школы-семинара для молодых ученых – Астрахань. – 2003. – С.94-97.
- Коханов А.В., Смычкова Е.В., Белопасов В.В., Суринков Д.Б. Изменения уровня сывороточного лактоферрина после ЧМТ и скелетной травмы // Теоретические вопросы современной медицины (по материалам научно-практической конференции, посвященной 85-летию ВУЗа). Труды АГМА - Астрахань. - 2003. Т.28. - С.133-138.
- Коханов А.В., Суринков Д.Б., Дячина М.Н., Костина Л.А. Особенности антигенного и изоферментного спектров костной ткани при остеомиелитах различной этиологии // Теоретические вопросы современной медицины (по материалам научно-практической конференции, посвященной 85-летию ВУЗа). Труды АГМА - Астрахань. - 2003. Т.28. - С.129-132.
- Смычкова Е.В., Белопасов В.В, Коханов А.В., Широков Н.А., Барабаш В.И. Железосодержащие белки в оценке степени тяжести закрытой черепно-мозговой травмы // Белки-маркеры патологических состояний - Материалы 3-й научной конференции и школы-семинара для молодых ученых – Астрахань. – 2003. – С.148-153.
- Суринков Д.Б., Коханов А.В. Иммунохимический контроль эффективности лечения больных с переломами длинных костей методом МДМ – терапии // Современные проблемы развития регионального здравоохранения.-Казань: Арт-Кафе, 2003. - С.235
- Безрукавникова Н.В., Коханов А.В., Гречухин С.Н. Иммунохимический анализ транспортной функции сывороточных белков // Современные достижения фундаментальных наук в решении актуальных проблем медицины - Материалы научно-практической конференции и школы-семинара для молодых ученых с международным участием – Астрахань-Москва. – 2004. – С.114-118.
- Демичев Н.П., Коханов А.В., Суринков Д.Б Кинетика белков воспаления и иммунитета в крови у больных с переломами длинных костей под воздействием мезо-диэнцефальной модуляции // Анналы травматологии и ортопедии. – 2004. – №1. – С. 47-52.
- Волохина И.В, Демичев Н.П., Коханов А.В., Суринков Д.Б. Влияние мезодиэнцефальной модуляции на показатели красной крови у больных с переломами длинных костей // Вестник новых медицинских технологий. –2004. – Т.X - №1-2. – С.
- Метелкина Е.В., Коханов А.В., Агапова А.Б., Кривенцев Ю.А., Суринков Д.Б. Железосодержащие белки в остром периоде черепно-мозговой и скелетной травмы травмы // Современные достижения фундаментальных наук в решении актуальных проблем медицины - Материалы научно-практической конференции и школы-семинара для молодых ученых с международным участием – Астрахань-Москва. – 2004. – С.114-118.
- Коханов А.В. / Возможность использования иммуносенсоров в ургентной медицине // Успехи современного естествознания. - 2005. - № 12.-С.43-44
- Коханов А.В., Метелкина Е.В., Барабаш В.И. Уровень термостабильной изоформы альбумина крови как показатель степени интоксикации // Эколого-биологические проблемы бассейна Каспийского моря. — Материалы 8-й Международной конференции. 11-12 октября 2005 г. – Астрахань. - 2005. - С.199-200
- Коханов А.В., Петрова О.В., Попов С.Н., Гордиенко А.А. Применение иммунопероксидазных комплексов в иммунодиффузионном анализе новых антигенов костной ткани // Актуальные вопросы современной медицины (по материалам научно-практической конференции, посвященной 87-летию ВУЗа). Труды АГМА - Астрахань. - 2005.- Т.31. - С.147-150
- Коханов А.В., Юсупов Р.Ш. Колебания уровней сывороточных белков и реактантов острой фазы у больных с тяжелой травмой на протяжении суток // Актуальные вопросы современной медицины (по материалам научно-практической конференции, посвященной 87-летию ВУЗа). Труды АГМА - Астрахань. - 2005.- Т.31. - С.150-153
- Коханов А.В., Анферов А.А., Мустафин Р.Д. Иммунохронобиологический анализ в оценке критических состояний в абдоминальной хирургии // Актуальные вопросы современной хирургии — Материалы Всероссийской конференции, посвященной 85-летию Астраханского областного научного медицинского общества хирургов — Астрахань, 2006. — С.110-111.
- Коханов А.В., Метелкина Е.В., Кривенцев Ю.А., Белопасов В.В. Суточные ритмы показателей системы эритрона у больных с тяжелой черепно-мозговой травмой // Актуальные вопросы современной медицины (по материалам научно-практической конференции, посвященной 88-летию ВУЗа). Труды АГМА - Астрахань. - 2006.- Т.33. - С.264-267
- Коханов А.В., Метелкина Е.В., Суринков Д.Б., Юсупов Р.Ш., Мамедов А.Э., Черкашина О.В. Суточные ритмы показателей красной крови в норме // Достижения фундаментальных наук в решении актуальных проблем медицины — Материалы 5-й научно-практической конференции с международным участием – Астрахань-Волгоград-Москва, 2006. – С. 305-307
- Кчибеков Э.А., Коханов А.В., Метелкина Е.В., Белопасов В.В., Суринков Д.Б., Антонова Л.Н. Уровни лактоферрина, ферритина и фетального гемоглобина при заболеваниях гепатобилиарной зоны и травмах // Актуальные вопросы современной хирургии — Материалы Всероссийской конференции, посвященной 85-летию Астраханского областного научного медицинского общества хирургов — Астрахань, 2006. — С.313-314.
- Безрукавникова Н.В., Коханов А.В., Кривенцев Ю.А., Никулина Д.М., Берштейн Л.М., Кутуков В.В. Стероидсвязывающие белки у больных раком молочной железы // Вопросы онкологии. - 2007.- Т.53. – №4- С.409-413
- Безрукавникова Н.В., Коханов А.В. Физико-химическая характеристика транскортина и подходы к его очистке // Актуальные вопросы современной медицины (по материалам научно-практической конференции, посвященной 89-летию АГМА). Труды АГМА - Астрахань. - 2007.- Т.35. - С.243-246
- Коханов А.В., Белопасов В.В., Барабаш В.И., Мустафин Р.Д., Парфенов Л.Л., Анферов А.А., Волохина И.В., Суринков Д.Б. Сывороточные белки – маркеры интоксикации // Астраханский медицинский журнал. – 2007. – №1. – С. 100
- Коханов А.В., Белопасов В.В., Меркулов А.М., Волохина И.В., Суринков Д.Б. Лактоферрин и ферритин в оценке тяжести политравмы // Астраханский медицинский журнал. – 2007. – №1. – С. 100-101
- Коханов А.В., Касаткин В.Н., Курьянов П.М., Медведев Р.А. Методы лабораторной экспресс-диагностики в практике врача скорой медицинской помощи // Актуальные вопросы современной медицины (по материалам научно-практической конференции, посвященной 89-летию АГМА). Труды АГМА - Астрахань. - 2007.- Т.35. - С.238-242
- Коханов А.В., Николаев А.А. Биохимические аспекты патологических изменений у больных с тяжелой черепно-мозговой травмой // Клиническая лабораторная диагностика. – 2007. – №9. – С. 63
- Коханов А.В., Николаев А.А. Определение онкомаркеров и железосодержащих белков в различные периоды травмы опорно-двигательного аппарата // Клиническая лабораторная диагностика. – 2007. – №9. – С. 63-64
- Безрукавникова Н.В., Коханов А.В. Транскортин как онкомаркер // Астраханский медицинский журнал. – 2008. – №1. – С. 9-11
- Коханов А.В., Белопасов В.В., Метелкина Е.В., Демичев Н.П., Ларионов А.А., Суринков Д.Б., Николаев А.А., Петрова О.В. Взаимосвязь уровней сывороточных, острофазовых белков и онкомаркеров с количественной оценкой тяжести травмы и общего состояния пострадавших. // Клиническая лабораторная диагностика. – 2008. – №9. – С. 40
- Коханов А.В., Белопасов В.В., Метелкина Е.В., Демичев Н.П., Ларионов А.А., Суринков Д.Б., Петрова О.В. Иммунохимические особенности сыворотки крови у больных с изолированной ЧМТ и травмой опорно-двигательного аппарата (ОДА) // Российский иммунологический журнал. – 2008. – Т.2. – №2-3. – С. 143
- Коханов А.В., Кривенцев Ю.А., Никулина Д.М., Белопасов В.В., Метелкина Е.В. Фетальный гемоглобин как маркер гипоксии при ЧМТ // Астраханский медицинский журнал. – 2008. – №1. – С. 171-173
- Мусатов О.В., Коханов А.В. Альфа-фетопротеин как маркер репаративных и иммунорегуляторных процессов после пластических операций // Российский иммунологический журнал. – 2008. – Т.2. – №2-3. – С. 181
- Мусатов О.В., Коханов А.В., Мустафаев И.М-А., Луцева О.А., Медведев Р.А. Альфа-фетопротеин как маркер репаративной регенерации // Астраханский медицинский журнал. – 2008. – №1. – С. 34-35
- Петрова О.В., Коханов А.В., Лапин А.А., Казимирова Е.И. Уровни ферритина в тканях больных с алкогольной болезнью // Вопросы наркологии. – 2008. – – №5. – С. 54-57
Патенты на изобретения
- Способ определения связывающей емкости альбумина человека / приоритет от 11.12.2007 Заявка № 2007146077 (050497). (Коханов А.В.).
- Способ компрессионного артродеза голеностопного сустава при травматическом остеоартрозе / приоритет от 09.01.2008 Заявка № 2008100976 (001068) (Коханов А.В., Ларионов А.А., Суринков Д.Б.).
Список использованных сокращений
АИ – алкогольная интоксикация
АФП – альфа-фетопротеин
БОФ – белки «острой» фазы
Д,кД – дальтон, килодальтон
ИФА – иммуноферментный анализ
ККФ – костная кислая фосфатаза
ЛИИ – лейкоцитарный индекс интоксикации
ЛФ – лактоферрин
МГ – 2-макроглобулин
МДМ – мезодиэнцефальная модуляция (метод ТКЭС-терапии)
МСМ – молекулы средней массы
ОДА – опорно-двигательный аппарат
ПДФ – продукты деградации фибриногена
ПЩФ – щелочная фосфатаза плацентарного типа
РИА – радиоиммунный анализ
РЭА – раково-эмбриональный антиген
СА – сывороточный альбумин
СБАГ – связанный с беременностью альфа2-гликопротеин (2-PAG)
СГМ, УГМ – сотрясение (ушиб) головного мозга
СРБ – С - реактивный белок (CRP)
ТБ – травматическая болезнь
ТК – транскортин
ТКЭС – транскраниальная электростимуляция головного мозга
ТСА – термостабильная фракция сывороточного альбумина
Фр – ферритин
ЦП – церуллоплазмин
ЧМТ – черепно-мозговая травма
AIS, ISS – международные шкалы тяжести повреждений
APASHE-2 шкала оценки тяжести состояния
HbA – гемоглобин А
HbF – фетальный гемоглобин F
IgM, IgG, IgA – иммуноглобулины трех классов
pO2 – напряжение кислорода (показатель оксигенации крови)
S-100 – нейроспецифический белок S-100
SCG – шкала комы Глазго
SIRS – синдром системного воспалительного ответа (ССВО)
КОХАНОВ
Александр Владимирович
ИММУНОХИМИЧЕСКИЕ показатели
В КЛИНИЧЕСКОЙ ОЦЕНКЕ
черепно-мозговой и скелетной травмы
03.00.04. Биохимия
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Тираж 100 экз. Подписано в печать 26.02.09г. Заказ № 2546
Издательство ГОУ ВПО «Астраханская государственная медицинская академия Росздрава», 414000, г. Астрахань, ул. Бакинская, 121

