Пути усовершенствования живой гриппозной вакцины и тактики ее применения при подготовке к пандемии
На правах рукописи
ДЕШЕВА
Юлия Андреевна
ПУТИ УСОВЕРШЕНСТВОВАНИЯ ЖИВОЙ ГРИППОЗНОЙ ВАКЦИНЫ
И ТАКТИКИ ЕЕ ПРИМЕНЕНИЯ ПРИ ПОДГОТОВКЕ К ПАНДЕМИИ
03.00.06 – Вирусология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Санкт-Петербург - 2009
Работа выполнена в отделе вирусологии им. А.А. Смородинцева
ГУ Научно-исследовательский институт экспериментальной медицины РАМН
Научный консультант:
доктор медицинских наук, профессор,
заслуженный деятель науки РФ Руденко Лариса Георгиевна
Официальные оппоненты:
доктор медицинских наук, академик РАМН,
профессор Зверев Виталий Васильевич
доктор медицинских наук, профессор Кузнецов Олег Константинович
доктор медицинских наук Зазимко Любовь Александровна
Ведущая организация: ГУ научно-исследовательский институт вирусологии
им Д.И. Ивановского РАМН
Защита состоится 31 марта 2009 г. в «____» часов на заседании диссертационного совета Д 001.043.01 при ГУ Научно-исследовательский институт гриппа РАМН (197376, Санкт-Петербург, ул. профессора Попова, 15/17)
С диссертацией можно ознакомиться в библиотеке ГУ НИИ гриппа РАМН
Автореферат разослан «_______» февраля 2009 г.
Ученый секретарь
диссертационного совета
кандидат медицинских наук В.Ф. Суховецкая
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Грипп является глобальной инфекцией, которая в период сезонных эпидемий поражает от 10 до 20% населения планеты, а также единственной, способной вызвать в современном мире пандемии. До настоящего времени было известно 3 подтипа вируса гриппа, вызвавшие пандемии: A(H1N1) - в 1918 г., A(H2N2) – в 1957 г., A(H3N2) – в 1968 г. Начиная с 1997 г., высокопатогенные (ВП) вирусы гриппа подтипа A(H5N1), циркулирующие среди дикой и домашней птицы в Юго-восточной Азии и других регионах мира, вызвали заболевание 390 человек с необычайно высокой смертностью, которая составила более 60%. Анализ вирусов гриппа А(H5N1), выделенных как от людей, так и от птиц, показал, что за последние 7-8 лет вирусы этого подтипа разделились на несколько линий, существенно отличающихся между собой, как антигенно, так и генетически. Клиническая картина при инфекции людей вирусами А(H5N1) характеризуется тяжестью клинических симптомов, связанных с проявлениями острой дыхательной и сердечно-сосудистой недостаточности, признаками гепатита и тяжелой лимфопении. Дикие перелетные, особенно водоплавающие птицы являются одновременно природным резервуаром и переносчиком инфекции из стран Юго-Восточной Азии в другие регионы. Начиная с 2006 г., помимо Азии возбудитель распространился и внедрился в экологическую природную систему всей Европы, а также северной и центральной частей Африки. Не осталась незатронутой и территория России. Несмотря на то, что до сих пор не было получено убедительных данных об устойчивой передаче вируса А(H5N1) от человека к человеку (Katz et al., 1999, Ungchusak et al., 2005, Uyeki et al., 2008), что ознаменовало бы начало новой пандемии, продолжающееся заражение людей создает угрозу возникновения пандемической ситуации (Guan, 2004; Webster, 2005). В настоящее время ситуация по гриппу в мире оценивается согласно классификации Всемирной Организации Здравоохранения (ВОЗ, 2005) как «Период угрозы пандемии, фаза 3», для которого характерно выявление случаев заражения людей новыми подтипами вируса, но при этом отсутствует устойчивая передача вируса от человека к человеку.
В качестве потенциального источника нового пандемического штамма рассматриваются также вирусы птичьего гриппа других подтипов, способные передаваться людям: А(H9N2), А(H7N7). Опыт возникновения пандемий гриппа не исключает также возврата в циркуляцию вируса человека A(H2N2), который вызвал пандемию в 1957 году. В практике уже имеется пример возвращения ранее циркулирующих штаммов, как это было в 1977 г. с вирусом гриппа A(H1N1). Около 70% населения нашей страны не никогда встречались с вирусом А(H2N2) и не имеют иммунитета к нему. Однако вирусы этого подтипа продолжают циркулировать в популяциях животных (птиц, свиней), что увеличивает риск заболевания людей. В США в 2006 году от свиней с бронхопневмонией были выделены вирусы подтипа А(H2N3) (Ma et al., 2007). Молекулярный анализ НА и NA вирусов А(H2N3) показал, что они имеют птичье происхождение, но оба вируса уже приобрели признаки, характерные для вирусов млекопитающих. Это наблюдение подтверждает роль свиней как промежуточных хозяев при адаптации вирусов гриппа птиц перед передачей человеку.
В настоящий момент неизвестно, какой подтип вируса гриппа может вызвать следующую пандемию, но необходимость срочной разработки эффективных мер и средств защиты человека от пандемии признается специалистами всего мира, что отражено в рекомендациях Всемирной организации Здравоохранения и Комитета США по практике иммунизации, а также приказах Министерства здравоохранения и социального развития РФ. Активная иммунизация общепризнанно считается наиболее эффективным медицинским средством профилактики вирусных инфекций. Опыт ликвидации наиболее опасных вирусных инфекций, таких как оспа, корь и полиомиелит позволяет заключить, что использование живых вакцин обеспечивает необходимую эффективность и результативность противоэпидемических мероприятий. На заседаниях ВОЗ 04.11.05 и 2.05-5.05.2006, посвященных разработке плана активных действий на пандемический период, живая гриппозная вакцина включена наряду с инактивированными вакцинами как средство профилактики пандемического гриппа.
Современные живые гриппозные вакцины (ЖГВ) включают аттенуированные штаммы вирусов гриппа, полученные методом генетической реассортации. Гены, кодирующие гемагглютинин (HA) и нейраминидазу (NA), наследуются от антигенно актуального штамма, а шесть генов, кодирующих негликозилированные белки – от холодоадаптированного (ХА) «донора аттенуации». В России в течение многих лет вакцинные штаммы вируса гриппа А, включаемые в состав ЖГВ для взрослых, подготавливают на основе ХА донорского штамма подтипа H2N2 - А/Ленинград/134/17/57 (Александрова, 1977), полученного путем последовательных пассажей в куриных эмбрионах при пониженной до 25-26С температуре. Для создания рекомбинантных штаммов ЖГВ для детей 3-14 лет был подготовлен дополнительно аттенуированный 30-кратным пассированием при низкой температуре донор аттенуации А/Ленинград/134/47/57(H2N2) (Гармашова с соавт., 1984). Изучение полной нуклеотидной последовательности генов, кодирующих негликозилированные белки доноров аттенуации А/Ленинград/134/17/57 и А/Ленинград/134/47/57, выявило ряд мутаций, ответственных за проявление этими штаммами признаков температурочувствительности, холодовой адаптации и аттенуации (Klimov, Cox, 1995). В отличие от ЖГВ для взрослых, которая вводилась однократно, детский вариант ЖГВ применялся при двукратном введении с интервалом в 4 недели. Для подготовки реассортантных вакцинных штаммов вирусов гриппа В, включаемых в состав тривакцины, используется донор аттенуации В/СССР/60/69.
Многолетнее изучение реассортантной ЖГВ подтвердило ее безвредность и эффективность (Alexandrova et al, 1986, Rudenko et al., 1993, Khan et al., 1996). В ряде широкомасштабных клинических испытаний было показано, что применение ЖГВ вызывает выраженную стимуляцию всех систем иммунного ответа (гуморального, локального, клеточного), включая сывороточные антитела, секреторные IgA, цитотоксические CD8+ Т-лимфоциты (Johnson et al. 1986, Найхин с соавт., 2000, 2002), обеспечивая формирование широкого спектра иммунитета против дрейфовых вариантов вирусов гриппа. Стимуляция неспецифических факторов иммунитета (интерферон, NK-клетки) обусловливает эффективность ЖГВ с первых дней применения (Rudenko et al., 2001). Создаваемый при применении ЖГВ уровень коллективного иммунитета, как показали исследования среди детей школьного возраста, играет значительную роль в ограничении распространения инфекции в обществе (Rudenko et al., 1993, Kendal et al., 1997, Monto et al., 1999).
Результаты целого ряда исследований свидетельствуют о генетической стабильности применяемых в настоящее время ХА донорских штаммов и реассортантов на их основе (Гендон с соавт., 1984, Klimov, Rudenko, 1996, Klimov et al., 2001). Клинические испытания американской реассортантной ЖГВ на основе донора аттенуации H2N2 А/Энн Арбор/6/60 показали, что при применении ЖГВ в условиях эпидемического подъема, вызванного вирусами А(H3N2), не происходило реассортации между вакцинными штаммами и дикими вирусами (Keitel et al., 1998). Более того, именно вакцинные штаммы выступали как доминирующие вирусы при опытах на хорьках и клиническом изучении у волонтеров, снижая уровень репродукции коинфицирующих диких вирусов (Whitaker-Dowling et al., 1991, Younger et al., 1994). Изучение полученных методами обратной генетики реассортантов американского донора аттенуации А/Энн Арбор/6/60(H2N2) с циркулирующим эпидемическим вирусом А/Сидней/5/97(H3N2) показало, что реассортанты с любым составом генома неизменно оказывались более аттенуированными по сравнению с эпидемическим вирусом, независимо от того, вводились ли гены ХА штамма в состав эпидемического вируса или наоборот, гены эпидемического вируса переходили к донору аттенуации (Parks et al., 2007).
Существенным практическим преимуществом использования ЖГВ является интраназальный (физиологический) путь введения в виде назального спрея. При этом стоимость живой вакцины, обусловленная особенностями технологического процесса, не требующего концентрации вирусного материала, в несколько раз меньше инактивированной. В случае возникновения пандемической ситуации повышение потребности в количестве доз инактивированной вакцины с учетом необходимости двукратной иммунизации, обусловленной отсутствием у людей предшествующего иммунитета к новому вирусу, может привести к недостатку производственных мощностей предприятий, производящих вакцину. В этом случае применение ЖГВ может значительно увеличить охват прививками.
К настоящему времени в России накоплен значительный опыт применения ХА реассортантной ЖГВ в практике здравоохранения, тем не менее, ряд теоретических и практических вопросов все еще оставался нерешенным.
Несмотря на то, что существующие в настоящее время доноры аттенуации, применяемые для подготовки реассортантов вирусов гриппа А, входящих в состав поливалентной ЖГВ - А/Ленинград/134/47/57(H2N2) (Россия) и А/Энн Арбор/6/60(США) - подробно охарактеризованы (определены основные мутации в их геноме, ответственные за проявление ts-фенотипа, изучена роль отдельных генов в аттенуации), не были определены мутации, ответственные за холодовую адаптацию вирусов гриппа, полученных в процессе пассирования при пониженной температуре. Не были проведены полное секвенирование и молекулярно-генетический анализ донора аттенуации вирусов гриппа В - В/СССР/60/69. Анализ реассортантов на основе В/СССР/60/69 проводился методами, требовавшими использования больших количеств концентрированного вирусного материала, что затрудняло проведение множественных исследований.
Не была разработана методика получения и оценки кандидатов в вакцинные штаммы ЖГВ для применения в случае пандемии, вызванной вирусом нового, не циркулирующего в настоящий момент подтипа.
До начала выполнения данной работы ЖГВ применялась для вакцинации лиц не старше 65 лет, а специфическая профилактика гриппа среди лиц пожилого в России не проводилась вообще.
До проведения настоящих исследований в России применялись два варианта ЖГВ – детский и взрослый, при этом использование для детского варианта ЖГВ специального донора аттенуации приводило к удорожанию производства вакцины. Необходимость двукратного введения детского варианта вакцины при вакцинации детей от 3-х лет затрудняло проведение вакцинопрофилактики в предэпидемический период, а также усложняло выполнение календаря плановых прививок против других инфекций.
Целью настоящей работы являлась разработка теоретических и научно-практических основ для создания, оценки и применения живой гриппозной вакцины против пандемически опасных вирусов гриппа.
Задачи исследования:
- Молекулярно-генетический анализ и сравнительная оценка на чувствительных моделях гриппозной инфекции (куриные эмбрионы, культура клеток MDCK, мыши, хорьки) безвредных для человека ХА штаммов вирусов гриппа А и В, полученных последовательным пассированием при пониженной температуре.
- Характеристика фенотипических и генотипических свойств ХА штамма А/Москва/21/17/65(H2N2) для применения в качестве нового донора аттенуации или вакцинного штамма в случае возвращения в циркуляцию вирусов этого подтипа.
- Секвенирование донора аттенуации В/СССР/60/69 и модификация метода рестрикционного анализа применительно к реассортантам на его основе для производства поливалентной ЖГВ.
- Подготовка, характеристика и доклиническое исследование высокопродуктивных реассортантных штаммов на основе ХА донора аттенуации А/Ленинград/134/17/57(H2N2) с потенциально пандемическими вирусами гриппа различных подтипов вирусов гриппа: Н5, Н7, Н9.
- Оценка в ограниченных клинических испытаниях безвредности, генетической стабильности и иммуногенности ЖГВ, разработанной с использованием модельного апатогенного птичьего вируса подтипа А(Н5N2).
- Разработка оптимальной стратегии и тактики вакцинации с использованием ЖГВ в интерпандемический период и при подготовке к пандемии.
Научная новизна. Автором впервые применен реассортантный метод к созданию вакцинных штаммов «шифтовых» вариантов вирусов гриппа на основе отечественного донора аттенуации А/Ленинград/134/17/57(H2N2) с использованием апатогенных вирусов гриппа птиц, что отражено в заявке на изобретение 118284 A1 (WO, 2007). Впервые определены условия и закономерности получения и апробации холодоадаптированных штаммов вирусов гриппа потенциально пандемических подтипов - Н5, Н7 и Н9.
Автором впервые разработана экспериментальная модель для доклинического изучения прививочных свойств холодоадаптированных реассортантных штаммов потенциально пандемических подтипов. В доклиническом и клиническом изучении впервые исследована роль различных серологических тестов (РТГА, реакция микронейтрализации, иммуноферментный анализ) в оценке иммунологической эффективности ЖГВ подтипа Н5. На экспериментальной модели впервые теоретически обоснованы схемы иммунизации живой гриппозной вакциной из реассортантного штамма A(Н5N2).
Впервые проведенное определение нуклеотидной последовательности и молекулярно-генетический анализ штаммов А/Москва/21/17/65(H2N2) и В/СССР/60/69 и позволили обосновать их применение в качестве доноров аттенуации для получения реассортантных вакцинных штаммов. Результаты секвенирования и рестриктазного картирования, выявившие целый ряд уникальных нуклеотидных замен в генах негликозилированных белков донора аттенуации В/СССР/60/69, указывают на единый генетический характер обеспечения холодовой адаптации вирусов гриппа А и В.
Теоретическая значимость проведенных исследований. Впервые разработана концепция создания реассортантной ЖГВ против вирусов гриппа, обладающих пандемическим потенциалом. Эта концепция основана на экспериментальных доказательствах безвредности, иммуногенности и протективной эффективности холодоадаптированных реассортантных штаммов, содержащих поверхностные антигены апатогенных птичьих вирусов, а также подтверждена данными о репродукции реассортантного штамма А(Н5N2) в носоглотке человека с формированием гуморальных и секреторных антител не только к вакцинному штамму, но и к высокопатогенным вирусам птичьего гриппа A(H5N1).
Получены новые фундаментальные данные о механизмах холодовой адаптации вирусов гриппа. Установлена связь изменений полимеразной субъединицы РВ2 с реализацией функции холодовой адаптации штамма А/Москва/21/17/65(H2N2).
Практическая значимость работы. Работа имеет большое народно-хозяйственное значение. В результате ее выполнения автором создана уникальная коллекция холодоадаптированных реассортантов потенциально пандемических подтипов вирусов гриппа А(H5N2), А(H7N3) и А(H9N2), которые депонированы в Государственной коллекции вирусов института вирусологии имени Д.И. Ивановского. Эти штаммы могут быть использованы для быстрой наработки вирусного материала при производстве пандемической ЖГВ, что является одним из направлений международной стратегии подготовки к пандемии.
Данные доклинических испытаний реассортантного штамма A/17/утка/Потсдам/86/92(H5N2) позволили разработать и утвердить программы 1 и 2 фазы клинических испытаний экспериментальной серии ЖГВ подтипа А(H5N2) «Орвакс», производства ФГУП НПО «Микроген» с целью создания модели для клинического изучения ЖГВ подтипа Н5. Суммарные данные доклинического и клинического изучения безвредности, иммуногенности и эффективности реассортантных штамма на основе апатогенного птичьего вируса гриппа А(H5N2) позволили разработать основы для апробации ЖГВ потенциально пандемического подтипа Н5.
На основании результатов клинических испытаний тривалентная ЖГВ, включающая реассортантные штаммы на основе донора аттенуации А/Ленинград/134/17/57(H2N2), рекомендована для профилактики гриппа среди детей с трех лет и пожилых людей, страдающих хроническими заболеваниями. Таким образом, были расширены контингенты для применения ЖГВ как единого препарата с включением наиболее уязвимых групп (детей дошкольного возраста и пожилых, хронически больных людей) что в случае пандемии позволяет обеспечить наибольший охват прививками всех групп и категорий населения.
Разработанные автором реассортантные вакцинные штаммы современных эпидемических вирусов В/60/Йоханнесбург/99/50, А/17/Калифорния/04/71(H3N2), А/17/Висконсин/05/84(H3N2) использовались для производства ЖГВ, на их основе подготовлено 5 млн. доз вакцины.
Анализ нуклеотидной последовательности донора аттенуации В/СССР/60/69 и модификация ОТ-ПЦР рестрикционного анализа впервые позволили выполнять этим методом идентификацию внутренних и неструктурных белков реассортантных вакцинных штаммов вирусов гриппа В.
Положения, выносимые на защиту.
- Холодовая адаптация штамма А/Москва/21/17/65(H2N2) связана с появлением в процессе пассирования при пониженной температуре множественных нуклеотидных замен в гене РВ2, приводящих к изменениям в структуре соответствующей полимеразной субъединицы. Свойства холодовой адаптации, аттенуации и генетической стабильности, присущие штамму А/Москва/21/17/65(H2N2), позволяют использовать его не только в качестве самостоятельного вакцинного штамма для иммунизации населения в случае возвращения в циркуляцию вируса гриппа А(H2N2), но и как потенциально новый донор аттенуации.
- Методы классической генетической реассортации в куриных эмбрионах позволяют регулярно получать высокоурожайные реассортантные штаммы на основе ХА донора аттенуации А/Ленинград/134/17/57(H2N2) с использованием в качестве источника поверхностных антигенов апатогенных вирусов гриппа птиц потенциально пандемических подтипов.
- Реассортантные штаммы апатогенных птичьих вирусов на основе донора А/Ленинград/134/17/57(H2N2) проявляют свойства температурочувствительности, холодовой адаптации и аттенуации в различных чувствительных моделях. Высокая степень аттенуации ХА реассортантов птичьих вирусов для кур вплоть до полной неспособности к репродукции, свидетельствуют о безопасности для птичьих хозяйств производства и использования подобных штаммов.
- Использование ЖГВ может быть эффективным против высокопатогенных вирусов гриппа даже в случае неполного антигенного соответствия между вакцинным вирусом и инфекционным штаммом (экспериментальная модель). Тем не менее, вакцинация штаммом нового подтипа до наступления пандемии является нецелесообразной, так как в настоящее неизвестен вирус, который вызовет пандемию.
- Прототип ЖГВ «Орвакс» подтипа A(H5N2) является безвредным, генетически стабильным препаратом и способен к репродукции в носоглотке человека. При оценке иммуногенности ЖГВ подтипа H5 показано, что сочетанное применение реакции торможения гемагглютинации и теста микронейтрализации в наибольшей степени удовлетворяет критериям чувствительности и специфичности (клиническое изучение).
- Реассортантная ЖГВ на основе доноров аттенуации А/Ленинград/134/17/57(H2N2) и В/СССР/60/69 является безвредной и эффективной для всех групп населения, включая детей от 3-х лет и пожилых людей старше 65 лет, страдающих хроническими заболеваниями (клиническое изучение).
- В случае появления нового пандемического штамма рекомендуется проведение двукратной прививки соответствующей моновакциной. Включение штамма нового антигенного подтипа в состав поливалентной живой гриппозной вакцины является нецелесообразным, так как его иммуногенность при этом снижается (экспериментальные данные).
Внедрение результатов работы. По теме работы получено 4 патента на изобретения. Подана 1 заявка на патент. Подготовлены методические рекомендации «Вакцинопрофилактика гриппа с помощью живой гриппозной вакцины среди лиц пожилого возраста». Внесены изменения в Фармакопейную Статью на «Вакцину гриппозную аллантоисную интраназальную живую сухую» ФСП 42-0504-4097-04.
Апробация работы. Основные результаты диссертационной работы доложены на 4-й Международной конференции по проблемам гриппа (Крит, Греция, 2000), 1-й и 2-й Европейских конференциях по проблемам гриппа (Мальта, 2002, 2005), 2-м Международном симпозиуме по проблемам респираторных инфекций (Ла Романа, Доминиканская Республика, 2002), 2-й Международной конференции по ортомиксовирусам (Нью-Джерси, США, 2003), 5-й Международной конференции по проблемам гриппа (Окинава, Япония, 2003), 1-й Международной конференции по вирусным вакцинам (Лиссабон, Португалия, 2004), Первой всероссийской конференции «Вакцинология 04» (Москва, 2004), VIII и IX Всероссийских научных Форумах с международным участием имени академика В. И. Иоффе «Дни иммунологии в Санкт-Петербурге» (Санкт-Петербург, 2004, 2005), Международной научной конференции «Актуальные вирусные инфекции – теоретические и практические аспекты» (Санкт-Петербург, 2004), 4-й Международной конференции по проблемам птичьего гриппа (Лондон, 2006), 2-й Международной конференции по вирусным вакцинам (Вена, Австрия, 2006). 6-й Международной конференции по проблемам гриппа (Торонто, Канада, 2007), Заседании ВОЗ по вопросам подготовки к пандемии (Женева, Швейцария, 2007), 3-й Европейской конференции по проблемам гриппа (Виламоура, Португалия, 2008). Материалы работы также представлялись и обсуждались на заседаниях Отдела вирусологии НИИЭМ РАМН (2004 г., 2005 г.) и Центра по контролю заболеваемости США, Атланта, США (2001 г., 2004 г.).
Публикации. По теме диссертации опубликовано 77 печатных работ, в том числе 29 статей (20 - в журналах, рекомендованных ВАК), 4 патента, 1 научный обзор и 43 тезиса докладов общим объемом более 200 страниц.
Структура и объем диссертации. Диссертация изложена на 328 страницах текста, включая 61 таблицу и 20 рисунков; состоит из введения, трех глав обзора литературы, семи глав собственных исследований, обсуждения, выводов и списка литературы, который содержит 485 источников, из них 98 отечественных и 387 – иностранных.
Личный вклад автора. Тема и план диссертации, ее основные идеи и содержание разработаны автором на основании многолетних (1998-2007 г.г.) исследований. Реассортантные штаммы апатогенных вирусов гриппа птиц A(Н5N2), А(H7N3) и A(Н9N2), а также реассортанты эпидемических вирусов гриппа А и В, подготовленные на основе ХА штаммов А/Москва/21/17/65(Н2N2) и В/СССР/60/69, получены, проанализированы и апробированы в доклинических исследованиях на животных (мыши, хорьки) лично автором. Автор принимала личное участие в клинических исследованиях в домах престарелых и детских садах Санкт-Петербурга и Ленинградской области, а также на базе Военного госпиталя № 1137. Во всех совместных исследованиях по теме диссертации, наряду с личным участием в их проведении, автору принадлежит участие в разработке программы исследований, а также анализ полученных данных. Все материалы, использованные в диссертационной работе, проанализированы и обобщены лично автором.
МАТЕРИАЛЫ И МЕТОДЫ
Вирусы. В работе были использованы штаммы вирусов гриппа из коллекции отдела вирусологии: ХА доноры аттенуации А/Ленинград/134/17/57(H2N2) и В/СССР/60/69; вакцинный штамм А/Москва/21/65(H2N2) и его ХА вариант А/Москва/21/17/65(H2N2), реассортантные штаммы современных эпидемических вирусов гриппа А и В. При разработке ЖГВ против пандемически опасных вирусов гриппа автором были подготовлены реассортантные штаммы на основе донора аттенуации А/Ленинград/134/17/57(H2N2) с использованием в качестве источника поверхностных антигенов апатогенных вирусов гриппа птиц подтипов H5, H7, H9, полученных из Центра по контролю и предупреждению заболеваний США. Для заражения иммунизированных животных применяли высокопатогенные (ВП) вирусы гриппа птиц подтипа А(H5N1), выделенные в во время вспышек в различных регионах. Все эксперименты с ВП вирусами гриппа птиц проводились в лабораториях с условиями повышенного уровня биологической защиты (BSL-3+).
Все вирусы культивировали в 10-дневных развивающихся куриных эмбрионах (РКЭ). ХА донорские и реассортантные штаммы инкубировали при 34С 48-76 часов. Апатогенные и высокопатогенные штаммы вирусов гриппа птиц инкубировали при 37С в течение 18-24 часов. Инфекционную активность вирусов определяли в РКЭ при оптимальной, повышенной до 40 и пониженной до 25С температуре, 50% эмбриональную инфекционную дозу (ЭИД50) рассчитывали по методу Reed-Muench (1938). К числу температурочувствительных (имеющих ts-) фенотип относили вирусы, которые репродуцировались при повышенной до 40С температуре на 5,0-6,0 lg ЭИД50 ниже по сравнению с оптимальной (RCT40). Если разница титров при оптимальной и пониженной до 25-26С температуре (RCT25) не превышала 3,0-4,0 lg ЭИД 50, вирусы относили к ХА группе (са- фенотип).
Культура клеток. Использовали линию клеток MDCK (NBL-2), полученную из Центра по контролю и предупреждению заболеваний США (Атланта, Джорджия).
Получение реассортантов между вирусами «дикого» типа и ХА донорами аттенуации проводили в РКЭ по описанным методикам (Александрова, 1977).
Молекулярно-генетический анализ. Определение состава генома реассортантных вирусов выполняли с помощью ОТ-ПЦР-рестрикционного анализа (Klimov, Cox, 1993) или частичным секвенированием отдельных генов. Для идентификации генов HA и NA применяли полное секвенирование. Специфические праймеры были разработаны с помощью компьютерной программы SeqLab. Обработку электрофореграмм нуклеотидных последовательностей проводили с помощью пакета программ DNAstar (Madison, WI). Множественное выравнивание нуклеотидных и аминокислотных последовательностей генов различных вирусов гриппа человека и птиц, а также определение идентичности проводили с помощью программы GeneDoc, версия 2.6.002 (Nicholas, 1997). Для филогенетического анализа использовали компьютерную программу Mega, версия 2.1 (Kumar, 2001) с применением алгоритма минимальной эволюции.
Лабораторные животные. Самки мышей линии BALB/c в возрасте 10 недель (Jackson Laboratories, Bar Harbor, MA, USA), самцы мышей линии СВА в возрасте 12-14 недель (питомник Рапполово, Ленинградская область), куры породы белый Леггорн в возрасте 4-х недель, хорьки обоего пола в возрасте 4-х месяцев.
Репродукция вирусов в дыхательных путях мышей. Мышам под легкой анестезией вводили интраназально (и/н) 50 мкл аллантоисной жидкости с содержанием вируса 101-107 ЭИД50. Эвтаназию проводили согласно «Правилам проведения работ с использованием экспериментальных животных» (приказ № 266 МЗ РФ от 19.06.2003).Титры вирусов определяли в легких и носовых ходах на 3-и сутки по показателям титрования суспензии органов в развивающихся куриных эмбрионах, начиная с разведения 1:10 для легких и 1:2 для носовых ходов. 50% мышиную инфекционную дозу (МИД50) и 50% летальную дозу (ЛД50) определяли по методу Reed-Muench (1938).
Реинфекция. Иммунизированных мышей инфицировали ВП вирусами птичьего гриппа А(H5N1) в летальных дозах. Летальность и снижение веса регистрировали в течение 14 дней. Концентрацию вируса в дыхательных путях и лимфоидной ткани (тимус) определяли на 3-й день после заражения по результатам титрования суспензии органов на РКЭ. Концентрацию вируса в головном мозге мышей определяли на 6-е сутки после инфекции.
Клиническое изучение безвредности и эффективности реассортантной ЖГВ. В исследовании использовали ЖГВ, выпускаемую Иркутским ФГУП по производству иммунобиологических препаратов. Вакцина и плацебо в виде шифрованных препаратов вводились однократно интраназально помощью распылителя РДЖ-М4 или индивидуального распылителя по 0,25 мл в каждый носовой ход прививаемого с последующей оценкой реактогенности, безвредности, иммуногенности и эффективности. Интенсивность вакцинальных лихорадочных реакций оценивали в соответствии с классификацией, принятой Комитетом вакцин и сывороток Минздрава РФ: реакция отсутствует – при температуре 37,0С; слабая реакция – с повышением температуры тела до 37,5С; средняя реакция – с температурой 37,6-38,5С; сильная реакция – с повышением температуры выше 38,6С. Согласно Фармакопейной статье на ЖГВ допускается наличие реакций с повышением температуры тела выше 37,5С не более чем у 2% привитых. Продолжительность температурной реакции не должна превышать 3 суток.
Получение и обработка клинических материалов (сыворотки крови, носовые смывы) производились согласно «Методическим указаниям по проведению контроля противогриппозных препаратов» от 16.11.84 или МУК 4.2.2136-06. Поствакцинальный иммунный ответ оценивали в реакции торможения гемагглютинации (РТГА), реакции микронейтрализации (РН) и непрямом варианте иммуноферментного анализа (ИФА) по описанным методикам (Rowe et al., 1999).
Статистическая обработка данных. При анализе полученных результатов определяли средние величины и стандартное отклонение (M±). Оценку статистической достоверности различий проводили при помощи компьютерной программы Statistica (версия 6,0) с использованием теста t-распределения Стьюдента для выборок с нормальным распределением, или непараметрических критериев Уилкоксона-Манна-Уитни. Влияние демографических факторов на иммунологическую эффективность вакцинации изучали с помощью дисперсионного анализа ANOVA. Сравнение долей (пропорций) в двух соотносящихся группах оценивали при помощи непараметрического критерия 2 Мак-Немара в модификации Лидделла, в других случаях использовали точный критерий Фишера. Различия считались достоверными при р<0,05.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ АНАЛИЗ ХОЛОДОАДАПТИРОВАННЫХ ШТАММОВ ВИРУСОВ ГРИППА А И В
Все применяющиеся в настоящее время для получения реассортантных вакцинных штаммов ХА доноры аттенуации были получены эмпирическим путем после длительных пассажей при пониженной температуре. Поскольку в каждом конкретном случае в основе аттенуации могут лежать различные механизмы, при создании живых вакцин необходимо подробно изучить эти механизмы, для того чтобы понять, какой из них способен привести к получению наиболее эффективного препарата.
Молекулярно-генетический анализ и изучение биологических свойств ХА штамма А/Москва/21/17/65(H2N2). Опыт появления пандемий не исключает возврата в циркуляцию вирусов человека A(H2N2), который является единственным подтипом, вызвавшим пандемию в 1957 году и исчезнувшим из циркуляции более 40 лет назад. Мы провели изучение штамма А/Москва/21/17/65(H2N2) [Москва/21/17], который принадлежит к вирусам, завершающим эру циркуляции вирусов гриппа подтипа A(H2N2). ХА донор аттенуации А/Ленинград/134/17/57 (H2N2), применяющийся в настоящее время для получения реассортантов, является документировано безвредным для людей и может использоваться как вакцинный штамм в случае возвращения в циркуляцию вирусов этого подтипа. Однако вирусы А(H2N2), выделенные в период с 1957 по 1968 год значительно отличаются между собой как антигенно, так и генетически. Наиболее существенные отклонения антигенных признаков от свойств пандемического возбудителя 1957 года произошло у штаммов 1965-1967 гг. выделения (Александрова, 1969). Предсказать антигенную структуру возможного возбудителя пандемии невозможно, так же как и его близость или отдаленность от имеющихся вакцинных штаммов соответствующего подтипа, поэтому является весьма важным наличие в коллекции вакцинных штаммов нескольких тщательно охарактеризованных вакцинных кандидатов.
По молекулярной структуре НА штамм Москва/21/17 является наиболее близким к эталонному штамму А/Англия/64. Вакцинный штамм Москва/21/17, входивший в состав ЖГВ для детей в 1967 году (Александрова с соавт., 1968), был получен после дополнительного 17-кратного пассирования при пониженной до 25-260C температуре вакцинного штамма А/Москва/21/65(H2N2) [Москва/21/65], применявшегося для вакцинации взрослых. Штамм Москва/21/17 характеризуется документированной безвредностью и высокой иммуногенностью для детей, что было неоднократно подтверждено за время его использования, как в виде моновакцины, так и в составе дивакцины в 1966 -1967 годах (Сиротенко с соавт., 1967, Александрова с соавт., 1968, Беляева с соавт., 1969).
С целью изучения молекулярных изменений, приводящих к холодовой адаптации штамма Москва/21/17, было проведено секвенирование всех его генов, которое выполнялось в Центре по контролю и предупреждению заболеваний США (Атланта, Джорджия). Анализ отличий в генах и генных продуктах, появление которых могло бы повлиять на проявление таких фенотипических признаков, как холодовая адаптация и ограничение репродукции при повышенной до 38-39С температуре штамма Москва/21/17, проводили в сравнении с вариантом Москва/21/65, полученным пассированием при оптимальной температуре. Было показано, что пассажный вариант Москва/21/65 отличался от ХА варианта сниженной репродукцией в РКЭ при 25С и, наоборот, отсутствием существенного снижения инфекционной активности при 38-39С (рис. 1 А). В культуре клеток MDCK было показано, что при заражении монослоя ХА вирусом Москва/21/17 при повышенной до 39С температуре инкубации имела место значительная задержка репродукции по сравнению с оптимальными условиями. Такое угнетение репродукции было наиболее выраженным на ранних сроках инфекции (первые сутки после инокуляции) (рис.1 В).
А. В.
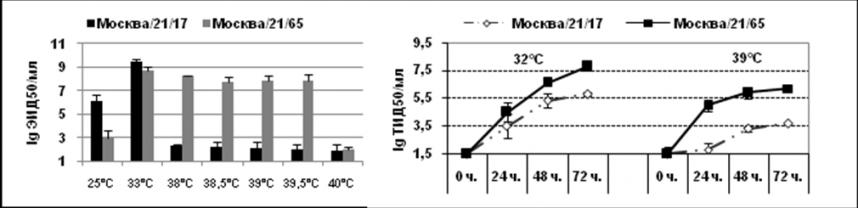 Рис. 1. А - репродуктивная активность ХА штамма А/Москва/21/17 и пассажного варианта А/Москва/21/65 в РКЭ; В - динамика репродукции (24, 48 и 72 часа) в культуре клеток MDCK при заражающей дозе 0,02 MOI.
Рис. 1. А - репродуктивная активность ХА штамма А/Москва/21/17 и пассажного варианта А/Москва/21/65 в РКЭ; В - динамика репродукции (24, 48 и 72 часа) в культуре клеток MDCK при заражающей дозе 0,02 MOI.
Таким образом, в различных системах было показано, что вариант Москва/21/65, утративший способность размножаться при 40С и аттенуированный для человека, достаточно сильно отличался от ХА варианта, по уровню репродукции при пониженной или повышенной до 38-39,5С температуре.
Анализ нуклеотидных последовательностей генов негликозилированных белков штаммов Москва/21/17 и Москва/21/65 показал, что в процессе дополнительного пассирования при пониженной температуре штамм Москва/21/17 приобрел 8 нуклеотидных замен в генах внутренних и неструктурных белков по сравнению с промежуточным вариантом Москва/21/65. При этом 6 нуклеотидных замен являются значащими и приводят к аминокислотным замещениям в PB2 белке (три) и PB1, M1 и NS1 белках (по одному) (табл. 1). Было показано, что большинство мутаций, отличающих ХА вариант от исходного пассажного, локализовано в гене РВ2. Все значащие замены в гене РВ2 являются уникальными, одна незначащая замена в 1740 положении нуклеотидной цепи не является уникальной, поскольку встречается у более поздних вирусов подтипа H3N2 (А/Англия/41, А/Токио/38). Замена метионина на изолейцин в 202 положении белка PB2 располагается в участке 51-259 аминокислотной последовательности, который участвует во взаимодействии субъединиц РВ1 и РВ2 вирусной полимеразы в процессе транскрипции и репликации вируса (Toyoda et al., 1996, Ohtsu et al., 2002). Несмотря на то, что уникальные аминокислотные замены валина на изолейцин в 414 положении и глицина на серин в 416 положении белка PB2 не ведут к изменению полярности или заряда, анализ с помощью методики Чжоу-Фасмана (1974) показал возможность изменения в результате этих близко расположенных замен вторичной структуры белка в положении 415-416 в области -спирали.
Таблица 1
Нуклеотидные замещения в генах ХА штамма A/Москва/21/17/65(H2N2) по сравнению с пассажным вариантом A/Москва/21/65(H2N2)
| Ген | № нуклеотида | № аминокислот- ного остатка | A/Москва/21/17 (ХА) | A/Москва/21/65 | ||
| нуклеотид | аминокислота | нуклеотид | аминокислота | |||
| PB2 | 633 1267 1273 1740 | 202 414 416 - | A A A G | I I S - | G G G A | M V G - |
| PB1 | 2191 | 723 | C | R | T | W |
| PA | - | - | - | - | - | - |
| НА | 41 477 | - 147 | C A | - D | A G | - G |
| NP | 396 | - | A* | - | G* | - |
| NА | - | - | - | - | - | - |
| M1 | 569 | 182 | A | T | G | A |
| NS1 | 219 | 65 | A | I | G | V |
*А>G
Замена триптофана на аргинин в 723 положении белка PB1 Москва/21/17 встречается у большинства проанализированных эпидемических вирусов и, таким образом, не может привносить изменений в сторону холодовой адаптации. Отсутствие отличий в РА белке Москва/21/17 от пассажного варианта подтверждает данные о роли отдельных генов, полученные на модели одногенных реассортантов на основе ХА донора аттенуации А/Ленинград/134/57(H2N2) (Киселева, 2001), когда было показано, что наследование только РА гена от ХА варианта не приводило к аттенуации, если остальные гены происходили от исходного штамма «дикого типа».
Нуклеотидная замена в гене NP является незначащей и прослеживается на электрофореграмме в виде двойного пика с преобладанием А над G у ХА варианта и G над А у его предшественника. Эта мутация не является уникальной, так как встречается также у эпидемического штамма А/Энн Арбор/67. Уникальная мутация в М-гене штамма Москва/21/17 (T-182-A), приводящая к замене в мембранном белке М1, сопровождается изменениями свойств гидрофобности. Ранее при изучении роли отдельных генов в аттенуации штамма А/Ленинград/134/57(H2N2) было показано, что присутствие в геноме вирулентного штамма М-гена от ХА варианта не приводило к проявлению ts- и ca- фенотипа (Киселева, 2001).
Мутация в гене NS приводит к аминокислотной замене в белке NS1 (I-65-V), которая расположена в N-концевом участке -спирали, состоящем из 73 аминокислот, который является эффекторным доменом взаимодействия с РНК (Qian et al., 1994), а также играет ключевую роль в модулировании таких факторов врожденного иммунитета, как интерферон / (Wang et al., 2000). Эта мутация является уникальной, однако, как будет продемонстрировано ниже, оказалось, что замещение NS-гена Москва/21/17 на NS-ген эпидемического вируса не приводило к изменению ts- и ca- фенотипа. Ранее в исследованиях in vitro было показано, что уровни индукции ранних цитокинов ХА реассортантными штаммами A(H1N1) и A(H3N2) на основе донора аттенуации А/Ленинград/134/17/57(H2N2) в основном совпадали с аналогичными показателями для эпидемических вирусов соответствующего серотипа. Индукция интерферона I типа ХА реассортантами оказалась сниженной по сравнению с эпидемическими родителями. Изучение одногенных реассортантов, включающих мутантные гены донора аттенуации А/Ленинград/134/17/57(H2N2), показало, что включение генов РВ2 или РВ1 в состав реассортантов значительно снижало продукцию ранних цитокинов, включая и интерферон I типа, при инфицировании эпителиальных макрофагов человека. В то же время, в отношении реассортантов, включающих мутантный М или NS гены, такого снижения не наблюдалось (Rekstin et al., 2006).
Локализация мутации в гене НА, приводящей к аминокислотной замене в одном из петлеобразных участков глобулярной части тяжелой цепи НА1, свидетельствует, что она могла появиться в процессе адаптации при длительном пассировании в РКЭ (Каверин с соавт., 2000). В гене нейраминидазы различий не выявлено.
Был проведен сравнительный анализ известных последовательностей генов внутренних и неструктурных белков таких доноров аттенуации подтипа H2N2, как А/Ленинград/134/17/57 (Klimov, Cox, 1988), А/Энн Арбор/6/60 (Maassab, 1969) и ХА штамма, полученного пассированием на культуре клеток Vero: А/Сингапур/1/57са (Romanova et al., 2004). Результаты представлены в таблице 2. Общим признаком для всех ХА штаммов является полигенный характер изменений, приводящих к проявлению са- и att- фенотипа при традиционном способе получения ХА штаммов, то есть методом последовательного пассирования при пониженной температуре, даже если это пассирование осуществляется в различных системах (куриные эмбрионы, первичные или перевиваемые культуры). Cопоставление данных о мутациях в различных генах и генных продуктах внутренних и неструктурных белков различных ХА штаммов подтипа A(H2N2) указывает на отсутствие каких-либо универсальных позиций в их геномах, мутации в которых должны приводить к аттенуации. Исключение составляет замена аланина в позиции 86 белка М2 на серин у штамма А/Энн Арбор/6/60 или треонин у штамма А/Ленинград/134/17/57, однако по данным Jin et al. (2003) эта мутация не связана с температурочувствительностью. Еще одним исключением является незначащая нуклеотидная замена в 813 положении гена NS вирусов А/Энн Арбор/6/60 (АG) и ХА А/Сингапур/1/57са.
Таблица 2
Мутации в генах негликозилированных белков ХА штаммов А(H2N2)
| Ген | Энн Арбор/6/60 | Ленинград/17 | Москва/21/17/65 | Сингапур/1/57 -xa | ||||
| нуклеотид | амино-кислота | нуклеотид | амино-кислота | нуклеотид | амино-кислота | нуклеотид | амино-кислота | |
| PB2 | A-141-G A-821-G T-1933-c | - A-265-S - | G-1459-T | V-478-L | G-633-A G-1267-A G-1273-A A-1740-G | M-202-I V-414-I G-416-S - | A-252-G A-498-G T-581-C G-1046-T | - - I-185-T R-340-I |
| PB1 | A-123-G A-1195-G G-1395-T A-1766-G G-2005-A C-2019-T | - K391-E E-457-D E-581-G A-661-T - | G-360-A G-819-T A-1795-G | - K-265-N V-591-I | T-2191-C | W-723-R | T-1279-A A-1965-C | L-419-I - |
| PA | T-20-C T-2167-C T-2168-C | L-715-P L-715-P | T-222-C T-107-C G-1045-T | - L-28-P V-341-L | - | - | A-707-T T-1425-A A-1537-G G-1819-C | N-228-I - I-505-V E-599-Q |
| NP | A-146-G | G-34-D | - | - | 396 G/A | - | G-210-A | - |
| M1 | - | - | G-68-A | V-15-I | A-567-G | T-182-A | C-55-T T-97-C G-32A-7 G-499-C | - - R-101-K Q-158-H |
| M2 | G-969-T | A-86-S | G-969-A | A-86-T | - | - | - | - |
| NS1 | G-483-A | A-153-W | G-193-A | V-65-I | - | |||
| NS2 | A-813-G | G-798-A | M-100-I | A-813-G | - | |||
Данные сравнительного анализа подтвердили, что наибольшим изменениям подвергаются гены полимеразного комплекса холодоадаптированных штаммов. Большинство нуклеотидных замен в этом случае сопровождается аминокислотными замещениями в соответствующих полимеразных субъединицах. Во всех случаях наиболее консервативным является белок NP. Аминокислотные замещения в NP-белке ХА вариантов по сравнению с «дикими» штаммами или отсутствуют (А/Ленинград/134/17/57, А/Сингапур/1/57ха), или существенно не влияют на структурную организацию белка. Во всех случаях множественный характер изменений в геноме ХА штаммов указывает на последовательную сопряженную эволюцию различных белковых субъединиц в процессе серийных пассажей при пониженной температуре. Эти сочетанные изменения в различных генах доноров аттенуации могут обеспечивать генетическую стабильность реассортантов на основе подобных штаммов.
Далее была поставлена задача оценить генетическую стабильность штамма А/Москва/21/17 и потенциальную возможность его применения как нового донора аттенуации. С этой целью были получены полигенные реассортанты с современным эпидемическим вирусом А/Новая Каледония/20/99(H1N1). Один из реассортантов унаследовал от эпидемического вируса гены HA и NA (структура генома 6:2), а другой помимо этого еще NS-ген (структура генома 5:3) (табл. 3). Секвенирование показало сохранность всех мутаций в генах внутренних и неструктурных белков, приобретенных реассортантами от ХА родителя А/Москва/21/17.
Таблица 3
Структура реассортантов на основе штамма А/Москва/21/17/65(H2N2)
| Вирус | Структура генома | |||||||
| А/Москва/21/17/65(H2N2) | PB2 | PB1 | PA | HA | NP | NA | M | NS |
| А/Новая Каледония/20/99(H1N1) | PB2 | PB1 | PA | HA | NP | NA | M | NS |
| Реассортант 6:2 | PB2 | PB1 | PA | HA | NP | NA | M | NS |
| Реассортант 5:3 | PB2 | PB1 | PA | HA | NP | NA | M | NS |
Были изучены ростовые характеристики реассортантов и родительских штаммов при различных температурах инкубации в РКЭ, а также их репродуктивная активность в легких мышей линии СВА (рис. 2). Было показано, что наследование от ХА штамма шести или пяти генов внутренних и неструктурных белков (независимо от источника происхождения NS-гена) приводило к проявлению реассортантами ts и ca- фенотипа (рис. 2, А)
А. В.

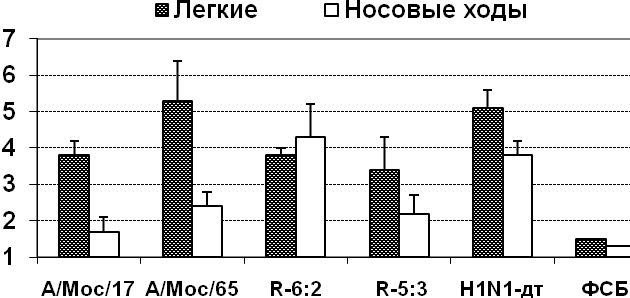
Рис. 2. А – инфекционная активность в куриных эмбрионах при различных температурах инкубации, В – репродукция в дыхательных путях мышей.
Репродукция 6:2 реассортанта в РКЭ при оптимальной температуре оказалась сниженной по сравнению с реассортантом 5:3 и родительским штаммом Москва/17, однако в дыхательных путях мышей такого снижения не наблюдалось (рис. 2, В).
Таким образом, было показано, что мутации, ответственные за холодовую адаптацию штамма А/Москва/21/17/65, локализованы в гене РВ2. Указанные замены расположены в активных доменах субъединицы РВ2 вирусной полимеразы: замена M-202-I локализуется в участке 51-259 аминокислотной последовательности, активном при взаимодействии субъединиц РВ1 и РВ2 вирусной полимеразы, а уникальные близкорасположенные замены V-414-I и G-416-S могут вызывать изменение вторичной структуры белка. Мутация V-65-I в белке NS1 не оказывает влияния на ca- и att-фенотип.
Генетическая стабильность штамма А/Москва/21/17(H2N2), а также сохранение свойств холодовой адаптации и аттенуации реассортантами, полученными на его основе, позволяют его использование в качестве нового донора аттенуации для получения реассортантов, а также в качестве ХА вакцинного штамма в случае возвращения в циркуляцию вирусов А(H2N2).
Молекулярно-генетический анализ и рестриктазное картирование ХА штамма вируса гриппа В/СССР/60/69. Современная реассортантная ЖГВ применяется в виде поливалентного препарата, включающего штаммы всех трех циркулирующих в настоящее время разновидностей вирусов гриппа A(H1N1), A(H3N2) и В. Для подготовки реассортантных вакцинных штаммов вируса гриппа В применяется ХА донор аттенуации В/СССР/60/69. Было проведено определение нуклеотидной последовательности донора аттенуации В/СССР/60/69. На основании данных секвенирования была модифицирована схема ОТ-ПЦР-рестрикционного анализа для изучения состава генома реассортантов на его основе. Ранее метод, основанный на идентификации уникальных нуклеотидных различий между генами ХА доноров аттенуации и эпидемических вирусов, был разработан для идентификации мутаций генов внутренних и неструктурных белков донора аттенуации А/Ленинград/143/17/57(H2N2), который в течение многих лет используется для подготовки ХА реассортантных вакцинных штаммов с современными эпидемическими штаммами вирусов гриппа А подтипов Н1 и Н3 (Klimov, Cox, 1993).
Для получения ДНК-копий участков генов внутренних и неструктурных белков донора аттенуации В/СССР/60/69 применяли следующие праймеры, разработанные А.И. Климовым: PB2-1550 (5’ TGG GGA AGT CAT AAT GG), PB1- 518 (5’ TTT GCC AAG ATA TCA TTG), PA-1061 (5’ AAA TAC AAT AAG TAA TGA GG), NP-1123 (5’ TGG GTA TGA AGC CAT GG), M-8 (5’ GCA CGC ACT TTC TTA AAA TG), NS-6 (5’ AAG CAG AGG ATT TAT TTA G). Комплементарными обратными праймерами были : PB2-r2389 (5' ACA CGA GCA TTT TTC ACT C), PB1-r1399 (5’ CCA TAC ATG TCT CTT CAT C), PA-r2303 (5’ GAA ACA CGT GCA TTT TT), NP - r1838 (5’ GAA ACA ACA GCA TTT TTT AC), M-r1183 (5’ ACA ACG CAC TTT TTC CAG), NS-r 576 (5’ CCC TTT TTA TTG TCA AAC GG). Анализ полученных нуклеотидных последовательностей показал, что гены PB2, PB1, PA, NP и NS ХА донора В/СССР/60/69 имеют нуклеотидные позиции, отсутствующие в геномах современных эпидемических штаммов вируса гриппа В и приводящие к возникновению сайтов рестрикции для Hind III, BspH I, Bcl II, Avr II, Mae I. Анализ нуклеотидной последовательности М гена выявил, что все современные изоляты имеют сайт рестрикции Bgl II, тогда как такой сайт отсутствует в М гене В/СССР/60/69 (табл. 4). Показано, что нуклеотидные замены, обнаруженные в PB1, PA, NP, M и NS генах донора аттенуации В/СССР/60/69, с большой долей вероятности можно считать уникальными, поскольку они не встречались у подавляющего большинства штаммов вируса гриппа В, выделенных в различных регионах мира и принадлежащих к различным генетическим линиям. Хотя нуклеотидная замена в PB2 гене не является уникальной, так как она встречалась у ряда вирусов линии В/Виктория, тем не менее, рестриктаза Hind III может применяться для определения происхождения гена PB2 у реассортантов, полученных на основе ХА донора В/СССР/60/69, поскольку у вирусов гриппа В линии В/Виктория, выделенных после 2002 года, сайт рестрикции для Hind III, характерный для гена PB2 донора В/СССР/60/69, отсутствует.
Таблица 4
Сайты рестрикции, уникальные для донора аттенуации В/СССР/60/69
| Ген | Сегмент | № нуклео-тида | Рестриктаза | В/СССР/60/69 | Современные штаммы |
| PB2 | 1550-2389 | 1939 | Hind III | 5'...AAGCTT...3' * | 5'...AGGCTT...3' |
| PB1 | 518-1399 | 1086 | BspH I | 5'...TCATGA...3' | 5'...TTATGA...3' |
| PA | 1061-2303 | 1796 | Bcl I | 5'...TGATCA...3' | 5'...TGAACA...3' |
| NP | 1123-1838 | 1291 | Avr II | 5'...CCTAGG...3 | 5'...CCTAGA...3' |
| M | 8-1183 | 524 | Bgl II | 5'...AAATCT...3 | 5'...AGATCT...3' |
| NS | 6-576 | 373 | Mae I | 5'...СTAG...3' | 5'...ATAG...3' |
Выявление целого ряда уникальных нуклеотидных замещений в генах внутренних и неструктурных белков донора аттенуации В/СССР/60/69, указывает на единый характер аттенуации вирусов гриппа А и В, полученных последовательным пассированием при пониженной температуре.
ПОДГОТОВКА И ХАРАКТЕРИСТИКА РЕАССОРТАНТНЫХ ХА ВАКЦИННЫХ ШТАММОВ ПАНДЕМИЧЕСКИ ОПАСНЫХ ВИРУСОВ ГРИППА
Характеристика вирусов птичьего гриппа, использованных в качестве источника поверхностных антигенов. В процессе отбора потенциальных кандидатов для подготовки вакцинных штаммов против возможных пандемий будущего были изучены характеристики репродукции в РКЭ при различных температурах следующих апатогенных вирусов гриппа птиц: А/утка/Потсдам/1406-86 (H5N2), А/утка/Вьетнам/342/01 (H5N1), А/дикая утка/Нидерланды/12/00 (H7N3), А/Гонконг/1073/99 (H9N2), А/перепел/Гонконг/6/97 (H9N2), А/курица/Гонконг/G9/97 (H9N2). Показана высокая степень температуроустойчивости всех вышеперечисленных вирусов: показатели роста при 400С не отличались или были выше, чем при 34 и 370С, только при повышении температуры до 410С наблюдалось снижение репродукции на 3-4 lg ЭИД50/мл. Для реассортации классическими методами в куриных эмбрионах были выбраны вирусы А/утка/Потсдам/1406-86(H5N2) [H5N2-дт], А/дикая утка/Нидерланды/12/00 (H7N3) [H7N3-дт], А/перепел/Гонконг/6/97(H9N2) антигенной линии G1 [H9N2-дт]. Молекулярно-генетический анализ НА родительских штаммов «дикого» типа показал, что все они содержат в сайте протеолитического расщепления гемагглютинина один остаток аргинина – признак, характерный для низкопатогенных вирусов. Анализ тяжелой цепи гемагглютинина НА1 вирусов подтипа Н5 показал наличие аминокислотных различий между родительским вирусом, использованным для подготовки реассортантного вакцинного штамма подтипа А(H5N2) - А/утка/Потсдам/1402-6/86 – и вирусами, выделенными в Гонконге в 1997 году (95-96% гомологии), а также вирусом A/Гонконг/213/03(H5N1) (94% гомологии). Количество аминокислотных различий между А/утка/Потсдам/1402-6/86(H5N2) и другими более поздними изолятами A(H5N1) находится в пределах 9-11%. Родительские «дикие» штаммы подтипа A(H9N2) и A(H7N3) были на 98% идентичными изолятам, выделенным от больных в Гонконге в 1999 г. и в Нидерландах в 2003 г.
Ростовые характеристики реассортантов птичьих вирусов при различных температурах инкубации в РКЭ. Для детального исследования были отобраны реассортанты, содержащие все значащие мутации в генах внутренних и неструктурных белков, описанные ранее для ХА донора аттенуации А/Ленинград/134/57(H2N2) [Лен/17]. С помощью ОТ-ПЦР-рестрикционного анализа и секвенирования генов НА и NA было показано, что реассортант А/17/утка/Потсдам/86/92(H5N2) [Лен 17/Н5] унаследовал от «дикого» вируса только ген НА, а остальные 7 генов – от донора аттенуации Лен/17 (формула генома 7:1). Реассортанты подтипов Н7N3 и Н9N2 - А/17/дикая утка/Нидерланды/00/84 (H7N3) [Лен 17/Н7] и А/17/перепел/Гонконг/97/86 (H9N2) [Лен 17/Н9] - имели формулу генома 6:2, так как унаследовали гены НА и NA от «диких» родительских штаммов. Показано, что все реассортанты вирусов гриппа птиц на основе холодоадаптированного донора аттенуации Лен/17 обладают высокой продуктивностью в РКЭ (8,5-9,6 lg ЭИД 50/мл) и устойчиво проявляют ts- и ca- фенотип, то есть свойства, характерные для ХА донора аттенуации (табл.5).
Таблица 5
Репродукция в куриных эмбрионах реассортантов апатогенных вирусов
гриппа птиц
| Вирусы | Инфекцион-ная активность lg ЭИД 50/мл | RCT25 (lg ЭИД50) | RCT40 (lg ЭИД50) | Фенотип |
| Холодоадаптированный донор аттенуации | ||||
| А/Ленинград/134/17/57(H2N2) | 9,5±0,3 | 2,2 | 8,0 | ts, ca |
| Апатогенные вирусы птичьего гриппа | ||||
| А/утка/Потсдам1406-86(H5N2) | 8,5±0,2 | 8,0 | 0 | non-ts, non-ca |
| А/дикая утка/Нидерланды/12/00(H7N3) | 8,7±0,2 | 7,5 | 0 | non-ts, non-ca |
| А/перепел/ Гонконг/6/97(H9N2) | 8,6±0,8 | 8,2 | 0 | non-ts, non-ca |
| Реассортанты апатогенных птичьих вирусов | ||||
| А/17/утка/Потсдам/86/92(H5N2) 7:1 | 9,3±0,3 | 3,1 | 7,7 | ts, ca |
| А/17/дикая утка/Нидерланды/00/84(H7N3) 6:2 | 9,6±0,5 | 4,0 | 8,5 | ts, ca |
| А/17/перепел/Гонконг/97/81(H9N2) 6:2 | 9,8±0,5 | 2,8 | 9,8 | ts, ca |
Оценка безвредности для кур ХА реассортантов, содержащих гены вирусов птичьего гриппа. Данный раздел работы был выполнен совместно с ветеринарной лабораторией, г. Афины, США под руководством Д. Свэйна. Для оценки аттенуации при введении курам использовали реассортанты вирусов птичьего гриппа подтипов А(H5N2) и А(H7N3) на основе Лен/17, а также родительские птичьи вирусы и донор аттенуации Лен/17. Патогенность определяли при внутривенном (в/в) введении стандартного разведения (10-1) вирусного материала (табл.6). «Дикий» вирус подтипа А(H5N2), а также ХА реассортанты подтипов А(H5N2) и А(H7N3) были безвредными и не вызывали развития инфекции. Из всех исследованных вирусов только «дикий» вирус H7N3-дт проявлял токсичность при в/в введении, когда развитие инфекции и смертность на 7-8 сутки наступали в 5 случаях из 8. После интраназального введения птичий вирус H7N3-дт был выделен из ротоглоточных и клоакальных смывов на 3-й день после инфекции в средних титрах 1,1-0,9 lg ЭИД50/мл. ХА реассортант данного подтипа не выделялся и не вызывал сероконверсий по данным радиальной иммунодиффузии в агарозном геле. Реассортант А(H5N2) и родительский вирус этого подтипа H5N2-дт, а также донор аттенуации Лен/17 также не были выделены после интраназального введения и не вызывали сероконверсий.
Таблица 6
Оценка безвредности и инфекционной активности реассортантов при внутривенном (в/в) и интраназальном введении курам
| Вирус | В/в введение (n=8) | Интраназальное введение (n=5) | |||||
| заболевае- мость | леталь- ность | выделение вируса на 3-й день (ЭИД50) | серокон- версии 21-й день | заболевае- мость | леталь- ность | ||
| оральное | клоакальное | ||||||
| Холодоадаптированный донор аттенуации | |||||||
| Лен/17 | 0/8 | 0/8 | 0/5 | 0/5 | 0/5 | 0/5 | 0/5 |
| Апатогенные вирусы птичьего гриппа | |||||||
| H5N2-дт | 0/8 | 0/8 | 0/5 | 0/5 | 3/5 | 0/5 | 0/5 |
| H7N3-дт | 5/8 | 5/8 | 2/5 (10 1.1) | 1/5 (10 0.91) | 5/5 | 0/5 | 0/5 |
| Реассортанты апатогенных птичьих вирусов | |||||||
| Лен17/Н5(H5N2) | 0/8 | 0/8 | 0/5 | 0/5 | 0/5 | 0/5 | 0/5 |
| Лен17/Н7(H7N3) | 0/8 | 0/8 | 0/5 | 0/5 | 0/5 | 0/5 | 0/5 |
Таким образом, было установлено, что приобретение реассортантами «внутренних» генов донора аттенуации А/Ленинград/134/17/57(H2N2) приводило к полной их аттенуации для кур. ХА реассортанты, являясь адаптированными к пониженной температуре репродукции и гиператтенуированными для кур, оказались неспособными ни инфицировать птиц, температура тела у которых значительно выше, чем у человека, ни выделяться от них в окружающую среду.
Безвредность кандидатов в вакцинные штаммы при интраназальном введении мышам. Изучение репродуктивной активности в дыхательных путях мышей показало, что все ХА реассортанты апатогенных птичьих вирусов были аттенуированными для мышей, репродуцируясь более эффективно в носовых ходах, чем в легочной ткани (табл.7).
Таблица 7
Репродуктивная активность реассортантов апатогенных птичьих вирусов и родительских штаммов в дыхательных путях мышей при заражающей дозе
6 lg ЭИД50
| Препарат | Характеристика | Выделение вируса на 3-й день п.и. (lg ЭИД50/мл), n=3 | |
| легкие | носовые ходы | ||
| Лен 17/Н5 | 7:1 ХА реассортант | 2,1±1,0 | 3,5±0,0 |
| Н5N2-дт | «дикий» температуроустойчивый | 6,3±0,3 | 1,6±0,2 |
| Лен 17/Н7 | 6:2 ХА реассортант | 1,5 | 3,7±0,3 |
| Н7N3-дт | дикий» температуроустойчивый | 6,4±0,2 | 1,7±0,0 |
| Лен 17/Н9 | 6:2 ХА реассортант | 1,5 | 3,7±0,2 |
| Н9N2-дт | «дикий» температуроустойчивый | 4,9±0,5 | 1,8±0,5 |
| Лен/17 | ХА донор аттенуации | 2,3±0,5 | 2,5±0,3 |
| Раствор ФСБ | Контроль | 1,5 | 0,8 |
Полученные результаты свидетельствуют, что классическими методами в куриных эмбрионах подготовлены высокорепродуктивные реассортанты вирусов гриппа потенциально пандемических подтипов, проявляющие свойства температурочувствительности, холодовой адаптации и аттенуации, необходимые для вакцинных штаммов ЖГВ.
РЕЗУЛЬТАТЫ ДОКЛИНИЧЕСКОГО ИЗУЧЕНИЯ
РЕАССОРТАНТНОГО ШТАММА А/17/УТКА/ПОТСДАМ/86/92(H5N2).
Основные этапы данного раздела работы были выполнены в Центре по контролю и предупреждению заболеваний США (Атланта, Джорджия).
Антигенная специфичность. Проведенное сравнение полных нуклеотидных последовательностей вируса H5N2-дт «дикого» типа и 7:1 реассортанта соответствующего подтипа выявило отсутствие изменений в процессе реассортации и селективных пассажей. Тем не менее, известно, что вирусы гриппа могут антигенно отличаться даже в случае полной идентичности аминокислотного состава НА, в частности, вследствие различных путей гликозилирования при культивировании в различных системах (Katz et al., 1999, Romanova et al., 2003). В таблице 8 представлены данные изучения антигенных свойств реассортантного штамма Лен 17/Н5 в РТГА с набором иммунных сывороток хорьков.
Таблица 8
Данные РТГА с антисыворотками хорьков
| Вирусы | Подтип | Антисыворотки хорьков | |||||
| Гк/156 | Гс/Гк/437 | Вн/113 | Вн/342 | Гк/213 | Лен 17/H5 | ||
| A/Гонконг/156/97 (Гк/156) | H5N1 | 320 | 160 | 640 | 640 | <20 | 160 |
| A/Гусь/Гонконг/437-4/99 (Гс/Гк/437) | H5N1 | 640 | 640 | 5120 | 2560 | 640 | 1280 |
| A/Гусь/Вьетнам/113/01 (Вн/113) | H5N1 | 160 | 40 | 2560 | 320 | 160 | 80 |
| A/Утка/Вьетнам/342/01 (Вн/342) | H5N1 | 320 | 160 | 320 | 2560 | <20 | 640 |
| A/Гонконг/213/03 (Гк/213) | H5N1 | 640 | 160 | 10240 | 2560 | 2560 | 640 |
| Лен17/H5 | H5N2 | 160 | 40 | 1280 | 640 | <20 | 640 |
| H5N2-дт | H5N2 | 160 | 80 | 1280 | 640 | <20 | 640 |
| A/курица/Гонконг/409.1/02 | H5N1 | 160 | 80 | 5120 | 320 | 640 | 320 |
| A/курица/Гонконг/31.4/02 | H5N1 | 320 | 80 | 320 | 640 | <20 | 320 |
| A/Гусь/Гонконг/668.1/01 | H5N1 | 160 | 80 | 640 | 640 | 160 | 160 |
Показано, что вакцинный кандидат Лен 17/Н5 являлся идентичным родительскому штамму А(H5N2), а также проявлял более выраженную степень антигенного родства с ВП вирусами А(H5N1), выделенными в Гонконге в 1997 году, по сравнению с вирусами А(H5N1) 2001-2003 годов выделения. При этом сыворотка, полученная к самому реассортанту Лен 17/Н5, реагировала в пределах всего 1:2 – 1:4 гомологичного титра как с вирусами 1997 года выделения, так и с более поздними изолятами.
Изучение генетической стабильности реассортантного ХА штамма Лен 17/Н5 после пассажа в носовых ходах хорька. В процессе получения иммунной антисыворотки реассортантный вирус вводили в носовые ходы хорька в дозе 6 lg ЭИД50/мл с последующим выделением реизолятов на 3-й и 6-й день после инокуляции. Носовые смывы пассировали трехкратно в РКЭ. Вакцинный вирус, выделенный на 3-й день после инокуляции, сохранил все значащие мутации в генах внутренних и неструктурных белков, характерные для донора аттенуации Лен/17. На 6-й день после инокуляции вирус не был выделен (Desheva et al, 2005).
Иммуногенность реассортантного штамма Лен 17/Н5 при введении белым мышам. На мышах была изучена возможность использования штамма Лен 17/Н5 в качестве как ЖГВ, так и инактивированной вакцины (ИГВ). Было проведено сравнительное изучение иммуногенности ЖГВ в дозе 107 ЭИД50/мл, вводимой интраназально (и/н) и цельновирионной ИГВ, инактивированной формалином, в дозе 10 мкг/100 мл, вводимой внутримышечно (в/м). Результаты представлены в таблице 9. После однократной и/н иммунизации ЖГВ из штамма Лен 17/Н5 сероконверсии антигемагглютинирующих и нейтрализующих антител в сыворотках крови наблюдались только к гомологичному вирусу подтипа А(H5N2). В качестве ИГВ, парентеральное введение Лен 17/Н5 стимулировало образование сывороточных антител как к гомологичному вирусу A(Н5N2), так и вирусам A(H5N1), выделенным в 1997 г. в Гонконге (А/Гонконг/156/97 и А/Гонконг/483/97).
Таблица 9
Иммуногенность ЖГВ и ИГВ из реассортантного штамма Лен 17/Н5 через 6 недель после введения мышам
| Препарат | РТГА (среднегеометрические титры), n=5 | РН (средние титры нейтрализующих антител), n=5 | ||||
| H5N2-дт | Гонконг/483 | Гонконг/213 | H5N2-дт | Гонконг/156 | Гонконг/213 | |
| ЖГВ (и/н) | 8,9 | <10 | <10 | 80 | <20 | <20 |
| ИГВ (в/м) | 10,0 | 7,6 | <10 | 160 | 80 | <20 |
| H5N2-дт (и/н) | 10,0 | <10 | <10 | 160 | 80 | 40 |
| ФСБ(и/н) | <10 | <10 | <10 | <20 | <20 | <20 |
Применение ИФА позволило выявить в ответ на введение ЖГВ или ИГВ развитие сероконверсий вирус-специфических IgG и IgA в сыворотках крови к вирусам H5N1: к цельному вирусу A/Гонконг/213/03 и очищенному НА А/Гонконг/156/97 (рис. 3). В группе мышей, иммунизированных ЖГВ, были выявлены специфические IgG и IgA антитела к вирусам А(H5N1) в легких и верхних дыхательных путях (ВДП). Внутримышечное введение ИГВ не стимулировало выработку IgA в легких и ВДП, локальный иммунный ответ в этом случае был представлен в основном IgG и был выражен значительно слабее, чем при интраназальном введении ЖГВ (р<0,001) (рис.3).

Рис. 3. Системные и секреторные IgG и IgA антитела (ИФА) к вирусам гриппа A(H5N1) после введения мышам реассортантного штамма Лен 17/Н5.
Таким образом, была подтверждена способность штамма Лен 17/Н5 индуцировать антитела не только к гомологичному варианту подтипа H5N2, но также и перекрестно- реагирующие антитела к вирусам А(H5N1) (Desheva et al., 2006).
Сравнительное изучение эффективности ЖГВ и ИГВ из штамма Лен 17/Н5 при реинфекции мышей вирусами A(H5N1). Для заражения животных через 1,5 месяца после однократной иммунизации ЖГВ и ИГВ на основе штамма Лен 17/Н5 использовали вирусы подтипа H5N1 А/Гонконг/483/97 в дозе 50 ЛД50 и А/Гонконг/213 в дозе 100 МИД50 (Desheva et al., 2006). Поскольку вирус А/Гонконг/213/03 не является высокопатогенным для мышей, оценку защитного действия вакцин проводили по показателям выделения этого вируса из легких на 3-й день после контрольного заражения. Результаты представлены в таблице 10.
Показано, что введение мышам ВП штамма А/Гонконг/483 в дозе 50 ЛД50 приводило в контрольной группе к значительной потере веса, начиная с 3-го дня после инфекции и к 100% смертности к 8-му дню, при этом средние титры вируса в легких достигали 5,9 lg ЭИД50/мл. Иммунизация ЖГВ на 100% защищала от летальности, при этом потеря в весе не превышала 5%, а средний титр инфекционного вируса в легких был в 10000 раз ниже, чем в контрольной группе (p<0,001). ИГВ защищала от летальности в 9 случаях из 10 (90%). Несмотря на то, что в группе ИГВ инфекционный вирус ни в одном случае не был выделен из легких, некоторое его количество было выделено из носовых ходов и из головного мозга.
Таблица 10
Эффективность против заражения вирусами А(H5N1),
выделенными в 1997 и 2003 гг.
| Препарат | Заражение 50 LD50 А/Гонконг/483/97 | Заражение 100 МИД50 А/Гонконг/213/2003 | ||||||
| летальность/всего | снижение веса (%) | средние титры (lg ЭИД50/мл), n=5 | выделение вируса из легких | |||||
| легкие | носовые ходы | головной мозг | тимус | выделено/всего | средние титры (lg ЭИД50/мл) | |||
| Лен17/H5(ЖГВ) | 0/8 | 6 | 1,9±0,5 | 0,8 | 0,8 | 0,8 | 1/10 | 1,8±0,9 |
| Лен17/H5(ИГВ) | 1/8 | 7 | 1,5 | 1,1±0,3 | 1,0±0,5 | 0,8 | 0/5 | 1,5 |
| H5N2-дт | 0/8 | 0 | 1,5 | 0,8 | 0,8 | 0,8 | 0/10 | 1,5 |
| Контроль | 8/8 | 22 | 5,9±1,3 | 4,0±0,7 | 4,3±0,8 | 3,6±1,3 | 10/10 | 5,3±1,4 |
Заражение вирусом А/Гонконг/213, значительно отличающимся по антигенным свойствам, показало, что ЖГВ была на 90% эффективной, когда инфекционный вирус выделялся из легких в 1 случае из 10 в среднем титре 1,8 lg ЭИД50/мл, то есть в 3000 раз меньшем, по сравнению с контролем (p<0,001).
В другом эксперименте была изучена эффективность против реинфекции антигенным вариантом вируса А(H5N1), выделенным во время вспышки во Вьетнаме в 2004 г (в сотрудничестве с Lu et al.). В исследование были добавлены еще две группы мышей, которых иммунизировали в/м цельновирионной неадьювантной ИГВ из штамма Лен 17/Н5 двукратно с интервалом в 4 недели, либо ИГВ с добавлением гидроокиси алюминия - двукратно (табл. 11). Через 3 месяца после первичной иммунизации животные во всех вакцинных группах были полностью защищены от летальной инфекции 200 ЛД50 вируса A/Вьетнам/1203/2004(H5N1). В контрольной группе наблюдалось развитие тяжелой системной инфекции, сопровождающееся снижением среднего веса до 19%, выделением инфекционного вируса из тканей головного мозга в высоких титрах и 100% гибелью животных на 6-9 день инфекции. В группе ЖГВ снижение среднего веса было незначительным (7%), наблюдалось снижение титра заражающего вируса в легких в 10000 раз по сравнению с контролем, при этом инфекционный вирус не был выделен из головного мозга и верхних дыхательных путей.
Таблица 11
Эффективность против заражения антигенным вариантом вируса А(H5N1), выделенным во время вспышки во Вьетнаме в 2004 г.
| Препарат | Кратность введения | Средние титры вируса lg ЭИД50/мл (n=5) | Снижение веса (%) | Летальность /всего | ||
| легкие | носовые ходы | головной мозг | ||||
| ЖГВ | 1 | 1,6±1,2 | 0,8 | 0,8 | 7,3 | 0/5 |
| ИГВ | 1 | 2,8±1,8 | 1,0±0,4 | 1,1±0,7 | 11,2 | 0/5 |
| ИГВ | 2 | 0,8 | 0,8 | 0,8 | 8,0 | 0/5 |
| ИГВ+адьювант | 2 | 0,8 | 0,8 | 0,8 | 1,8 | 0/5 |
| Контроль | 1 | 6,1±0,7 | 4,7±0,9 | 4,5±0,1 | 19,4 | 5/5 |
Однократное введение ИГВ без адьюванта защищало мышей от летальности, однако заражающий вирус выделялся не только из легких, но также из носовых ходов и головного мозга. Для достижения полной защиты против системного распространения инфекционного вируса и его выделения из ВДП потребовалось две дозы ИГВ.
Таким образом, было показано, что однократная иммунизация ЖГВ из реассортантного штамма Лен 17/Н5 полностью защищала мышей против летальной инфекции высокопатогенными вирусами А(H5N1). При минимальном выделении вируса из легочной ткани зараженных животных, вирус не был выделен из носовых ходов или головного мозга, что коррелировало с наличием вирус-специфических IgA в секретах ВДП. Наблюдаемый защитный эффект реассортантного штамма Лен 17/H5 в отношении вирусов A(H5N1), принадлежащих к различным антигенным линиям в отсутствие достоверного уровня сероконверсий антигемагглютинирующих антител может объясняться как формированием специфических системных и локальных IgA и IgG, выявленных иммуноферментным методом, так и стимуляцией клеточного компонента иммунного ответа, что подтверждается выраженной индукцией интерферона- спленоцитами мышей, иммунизированных ЖГВ, в ответ на стимуляцию цельным вирусом А/Гонконг/213/03 или рекомбинантным НА вируса А/Гонконг/156/97(H5N1).
Перекрестная защита против ВП вируса A(H5N1), выделенного в 2005 г. на территории Российской Федерации. Данный раздел работы был выполнен на базе Вирусологического Центра НИИ микробиологии МО РФ (Москва) под руководством начальника отдела, к.б.н. С.А. Мельникова и начальника 1 НИУ, д.м.н., проф. Р.А. Хамитова, за что автор выражает им искреннюю благодарность. С целью изучения перекрестно-реактивной защиты, создаваемой ЖГВ из штамма Лен 17/Н5, было проведено заражение иммунизированных мышей вирусом H5N1 А/курица/Курган/2/05, выделенным специалистами Вирусологического центра в сентябре 2005 г. из легкого павшей курицы птицефабрики «Утятская». Культура штамма прошла один пассаж в легких белых мышей массой 14-16 г. В условиях закрытых лабораторий с повышенным уровнем безопасности на белых мышах линии BALB/с была изучена иммуногенность и эффективность ЖГВ из штамма Лен 17/Н5 по сравнению с субъединичной адьювантной ИГВ, приготовленной ФГУП «Микроген» из реассортантного штамма А(H5N1) NIBRG-14, полученного из Национального Института Биологических Исследований, Великобритания (WHO, 2006). Реассортант NIBRG-14 был подготовлен на основе штамма А/PR/8/34 и содержал модифицированные методами обратной генетики HA и NA от вируса A/Вьетнам/1203/2004(H5N1). В качестве адьюванта использовали иммуномодулятор полиоксидоний (полимер-субъединичная вакцина) или гидроокись алюминия (адсорбированная вакцина). ЖГВ в дозе 106,4/0,05 мл вводили интраназально однократно или двукратно с интервалом в 10 дней, ИГВ в дозе 15 мкг НА по ОРИД – парентерально однократно. Для оценки иммунного ответа у вакцинированных животных были взяты сыворотки крови на 21 день после последней иммунизации. Результаты представлены в таблице 12.
Интраназальное введение ЖГВ как двукратное, так и однократное вызывало образование перекрестно-реагирующих антигемагглютинирующих антител в титрах на уровне протективных (1:80 и 1:40 соответственно). Наиболее высокие титры антител к вирусу А(H5N1) были выявлены при помощи ИФА. В случае применения полимер-субъединичной вакцины, содержащей полиоксидоний, по всем трем тестам были получены наиболее низкие показатели.
Таблица 12
Результаты оценки иммуногенных и протективных свойств вакцинных кандидатов против птичьего гриппа подтипа H5
| Кратность введения | Название препарата, доза | Средние титры антител после иммунизации | Доля выживших животных после инфекции | ||||
| ИФА | РН | РТГА | заражающая доза (ЛД50) | абс./ всего | % | ||
| 1 | Полимер-субъединичная вакцина H5N1, 15 мкг | <1:40 | <1:10 | <1:10 | 25 | 3/15 | 20 |
| Субъединичная адсорбированная H5N1, 15 мкг | 1:80 | 1:10 | <1:10 | 25 | 6/15 | 40 | |
| Интраназальная живая Лен 17/Н5, 6,4 lg ЭИД50 | 1:320 | 1:14 | 1:40 | 27 | 8/14 | 57 | |
| 2 | Полимер-субъединичная вакцина H5N1, 15 мкг | 1:80 | 1:20 | 1:20 | 25 | 7/14 | 50 |
| Субъединичная адсорбированная H5N1, 15 мкг | 1:320 | 1:20 | 1:10 | 25 | 12/15 | 80 | |
| Интраназальная живая Лен 17/Н5, 6,4 lg ЭИД50 | 1:1280 | 1:40 | 1:80 | 27 | 13/15 | 87 | |
| Контроль | Раствор ФСБ | <1:40 | <1:10 | <1:10 | 27 | 0/10 | 0 |
Реинфекцию высокопатогенным вирусом А(H5N1) проводили на 21 день после первичной иммунизации в случае однократной вакцинации или на 21 день после последней иммунизации – в случае двукратного введения вакцины. После введения заражающего вируса в контрольной группе гибель животных наблюдалась, начиная с 6-го дня инфекции, и достигала 100% к 9-му дню. Иммунизация ЖГВ из штамма Лен 17/Н5 оказалась наиболее эффективной: двукратное введение защищало 87% иммунизированных животных против 27 ЛД50 заражающего вируса (р<0,001), а однократная иммунизация ЖГВ была эффективной на 57% (р=0,006). У животных, выживших после введения летальной дозы вируса A(H5N1), были также собраны сыворотки крови на 21 день после заражения. Показано, что титры антигемагглютинирующих антител после инфекции ВП вирусом подтипа А(H5N1) были всего в 2 раза выше (1:160), чем после двукратной иммунизации ЖГВ подтипа A(H5N2) (1:80). Таким образом, была продемонстрирована корреляция более высокого уровня создаваемой защиты против ВП вируса А(H5N1) при двукратном применении ЖГВ Лен 17/Н5 с более высоким уровнем сывороточных перекрестно-реагирующих антител.
БЕЗВРЕДНОСТЬ И ИММУНОГЕННОСТЬ ЖГВ «ОРВАКС» ПОДТИПА А(H5N2) В ОГРАНИЧЕННОМ КЛИНИЧЕСКОМ ИЗУЧЕНИИ
С целью разработки модели для клинической оценки вакцинных препаратов потенциально пандемического подтипа Н5 ФГУП НПО «Микроген» были подготовлены экспериментальные серии ЖГВ «Орвакс» из реассортантного штамма Лен 17/Н5. Клинические исследования проводили в сотрудничестве с зам. начальника ВЦ НИИМ МО РФ по научной работе к.м.н., ст. науч. сотр. В.И. Марковым и нач. отдела к.б.н., ст. науч. сотр. С.А. Мельниковым в соответствии с Протоколом исследования № ВГЖ-00/004/2006 «Оценка иммуногенных и протективных свойств вакцины гриппозной аллантоисной интраназальной живой, лиофилизат для приготовления раствора для интраназального введения (Орвакс)», согласованным с директором ФГУН ГИСК им. Л.А. Тарасевича. Изучение препарата, проводимое на клинической базе Военного госпиталя № 1137 Минобороны России, включало 2 этапа. Первый этап проводился на 20 добровольцах и согласно рекомендации «Комитета по этике при федеральном органе контроля качества лекарственных средств» в исследование не была включена группа плацебо. Во время второго этапа изучения в исследование была включена группа плацебо.
Безвредность. В ходе первого этапа испытаний показана безвредность и ареактогенность ЖГВ из реассортантного штамма Лен 17/Н5 для 20 вакцинируемых. ЖГВ вводили в дозе 6,9 lg ЭИД50/0,5 мл. Регулярная термометрия в течение 42 суток после вакцинации не выявила повышения температуры тела ни у одного добровольца (табл. 13).
Таблица 13
Клинические реакции у волонтеров, привитых живой гриппозной вакциной «Орвакс» после первой и второй вакцинации
| Вакцинация | Температурная реакция | Интоксикация | Катаральные явления в носоглотке | |||||||||
| 37,0 С | 37,1 – 37,5 С | 37,6 – 38,5 С | 38,6 С | |||||||||
| абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | |
| Первая (n=20) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 8 | 40 |
| Вторая (n=20) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
Катаральные явления, наблюдаемые только после первичной иммунизации, были очень слабо выражены, возникали на 3-4 день после вакцинации и проходили самопроизвольно к 6-му дню, их развитие не коррелировало с выделением вакцинного вируса из ВДП привитых (r=-0,29, р>0,05) и последующим приростом специфических антител в сыворотке крови добровольца.
Результаты клинического обследования добровольцев врачами-специалистами разного профиля и проведенные лабораторно-инструментальные исследования свидетельствовали об отсутствии отклонений в самочувствии и в результатах анализов после иммунизации вакциной «Орвакс» в сравнении с фоновыми значениями.
Генетическая стабильность. У вакцинированных волонтеров были получены мазки из носа на различные сроки после первичной иммунизации и ревакцинации. Всего было получено 33 реизолята, 16 - от 11 добровольцев после первичной вакцинации, и 17 - от 14 добровольцев после ревакцинации. Все реизоляты были выделены либо после 3-х пассажей в РКЭ, либо после 1-2 пассажей в культуре клеток MDCK в присутствии 2 мкг/мл трипсина TPCK c последующим пассажем в РКЭ. В отличие от выделения реизолятов реассортантов современных эпидемических вирусов на основе донора аттенуации А/Ленинград/134/17/57(H2N2), которые ранее не удавалось получить в сроки более 3 суток после иммунизации (Egorov et al., 1993, Klimov et al., 2000), средняя продолжительность выделения вакцинного вируса Лен 17/Н5 после 1-й вакцинации и ревакцинации составила 5,5 суток, что согласуется с ранее полученными данными о замедленной репродукции ХА реассортантов птичьих вирусов в клетках млекопитающих (Suguitan et al., 2006). Ввиду того, что у нескольких волонтеров положительный результат выделения вакцинного вируса был получен несколько раз на разные сроки после прививки, интерес представляло изучение возможных изменений фенотипических и генотипических признаков этих реизолятов. Показано, что реизоляты, полученные от одних и тех же добровольцев на разные сроки после вакцинации, сохранили ts фенотип и все мутации в генах внутренних и неструктурных белков, охарактеризованные для донора аттенуации А/Ленинград/134/17/57(H2N2).
Иммуногенность. РТГА проводили с использованием в качестве антигенов гомологичного вируса Лен 17/Н5 и реассортантного штамма подтипа А(H5N1) А/Индонезия/05/2005 c модифицированным методом обратной генетики НА, полученного на основе штамма А/PR/8/34. После первичной иммунизации выявлено 5,9% 4-х кратных приростов специфических антител (рис.4) к вирусу А(H5N2). Повторная иммунизация с интервалом в 21 день значительно усиливала иммунный ответ, приросты гомологичных антител после ревакцинации были выявлены в 47,1% случаев (р=0,02). Показатели приростов среднегеометрических титров антител (СГТ) возрастали с большей интенсивностью у повторно привитых по сравнению с первично привитыми и составили 1,3-2,8 (р=0,005).
4-х кратные и более поствакцинальные сероконверсии нейтрализующих антител к вирусу А(H5N2) были выявлены у 4-х волонтеров после первой прививки (20%) и у 10 (50%) - после повторной вакцинации (рис. 4).
 Рис. 4. Иммунный ответ на введение вакцины «Орвакс», n=20.
Рис. 4. Иммунный ответ на введение вакцины «Орвакс», n=20.
Прирост СГТ нейтрализующих антител после первичной иммунизации составил в среднем 1,9, после ревакцинации этот показатель увеличился до 2,9 (р=0,01). Число лиц с титрами 1:20 антигемагглютинирующих и нейтрализующих антител к гомологичному вирусу А(H5N2), составил после первичной вакцинации 17,7 и 25% соответственно. После ревакцинации эти показатели составили 47,1% и 55% (рис. 4).
У волонтеров было выявлено образование перекрестно-реагирующих антител к реассортантному штамму подтипа A(H5N1), принадлежащему к антигенно и генетически удаленной линии вирусов подтипа Н5. Поствакцинальные титры антигемагглютинирующих антител 1:20 к вирусу A(H5N1) были выявлены среди 11,8% обследованных после первой прививки и у 29,4% - после ревакцинации (р<0,05), приросты СГТ к вирусу A(H5N1) составили 1,2 после первичной вакцинации и 1,6 – после ревакцинации.
Для непрямого варианта ИФА 96-луночные панели покрывали 0,5 мкг/мл очищенного НА штамма Лен 17/Н5, предоставленного ФГУП НПО «Микроген». Применение ИФА позволило выявить в сыворотках крови 4-кратные сероконверсии вирус-специфических IgG у 35% волонтеров после первой прививки и у 55% - после повторной вакцинации. При этом 4-кратные сероконверсии вирус-специфических IgА наблюдались у 45% волонтеров после первой прививки и у 60% - после повторной вакцинации. Средняя кратность приростов IgG составила 1,6 после первой прививки (р=0,03) и 2,5 – после ревакцинации (р<0,001). В отношении сывороточных IgА этот показатель составил соответственно 1,9 (р=0,02) и 3,2 (р=0,002). Необходимо отметить, что специфичность данного метода при оценке иммунного ответа к гриппу у взрослых людей может быть недостаточной, поскольку в этом случае часто наблюдается неспецифическое реагирование, в частности с ревматоидным фактором или аутоантителами (Salonen et al., 1992, Huang et al, 1992). При этом могут выявляться также антитела к антигенным детерминантам внутренних белков вирусов гриппа (в случае, если в качестве антигена используется цельный вирус). Если же в качестве антигена использовать очищенный или рекомбинантный НА, то неспецифическое реагирование может объясняться наличием общих антигенных эпитопов в НА вирусов подтипов Н1, Н2 и Н5 (Rowe et al., 1999) или конформационными изменениями в молекуле НА в процессе адсорбции на твердой фазе, делающими консервативные эпитопы более доступными для распознавания. В обоих случаях при исследовании сывороток взрослых людей наблюдается высокий иммунологический фон до прививки. Так, средний уровень сывороточных IgG до прививки в нашем исследовании составил 1:5000. В этом отношении более показательным оказалось изучение сывороточных IgА, средний титр которых до прививки составил 1:100. После вакцинации и ревакцинации эти показатели возросли соответственно до 1:256 и 1:400, при этом наблюдалась корреляция с уровнем локальных IgА в носовых секретах. Показано значительное (р=0,03) увеличение числа 4-х кратных сероконверсий секреторных IgA (SIgA) после ревакцинации (65%) по сравнению с первичной вакцинацией (30%). СГТ секреторных антител после ревакцинации составили 1:16.
Были проанализированы суммарные данные вирусологического подтверждения выделения вакцинного вируса от привитых и развития сероконверсий антител к гомологичному вирусу A(H5N2) по данным различных серологических тестов. Частота 4-х кратных сероконверсий по данным РТГА, РН и ИФА (IgG) не зависела от положительного или отрицательного результата выделения вакцинного вируса из носовых ходов привитых ни после первичной иммунизации, ни после ревакцинации (р>0,05).
Таким образом, результаты 1 фазы клинических испытаний показали, что количество реакций после введения вакцины «Орвакс» не превышало регламентированных норм, установленных Фармакопейной статьей на ЖГВ. Для получения реизолятов вакцинного вируса от привитых потребовалось не менее 2-3 пассажей на чувствительных культурах, что говорит о крайне незначительном содержании вируса в мазках из полости носа и свидетельствует о безопасности вакцины для окружающих. Показатели иммунного ответа после однократной иммунизации гриппозной вакциной подтипа Н5 были несколько ниже, чем при иммунизации сезонными гриппозными вакцинами, что является вполне закономерным в серонегативной популяции. Двукратная иммунизация значительно усиливала показатели иммуногенности вакцины «Орвакс». Европейским комитетом по контролю медицинских препаратов были установлены следующие критерии иммуногенности вакцинных препаратов на основе как эпидемических, так и потенциально пандемических вирусов гриппа: кратность приростов антител не менее 2,5 для лиц 18-60 лет и развитие достоверных сероконверсий у 40% привитых. Как видно из вышеприведенных данных, вакцина «Орвакс» подтипа А(H5N2) при двукратном введении соответствовала Европейским критериям иммуногенности по числу сероконверсий (47,1%) и по кратности приростов антигемагглютинирующих антител (2,8). В отношении числа лиц с защитным титром антител после прививки, до сих пор остается не выясненным вопрос, какой титр антигемагглютинирующих антител можно считать защитным в отношении потенциально пандемических вирусов - 1:20 или 1:40.
Тест микронейтрализации, который ранее был рекомендован для изучения антительного ответа в сыворотках лиц, перенесших инфекцию вирусами А(H5N1) (ВОЗ, 2005), оказался достаточно чувствительным и специфичным в выявлении поствакцинальных штаммоспецифических вирус-нейтрализующих антител после иммунизации ЖГВ. Необходимо отметить, что при оптимизации теста микронейтрализации желательно использовать клеточные линии MDCK, поддерживающие оптимальную репродукцию используемого в тесте вируса (Rowe et al., 1999), прошедшие не более 20-25 пассажей до замораживания в жидком азоте.
Изучение поствакцинального секреторного иммунитета показало, что вакцина способна вызывать значительный уровень иммунного ответа вирус-специфических IgA в ВДП, то есть непосредственно во входных воротах инфекции.
Необходимо отметить, что обычно рекомендуемая инфекционная активность ЖГВ из реассортантных штаммов вирусов гриппа А подтипов А(H1N1) и А(H3N2) составляет не менее 7,5 lg ЭИД50/0,2 мл. Однако, учитывая, что это был первый опыт применения среди людей ЖГВ подтипа H5, была использована сниженная доза вакцинного вируса (6,9 lg ЭИД50/0,5 мл). При этом после двукратной вакцинации с интервалом в 21 день удалось вызвать выраженный иммунный ответ. При проведении 2-го этапа клинических испытаний на 42 добровольцах, дважды получивших вакцину с интервалом в 21 день, доза вакцинного вируса была увеличена до 8,3 lg ЭИД50/0,5 мл. Данные по безвредности и реактогенности препарата полностью подтвердили ранее полученные показатели: отсутствовали температурные реакции и не было выявлено какого-либо неблагоприятного действия на организм привитых по данным инструментального и лабораторного обследования. По результатам иммуногенности за два года исследования был проведен суммарный анализ поствакцинального иммунного статуса привитых по данным двух серологических тестов (РТГА и РН) с учетом кратности вакцинации и дозы вакцинного вируса. Было показано, что после первичной иммунизации ЖГВ в дозе 6,9 lg ЭИД50/0,5 или 8,3 lg ЭИД50/0,5 мл общее число 4-х кратных сероконверсий сывороточных антител составило 23-50% соответственно, а после ревакцинации – 71-74% (рис. 5). При этом число сочетанных конверсий у одних и тех же лиц было относительно невысоким 0-2,4% после первой вакцинации и 14-24% после ревакцинации (r=-0,64-0,12, р>0,05).

Рис. 5. Суммарный уровень сероконверсий в сыворотках крови привитых вакциной «Орвакс» по данным РТГА и РН.
Таким образом, по результатам 2-х исследований было установлено, что при оценке ЖГВ подтипа Н5 сочетанное применение тестов РТГА и МН для изучения гуморального иммунного ответа позволяет получить наиболее полную информацию о развитии сероконверсий в ответ на прививку.
РАЗРАБОТКА СТРАТЕГИИ И ТАКТИКИ ВАКЦИНОПРОФИЛАКТИКИ ГРИППА С ПОМОЩЬЮ ЖГВ В ИНТЕРПАНДЕМИЧЕСКИЙ ПЕРИОД И ПРИ ПОДГОТОВКЕ К ОЧЕРЕДНОЙ ПАНДЕМИИ
Вакцинация против гриппа во всем мире в первую очередь рекомендована лицам с высоким риском возникновения осложнений, в том числе пожилым людям старше 60 лет и лицам, страдающим хроническими соматическими заболеваниями, а также тем, кто в наибольшей степени подвержен риску заболевания гриппом и заражения других лиц. Из 3-х пандемий 20-го столетия две (1957 и 1968 гг.) вызвали наибольшую заболеваемость и смертность среди маленьких детей, пожилых и хронически больных людей (Potter, 2001).
Применение ЖГВ в группах высокого риска последствий заболевания гриппом. В настоящее время доля лиц в возрасте старше трудоспособного в общей численности населения России составляет 20,5% (26,8 млн. человек), а к 2025 г по прогнозам она возрастет до 26,7%. По программе ВОЗ совместно со специалистами из Центра по контролю и предупреждению заболеваний США на базе домов престарелых Санкт-Петербурга и Ленинградской области были разработаны схемы иммунизации лиц преклонного возраста и больных, страдающих хроническими заболеваниями сердечно-сосудистой системы и нарушениями обмена веществ, с использованием ХА реассортантной ЖГВ. Всего под наблюдением находилось 1177 человек в возрасте от 65 до 90 лет с различными диагнозами и уровнями функциональной активности Полученные данные клинического и лабораторного обследования престарелых и хронически больных, привитых ЖГВ, показали, что ХА тривакцина не вызывала каких-либо неблагоприятных реакций у этой группы лиц. Наиболее эффективным методом иммунизации в пожилом возрасте признано сочетанное введение ЖГВ+ИГВ с последующей ревакцинацией ЖГВ. Изучение особенностей поствакцинального ответа на введение ЖГВ у лиц пожилого возраста показало, что в этой возрастной группе живой антиген не уступает инактивированному в стимуляции циркулирующих сывороточных антител. У пожилых людей ЖГВ стимулировала образование секреторных IgA в титрах не ниже, чем у лиц молодого возраста, при этом их концентрация в секретах ВДП не снижалась на протяжении 3-х месяцев. В соавторстве с А.Н. Найхиным и др. (2002) было изучено влияние возрастных изменений на функцию клеточного иммунного ответа при иммунизации гриппозными вакцинами. Показано, что ЖГВ активно индуцировала продукцию Th1-маркерных цитокинов (ИЛ-2 и ИФН-) лимфоцитами периферической крови, стимулированными in vitro вирусом A(H1N1), как у молодых людей, так и у пожилых, тогда как ИГВ – только у молодых. Результаты продукции Th1-маркерных цитокинов хорошо согласуются с данными об индукции клеточного иммунного ответа в ответ на введение ЖГВ. Показатели ПАЛ у пожилых и молодых людей оказались соответственно в 2 и 1,5 раза выше после введения ЖГВ по сравнению с ИГВ, при введении которой увеличение этого показателя составило у пожилых не более 1,3, а у молодых людей отсутствовало.
Оценка эффективности вакцинации против гриппа в домах престарелых показала, что в эпидемический по гриппу период среди лиц, привитых ЖГВ, имело место снижение заболеваемости в 1,6-2,0 раза по сравнению с непривитыми.
Таким образом, было показано, что иммунизация ЖГВ лиц пожилого возраста является не только безвредной, но и имеет преимущество в отношении стимуляции локального и клеточного компонентов иммунного ответа. По данным проведенных исследований были разработаны методические рекомендации «Вакцинопрофилактика гриппа с помощью живой гриппозной вакцины среди лиц пожилого возраста».
Применение тривалентной ЖГВ, включающей реассортантные вакцинные штаммы на основе донора аттенуации А/Ленинград/134/17/57(H2N2), среди детей дошкольного возраста. По данным ВОЗ, начиная с 1997 г. 50% всех заболевших гриппом А(H5N1) составили лица до 18 лет, а 90% - лица до 37 лет (ВОЗ, 2007). По прогнозам ВОЗ, в случае возникновения пандемии, вызванной вирусами А(H5N1), наибольшему риску заболевания могут подвергнуться дети, подростки и люди молодого возраста. Дети дошкольного и школьного возраста являются основными распространителями гриппозной инфекции в обществе. В то же время имеются данные о том, что при массовой вакцинации детей резко снижается заболеваемость невакцинированных лиц более старшего возраста (Monto et al., 1999).
Для вакцинации детей в детских садах Ленинградской области применялась коммерческая тривалентная ЖГВ для взрослых, включающая реассортантные штаммы, подготовленные в отделе вирусологии НИИЭМ РАМН на основе штаммов, рекомендованных ВОЗ на 1999-2001 эпидемические сезоны: A/17/Пекин/95/25 (H1N1), A/17/Новая Каледония/99/50 (H1N1), A/17/Сидней/97/76 (H3N2) и B/60/Петербург/95/20. Данный раздел работы был выполнен в рамках совместной с ГИСК им. Л.А. Тарасевича «Программы исследований по оценке безвредности и иммуногенности живой гриппозной вакцины для детей в возрасте 3-6 лет как единого препарата для взрослых и детей». Исследования проводили в сотрудничестве с руководителем клиники НИИ гриппа РАМН проф., д.м.н. В.П. Дриневским и руководителем лаборатории испытаний новых средств защиты против вирусных инфекций д.м.н. М.К. Ерофеевой.
В течение 2-х эпидемических сезонов было обследовано и привито 369 детей. По суммарным данным 2-х лет исследования показано, что ЖГВ, включающая реассортантные вакцинные штаммы на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), была ареактогенной при применении у детей 3-6 лет. ЖГВ не оказывала какого-либо побочного влияния на организм детей по данным частоты соматической и аллергологической патологии в течение 6 месяцев после прививки. Во время прививочного сезона 1999-2000 г. титры антигемагглютинирующих антител к вирусам гриппа А 1:40 после вакцинации наблюдались у 45-53% вакцинированных (к вирусу В – у 30 %), кратность приростов СГТ антител к вирусам гриппа А и В у привитых детей составила 3,2-3,6. Анализ не выявил статистически значимых различий между количественными параметрами иммунного ответа в группах привитых однократно и двукратно.
В 2000 г. в состав вакцины был включен штамм А(H1N1) новой антигенной разновидности - A/17/Новая Каледония/99/50. Перед началом вакцинации подавляющее большинство детей (98%) были серонегативными к этому штамму. Сероконверсии сывороточных антител к вирусу А(H1N1) наблюдались в 26,4% случаев, при этом 4-х кратные приросты секреторных IgA к этому антигену наблюдались у 44% обследованных. Таким образом, даже при условии, что подавляющее большинство детей перед прививкой были серонегативными, при однократном применении взрослого варианта ЖГВ удалось стимулировать выраженный иммунный ответ. По данным 2-х эпидемических сезонов вакцинация привела к значительному снижению заболеваемости ОРЗ и гриппом в период эпидемического подъема среди привитых, коэффициент эффективности вакцинации ЖГВ в отношении гриппа и ОРЗ составил 64 %.
На основании полученных результатов тривалентная ЖГВ для взрослых, включающая реассортантные штаммы современных эпидемических вирусов на основе доноров аттенуации А/Ленинград/134/17/57(H2N2) и В/СССР/60/69, рекомендована для применения среди детей от 3-х лет и взрослых без ограничения возраста, в связи с чем внесены изменения в фармакопейную статью на ЖГВ ФСП 42-0504-4097-04.
Изучение на экспериментальной модели оптимальной схемы иммунизации реассортантным штаммом подтипа Н5. В случае формирования пандемического штамма одним из важнейших условий эффективности вакцины нового подтипа будет являться разработка стратегии и тактики ее применения как во время пандемического подъема, так и после него, в период стабилизации эпидемиологической ситуации, а именно: кратность применения, целесообразность включения в состав существующей поливалентной вакцины и возможности сочетания с другими профилактическими средствами. В связи с этим необходимо проводить исследования в направлении изучение взаимодействия вакцинных штаммов подтипа Н5 с реассортантными штаммами современных эпидемических вирусов, изучение иммуногенности и эффективности при различных схемах введения, включающих в себя комбинированное введение с ИГВ. На экспериментальной модели были изучены прививочные свойства вакцинного штамма Лен 17/Н5 при введении в составе поливалентной вакцины. Для оценки на мышах линии CBA инфекционной активности и иммуногенности реассортантного штамма Лен 17/Н5 при смешанном введении с реассортантами современных эпидемических вирусов было проведено интраназальное заражение ХА реассортантными штаммами Лен 17/Н5, А/17/Новая Каледония/99/145(H1N1), А/17/Висконсин/05/84(H3N2) и В/60/Малайзия/04/898 раздельно и в сочетании при заражающей дозе 6 lg ЭИД50 каждого вируса. Репродуктивную активность в легких определяли на 3-и сутки после инфекции по результатам титрования суспензии органов в РКЭ. Сыворотки крови для оценки иммуногенности были собраны через 28 дней после иммунизации. Результаты представлены в таблице 14.
Таблица 14
Прививочные свойства реассортантного штамма Лен 17/Н5 при введении мышам раздельно и в составе дивалентной или поливалентной ЖГВ
| Вакцинный препарат | Максимальное снижение веса (%) на 5-е сутки п.и. | Средние титры по данным титрования суспензии органов на 3-и сутки п.и. (lg ЭИД50/мл) n=3 | Нейтрализующие антитела к вирусу Н5N2 (СГТ) n=5 | Вирус-специфические IgG к НА Н5 (lоg10) n=5 | |
| легкие | носовые ходы | ||||
| A(Н1N1) | 3 | 3,8±1,6 | 1,3±0,5 | 14,1 | 2,8±0,5 |
| A(Н3N2) | 0 | 1,5 | 1,0±0,3 | 5,0 | 2,1±0,2 |
| В | 0 | 3,9±1,8 | 2,4±1,0 | 5,0 | 2,0 |
| Н5N2 | 0 | 1,6±0,2 | 1,9±1,5 | 30,3 | 3,4±0,3 |
| A(Н1N1)+A(Н5N2) | 1 | 1,8±0,6 | 3,4±0,5 | 31,8 | 3,2±0,2 |
| A(Н1N1)+A(Н3N2)+В | 5 | 3,6±0,7 | 4,1±0,6 | 20,0 | 2,2±0,3 |
| A(Н1N1)+A(Н3N2)+В+A(Н5N2) | 3,5 | 3,8±2,0 | 4,7±1,0 | 14,1 | 2,3±0,2 |
| Контроль (раствор ФСБ) | 0 | 1,5 | 0,8 | 5,0 | 2,0 |
Было показано, что введение каждого из реассортантных вирусов, а также их сочетания - A(Н1N1)+A(Н5N2), A(Н1N1)+A(Н3N2)+В, A(Н1N1)+A(Н3N2)+В+A(Н5N2) - не приводило к снижению массы тела животных более чем на 5%. При раздельном введении наибольший уровень репродуктивной активности в легких мышей наблюдался для реассортантов А(Н1N1) и В (4,6 и 3,9 lg ЭИД50/мл соответственно). Использование штамма Лен 17/Н5 как в виде дивакцины в сочетании с реассортантом А(Н1N1), так и в составе тетравакцины, не приводило к дополнительному снижению массы тела животных по сравнению с раздельным заражением.
При смешанном заражении реассортантами А(Н1N1)+А(H5N2) наблюдалось достоверное снижение выделения смеси вирусов из легких по сравнению с показателями репродукции обоих штаммов, введенных по отдельности. При одновременном введении трех реассортантных вирусов современных циркулирующих разновидностей A(Н1N1)+A(Н3N2)+В уровень репродукции в легких не превышал таковых для отдельно взятых реассортантов А(Н1N1) или В. Добавление к трем реассортантам эпидемических вирусов штамма Лен 17/Н5 приводило к снижению титров выделения вирусной смеси из легких, хотя различия не были статистически значимыми.
Через 28 дней после иммунизации штаммом Лен 17/Н5 отдельно или в сочетании с реассортантным штаммом подтипа А(Н1N1) в сыворотках крови определялись сходные по значению титры нейтрализующих антител к вирусу подтипа Н5, в то время как при введении в составе тетравакцины наблюдалось достоверное снижение титров нейтрализующих антител (р=0,03). Результаты ИФА с использованием в качестве подложки очищенного НА гомологичного вируса Лен 17/Н5 подтвердили это наблюдение. После иммунизации моновакциной Лен 17/Н5 или дивакциной А(Н5N2)+А(Н1N1) средние титры специфических IgG к вирусу Н5 составили 3,4 и 3,2 lg соответственно. При введении реассортантного штамма Лен 17/Н5 в составе тетравакцины уровень вирус-специфических IgG не превышал 2,5 lg, то есть был достоверно ниже (р<0,001). Таким образом, было показано, что сочетанное введение реассортантов А(Н5N2) и А(Н1N1) не приводило к снижению иммуногенности в отношении компонента Н5, в то время как в составе тетравакцины реассортант Лен 17/Н5 оказался менее иммуногенным, чем при отдельном введении. Это явление согласуется с ранее полученными данными, когда в опытах in vitro было показано, что при равных заражающих дозах штаммы вируса гриппа В в гетерогенных смесях оказывались более сильными конкурентами по сравнению со штаммами типа А (Амвросьева с соавт., 1983).
Ранее в клинических испытаниях сезонных гриппозных вакцин было показано, что иммунизация моновалентной или дивалентной ЖГВ в сочетании с ИГВ приводит к появлению хорошо выраженного добавочного эффекта в отношении сероконверсий как сывороточных, так и секреторных антител (Powers et al., 1989, Rudenko et al, 2001). Сочетанное применение ИГВ и ЖГВ может позволить прийти к компромиссу по затрате материальных и временных ресурсов при применении пандемической вакцины. В связи с этим в эксперименте было проведено изучение иммуногенности при различных схемах последовательного введения ЖГВ и ИГВ из штамма Лен17/Н5. В качестве положительного контроля использовали сыворотки мышей, иммунизированных в/м субъединичной инактивированной вакциной из вируса А(H5N2) c гидроокисью алюминия производства ФГУП «Микроген». Результаты представлены в таблице 15.
Наиболее высокий уровень СГТ антигемагглютинирующих антител к очищенному НА вируса А(H5N2) наблюдался после сочетанной иммунизации ЖГВ с ревакцинацией ИГВ. СГТ нейтрализующих антител, напротив, были наиболее выраженными (1:80) при вакцинации по сочетанной схеме ИГВ с последующей ревакцинацией ЖГВ. В этом случае также наблюдались существенные приросты локальных IgG (p=0,03) и IgA (p=0,05).
Таблица 15
Иммуногенность ЖГВ и ИГВ подтипа А(H5N2) при введении мышам раздельно и в сочетании
| Вакцинная группа | РТГА (СГТ), n=5 | РН (СГТ), n=5 | ИФА (lg) | |||
| сыворотки (n=5) | носовые смывы (n=5) | |||||
| IgG | IgA | IgG | IgA | |||
| ЖГВ | 8,4 | 20,0 | 3,4±0,5 | 2,9±0,3 | 1,9±0,4 | 1,8±0,4 |
| ИГВ | 26,4 | 16,8 | 3,2±0,5 | 2,4±0,3 | 1,9±0,4 | 1,5 |
| ИГВ+ЖГВ | 253,9 | 80,0 | 4,5±0,3 | 3,4±0,4 | 2,3±0,7 | 2,0±0,5 |
| ЖГВ+ИГВ | 320 | 40 | 4,4±0,4 | 3,1±0,3 | 1,7±0,3 | 1,6±0,2 |
| ИГВ+Al | 67,3 | 31,8 | 3,8±0,2 | 2,6±0,2 | 1,5 | 1,5 |
| Контроль | <10 | <10 | 2,0 | 2,0 | 1,5 | 1,5 |
Таким образом, в эксперименте было показано, что двукратная сочетанная иммунизация с использованием ЖГВ и ИГВ позволила повысить СГТ антигемагглютинирующих антител в 10 раз, в то время как применение ИГВ с адьювантом – в 2,5 раза. Использование ИГВ для первичной вакцинации и ЖГВ для ревакцинации позволило добиться не только повышения интенсивности гуморального иммунного ответа, но и сочетанности продукции секреторных IgA и антител в сыворотке крови.
ВЫВОДЫ
- Сравнительный анализ нуклеотидных замещений в генах холодоадаптированного штамма А/Москва/21/17/65(H2N2) и его предшественника – варианта А/Москва/21/65(H2N2) показал, что основные изменения, ответственные за проявления холодовой адаптации, локализуются в гене РВ2. Свойства холодовой адаптации и аттенуации, наследуемые реассортантами на основе штамма А/Москва/21/17/65(H2N2), позволяют обосновать его использование не только в качестве холодоадаптированного вакцинного штамма в случае пандемии, вызванной вирусом гриппа подтипа А(Н2N2), но и как потенциальный новый донор аттенуации для получения реассортантных вакцинных штаммов.
- Результаты секвенирования донора аттенуации В/СССР/60/69 для сезонной тривалентной ЖГВ подтвердили полученные ранее данные об аттенуации этого донорского штамма и дали возможность модифицировать ОТ-ПЦР рестрикционный метод применительно к генам внутренних и неструктурных белков реассортантных вакцинных штаммов вирусов гриппа В.
- Впервые получена уникальная коллекция высокорепродуктивных реассортантов вирусов гриппа А(Н5N2), А(Н7N3) и А(Н9N2), устойчиво проявляющих ts-, ca- и att- фенотип, с использованием стандартного метода генетической реассортации на основе холодоадаптированного донора аттенуации А/Ленинград/134/17/57(H2N2).
- Экспериментально установлено, что ЖГВ подтипа А(H5N2) из реассортантного штамма А/17/утка/Потсдам/86/92 защищает мышей против реинфекции высокопатогенными вирусами А(Н5N1), значительно различающимися как антигенно, так и генетически. Защита от летальности и системного распространения инфекции коррелирует с образованием перекрестно-реагирующих сывороточных и секреторных антител.
- В доклинических испытаниях на курах установлена неспособность к репродукции в организме птиц холодоадаптированных вакцинных штаммов А(H5N2) и А(H7N3), что подтверждает безопасность их производства и применения в районах с высокоразвитым сельским хозяйством.
- В клиническом изучении показана безвредность и ареактогенность прототипа ЖГВ из реассортантного штамма А/17/утка/Потсдам/86/92(H5N2) для волонтеров. Генетическая стабильность реизолятов вакцинного вируса подтипа является дополнительной гарантией безвредности применения подобных штаммов на людях. Вакцина вызывает образование системных и секреторных антител. Для достижения наибольшего уровня иммунологической эффективности требуется двукратное введение вакцины с интервалом в 21 день.
- В клинических испытаниях обосновано применение тривалентной ЖГВ, включающей реассортантные вакцинные штаммы на основе доноров аттенуации А/Ленинград/134/17/57(H2N2) и В/СССР/60/69, в качестве единого препарата для всех групп населения, включая детей от трех лет, взрослое население и лиц пожилого возраста, на основании чего внесены изменения в Фармакопейную Статью на «Вакцину гриппозную аллантоисную интраназальную живую сухую» ФСП 42-0504-4097-04.
- Предложена тактика применения ЖГВ в случае пандемии, которая заключается в подготовке и апробации вакцинных кандидатов всех потенциально пандемических подтипов вирусов гриппа. В случае формирования нового пандемического штамма наиболее целесообразной является двукратная иммунизация соответствующей моновалентной ЖГВ, начиная с 1-й волны пандемии с охватом всех возрастных групп населения.
СПИСОК ОСНОВНЫХ РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Авторские свидетельства.
- Дешева Ю.А., Ларионова Н.В. Александрова Г.И., Руденко Л.Г., Климов А.И. Штамм вируса гриппа В/60/Иоханнесбург/99/50 для производства живой гриппозной интраназальной вакцины для взрослых и для детей // Патент № 2215786, опубл. 10.11.2003.
- Дешева Ю.А., Руденко Л.Г., Александрова Г.И. Штамм вируса гриппа А/17/Калифорния/04/71(Н3N2) // Патент № 2307162, опубл.27.09.2007.
- Rudenko L.G., Desheva J.A., Alexandrova G.I. Influenza virus vaccine // WO 2007/118284 A1, 25.10.2007.
- Дешева Ю.А., Руденко Л.Г., Александрова Г.И. Штамм вируса гриппа А/17/утка/Потсдам/86/92(Н5N2) для производства живой и инактивированной гриппозной вакцины // Патент № 2318871, опубл. 10.03.2008.
Научные обзоры.
- Дешева Ю.А., Руденко Л.Г. Состояние и перспективы разработки вакцин против пандемически опасных вирусов гриппа птиц // Медицинский академический журнал, 2005.-Т.4.-№ 4.-С.26-35.
Статьи в реферируемых журналах и сборниках научных статей.
- Найхин А.Н., Руденко Л.Г., Арден Н., Кац Д., Григорьева Е.П., Дешева Ю.А., Донина С.А., Рекстин А.Р., Кокс Н. Формирование гуморального и секреторного иммунитета у лиц пожилого возраста при различных схемах иммунизации гриппозными вакцинами // Вопросы вирусологии.- 1998.- №1.- Т. – 43. - С. 20-24.
- Найхин А.Н., Руденко Л.Г., Арден Н., Кац Д., Григорьева Е.П., Дешева Ю.А., Донина С.А., Рекстин А.Р., Кокс Н. Иммунный ответ лиц пожилого возраста в зависимости от числа ежегодных сезонных иммунизаций живой и инактивированной гриппозными вакцинами // Вопросы вирусологии.- 1998.- Т. 43. - №3. С.130-134.
- Найхин А.Н., Рекстин А.Р., Кац Д., Донина С.А., Дешева Ю.А., Арден Н., Руденко Л.Г., Кокс Н. Продукция интерлейкина-2 in vitro и in vivo у пожилых людей, привитых раздельно и сочетанно живой и инактивированной гриппозными вакцинами // Вопросы вирусологии.- 2000.-Т. 45.- №1.- С. 25-29.
- Найхин А.Н., Рекстин А.Р., Кац Д., Донина С.А., Григорьева Е.П., Дешева Ю.А., Арден Н., Руденко Л.Г., Кокс Н. Пролиферативная активность лимфоцитов пожилых людей in vitro при раздельной и сочетанной иммунизации живой и инактивированной гриппозными вакцинами // Вопросы вирусологии.- 2000.-Т.45- №2.-C.41-45.
- Klimov A.I., Kiseleva I.V., Desheva J.A., Alexandrova G.I., Cox N., Rudenko L.G. Live attenuated reassortant influenza vaccine prepared using A/Leningrad/134/17/57(H2N2) donor strain is genetically stable after replication in children 3-6 years of age // Options for the Control of Influenza IV.-A. Osterhaus et al. eds., Exerpta Medica.- 2001.-p. 951-954.
- Rudenko L.G., Arden N.H., Grigorieva E., Naychin A., Rekstin A., Klimov A.I., Donina S., Desheva J., Holman R.C., DeGuzmzn A., Cox N., Katz J.M. Immunogenicity and efficacy of Russian live attenuated and US inactivated influenza vaccines used alone and in combination in nursing home residents // Vaccine.-2001.- Vol. 19.-Р. 308-318.
- Григорьева Е.П., Дешева Ю.А., Донина С.А., Найхин А.Н., Рекстин А.Р., Баранцева И.Б. Завиткова Е.А., Москвичева Т.М., Жаворонков В.Г., Руденко Л.Г. Сравнительная оценка безвредности, иммуногенной активности и профилактической эффективности взрослого и детского вариантов живой гриппозной вакцины у школьников 7-14 лет // Вопросы вирусологии.-2002.-№4.-C.24-27.
- Дешева Ю.А., Данини Г.В., Григорьева Е.П., Донина С.А., Киселева И.В., Рекстин А.Р., Ермакова Л.А., Нацина В.К., Николаева В.М. Лонская Н.И., Епишина Г.А., Жаворонков В.Г, Дриневский В.П., Ерофеева М.К., Найхин A. Н., Руденко Л.Г. Изучение безвредности, генетической стабильности и иммуногенности живой гриппозной вакцины для взрослых при вакцинации детей до 3х лет // Вопросы вирусологии.- 2002.-№4.-C.21-24
- Найхин А.Н., Рекстин А.Р., Баранцева И.Б., Донина С.А., Дешева Ю.А., Григорьева Е.П., Киселева И.В., Руденко Л.Г. Иммунный ответ на живую гриппозную вакцину // Вестник РАМН.- 2002.- № 12.- С. 24-28.
- Найхин А.Н., Рекстин А.Р., Донина С.А., Дешева Ю.А., Григорьева Е.П., Борланд Р., Руденко Л.Г. Иммуномодулирующий эффект липринола у людей, вакцинированных живой гриппозной вакциной // Медицинский Акадeмический журнал.- 2003.- Т.3.- № 4.- С. 60-65.
- Баранцева И.Б., Найхин А.Н., Донина С.А., Степанова Л.А., Рекстин А.Р., Григорьева Е.П., Дешева Ю.А., Руденко Л.Г. Гуморальный и местный иммунный ответ на гриппозные вакцины у лиц пожилого и молодого вазраста // Вопросы вирусологии.- 2003.-№2.-C.32-36.
- Донина С.А., Найхин А.Н., Григорьева Е.П., Дешева Ю.А., Баранцева И.Б., Рекстин А.Р., Руденко Л.Г. Локальный иммунный ответ на живую холодоадаптированную реассортантную гриппозную вакцину у детей, взрослых и престарелых лиц // Вопросы вирусологии.- 2003.-№ 2.-C. 29-31.
- Desheva J., Rudenko L., Alexandrova G., Cox N., Klimov A. Reassortment between avian apathogenic and human attenuated cold-adapted viruses as an approach for preparing influenza pandemic vaccines. Options for the control of Influenza V.– Ed. Y. Kawaoka, Elsevier.- 2004.- P. 724-727.
- Дриневский В.П., Дорошенко Е.М., Гаврилов А.А., Данини Г.В., Григорьева Е.П., Дешева Ю.А. Профилактика гриппа живой гриппозной вакциной у детей // Эпидемиология и вакцинопрофилактика.-2005.-№5 (24).-С.35-37.
- Дешева Ю.А., Рекстин А.Р., Лу Х., Кац Д., Климов А.И., Руденко Л.Г. Системный и местный ответ на введение мышам живого холодоадаптированного (ХА) или инактивированного реассортантного штамма подтипа Н5 // Медицинская иммунология. -2005.-Т. 7.-№ 2-3.-С.258-259.
- Рекстин А.Р., Дешева Ю.А., Лу Х., Александрова Г.И., Климов А.И., Катц Дж., Руденко Л.Г. Гетеросубтипический иммунный ответ и защита от высокопатогенныого вируса гриппа А(H5N1) у мышей, иммунизированных холодоадаптированным вирусом гриппа А/Ленинград/134/17/57(H2N2) // Медицинская иммунология.- 2005.- № 5-6.- С. 506-510.
- Чиркова Т.В., Найхин А.Н., Донина С.А., Григорьева Е.П., Петухова Г.Д., Рекстин А.Р., Дешева Ю.А., Руденко Л.Г. Продукция общих и вирус-специфических IgE у детей и пожилых людей, иммунизированных живой гриппозной вакциной // Аллергология.-2006.-№3.-С. 17-21.
- Lu X., Edwards L.E., Desheva J.A., Nguen D., Rekstin A, Stephenson J., Szretter K., Cox N., Rudenko L.G., Klimov A., Katz J. Cross-protective immunity in mice induced by live-attenuated or inactivated vaccines against highly pathogenic influenza A (H5N1) viruses // Vaccine.- 2006.- Vol. 24.- № 44-46.-Р.6588-6593.
- Desheva J. A., Lu X. H., Rekstin A.R., Rudenko L.G., Swayne D.E., Cox N.J., Katz J.M., Klimov A.I. Characterization of an influenza A H5N2 reassortant as a candidate for live-attenuated and inactivated vaccines against highly pathogenic H5N1 viruses with pandemic potential // Vaccine.- 2006.-Vol. 24.-№ 47-48.-Р. 6859-6866.
- Рекстин А.Р., Киселева И.В., Дешева Ю.А., Кац Д., Александрова Г.И., Климов А.И.,
Руденко Л.Г. Анализ ростовых характеристик одногенных реассортантов эпидемического вируса А/Ленинград/134/57(H2N2) и его холодоадаптированного мутанта А/Ленинград/134/17/57(H2N2) // Вопросы вирусологии.-2007.-Т.52.-№ 2.-С. 13-15. - Дешева Ю.А., Руденко Л.Г., Климов А.И. Определение состава генома реассортантных холодоадаптированных штаммов вируса гриппа В методом рестриктазного анализа // Вопросы вирусологии.-2007.-Т.52.-№3.-с.16-19.
- Дешева Ю.А., Лу Х., Рекстин А.Р., Кац Д.М., Руденко Л.Г., Климов А.И. Прививочные свойства реассортантного холодоадаптированного штамма вируса гриппа А(H5N2) при интраназальном введении мышам // Вопросы вирусологии.-2007.- Т.52.-№4.-с.27-30.
- Gambaryan A.S., Tuzikov A.B., Pazynina G.V., Desheva J.A., Bovin N.V., Matrosovich M.N., Klimov A.I. 6-sulfo sialyl Lewis X is the common receptor determinant recognized by H5, H6, H7 and H9 influenza viruses of terrestrial poultry // Virol. J.- 2008.- 5:85.-10 p. (http://www.virologyj.com/content/5/1/85).
- Desheva J.A., Rudenko L.G., Rekstin A.R., Swayne D.E., Cox N.J., Klimov A.I. Development of candidate H7N3 live attenuated influenza vaccine // Options for the control of influenza VI.- Ed. J.M. Katz., Int. Med. Press.-London, Atlanta.-2008.-P. 591-592.
- Rekstin A.R., Desheva J.A., Rudenko L.G. Interference-dominance properties of cold-adaped influenza viruses // Ibid.- P. 522-524.
- Дешева Ю.А., Смолоногина Т.А., Сергеева М.В., Рекстин А.Р., Свэйн Д., Климов А.И., Руденко Л.Г. Изучение биологических свойств холодоадаптированного реассортантного штамма вируса гриппа подтипа H7N3 // ЖМЭИ.-2008.-№ 6 (в печати).

