Физиологическое обоснование действия электрохимически активированных растворов поваренной соли на организм животных
На правах рукописи
ГОМБОЕВ Доржи Дашиевич
ФИЗИОЛОГИЧЕСКОЕ ОБОСНОВАНИЕ ДЕЙСТВИЯ ЭЛЕКТРОХИМИЧЕСКИ АКТИВИРОВАННЫХ РАСТВОРОВ ПОВАРЕННОЙ СОЛИ НА ОРГАНИЗМ ЖИВОТНЫХ
03.00.13 – физиология
Автореферат
диссертации на соискание ученой степени
доктора биологических наук
Новосибирск – 2009
Работа выполнена в ГНУ Сибирский ордена «Знак Почета» научно-исследовательский и проектно-технологический институт животноводства Сибирского отделения Российской академии сельскохозяйственных наук.
Научный консультант: доктор сельскохозяйственных наук, профессор,
действительный член Россельхозакадемии
Солошенко Владимир Андреевич
Официальные оппоненты: доктор биологических наук, профессор
Магер Сергей Николаевич
доктор биологических наук, профессор
Шестопалова Лидия Владимировна
доктор биологических наук, профессор
Айзман Роман Иделевич,
Ведущая организация: Уральский научно-исследовательский
ветеринарный институт Россельхозакадемии
Защита состоится «___»___________2009 г. в ___ часов на заседании диссертационного совета Д 220.048.04 при Новосибирском государственном аграрном университете (630039, г. Новосибирск, ул. Добролюбова, 160).
С диссертацией можно ознакомиться в библиотеке ФГОУ ВПО «Новосибирский государственный аграрный университет».
Автореферат разослан «___»______________2009 г.
Ученый секретарь
диссертационного совета Князев С.П.
1. Общая характеристика работы
Актуальность проблемы. Действие современных фармакологических препаратов, связанное с подавлением одних функций и стимуляцией других, не соответствует концепции сохранения гомеостаза. Поэтому поиск средств, действие которых основано на принципах, щадящих внутреннюю среду организма и потому влияющих на сохранение качества продукции, является актуальным направлением животноводства. В связи с этим растет интерес к действию на животных факторов малой интенсивности (ФМИ). К ним относят факторы физической – слабые магнитные поля, электромагнитные излучения, низкоинтенсивные токи и физико-химической природы – малые (МД), сверхмалые (СМД) дозы химических веществ, гомеопатические средства (Подколзин А.А., Донцов В.И., 1995). ФМИ физико-химической природы можно объединить в одну группу и по признаку нарушения основного правила современной фармакологии, зависимости «доза – эффект». Действие гомеопатических препаратов имеет общие патогенетические основы с эффектами МД и СМД (Блюменфельд Л.А., 1994; Бурлакова Е.Б. и др., 1999; Подколзин А.А., Гуревич К.Г., 2002).
Существует явление, которое не относят к ФМИ и ряд авторов не признают его реальным фактом (Волькенштейн М.В.,1975; Подколзин А.А. и Гуревич К.Г.,2002; и др.). Однако, на рубеже ХХ и ХХI веков опубликованы данные по физическому обоснованию его действия на биообъекты (Антонченко В.Я. и др.,1991; Фролов Б.А.,2004; Моkshin A.V.,1991).
Это водные электрохимически активированные растворы (ЭХАР) поваренной соли, которые в процессе неполного электролиза разделяются на анодную и катодную фракции – анолит и католит (Бахир В.М. и др., 1983; Кирпичников П.А. и др., 1986, 1993). Анолит ЭХАР – кислая фракция, имеет в своем составе избыток анионов активного хлора и является сильным консервирующим и антимикробным средством.
Католит ЭХАР – щелочная фракция, имеет в своем составе избыток катионов натрия и по данным разных авторов влияет на увеличение продуктивности животных при выпаивании (Фисинин В.И. и др., 1987; В.А. Солошенко и др., 1992; Богатова О.В., 1996) и др.
В более поздних работах (Скляров С.П. и др., 2007; Детцель Н.И., 2007 и др.), просматривается направленность на изучение физиологических механизмов, на гомеостаз животных, при выпаивании католита ЭХАР.
Работа ветеринарных специалистов со стадами животных не соответствует основному принципу медицины гуманитарной – «лечение не болезни, а больного» (Кветков В.П., 1992). Индивидуальный подход к пациенту, необходимый при применении гомеопатических средств (Вавилова Н.И., 1992), затруднителен в стадах по экономическим причинам.
Действие активированных растворов, влияющих как и ФМИ на процессы, происходящие в водной среде организма животных, – основано на квантовых, кристаллических свойствах воды, обосновано физически и не требует индивидуального подхода.
Католит ЭХАР обладает наиболее общими свойствами, регулирующими гомеостаз водной среды организма животных. При этом взаимодействие его с водной средой организма, с функциями органов и систем животных, а также с ФМИ изучено недостаточно.
Цель исследований – изучить физиологические основы действия электрохимически активированных катионов натрия поваренной соли на водную среду организма животных.
Задачи исследований:
- определить действие активированных катионов натрия на электролитный гомеостаз организма животных;
- изучить процессы активизации защитных реакций при нарушении динамического равновесия водной среды организма животных вызванного выпаиванием католита ЭХАР;
- выявить иммуномодулирующие и противовоспалительные свойства католита ЭХАР;
- определить возможность стимуляции чувствительности организма животных католитом ЭХАР к малым дозам лекарственных веществ;
- изучить действие активированных катионов натрия на минеральный и витаминный обмен организма животных;
- изучить процессы антимикробного и пребиотического действия электрохимически активированных растворов поваренной соли.
Научная новизна. Показано, что введение активированных водных растворов поваренной соли в организм животных, среди других ФМИ, является универсальным гомеостатическим средством.
Дана оценка регуляторного действия католита ЭХАР поваренной соли в сравнении с другими ФМИ на функциональные системы организма животных, выражающаяся в нарушении, с последующим восстановлением динамического равновесия. Введение избытка катионов натрия в организм нарушает динамическое равновесие водной среды и дает дополнительный стимул к усилению приспособительных реакций.
Изучены морфофункциональные особенности иммуномодулирующего действия католита ЭХАР на неспецифическую резистентность, стимуляцию клеточного и гуморального иммунного ответа организма животных.
Впервые получены данные по повышению чувствительности организма животных к ФМИ – малым дозам фармакологических средств и к гомеопатическим препаратам, при выпаивании животным католита ЭХАР.
Впервые показано противовоспалительное действие католита ЭХАР при активизации оппортунистической микрофлоры у животных.
Впервые установлено пребиотическое действие католита ЭХАР на симбионтную кишечную микрофлору животных при экспериментальных и спонтанных дисбиозах (дисбактериозах).
Впервые установлено регуляторное действие католита ЭХАР на гомеостаз при экспериментальном дефиците витаминов в рационе животных.
Дана фармакотоксикологическая и антимикробная оценка образуемого параллельно с католитом продукта электрохимической активации раствора поваренной соли – анодной фракции – анолита ЭХАР.
Показана возможность применения МСТ (мультисубстратного теста) для диагностики изменений микрофлоры при дисбиозах у животных.
Теоретическая и практическая значимость работы. Результаты исследований вносят существенный теоретический и практический вклад в изучение физиологии и патологии водной среды организма животных.
Выявлены патогенетические основы действия ЭХАР на функциональные системы организма животных – гомеостатические, минерального и витаминного обмена, пребиотического действия на симбионтную микрофлору и др.
Обоснована и экспериментально подтверждена возможность снижения доз витаминов в рационе птицы при выпаивании католита ЭХАР без снижения показателей продуктивности, открываются возможности для применения ФМИ в промышленном животноводстве при профилактике, лечении заболеваний, стимуляции продуктивности.
Показано, что анодная фракция ЭХАР поваренной соли является экологически чистым дезинфектантом, по эффективности не уступающим общепринятым средствам, а также консервантом и химически неагрессивной средой для хранения отходов первичной переработки продуктов животноводства и пищевой промышленности (кости, яичная скорлупа).
Апробация работы. Материалы диссертационной работы доложены и обсуждены на заседаниях ученого совета ГНУ СибНИПТИЖ (1997 – 1999, 2003 – 2008 гг.), международных конференциях «Современные проблемы и достижения аграрной науки» (Барнаул, 2003, 2006, 2008), 6-й и 7-й международных конференциях «Аграрная наука Сибири, Монголии, Казахстана, Кыргызстана и Башкортостана – сельскому хозяйству» (Павлодар, 2003; Новосибирск, 2004), международных конференциях (Якутск, 2004; Кемерово, 2005; Улан-Удэ, 2003 – 2007; Чита, 2008).
Публикация результатов исследований. По теме диссертации опубликовано 31 научная работа, в том числе 12 статей в ведущих рецензируемых научных журналах, рекомендованных ВАК Минобразования РФ для опубликования основных материалов докторских диссертаций.
Объем и структура работы. Диссертация изложена на 265 страницах текста, состоит из введения, обзора литературы, результатов собственных исследований, обсуждения, выводов, практических предложений, списка литературы. Работа иллюстрирована 62 таблицами и 32 рисунками. Список литературы включает 345 наименований, из них 269 на русском и 76 на иностранных языках.
Внедрение результатов исследований. По результатам исследований разработан «Способ экономии витаминов в рационе перепелов», оформлена заявка на патент (справка о приоритете № 2008120070 от 20.05.2008). Материалы диссертационной работы используются в учебном процессе в Бурятской и Иркутской государственных сельскохозяйственных академиях; на медицинском факультете Бурятского государственного университета; в Новосибирском государственном университете. Полученные данные приняты для использования в научных исследованиях по микробиологии и иммунологии в ГНУ НИИ ветеринарии Восточной Сибири и Забайкальском НИИ сельского хозяйства СО Россельхозакадемии, используются в животноводческих хозяйствах Новосибирской области.
Основные положения, выносимые на защиту.
- Активизация обменных процессов в организме при избытке катионов натрия, вызванном выпаиванием животным католита ЭХАР.
- Стимуляция чувствительности организма животных к малым дозам лекарственных препаратов и к гомеопатическим препаратам католитом ЭХАР, его иммуномодулирующее действие.
- Адаптогенное действие ЭХАР на систему «микроорганизм – хозяин».
Автор считает приятным долгом выразить признательность научному консультанту, академику Россельхозакадемии В.А.Солошенко, коллективу сектора технологии кормов СибНИПТИЖ в лице доктора сельскохозяйственных наук В.А.Рогачева, коллективу ЗАО «Сибветфарм» в лице доктора ветеринарных наук О.В.Распутиной, докторам биологических наук А.А.Даниловой (СибНИИЗХим), Т.И.Глотовой (ИЭВСи ДВ), а также коллективу отдела патофизиологии НИЦ ИКЭМ СО РАМН в лице доктора медицинских наук, профессора Д.Д.Цырендоржиева за моральную поддержку, техническую, научную, методическую помощь.
2. Материал и методы исследований
Комплекс экспериментальных и клинических исследований выполнен в 1997 – 2008 гг. на базе ГНУ СибНИПТИЖ СО Россельхозакадемии и хозяйств Новосибирской области.
Исследования проводились в соответствии с тематическим планом выполнения НИР ГНУ СибНИПТИЖ, согласно государственным программам Россельхозакадемии: в рамках отраслевых научно-технических программ (номер государственной регистрации 018220081184) и «Программы фундаментальных и приоритетных прикладных исследований по научному обеспечению АПК Российской Федерации», подраздел 03.02.01.
Действие католита ЭХАР и ФМИ на водную среду организма изучали в экспериментальных и клинических условиях на животных разных видов: 850 мышах и 270 крысах с потомством, 13 кошках, 38 коровах, 328 телятах, 200 перепелках, 240 курах родительского стада и 600 цыплятах-бройлерах. Аспекты исследований представлены на рисунке 1.
Изучали патогенетическое действие католита ЭХАР поваренной соли в сравнении с гомеопатическими препаратами, малыми дозами лекарственных веществ, католитами ЭХАР других химических соединений, химиопрепаратами.
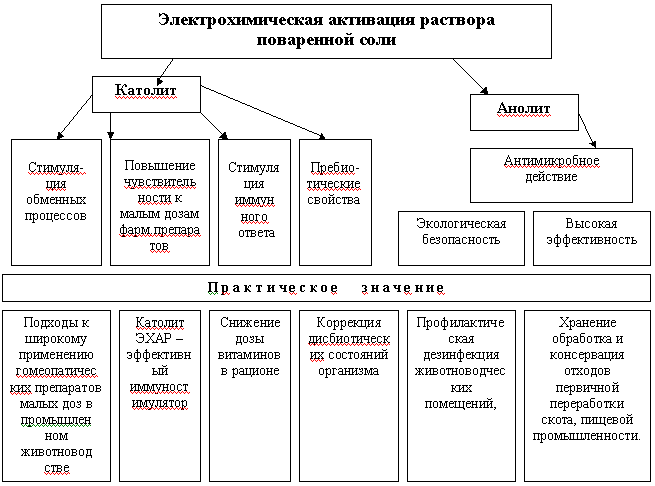
Рис.1.Основные направления исследований по теме диссертации
Патологические состояния организма лабораторных животных – хронический минеральный токсикоз – моделировали с помощью выпаивания растворов соединений свинца в разных сочетаниях и дозах.
Катодные и анодные фракции электрохимически активированных 0,1 – 0,5%-х растворов поваренной соли и других минеральных соединений – католиты и анолиты ЭХАР – готовили в активаторе конструкции ОпКТБ СибНИПТИЖ СО Россельхозакадемии, рис. 2.
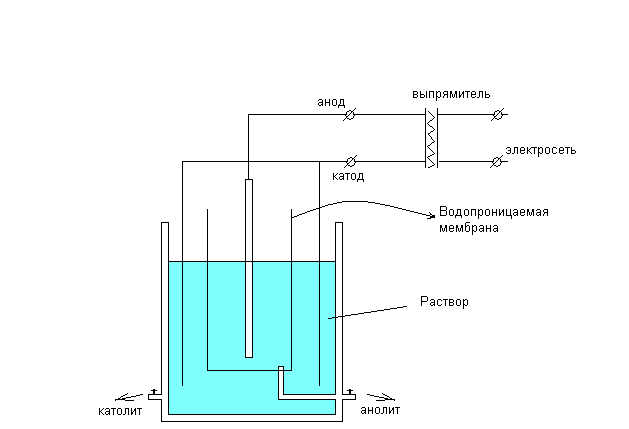
Рис. 2. Принципиальная схема активатора для получения ЭХАР
Концентрацию активного хлора в анолите ЭХАР определяли титриметрически, избыток катионов натрия в католите пробит-анализом.
Изучение гомеостатического, адаптогенного, антитоксического действия католита ЭХАР поваренной соли в сравнении с действием католитов других солей и ФМИ проводили на мышах, крысах и их потомстве. У животных вызывали состояние хронической интоксикации соединениями свинца до и во время беременности, воздействовали на них католитами ЭХАР поваренной соли и других солей, малыми дозами биологически активных препаратов, гомеопатическими препаратами. Определяли сравнительный уровень эмбриотоксического и тератогенного действия на эмбрионы, рост эмбрионального скелета по Dawson (1926) в модификации А.П. Дыбан (1970), темпы постнатального роста молодняка в длину, прирост массы, показатели развития – по срокам отлипания ушей, опушения, прозрения, уровень смертности к 21-му дню внеутробной жизни – срока, после которого организм может жить самостоятельно.
Показатели состояния нервно-мышечного аппарата определяли по изменениям мышечной силы (Саноцкий И.В., Фоменко В.Н., 1979).
Для гистологических исследований срезы органов животных окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизон, толуидиновым синим, метиловым зеленым – пиронином (Браше). Определяли процент больших, средних, малых лимфоцитов, плазмобластов, плазмоцитов, макрофагов, нейтрофилов, эозинофилов, лаброцитов в Т- и В-зависимых зонах лимфоузлов и селезенки. С помощью окулярной сетки Г.Г. Автандилова (1990) определяли площадь Т- и В-зависимых зон.
Уровень неспецифической резистентности определяли по П.Н. Никонорову (1979) и П.Н. Смирнову (2003), лизосомально-катионный тест (ЛКТ) по В.И. Жибинову (1983). Особое внимание уделяли тестам фагоцитарной активности (ФА) нейтрофилов и ее производным – фагоцитарному числу, индексу. Из гуморальных факторов определяли комплементарную активность сыворотки крови, уровень нормальных антител. Степень напряженности фагоцитарной функции в нативных мазках-отпечатках из слизистых оболочек органов определяли по индексу лейкофагии макрофагов, которая равняется количеству лейкофагирующих макрофагов на сто клеток по Л.А. Матвеевой (1986). Процессы перекисного окисления липидов (ПОЛ) в сыворотках крови животных изучали в отделе патологической физиологии НИЦ ИКЭМ СО РАМН. Содержание вторичных стабильных продуктов ПОЛ оценивали по малоновому диальдегиду (МДА) спектрофотометрическим методом Y. Yagi et al. (1976). Уровень антиоксидантной защиты организма – по содержанию альфа-токоферола (АТ) хроматографическим методом по S.D.Cuesta, C.M.Castro, 1986.
Статистическую обработку экспериментального материала проводили с помощью пакета прикладных программ Statistica-6.
3. Результаты исследований
3.1.Регуляция обменных процессов в организме животных при избытке катионов натрия
3.1.1. Роль и место катионов и анионов соединений макроэлементов в электролитном гомеостазе организма животных
В настоящее время идут споры о фактическом существовании ассоцитатов молекул воды, гидратации молекул электролитов, структурировании молекул воды, квантовом, кристаллическом ее строении, «памяти воды». Спектр мнений по проблеме – от полного отрицания ее (Волькенштейн М.В., 1988; Подколзин А.А., Гуревич К.Г., 2002 и др.) до
физического обоснования (Антонченко В.Я. и др., 1991; Слесарев В.И., 2001; Фролов Б.А., 2004; Резников А.А., Шапошник В.А., 2007 и др.). На практике показана адаптивная роль электрохимически активированных растворов электролитов. При этом остается не совсем ясной роль различных катионов и анионов в регуляции обменных процессов в организме.
Задачей раздела явилось – сравнение адаптогенного действия галогенных и негалогенных соединений натрия, калия, кальция как регуляторов гомеостаза водной среды организма животных.
Установлено, что действующим началом католита ЭХАР является избыток катионов натрия, поддерживающий электролитный гомеостаз.
В опытах использовали мышей (по 10 голов в группе), которым за 10 дней до случки выпаивали в качестве питьевой воды раствор нитрата свинца в концентрации до 2 мг/л. Католит сульфата натрия достоверного антитоксического действия на потомство мышей не проявил. Католит бромида натрия, очевидно, в сочетании с нитратом свинца оказал выраженное токсическое действие: увеличилась масса тела плодов, что не всегда является благоприятным признаком, увеличилась гибель молодняка к 21-му дню внеутробной жизни, замедлились показатели развития. В группе с выпаиванием католита хлорида натрия показатели развития к 21-му дню жизни были существенно выше, чем в контроле и других группах (табл. 1).
Таблица 1 – Показатели действия католитов на потомство мышей
| Показатели | Контроль | Католит NaCl | Католит NaBr | Католит | |
| Na2SO4 | |||||
| Длина новорож- денных | 23,7 + 1,2 | 23,3 + 1,3 | 24,9 + 0,7 | 23,5 + 0,7 | |
| 5-й день, мм | 30,3 + 1,1 | 29,7 + 1,0 | 32,8 + 0,45* | 31,1 + 1,3 | |
| Масса новорожденых | 1,55 + 0,02 | 1,4 + 0,08* | 1,62+ 0,07 | 1,5+ 0,1 | |
| На 7-й день, г | 5,05+ 0,2 | 5,0 + 0,6 | 5,13+ 0,2* | 5,15+ 0,5 | |
| 14-й | 8,3 + 0,2 | 8,1 + 0,5 | 8,46 + 0,3* | 8,1 + 0,3 | |
| 21-й | 12,5 + 0,5 | 12,0 + 0,9 | 13,9+ 0,4* | 11,2+ 0,3 | |
| 28-й | 18,3 + 0,4 | 18,1 + 1,0 | 19,9+0,3** | 18,9+ 0,5 | |
| Отлипание ушей, дней | 4,5 + 0,6 | 4,0 + 0,5 | 5,0 + 0,5 | 4,0 + 0,3 | |
| Опушение, дни | 5,0 + 0,6 | 5,5 + 0,4 | 6,5 + 0,3* | 5,5 + 0,6 | |
| Прозрение, дни | 14,0 + 0,6 | 12,0+0,4* | 16,0 + 0,4* | 14,0 + 0,6 | |
| Смертность к 21 дню, % | 6,8 + 0,7 | 4,1+0,3** | 9,5 + 1,5** | 6,1 + 0,5 | |
* Разница с контролем достоверна при Р < 0,05 ** - P < 0,01
Следовательно, именно сочетание ионов натрия и хлора оказывало стимулирующее действие на организм молодняка, увеличивало темпы развития, снижало уровень пренатальной смертности.
Для определения роли натрия среди катионов других макроэлементов – калия и кальция – провели опыт по детоксикации организма при экспериментальном свинцовом токсикозе на потомстве четырех групп мышей (по 10 голов). Католиты ЭХАР хлоридов натрия, калия и кальция выпаивали в группах дважды в неделю в течение беременности и в неонатальный период. Первой группе (фон) дважды в неделю выпаивали дегазированную воду.
Католит ЭХАР поваренной соли оказал наиболее благоприятное действие на животных, существенно сократив гибель молодняка к 21-му дню внеутробной жизни (Гомбоев Д.Д., 2007).
Достоверных различий по другим показателям роста и развития не было отмечено. Натрий является наиболее гидрофильным из всех катионов, обладает высокими гидратирующими свойствами – структурирует большее количество молекул воды – до 400 (Фролов Б.А., 2004).
Таким образом, действующее начало католита ЭХАР – избыток катионов натрия в присутствии анионов хлора – проявило свойства фактора, поддерживающего осмотический гомеостаз среди катионов и анионов других макроэлементов.
Экспериментально установлены оптимальные параметры католита ЭХАР для сельскохозяйственных и лабораторных животных при работе с активатором конструкции ОпКТБ СибНИПТИЖ: концентрация исходного раствора NaCl – 0,2–0,5%, окислительно-восстановительный потенциал – 1100 мВ, сила тока – 300 А, рН анолита – 5, католита – 8–9. В католите оптимальный дефицит анионов хлора – 150 – 200 мг/л, разовая доза католита для выпаивания животным может составить 8–12 мл/кг живой массы, кратность выпаивания 1-2 раза в неделю, курс 2-4 недели.
3.1.2. Действие ЭХАР на рост эмбрионального скелета
Проблема снабжения организма минеральными веществами заключается не в их количестве, а в регуляции минерального обмена (Гомбоев Д.Д. и др., 2007).
Опытным группам (по 10 голов) половозрелых крыс-самок дважды в неделю выпаивали католиты ЭХАР СаС12 и NaCl, контроль – интактная группа. Через 14 дней в группы подсадили интактных самцов.
Среди показателей пренатального развития крыс наиболее стабильным было увеличение массы тела плодов и особенно в группе с выпаиванием католита ЭХАР NaCl. Выпаивание католита ЭХАР СаС12 способствовало более интенсивному увеличению длины плодов и окостенению фрагментов скелета в сравнении с католитом NaCl. Динамика постнатального развития крысят была неодинаковой по вариантам опыта. При выпаивании католита СаС12 масса тела превысила контроль с 21-го дня опыта, длина тела превышала контроль с 1-го дня, а с 21-го по 28-й дни отмечали резкое повышение показателя. В 3-й группе с католитом NaCl масса тела достоверно превышала контроль с 14-го дня. Длина тела достоверно превышала контроль, но не достигла уровня 2-й группы.. Различий в концентрации кальция в сыворотке крови крыс по вариантам опыта не было.
Темпы увеличения массы тела группы с выпаиванием хлорида кальция в сравнении с контролем были невысокими, разницу можно объяснить гидрофобными свойствами кальция, хотя шел активный рост и оссификация скелета, показатель длины здесь превысил контрольные показатели при Р < 0,01, длина крысят в группе с выпаиванием католита поваренной соли различалась с контролем при Р < 0,05.
Активированные ионы Na+ католита ЭХАР NaCl более интенсивно стимулировали прирост массы тела крысят, очевидно, благодаря гидрофильным свойствам натрия. Такое количество поваренной соли не могло задержать столько воды. Очевидно, вопрос состоит в структурировании – гидратации молекул воды (Фролов Б.П., 2004).
3.1.3. Нарушение динамического равновесия водной среды организма животных при действии католита ЭХАР
Развивающийся организм животных – чрезвычайно восприимчивая среда к действию внешних факторов, в том числе католита ЭХАР и ФМИ. Эти факторы не могут не влиять на электролитный состав водной среды организма животных, что оказывает системное влияние на защитные силы, отвечающие общими и местными реакциями. Организм, находящийся в состоянии интенсивного роста, как любая неравновесная система, более активно стремится к достижению равновесия (Анохин П.К., 1973).
С позиций гомеопатического учения, организм и его водная среда являются динамически равновесной системой, тенденции к нарушению этого равновесия нежелательны и требуют нейтрализации со стороны защитных сил (Вавилова Н.П., 1992; Липин А.В., 1997).
Эти две противоречивые позиции, на самом деле взаимодополняют друг друга, поскольку рассматриваемое равновесие является процессом роста и развития. Рост – ведущий системообразующий фактор организма молодняка животных. Функциональная система, им образованная, включает множество различных компонентов, в том числе пищеварительную, иммунную системы, опорно-двигательный аппарат, водную среду и т.п.
Для изучения влияния ЭХАР в сравнении с ФМИ на организм растущих животных (Гомбоев Д.Д., 2007) подобрали 3 группы новорожденных телят по 10 голов в каждой: 1-я группа – интактная, 2-й с 4-го по 30-й день дважды в неделю выпаивали по 150 – 200 мл католита ЭХАР, 3-й, с 4-го дня в течение 7 дней ежедневно по методике Н.И. Вавиловой (1992) выпаивали по 3,0 мл гомеопатически потенцированного спиртового раствора глауберовой соли в стомиллионном разведении 4С – 100-4 (принятое в гомеопатии обозначение).
К 23-му и 30-му дню проявилась разница в приростах живой массы телят 2-й и 3-й групп с контролем. Увеличилось количество лейкоцитов. В лейкоформуле увеличилось количество нейтрофилов и моноцитов.
Изменился электролитный состав сыворотки крови – увеличилось содержание кальция в опытных группах до 8,3 г %. Показатель резервной щелочности во 2-й группе 5,2 – 5,4 объемных процентов, достоверно выше контроля, как и содержание каротина.
При гистоисследовании подвздошной кишки достоверное действие ФМИ выявлено в соотношениях между бокаловидными и лимфоидными клетками слизистой оболочки кишечника (рис. 3). Увеличение количества бокаловидных клеток в опытных группах говорит об увеличении секреторной активности слизистой оболочки кишечника. Данный секрет обладает защитными свойствами.
Уменьшение количества лимфоцитов и увеличение количества плазмоцитов в слизистой оболочке кишечника – продуцентов иммуноглобулина А – свидетельствует об активации гуморального иммунного ответа. Резкое снижение в пределах нормы количества эозинофилов говорит о десенсибилизирующем действии применяемых растворов.
Таким образом, избыток катионов натрия, образующийся при выпаивании животным католита ЭХАР, нарушает динамическое равновесие
водной среды, стабилизируя минеральный и другие обменные
процессы в организме, активизирует секреторную деятельность клеток
Рис. 3. Относительный клеточный состав слизистых оболочек подвздошной кишки животных опытных групп (контроль принят за 100%):
1-бокаловидные клетки, 2- лимфоциты, 3- плазматические клетки, 4- эозинофилы
слизистой оболочки кишечника, происходят изменения ее клеточного состава. Последнее обстоятельство подводит к рассмотрению вопроса о действии католита ЭХАР на иммунный гомеостаз организма животных.
3.2. Действие католита ЭХАР на иммунный гомеостаз
3.2.1. Иммуномодулирующее действие католита ЭХАР на специфический гуморальный иммунный ответ
Специфический гуморальный иммунный ответ организма животных является показателем благополучия стада и нормального течения обменных процессов. Католит ЭХАР, среди адаптогенных воздействий на организм, относящихся к гомеостатической регуляции, проявляет также свойства модулятора гуморального иммунного ответа (Гомбоев Д.Д. и др, 2008).
Для опыта 18 глубокостельных коров разделили на три группы. Контрольную группу за 2 месяца до отела иммунизировали формолквасцовой вакциной против сальмонеллеза телят; 2-й группе – вместе с вакциной ввели 10,0 мл 20%-го раствора тиосульфата натрия (Чекишев В.М., Теш А.И., 1988); 3-й группе с вакциной вводили 10,0 мл католита ЭХАР. Телят разделили на те же группы, и после 20-го дня жизни иммунизировали этой же вакциной с этими же препаратами (табл. 2).
По уровню титров антител у телят, различий в начале наблюдения не отмечали. К 14-му дню уровень антител во всех группах снизился, что связали с элиминацией коллостральных антител и недостаточным уровнем гуморального иммунного ответа в этом возрасте (Шахов А.Г. и др., 2006).
Таблица 2 – Динамика изменения титров антител по вариантам опыта
| Дни | 1-я контроль, вакцина | 2-я, вакцина + католит ЭХАР | 3-я, вакцина + тиосульфат Na |
| 3 – 4 | 13,3 + 1,7 | 14,6 + 1,3 | 14,6 + 1,3 |
| 14 | 6 + 0,9 | 6,67 + 0,8 | 7,3 + 1,9 |
| 28 | 16 + 3,4 | 22,6 + 5,2 | 20 + 6,7 |
| 42 | 21,3 + 3,4 | 30,7 + 1,2 * | 42,6 + 6,7 * |
| 60 | 32 + 4,2 | 44,8 + 2,4 * | 48 + 5,4 * |
| 90 | 29,3 + 3,4 | 48 + 5,4 * | 51,2 + 5,2 ** |
* Разница с контролем достоверна при Р < 0,05; ** - Р < 0,01.
К 28-му дню титры антител во всех группах увеличились. С 42-го дня проявились достоверные различия между контролем и опытом, которые отмечались и к 60-му дню. К 90-му дню снизились титры антител в контроле. В опытных группах снижения титров не отмечали.
3.2.2. Действие католита ЭХАР на клеточный иммунный ответ
При изучении морфологии органов иммунитета определяли потенциал иммунного ответа по составу клеток лимфоидного ростка, мононуклеаров, гранулоцитов. Исследования показали, что при действии на клеточное звено иммунного ответа проявляются выраженные адаптогенные свойства католита ЭХАР, что является основой для снижения уровня иммунодепрессивного и сенсибилизирующего действия антибиотиков (Гомбоев Д.Д., 2007).
Для опыта 60 самцов крыс разделили на 5 групп: 1-я группа – интактный контроль, остальным в воду добавляли тетрациклина гидрохлорид (500 мг/л); 2-й группе режим выпойки не меняли в течение всего опыта; 3-й – дважды в неделю вместо антибиотика выпаивали католит ЭХАР; 4-ю поили раствором антибиотика, не добавляя католит, а на 10-й день ввели внутрибрюшинно 1 мл суточной культуры E. coli (штамм 096), содержащей 1 млрд. клеток; 5-й группе выпаивали католит на фоне введения антибиотиков и на 10 день также ввели эту же культуру. Пробы для гистологических исследований и сыворотки крови для определения уровня нормальных антител взяли на 30-й день.
Титры нормальных антител в сыворотках крови животных 1-й (контрольной), 3,4,5 опытных групп составили 1:32 (lg 1,5). Во 2-й группе он составил 1:8 (lg 0,9). Наиболее выраженные изменения состава клеток были отмечены в группах, где животным выпаивали только антибиотик. Снизилось количество плазматических клеток, что является морфологическим критерием снижения уровня гуморального иммунного ответа и подтверждено данными серологических исследований. Увеличилось количество эозинофилов, лаброцитов, снизилось количество нейтрофилов и митозов. Снижение митотической активности свидетельствует о действии тетрациклина, тормозящего процессы размножения клеток иммунной системы.
В 3-й группе выпаивание католита ЭХАР сказалось на сохранении количества плазматических клеток. Снизилось количество эозинофилов и тучных клеток, что можно отнести к десенсибилизирующим свойствам католита ЭХАР (Солошенко В.А. и др., 2004). Благодаря высокой концентрации антибиотика не изменились содержание нейтрофилов и митотическая активность. Увеличенное количество макрофагов подтверждает высокий потенциал иммунной системы (Учитель И.Я., 1978) как основы дальнейшего роста и развития организма. В 4-й группе при постоянной концентрации тетрациклина ввели чужеродный антиген – культуру кишечной палочки, на что соответствующе отреагировала иммунная система. Реакция существенно отличалась от реакции во 2-й и 3-й группах. Воспалительный процесс в брюшной полости (перитонит), развившийся при введении E. coli, вызвал соответствующую реакцию полиморфоядерных клеток, нейтрофилов и эозинофилов, контролирующих гиперчувствительность. Введение тетрациклина могло вызвать снижение количества плазматических клеток, однако чужеродный антиген, очевидно, стабилизировал их количество на уровне контроля. Угнетение митотической активности также может быть результатом действия антибиотика. В 5-й группе взаимодействие между высокой концентрацией тетрациклина и введением кишечной палочки стабилизировалось католитом ЭХАР, выраженных изменений состава клеток не выявлено. Количество клеток не отличалось от контроля. Снизилось количество эозинофилов, увеличилось количество макрофагов (табл.3).
Таблица 3 – Клеточный состав лимфоузлов крыс опытных групп
| Клетки мякотных тяжей лимфоузлов | Опытные группы | |||
| 1-я фон | 2-я контроль с тетрациклином | 4-я тетрациклин+ Е.coli | 5-я тетрацикл. + католит + Е.coli | |
| Малые лимфоциты | 45,5 +2,2 | 46,7+3,5 | 41,3+3,0 | 44,1+2,7 |
| Большие лимфоциты | 9,4 +0,5 | 10,8+0,9 | 9,1+0,8 | 9,2+0,3 |
| Плазмобласты | 6,6+0,3 | 7,4+0,5 | 6,5+0,7 | 6,7+0,8 |
| Плазмоциты | 26,6+1,3 | 21,3+1,2** | 27,2+1,6 | 28,5+3,4 |
| Иммунобласты | 1,7+0,07 | 2,3+0,1* | 1,5+0,05* | 1,5+0,1 |
| Макрофаги | 4,6+0,2 | 4,3+0,2 | 5,2+0,2* | 5,8+0,67* |
| Эозинофилы | 1,3+0,05 | 2,4+0,07*** | 3,2+0,1*** | 1,2+0,02 |
| Нейтрофилы | 1,8+0,08 | 1,4+0,03*** | 3,8+0,7** | 1,6+0,08 |
| Лаброциты | 0,32+0,03 | 0,6+0,06*** | 0,5+0,06** | 0,3+0,02 |
| Митозы | 0,33+0,01 | 0,2+0,01*** | 0,2+0,01*** | |
* Разница с контролем достоверна при Р < 0,05; ** - Р < 0,01; *** - Р < 0,001.
Таким образом, адаптогенные свойства католита ЭХАР проявляются в стимулирующем действии на клеточное звено иммунного ответа и могут быть основой для предотвращения иммунодепрессивного действия антибиотиков.
3.2.3. Стимуляция иммунного ответа католитом ЭХАР после курса интенсивной антибиотикотерапии
При интенсивных курсах лечения антибиотики могут угнетающе действовать и на клетки макроорганизма (Егоров Н.С., 1986; Кашкин К.П., Караев З.О., 1984). Это проявляется иммунодепрессией, нарушением не только первичного звена иммунного ответа – фагоцитарной функции (Егоров Н.С., 1986; Кашкин К.П., Караев З.О., 1984), но и гуморального иммунного ответа (Митрофанов П.М., Гомбоев Д.Д., 1986). У телят и поросят клинически просматриваются угнетение, снижение аппетита, отставание в росте и развитии, хронические воспалительные процессы органов пищеварительной системы с периодическими обострениями. Шерсть у животных взъерошена, габитус нарушен – животные сгорблены, малоподвижны, замедлена реакция на внешние раздражители, жвачка вялая. Больных животных нелегко вывести из такого состояния. Для этого, наряду с усиленным питанием с высоким содержанием протеинового компонента в рационе, применяют иммуномодуляторы, повышенные дозы витаминных препаратов и микроэлементов, активизирующих иммунную реактивность.
Опыт провели на сорока 3-месячных телятах. Животные в 10-30-дневном возрасте, по данным районной ветлаборатории, перенесли колибактериоз. После лечения заболевание перешло в хроническую стадию – низкий прирост живой массы (до 300 г/сут), рецидивы расстройства пищеварительной функции, нарушения работы сердечно-сосудистой системы – застойные явления в системе полой вены, дистрофия печени.
Телят разделили на 4 группы по 10 голов: 1-й и 2-й группам отменили введение антибиотиков, другим группам продолжили их введение; 2-й группе дважды в неделю выпаивали католит ЭХАР в дозе 300 мл/гол; 4-й, наряду с антибиотиками, также выпаивали католит ЭХАР, табл. 4.
Таблица 4 – Показатели уровня неспецифической резистентности телят, подвергнутых антибиотикотерапии и выпаиванию католита ЭХАР
| Показатели | Опытные (2-я и 4-я) и контрольные (1-я и 3-я) группы | |||
| 1-я | 2-я | 3-я | 4-я | |
| Эозинофилы, % | 4,5 + 0,2 | 2,5 +0,3** | 4,6 + 0,3 | 4,2 + 0,2 |
| Палочкоядерные, % | 4,5 + 0,7 | 2,9 + 0,3* | 3,6 + 0,5 | 3,9 + 0,3 |
| Моноциты, % | 6,2 + 0,3 | 8,3 +0,5** | 7,0 + 0,2 | 8,1 + 0,3* |
| Щелочной резерв, об.% | 45,2 +1,3 | 52,2 +2,2* | 46,3 + 1,5 | 53,2+2,1* |
| Кальций, мг% | 7,2 + 0,3 | 8,5 + 0,3* | 7,6 + 0,5 | 8,0 + 0,3 |
| Коэффициент ЛКТ | 2,3 +0,08 | 2,6 +0,06* | 2,1+ 0,07 | 2,3 + 0,07 |
| Фагоцитарная активность нейтрофилов, % | 26,5+0,6 | 29,1+0,73* | 25,8 + 0,6 | 27,2 + 0,8 |
| Комплемент, мл | 0,1+0,02 | 0,15+0,01* | 0,1 + 0,02 | 0,1 + 0,02 |
* Разница с контролем достоверна при Р < 0,05; ** - P < 0,01.
Состояние животных во 2-й и 4-й группах стабилизировалось на 7 – 10-й дни с начала опыта. Через месяц приросты в этих группах достоверно (Р 0,01) увеличились. По неспецифической резистентности показатели 2-й и 4-й групп достоверно различались с показателями 1-й и 3-й групп.
Выпаивание католита в 4-й группе без отмены антибиотиков не способствовало усилению лейкоцитарной реакции, что соответствует данным (Израйлет Л.И., 1976; Nolting S.F., Kowalewska F., Ludwig G., 1975; Davies J., 1979) о том, что продолжительное хроническое введение антибиотиков, угнетает иммунную реактивность. Заметно увеличение моноцитов при Р < 0,01 во 2-й группе – с отмененной антибиотикотерапией и с меньшей степенью достоверности в 4-й группе, где антибиотики не отменяли.
Интерес в лейкоцитарных формулах представляют: а) высокая степень достоверности уменьшения эозинофильной реакции во 2-й группе, что может говорить о десенсибилизирующем действии католита ЭХАР в отношении остаточных количеств антибиотиков; и б) тенденция к снижению эозинофилии в 4-й группе.
Увеличение активности клеток белой крови телят подтверждается увеличением показателей коэффициента лизосомально-катионного теста (ЛКТ) и фагоцитарной активности (ФА) нейтрофилов (Гомбоев Д.Д., 2007).
Католит ЭХАР оказал стабилизирующее действие на буферные системы, что проявилось увеличением щелочного резерва. Избыток ионов натрия подействовал на увеличение концентрации кальция во 2-й группе, что связано с активизацией работы натрий-калий-кальциевого насоса (Герасев А.Д., 2003). Отмена антибиотиков и действие католита во 2-й группе способствовали достоверному увеличению концентрации комплемента.
3.2.4. Противовоспалительное действие католита ЭХАР
Воспалительный процесс, как адаптационная реакция организма на действие повреждающих факторов, – чрезвычайно разносторонее явление; наряду с местными тканевыми реакциями вовлекает в процесс иммунную и другие защитные системы. Действие фармакологических препаратов не должно быть направлено против воспаления. Оно должно оказывать регуляторное действие на воспаление, умеренно действуя на его причину (Давыдовский И.В., 1962), стимулируя формирование соответствующих функциональных систем (Анохин П.К., 1973; Судаков К.В., 1987).
Мы проанализировали действие католита ЭХАР в сравнении с гомеопатическими препаратами при экспериментально индуцированном воспалительном процессе. В опыт взяли 5 групп самцов мышей, по 10 голов. Интактным контролем служила 1-я группа, которую не подвергали воздействиям. Остальным 40 животным внутрибрюшинно ввели по 1 млрд клеток суточной бульонной культуры E. coli (штамм АТСС 25922); 2-я группа – контроль сравнения; 3-й выпаивали в качестве питьевой воды католит ЭХАР (на 3-й и 5-й дни недели); 4-й со дня заражения до конца опыта, подкожно ежедневно вводили по 0,05 мл гомеопатического препарата энгистола; 5-й ежедневно вводили в дневную норму воды 0,2 г цефалоспорина.
На следующий день после введения культуры E. сoli в опытных группах начался падеж. К 5-му дню в 1-й группе осталось 9 живых мышей, во 2-й – 3, в остальных – по 8. К 10-му дню (концу опыта) в 1-й группе осталось 9 мышей, во 2-й – 2, в 4-й – 7, в 3-й и 5-й – по 6.
При микроскопии мазков, фибринозно-слипчивый перитонит наиболее выражен во 2-й группе: фибрин, полиморфоядерные клетки, некоторое количество слущенных мезотелиоцитов и лимфоцитов. В перитонеальном экссудате 3, 4, 5-й групп преобладали лимфоциты.
В Т-зоне селезенки – периартериальной области фолликулов 2-й группы наблюдалась выраженная нейтрофильная реакция при Р < 0,01, отличавшаяся от интактного контроля. Большое количество тучных клеток, митозов. Состав клеток 3-й группы, не отличался от интактного контроля – плазмоцитарная и макрофагальная реакция, как и в 4-й группе. В 5-й группе, которой вводили цефалоспорин, снижена нейтрофильная реакция, митотическая активность, при одновременном увеличении количества лаброцитов.
В 3-й и 4-й группах изменений состава клеток не было, выражена макрофагальная и митотическая активность. В 5-й группе снизилось количество нейтрофилов, митозов, увеличено количество лаброцитов.
Реакция пульпарных тяжей селезенки мышей 2-й контрольной группы (В-зона) также характеризовалась нейтрофилией. Увеличено количество лаброцитов, снижена макрофагальная и плазмоцитарная активность (табл. 5).
Таблица 5 – Клеточная реакция пульпарных тяжей селезенки
| Клетки | Контрольные группы | Опытные группы | |||
| 1-я интактная | 2-я контроль | 3-я католит | 4-я гомеопатия | 5-я антибиотик | |
| Малые лимфоциты | 38,2 + 3,7 | 38,7 + 2,5 | 38,6 + 6,7 | 39,5 + 5,1 | 39,7 + 4,0 |
| Средние лимфоциты | 9,9 + 1,5 | 9,9 + 2,7 | 11,7 + 2,1 | 10,2 + 1,3 | 10,8 + 1,1 |
| Иммунобласты | 3,7 + 0,5 | 3,3 + 0,1 | 3,1 + 0,05 | 2,5 + 0,05 | 4,5 + 0,05 |
| Плазмоциты | 22,9 + 1,8 | 18,1 + 1,2 * | 22,4 + 3,1 | 22,1 + 3,5 | 20,6 + 3,2 |
| Макрофаги | 3,2 + 0,6 | 1,1+0,1** | 4,9 + 0,3* | 4,9 + 0,3* | 1,8 + 0,5 |
| Ретикулярные | 16,7 + 0,4 | 17,3 + 1,1 | 13,5 + 1,2 | 16,1 + 2,1 | 18,1 + 1,6 |
| Нейтрофилы | 3,9 + 0,2 | 9,8+1*** | 4,3+0,3 | 3,4 + 0,3 | 1,9 + 0,5** |
| Лаброциты | 1,4 + 0,1 | 2,0 + 0,2* | - | - | 2,2 + 0,2** |
| Митозы | 0,5 + 0,1 | 0,7 + 0,1 | 0,9 + 0,1 * | 0,9 + 0,1* | 0,1 + 0,1* |
* Разница с интактным контролем достоверна при Р < 0,05;**- Р < 0,01;***- Р < 0,001.
Приведенные данные отражают значимость нейтрофильной реакции иммунной системы при бактериальном инфицировании, ярко проявившейся во 2-й контрольной группе, где животные не были защищены. В опытных 3-й и 4-й группах, где протективными средствами послужили католит ЭХАР и гомеопатические препараты, нейтрофильная реакция менее выражена. В 5-й группе антибиотик оказал угнетающее действие на нейтрофилы. Другой физиологически значимой реакцией явилось появление лаброцитов в Т- и В-зонах селезенки, в группе сравнения и в 5-й группе, которой вводили антибиотики. В 3-й и 4-й группах католит ЭХАР и энгистол оказали десенсибилизирующее действие – тучных клеток не было выявлено. В обеих зонах животных этих групп увеличено количество макрофагов.
Таким образом, гомеопатические средства и католит ЭХАР стабилизируют гомеостаз (Гомбоев Д.Д. и др., 2008). Действуя на водную среду организма животных, они снижали остроту протекания воспалительного процесса, оказывали десенсибилизирующее действие, стимулировали активность клеток мононуклеарно-фагоцитирующей системы, являющейся основой полноценного иммунного ответа.
3.2.5. Антиоксидантные свойства католита ЭХАР
В основе альтеративно-дистрофических процессов лежат нарушения обмена веществ и физико-химических свойств поврежденной ткани. Накопление продуктов распада и увеличение концентрации ионов (особенно ионов К+) резко повышают осмотическое давление в воспалительном очаге, вызывают приток жидкости, припухание. Развиваются процессы перекисного окисления липидов (ПОЛ), инициируемые кроме повреждений низким содержанием витаминов и микроэлементов в кормах, несбалансированными рационами, экотоксикантами и др. Их признаки не ясно выражены: вялость, расстройства пищеварительной функции, анемия, лейкопения, снижение воспроизводительной способности, интенсивности роста и продуктивности (Журавлев А.И., 1982), что не всегда привлекает внимание вет.службы. Животные остаются в этом состоянии длительное время, дегенеративные процессы усугубляются, увеличивая хронические потери.
Для опыта в хозяйствах Новосибирской области отобрали 30 телят месячного возраста с различным уровнем нарушения функции органов пищеварительного тракта. В сыворотках крови телят выявлено высокое содержание продуктов ПОЛ – малонового диальдегида (МДА) до 2,4 мкмоль/мл. Телятам выпаивали католит 0,5%-го раствора поваренной соли по 2 мл/кг живой массы. По показателям ПОЛ и антиперекисной защиты в начале нарушений, в разгаре и в конечной стадии после лечения существенных изменений не выявили. После лечения достоверно увеличился уровень антиперекисной защиты. Уровень МДА у больных телят достоверно снизился при введении католита ЭХАР с 2,4 до 2 мкмоль при Р < 0,05, одновременно с увеличением уровня антиперекисной защиты – альфа-токоферола на 5 – 7 %.
К концу опыта увеличился при Р < 0,01 уровень комплементарной активности (КА) сыворотки крови. У здоровых телят изменений лизосомально-катионного теста (ЛКТ), фагоцитарной активности (ФА) и КА не отмечали.
По мере развития заболеваний органов пищеварения концентрация МДА (малоновый диальдегид) увеличивалась в выраженную стадию болезни, при выпаивании католита ЭХАР показатель постепенно снижался (Гомбоев Д.Д. и др., 2005, 2006). К концу периода наблюдения показатели ЛКТ и ФА не претерпели изменений, комплементарная активность стабилизировалась.
При моделировании процессов ПОЛ на мышах с помощью имитации транспортного, низкотемпературного стресса, безвитаминного рациона и др., наиболее выраженные стабильные призники ПОЛ проявились при облучении животных ультрафиолетовыми лучами: облучение мышей бактерицидной лампой на расстоянии 40 см от клетки 8 – 9 ч в сутки. В течение 7 – 8 суток, развились клинически выраженные процессы ПОЛ, увеличивался уровень малонового диальдегида на 10%. Эти признаки снимались при выпаивании животным католита ЭХАР и при скармливании витамина Е с премиксом.
3.2.6. Повышение чувствительности животных к действию ФМИ
Фундаментальным принципом классической токсикологии и фармакологии является зависимость «доза – эффект». В конце ХХ в. ряд исследователей описали явления, противоречащие ей: действие малых доз биологически активных веществ (Ашмарин И.П. и др., 1996; Бурлакова Е.Б. и др., 1986, 1990; Зайцев С.В., 1990; Сазанов Л.А., Зайцев С.В., 1992). Эти эффекты наблюдали при дозах и концентрациях порядка 10-3 – 10-17 М и ниже. Гомеопатическое направление медицины отличается от этих эффектов, во-первых, физическими характеристиками гомеопатических препаратов, которые меняются при гомеопатическом потенцировании (Блюменфельд Л.А., 1994). Во-вторых, эффекты МД и СМД и по современным представлениям неотделимы от классической фармакологии.
Действие электрохимически активированных ионов натрия – одного из основных электролитов организма – повышает чувствительность организма к МД фармакологических препаратов, подтверждая их специфичность.
В клинических опытах на кошках с уретральным синдромом и с кератоконъюнктивитом, в контрольных группах использовали терапевтические дозы гипотиазида и тетрациклина. В опытных группах – использовали малые дозы этих препаратов – 10-3 от терапевтических доз и одновременно выпаивали по 6,0 мл католита ЭХАР (Гомбоев Д.Д., 2008).
Для уточнения результатов, полученных в клинической серии опытов, провели экспериментальную серию на 4 группах мышей, по 10 голов. Всем животным внутрибрюшинно ввели по 1 мл суточной бульонной культуры E. coli, штамм АТСС 25922. 1-я группа – контроль; 2-й внутрижелудочно выпаивали 0,5 мл католита ЭХАР; 3-й вводили ежедневно внутрижелудочно по 0,005 мг энрофлона; 4-й ежедневно внутрижелудочно выпаивали по 0,000005 мг энрофлона (10-3 терапевтической дозы) и католит 0,5 мл.
Признаки заболевания в первом клиническом опыте прекратились на 4 – 7-й дни. В контроле салуретическое действие гипотиазида изменило реабсорбцию солей в канальцах и облегчило их выведение с мочой, открылось свободное мочеиспускание. Малые дозы гипотиазида в опытной группе сыграли направляющую роль на фоне незначительного нарушения электролитного состава тканей католитом ЭХАР, активизации регуляторных механизмов, восстановивших гомеостаз.
Во втором клиническом опыте на 5-6-й дни состояние стабилизировалось. МД антибиотика в опыте не могли оказать антимикробного действия, соразмерного действию терапевтической дозы в контроле. Католит ЭХАР, изменяя электролитный состав тканей, нарушил обычное течение воспалительной реакции, что стимулировало работу регуляторных механизмов, снявших комплекс признаков конъюнктивита.
В экспериментальной серии на следующий день после введения культуры кишечной палочки начался падеж. На вскрытии выявляли перитонит. К 6-му дню падежа не было, состояние животных удовлетворительное. Из перитонеального экссудата животных 1, 2, 4-й групп реизолировали кишечную палочку. Антимикробный эффект лечебных доз энрофлона в 3-й группе был вполне ожидаем. В 4-й группе лечебный эффект отнесли к стимулирующему действию католита. В большей мере здесь сыграла роль его гомеостатическая составляющая, что подтверждено реизоляцией кишечной палочки (Гомбоев Д.Д., 2008).
Эффект действия католита ЭХАР, таким образом, заключается в изменении электролитного состава тканей, нарушении динамического равновесия функциональных систем, неустойчивого в период заболеваний и в образовании на этой основе дополнительных стимулов к усилению приспособительных – регуляторных реакций.
Электрохимически активированные ионы натрия – основного электролита организма, регулируют нарушенный гомеостаз, изменяя течение патологических процессов, стимулируя приспособительные реакции. МД химиопрепаратов играют направляющую роль в этих процессах.
3.3. Действие ЭХАР на систему «микроорганизм - хозяин»
3.3.1. Регуляция витаминного гомеостаза католитом ЭХАР
Одной из причин нарушений обменных процессов в организме животных является витаминный дисбаланс. Между витаминным и минеральным обменом, по данным разных авторов (Подлетская Н.Н., Караченкова Е.А., 1978; Авцын А.П. и др., 1991 и др.), существует определенная зависимость.
На основе данных, свидетельствующих о том, что католит является фактором регуляции обмена веществ в организме животных, предположили компенсаторное его действие при гиповитаминозе. Поэтому одним из этапов исследований был поиск способа регуляции витаминного питания животных ионизированными растворами минеральных веществ.
В опыте задействовали две группы перепелок, по 100 голов в каждой. В 1-й группе – общий рацион; 2-й группе сократили дачу синтетических витаминов групп А, D3, E, B на 35%. Дважды в неделю здесь выпаивали катодную фракцию 0,5%-го раствора поваренной соли.
Прибавка живой массы перепелят в группах достоверно не различалась до начала яйценоскости – 60-го дня жизни. К этому дню в группах живая масса птицы составила 180 – 190 г. В первые декады периода яйценоскости яичная продуктивность в группах сравнялась и постепенно повышалась до 15-й декады – пика яйценоскости, где составила 83,3% (рис.4).
Рис. 4. Динамика яйценоскости перепелок опытной и контрольной групп
Примечание. Отрезком обозначен доверительный интервал при Р 095, n=100
По содержанию витаминов в сыворотке крови, минеральных веществ, биохимическим показателям различий между группами не выявлено.
На птицефабрике «Коченевская» опытной группе бройлеров в рационе сократили дозу всех синтетических витаминов на 35% и выпаивали католит ЭХАР в том же режиме. Динамика прибавки живой массы птицы была в течение производственного периода постоянной и достоверно не различалась по группам. Содержание витаминов и микроэлементов, показатели неспецифической резистентности в группах, также не различались.
Таким образом, регуляция витаминного гомеостаза католитом ЭХАР позволяет сократить дозу синтетических витаминов в рационе птицы на 35%, что сказывается на снижении себестоимости продукции.
3.3.2. Пребиотические свойства католита ЭХАР
Мы предположили, что одним из механизмов действия католита ЭХАР на гомеостаз организма животных может быть регуляция функциональной деятельности резидентной микрофлоры. Для изучения этого вопроса у мышей вызвали экспериментальный дисбиоз (дисбактериоз) подкожным введением антибиотика энрофлоксацина по 0,3 мг на голову (10-кратная терапевтическая доза) в течение 5 дней. Действие католита на активность микрофлоры сравнивали с действием пробиотика «Астра» производства Бердского химфармзавода, рекомендованного для применения в животноводстве. Общую обсемененность пищеварительного тракта изучали титрованием на среде «Кода». Функциональные характеристики микрофлоры изучали методом мультисубстратного тестирования (МСТ), по J.L.Garland, A.L.Mills, (1991). Использовали субстраты: дульцит, инозит, маннит, сорбит, мальтозу, лактозу, сахарозу, раффинозу, глюкозу, арабиозу, рамнозу, ксилозу, галактозу, ацетат и цитрат натрия.
После курса антибиотикотерапии мыши были угнетены, малоподвижны, аппетит, потребление воды, проявления визуальных, слуховых, осязательных рефлексов, живая масса снижены. Титр кишечной микрофлоры резко снизился, функциональная активность ее была подавлена.
Через неделю после начала выпаивания католита ЭХАР и пробиотика «Астра» в опытных группах увеличились аппетит, подвижность, усилилась реакция на внешние раздражители. Биохимическая активность кишечной микрофлоры при введении католита возрастала более существенно в сравнении с пробиотиком, рис. 5.
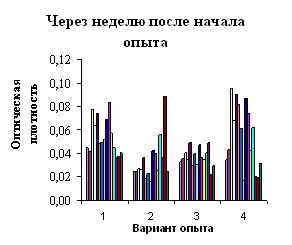
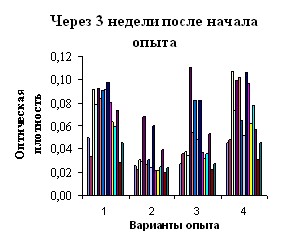
Рис.5. Функциональный портрет микрофлоры кишечника мышей по вариантам опыта: 1- интактный контроль, 2 – антибиотик, 3 – пробиотик, 4- католит
Нормализация физиологического состояния животных 2-й группы отмечалась через 3 недели после прекращения антибиотикотерапии: появился аппетит, увеличилась подвижность. При этом, как показали анализы, состояние кишечной микрофлоры оставалось практически на исходном уровне. По результатам кластерного анализа степень сходства функционального портрета микрофлоры была наибольшей между интактным контролем и вариантом, где применяли католит.
В динамике изменений лейкоформулы животных в первую неделю после введения антибиотиков проявилось резкое снижение количества всех типов клеток, особенно нейтрофилов и лимофоцитов. В течение срока наблюдения просматривалось постепенное стабильное увеличение количества клеток в 3-й и 4-й группах. Восстановление лейкоформулы во второй группе существенно отставало от опытных групп.
Сходные результаты получены в опытах на телятах.
Подобное влияние на микрофлору оказывают фармакологические препараты, относящиеся к пребиотикам. Действие католита ЭХАР можно объяснить нарушением осмотической составляющей водной среды, избытком активированных ионов натрия, с одновременным стремлением ее к восстановлению равновесия, возрастанием ферментативной активности кишечного тракта и микрофлоры (Вотановская Н.А., 2002).
Таким образом, установлено пребиотическое действие католита ЭХАР при экспериментальном дисбиозе животных, способствующее восстановлению структурно-функциональных параметров кишечной микрофлоры. Подобные результаты получены при спонтанном дисбактериозе на телятах.
3.3.3. Антимикробные и токсические свойства анолита ЭХАР
В литературе имеются некоторые сведения об использовании ЭХАР 0,9%-го раствора поваренной соли в качестве антимикробного средства в медицине, перерабатывающей промышленности (Бахир В.М. и др., 1988; Кирпичников П.А. и др., 1993; Пасько О.А. и др., 2000 и др.). Мы провели количественную оценку дезинфицирующей активности анолита. В качестве тест-объектов использовали музейные культуры кишечной палочки (Escherihia coli, штамм АТСС 25922), золотистого стафилококка(Staphylococcus aureus, штамм 6646), синегнойной палочки (Pseudomonas aeroginosa, штамм В 6643).
Установлено, что по дезинфицирующей активности анолит с 5,8 %-й концентрацией активного хлора (350 мг/л) не уступал соответствующим показателям обычных средств – каустической соды и гипохлорита кальция.
Суточная бульонная культура кишечной палочки полностью инактивировалась анолитом с концентрацией активного хлора 350 мг/л при 15-минутной экспозиции на стекле и металле, на пористых строительных материалах – при 30-минутной Для элиминации культуры золотистого стафилококка требовалась экспозиция не менее 60 мин; синегнойной палочки – 15 (стекло и металл) и 60 мин (бетон и кирпич).
На следующем этапе исследований определили возможный уровень токсичности препарата для животных при обработке помещений в их присутствии. При воздействии на мышей активного хлора анолита в вышеуказанной концентрации после 2-часовой экспозиции погибли 7 мышей из десяти. На вскрытии выявили цианоз, воспаление слизистой оболочки верхних дыхательных путей, отек легких. Средняя летальная концентрация активного хлора в воздухе равнялась 0,3 мг/л. Расчетная концентрация активного хлора в родильно-профилакторном блоке не превысила 300 мл анолита на 1 м3 объема помещения или 120 мг/м3 активного хлора (0,12 мг/л).
При клиническом осмотре телят после дезинфекции помещения отмечена повышенная секреция слизистой оболочки носовой полости. Эти явления быстро стабилизировались. По показателям уровня резистентности, у телят до и после дезинфекции не выявлено разницы с контролем.
Остаточную токсичность поверхностей после обработки оценивали с использованием в качестве тест-объекта парамеций. В лабораторных условиях на образцах металла и стекла, на местах высыхающих капель анолита ЭХАР тест-объекты замедляли активность в пределах 30 мин после дезинфекции. На образцах дерева, кирпича и бетона инфузории погибали в течение 2 ч после дезинфекции, через 3 ч активность их снижалась, но они не погибали. В производственных условиях в каплях на стекле, дверце клетки простейшие перестали погибать через 60 мин после дезинфекции. После проветривания помещения активность парамеций перестала замедляться. Следовательно, специальных мер для дезактивации после дезинфекции не требуется, достаточно простого проветривания.
Таким образом, результаты исследования позволяют заключить, что анолит ЭХАР поваренной соли может применяться в качестве эффективного и экологически безопасного дезинфицирующего средства.
3.3.4. Исследование возможности использования анолита ЭХАР, в качестве консерванта сырья животного происхождения, для приготовления кормовых добавок
Из яичной скорлупы готовят общепризнанные кормовые добавки. Проблема заключается в доставке и переработке сырья, содержащего остатки яичного белка быстро и интенсивно обсеменяющегося широким спектром микроорганизмов, среди которых возможны и специфические патогены, имеющиеся в исходном материале. Цель исследования заключалась в оценке возможности обеззараживания яичной скорлупы анолитом ЭХАР от возбудителей инфекционных заболеваний и сопутствующей флоры. Установлено, что общая бактериальная обсемененность яичной скорлупы в среднем может достигать 7 х 104 КОЕ/г, микрофлора в основном была представлена кишечной палочкой, стафилококк ни в одной партии сырья не был выделен. После дезинфекции проб скорлупы анолитом ЭХАР с концентрацией активного хлора 300 мг/л при экспозиции 4 ч бактериальная обсемененность не была отмечена. После экспериментального заражения скорлупы суточной культурой золотистого стафилококка (штамм 6646) для полного уничтожения культуры было достаточно дезинфекции сырья анолитом ЭХАР с концентрацией активного хлора 300 мг/л в течение 8 ч. После слива отработанного дезинфектанта запах хлора исчезал из скорлупы в течение 2 ч. Повторная обработка сырья позволяла сохранять качество его до переработки длительное время.
Таким образом, для уничтожения золотистого стафилококка - группового маркера устойчивых к дезосредствам возбудителей пастереллеза, лептоспироза, сальмонеллеза, микоплазмоза) – достаточно 8 ч экспозиции сырья в анолите ЭХАР с концентрацией активного хлора 300 мг/л; для уничтожения кишечной палочки (группового маркера слабоустойчивых к дезосредствам возбудителей инфекционных заболеваний) достаточно 4 ч.
Сходная проблема стоит и при производстве костной муки.
В серии исследований установлено, что дезинфекция анолитом дает возможность поддержания микробной обсемененности костного сырья на низком уровне в течение двух суток при температуре 25…300 С (табл. 6).
Таблица 6 – Динамика развития микроорганизмов на поверхности лопаточной кости свиней после дезинфекции анолитом ЭХАР, КОЕ/ см2
| Варианты опыта | Время после дезинфекции, ч | ||
| 6 | 24 | 48 | |
| Контроль | 7*106 | 1800*106 | 7000*106 |
| После дезинфекции | 2*103 | 1,5*106 | 10*106 |
Примечание. Исходная обсеменность сырья 1- 5*106 КОЕ/ см2.
Таким образом, дезинфекция костного сырья погружением в анолит ЭХАР с концентрацией активного хлора 300 мг/л в течение 3 ч позволяет сохранить его качество, как минимум, в течение 24 ч. Помещение сырья в анолите, в закрытой емкости из нейтрального материала (пластик), позволяет хранить его длительное время.
Консервирование анолитом плющенного зерна
Широко известны консервирующие свойства анолита ЭХАР при заготовке грубых кормов – сенажа, силоса (Солошенко В.А. и др., 1999; Рогачев В.А. и др., 2005). В этой связи предприняли попытку консервирования анолитом ЭХАР плющенного зерна. Зерно пшеницы, расплющенное на агрегате-плющилке конструкции ОпКТБ СибНИПТИЖ, залили анолитом ЭХАР с концентрацией активного хлора 7%, из расчета 1 л/10 кг зерна и закрыли полиэтиленовой пленкой. В течение периода, необходимого для консервации грубых кормов (28 дней), в опытном образце развилось большое количество колоний микроскопических грибов и другой микрофлоры. Данная партия корма была признана непригодной для скармливания животным. В отличие от зеленой кормовой массы, предназначенной для заготовки силосованных кормов, в плющенном зерне содержится меньшее количество воды. Поэтому добиться анаэробных условий в массе плющенного зерна намного труднее, чем в силосе. Анолит ЭХАР – в химическом отношении нестабильное образование, быстро инактивировался, превратившись в воду. Эти условия оказались благоприятными для интенсивного роста сопутствующей аэробной микрофлоры. Химически стабильные консерванты, в отличие от анолита, оказывают постоянное негативное действие на микрофлору, что является основным фактором созревания плющенного зерна.
ЗАКЛЮЧЕНИЕ
Среди всех групп ФМИ – физических, химических и других видов воздействий, в животноводстве, ветеринарной медицине в настоящее время, в большей мере используют гомеопатические средства. Однако их применение ограничивается – индивидуальным подходом к лечению. Ветеринарная медицина в крупных промышленных животноводческих предприятиях не имеет экономических возможностей к такому подходу.
Представленная работа раскрывает физиологическую сторону процессов, происходящих в водной среде организма животных, физиологическую значимость поваренной соли, макроэлемента натрия, значимость избытка катионов натрия, в водной среде организма. Рассматриваются вопросы значения нарушений и восстановления динамического равновесия функциональной системы водной среды организма животных, активизации обмена веществ, роста и развития животных в ходе этих процессов.
Показано также антиоксидантное и десенсибилизирующее действие катионов натрия в сравнении с другими катионами и факторами малой интенсивности, иммуномодулирующие их свойства, действие на иммунный ответ, а также стимулирующее действие при антропогенных иммунодепрессивных состояниях.
Католит ЭХАР, проявляет свойства регулятора состояния внутренней среды организма, оказывает наиболее общее, стабилизирующее действие на гомеостаз в отличие от гомеопатических средств, оказывающих специфическое действие. Катионы натрия, кроме того, оказывают противовоспалительное и адаптогенное действие на систему «микроорганизм – хозяин», проявляют выраженные пребиотические свойства в отношении микрофлоры организма.
Еще одной как практической, так и теоретической стороной этой работы является выявление свойства активированных катионов натрия как стимулятора чувствительности организма животных к малым дозам лекарственных веществ и гомеопатических средств.
Это свойство в большей мере отражает физиологическое значение катионов натрия в функциональной системе водной среды организма, обосновывает и подтверждает достоверность патогенетического действия гомеопатических средств. В практическом отношении оно может указать один из путей для широкого внедрения малых доз лекарственных средств и гомеопатических препаратов в ветеринарную медицину производственного направления.
ВЫВОДЫ
- Действующим началом католита ЭХАР является избыток катионов натрия, поддерживающий осмотический гомеостаз. Наиболее оптимальная концентрация исходного раствора для получения католита хлорида натрия находится в пределах 0,2-0,5%. Окислительно-восстановительный потенциал католита - 1100 мВ, рН анодной фракции 5,0-6,0; катодной 9-10. Доза и курс введения католита с этими характеристиками равны 8-12 мл на 1 кг живой массы животных, 1-2 раза в неделю, в течение 3-4 недель.
- Католит ЭХАР является неспецифическим активатором защитных реакций организма, он нарушает динамическое равновесие и дает дополнительный стимул к росту и развитию, он оказывает системное действие на организм животных, выражающееся в изменении электролитного состава сыворотки крови, увеличении резервной щелочности до 51,2+1,6 – 54+1,8 объемных процентов, кальция до 8,2+0,3 – 8,3+0,4 г %, изменении клеточного состава слизистых оболочек пищеварительного тракта, активизации защитных сил, усилении на этом фоне тенденций роста и развития системы.
- Католит ЭХАР проявляет свойства модулятора иммунного ответа, способствует дифференциации клеток лимфоидного ростка, дальнейшей их интенсивной дифференциации в плазмоциты, резкому снижению количества эозинофилов до 40% и лаброцитов на 30%, что говорит о десенсибилизирующем действии. Способствует увеличению количества макрофагов – основы иммунитета, в органах иммунной системы животных, подвергнутых антигенному воздействию, на 10-15%, снижает остроту протекания воспалительного процесса.
- Влияние гомеопатических препаратов и католита ЭХАР поваренной соли, а также терапевтических доз антибиотиков на водную среду организма животных сопоставимо по противовоспалительному действию, но механизм этого действия у антибиотиков в корне отличается от испытуемых препаратов. Католит ЭХАР и энгистол активизируют макрофагальную активность на 50% в сравнении с контролем, антибиотик угнетает ее на 20%. Все препараты на 20 – 30% снижают нейтрофильную реакцию, в то же время введение антибиотика увеличивает количество тучных клеток на 60%.
- Католит ЭХАР обладает выраженной антиоксидантной активностью. Уровень малонового диальдегида у больных телят достоверно снижается при введении католита ЭХАР с 2,4 до 2 мкмоль при Р < 0,05, одновременно с увеличением уровня антиперекисной защиты – альфа-токоферола на 5 – 7 %. При облучении мышей бактерицидной лампой на расстоянии 40 см от клетки 8 – 9 ч в сутки, в течение 7 – 8 суток, развиваются клинически выраженные процессы ПОЛ, увеличивается уровень малонового диальдегида на 10%.
- Действие электрохимически активированных ионов натрия – одного из основных электролитов организма – направлено на восстановление нарушенного гомеостаза и на повышение чувствительности организма к малым дозам фармакологических препаратов, подтверждая специфичность этих препаратов, а также является примером нарушения закона действующих масс.
- Католит ЭХАР хлористого натрия оказывает адаптогенное действие на организм перепелок и цыплят-бройлеров при снижении дозы витаминов (А,D,E,B) в рационе на 35%. При выпаивании его птице в качестве питьевой воды дважды в неделю среднесуточные показатели роста и яйценоскости не снижаются.
- Католит ЭХАР обладает пребиотическими свойствами, эффективность которых сопоставима с действием пробиотических препаратов. При экспериментальном дисбиозе, вызванном длительным введением высоких доз антибиотика энрофлоксацина (в 10 раз выше терапевтических доз), католит ЭХАР способствует более быстрой нормализации физиологического состояния и восстановлению численности, функциональной активности микрофлоры кишечника животных в сравнении с пробиотиками «Астра» и «Биовестин-Лакто». При спонтанном дисбиозе телят (снижение титра кишечной микрофлоры на 2-3 порядка) после интенсивного курса антибиотикотерапии, выпаивание католита ЭХАР в течение трех недель способствует увеличению титра микрофлоры и нормализации ее состава.
- Анодная фракция ЭХАР (анолит) является экологически чистым консервантом, по эффективности не уступающим химическим дезосредствам. Средняя летальная концентрация активного хлора анолита для млекопитающих в воздухе равна 0,3 мг/л. При профилактической дезинфекции помещений для животных 1 л анолита на 1 м2 площади помещения, расчетная концентрация активного хлора не превышает 0,12 мг/л. При проветривании, через 30 мин, она снижается до минимума. Годовая потребность хозяйств в дезосредствах компенсируется адекватным количеством анолита ЭХАР, что стоит в 5 раз дешевле.
- Дезинфекция костного сырья и яичной скорлупы погружением в анолит ЭХАР с концентрацией активного хлора 300 мг/л в течение 3 ч позволяет сохранить его качество на воздухе в течение 24 ч при температуре окружающей среды 25…30ОС. В анолите в закрытой емкости хранить сырье можно длительные сроки.
- Анолит ЭХАР не может быть использован в качестве консерванта при заготовке плющенного зерна.
ПРАКТИЧЕСКИЕ ПРЕДЛОЖЕНИЯ
- С целью профилактики заболеваний, повышения уровня резистентности и иммунного ответа предлагаем сопровождать массовые обработки, а также процесс выращивания молодняка выпаиванием катодной фракции электрохимически активированного раствора поваренной соли (католит ЭХАР) с дефицитом активного хлора 3 – 5% по 10 мл на 1 кг живой массы 1 – 2 раза в неделю в течение 2 – 3 недель.
- Для экономии витаминов предлагаем снижать дозу их в рационе птицы на 30 – 35% и выпаивать католит ЭХАР 0,5%-го раствора поваренной соли дважды в неделю в качестве питьевой воды в первую половину дня.
- При развитии у животных дисбиотических состояний после стрессирующих воздействий, антибиотикотерапии, действия других факторов, предлагаем в качестве пребиотической терапии введение католита ЭХАР в названных дозах и режиме.
- Лабораторную диагностику дисбиотических состояний животных предлагаем проводить с помощью мультисубстратного теста (МСТ).
- Предлагаем проводить профилактическую дезинфекцию животноводческих помещений в присутствии животных анолитом ЭХАР с 5,8%-м содержанием активного хлора, а также консервировать и хранить костное сырье и яичную скорлупу анолитом с таким же содержанием активного хлора в закрытых пластмассовых емкостях.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
А. Издания, рекомендованные ВАК России для публикации основных материалов докторских диссертаций
- Гомбоев Д.Д. Дезинфицирующая активность и экологическая безопасность электрохимически активированных растворов (ЭХАР) солей природных источников /Д.Д.Гомбоев, В.А.Солошенко, В.А.Рогачев, А.А.Данилова, В.И.Полосенко, О.Б.Фролов, Е.Н.Фролова // Сиб. вестник с.-х. науки. – 2004. – №3. – С.16 – 18.
- Солошенко В.А. Биостимулирующее действие озерного католита / В.А.Солошенко, В.А.Рогачев, Д.Д.Гомбоев, О.Б.Фролов, Е.Н.Фролова // Там же. – С.62–64.
- Гомбоев Д.Д. Фармакотоксикологическая оценка анолита / Д.Д.Гомбоев, Солошенко, В.А.Рогачев, А.А.Данилова // Ветеринария. – 2006. – №1. – С.54 – 56.
- Гомбоев Д.Д. Оссификация эмбрионального скелета крыс под воздействием активированных минеральных препаратов в низких дозах / Д.Д.Гомбоев, В.А.Солошенко, О.В.Распутина, В.А.Рогачев // Сельскохозяйственная биология.– 2007. – №2. – С.107 – 110.
- Гомбоев Д.Д. Реакция лимфоузлов крыс на ионизацию организма после курса антибиотикотерапии // Вестник РАСХН.– 2007. – №2. – С.68 – 69.
- Гомбоев Д.Д. Адаптогенные свойства католита электрохимически активированных растворов минеральных веществ // Доклады РАСХН. – 2007. – №2. – С.45 – 47.
- Гомбоев Д.Д. Стимуляция резистентности телят католитом ЭХАР после интенсивной антибиотикотерапии / Д.Д.Гомбоев, В.А.Солошенко, В.А.Рогачев, О.В.Распутина // Ветеринария. – 2007. – №6. – С.43 – 45.
- Гомбоев Д.Д. Действие факторов малой интенсивности на молодняк животных // Ветеринария.– 2007. – №11. – С. 43 – 45.
- Гомбоев Д.Д. Факторы малой интенсивности в функциональной системе водной среды организма животных (обзор литературы) // Ветеринарная патология.– 2007. – №4. – С.45 – 49.
- Гомбоев Д.Д. Повышение фармакологической чувствительности кошек // Ветеринария.– 2008. – № 7. – С. 54 – 56.
- Гомбоев Д.Д. Иммуномодулирующие свойства факторов малой интенсивности / Д.Д.Гомбоев, В.А.Солошенко, В.А.Рогачев // Вестник РАСХН. – 2008. – № 3. – С. 78 – 79.
- Гомбоев Д.Д. Пребиотические свойства католита ЭХАР / Д.Д.Гомбоев, А.А.Данилова // Сиб. вестн. с. – х. науки.– 2008. – №4. – C. 85 – 90.
Б. Работы опубликованные в сборниках трудов, научных конференций, патенты на изобретения
- Гомбоев Д.Д. Использование электрохимически активированного раствора поваренной соли в качестве экологически безопасного дезинфектанта /Д.Д.Гомбоев, В.А.Солошенко, В.А.Рогачев//Эффектив-ные технологии в животноводстве Сибири: сб. науч. тр./РАСХН. Сиб.отд-ние. СибНИПТИЖ. – Новосибирск, 2003. – С.223 – 226.
- Солошенко В.А. Стимулирующие, дезинфицирующие и консервирующие свойства электрохимически активированной воды соленых Кулундинских и Барабинских озер / В.А.Солошенко, Д.Д.Гомбоев, В.А.Рогачев, А.А.Данилова, В.И.Полосенко, В.Ф.Пономаренко, О.Б.Фролов, Е.Н.Фролова//Современные технологии производства продуктов животноводства: сб. науч. тр. / РАСХН. Сиб. отд-ние. СибНИПТИЖ. – Новосибирск, 2004. – С.176 – 179.
- Рогачев В.А. Использование воды соленых озер Кулунды и Барабы в животноводстве / В.А.Рогачев, В.А.Солошенко, Д.Д.Гомбоев, А.А.Данилова, В.И.Полосенко, В.Ф.Пономаренко, О.Б.Фролов, Е.Н.Фролова // Сельские новости. – 2004. – №4. – С.54 – 56.
- Гомбоев Д.Д. Моделирование перекисного окисления липидов у животных / Д.Д.Гомбоев, В.А.Солошенко, В.А.Рогачев // Аграрная наука – сельскохозяйственному производству Сибири, Монголии, Казахстана и Кыргызстана: тр. 8-й междунар. науч.-практ. конф. (Барнаул, 26 – 28 июня 2005 г.) / РАСХН. Сиб. отд-ние. – Новосибирск, 2005. – С.45 – 48.
- Гомбоев Д.Д. Ионизация водной среды организма животных / Д.Д.Гомбоев, В.А.Солошенко, В.А.Рогачев // Деятельность академика И.И.Синягина в становлении и развитии сибирской аграрной науки: материалы междунар. науч. конф., посвящ. 95-летию со дня рождения академика И.И.Синягина (Новосибирск, 20 – 22 марта 2006 г.) / РАСХН. Сиб. отд-ние. – Новосибирск, 2006. – С.454 – 458.
- Распутина О.В. Действие малых доз активированных минеральных веществ на рост животных / О.В.Распутина, Д.Д.Гомбоев, В.А.Солошенко, В.А.Рогачев // Актуальные проблемы животноводства. Наука, производство, образование: материалы II междунар. науч.-практ. конф., посвящ. 70-летию зооинженер. фак. Новосиб. гос. аграр. ун-та (Новосибирск, 22 – 24 марта 2006 г.) / ФГОУ ВПО НГАУ. – Новосибирск, 2006. – С.59 – 60.
- Гомбоев Д.Д. Ионизированная водная среда – ведущий компонент физиологической функциональной системы / Д.Д.Гомбоев // Там же. – С.200 – 202.
- Гомбоев Д.Д. Восстановление резистентности телят ионизированными водными растворами после интенсивного курса антибиотикотерапии / Д.Д.Гомбоев, В.А.Солошенко, В.А. Рогачев, О.В.Распутина // Аграрная наука – сельскому хозяйству: материалы Междунар. науч.-практ. конф. (Барнаул, 21 – 22 апреля 2006 г.) / ФГОУ ВПО АГАУ. – Барнаул, 2006. – С.352 – 354.
- Гомбоев Д.Д. Нарушения адаптационных процессов при заболеваниях телят / Д.Д.Гомбоев, В.А.Солошенко, В.А.Рогачев // Повышение эффективности животноводства в Сибири: сб. науч. тр. / РАСХН. Сиб. отд-ние. СибНИПТИЖ. – Новосибирск, 2006. – С.162 – 165.
- Гомбоев Д.Д. Уровень неспецифической резистентности стельных коров при спонтанно протекающих процессах перекисного окисления липидов / Д.Д.Гомбоев, В.А.Солошенко, В.А.Рогачев // Повышение эффективности животноводства в Сибири: сб. науч. тр. / РАСХН. Сиб. отд-ние. СибНИПТИЖ. – Новосибирск, 2006. – С.165 – 169.
- Гомбоев Д.Д. Детоксицирующее действие растворов минеральных солей / Д.Д.Гомбоев, В.А.Рогачев, В.А.Солошенко // Прогрессивные технологии производства продуктов животноводства в Сибири: сб. науч. тр. / РАСХН. Сиб. отд-ние. СибНИПТИЖ. – Новосибирск, 2007. – С.138 – 143.
- Рогачев В.А. Антиоксидантное действие католита ЭХАР / В.А.Рогачев, В.А.Солошенко, Д.Д.Гомбоев // Прогрессивные технологии производства продуктов животноводства в Сибири: сб. науч. тр. / РАСХН. Сиб. отд-ние. СибНИПТИЖ. – Новосибирск, 2007. – С.144 – 147.
- Хрупов А.А. Использование отавы бобовых трав при силосовании кукурузы / А.А.Хрупов, В.А.Рогачев, К.А.Соловьев, Д.Д.Гомбоев // Там же. – С. 148 – 151.
- Гомбоев Д.Д. Управление гомеостазом водной среды организма животных / Д.Д.Гомбоев // Научное обеспечение АПК Сибири, Монголии и Казахстана: Материалы 10-й междунар. конф. по научному обеспечению азиатских территорий (г.Улан-Батор, 3 – 6 июля 2007 г.) / РАСХН. Сиб. отд-ние. – Новосибирск, 2007. – С.227 – 228.
- Солошенко В.А. Способ экономии витаминов в рационе перепелов / В.А.Солошенко, Д.Д.Гомбоев, В.А.Рогачев, В.Г.Чегодаев, О.Г. Мерзлякова. – Заявка на изобретение, приоритет № 2008120070 от 20.05.2008
- Гомбоев Д.Д. Противовоспалительное действие факторов малой интенсивности / Д.Д. Гомбоев, В.А. Рогачев // Технология производства продуктов животноводства в современных условиях Сибири: сб.науч.тр. / РАСХН. Сиб. отд-ние. СибНИПТИЖ. – Новосибирск, 2008. – С. 183 – 188.
- Рогачев В.А. Использование влажного фуражного зерна в рационах ремо-
нтных телочек / В.А. Рогачев, К.А. Соловьев, Д.Д. Гомбоев // Там же. – С. 108 – 112.
- Егоров С.В. Применение пробиотика «Астра» и МЭК «Кормозим» в корм-
лении ягнят подсосного периода / С.В. Егоров, С.С. Мегедь, Д.Д. Гомбоев // Там же. – С. 148 – 154.
- Гомбоев Д.Д. Действие католита ЭХАР на кишечную микрофлору кишечника телят при дисбиозах / Д.Д. Гомбоев // Аграрная наука – сельскому хозяйству: материалы международной научно-практической конференции (Барнаул, 12 – 13 марта 2008 г.) / ФГОУ ВПО АГАУ. – Барнаул, 2008. – С.255 – 257.

