Министерство образования и науки Российской Федерации
Федеральное государственное автономное
образовательное учреждение
высшего профессионального образования
«Сибирский федеральный университет»
УДК 577.151.03, 577.151.45
№ госконтракта 02.740.11.0766
№ госрегистрации И100921055352
Инв.№ 12
УТВЕРЖДАЮ
Ректор СФУ
академик РАН
Е.А. Ваганов
______________________
(подпись)
“____” ноября 2010 г.
М.П.
ОТЧЕТ
О НАУЧНО-ИССЛЕДОВАТЕЛЬСКОЙ РАБОТЕ
В рамках федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы
по теме:
БИОЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ МОЛЕКУЛЯРНЫХ ПРОЦЕССОВ В КЛЕТКАХ И ИХ ФИЗИКО-ХИМИЧЕСКИХ МОДЕЛЯХ; СОЗДАНИЕ НА ИХ ОСНОВЕ НОВОГО ПОКОЛЕНИЯ БИОЛЮМИНЕСЦЕНТНЫХ СЕНСОРОВ ДЛЯ БИОЛОГИИ И МЕДИЦИНЫ
(промежуточный, этап № 2)
Наименование этапа: «Изучение молекулярно-клеточного механизма биолюминесценции грибов»
| Руководитель НИР, академик, д-р медиц. наук, проф. | _________________ подпись, дата | И.И.Гительзон |
Красноярск 2010
СПИСОК ИСПОЛНИТЕЛЕЙ
| Руководитель темы, д-р медиц. наук, профессор-консультант ИФБиБТ СФУ, научный руководитель НОЦ «Енисей», академик РАН | _________________ подпись, дата | И.И. Гительзон (введение, разделы 1-5, заключение) |
| Д.б.н., профессор, зав. кафедрой биофизики ИФБиБТ СФУ | _________________ подпись, дата | В.А.Кратасюк (раздел 5) |
| Д. ф.-м.н., профессор кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | П.И. Белобров (раздел 5) |
| Д.б.н., профессор ИЦМиМ СФУ | _________________ подпись, дата | Н.С. Кудряшева (раздел 5) |
| Д.ф.-м.н., профессор кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | С.И.Барцев (раздел 5) |
| К.б.н., доцент кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | Е.Н. Есимбекова (раздел 5) |
| К.б.н., с.н.с кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | И.В. Свидерская (раздел 5) |
| К.б.н., доцент кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | В.В. Межевикин (раздел 5) |
| К.б.н., доцент кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | И.Е. Суковатая (раздел 5) |
| К.ф.-м.н., директор ИФБиБТ СФУ, директор НОЦ «Енисей» | _________________ подпись, дата | В.А. Сапожников (раздел 5) |
| К.ф.-м..н., доцент кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | Е.В. Немцева (раздел 5) |
| Инженер СФУ | _________________ подпись, дата | М.В. Даценко (раздел 5) |
| Инженер СФУ | _________________ подпись, дата | С.М. Гусев (раздел 5) |
| К.т.н., в.н.с. НИЧ СФУ | _________________ подпись, дата | А.Г. Суковатый (раздел 5) |
| Инженер СФУ | _________________ подпись, дата | О.С. Максимова (оформление документов по проекту) |
| Электроник сектора административных территориальных сегментов МКИВС СФУ | _________________ подпись, дата | А.В. Суханов (раздел 5) |
| Аспирант СФУ | _________________ подпись, дата | В.О. Шеходанов (раздел 5) |
| Аспирант СФУ | _________________ подпись, дата | Н.В. Шманько (раздел 5) |
| Старший преподаватель ИМ СФУ | _________________ подпись, дата | Р.Г. Углев (раздел 5) |
| Аспирант СФУ | _________________ подпись, дата | В.В. Зыков (раздел 5) |
| Начальник отдела интеллектуальной собственности СФУ | _________________ подпись, дата | Л.И. Черепанова (раздел 1-3) |
| Аспирант СФУ | _________________ подпись, дата | А.С. Тарасова (раздел 5) |
| Начальник отдела ОРГиП ЦГП НИЧ СФУ | _________________ подпись, дата | С.А. Кузнецов (оформление документов по проекту) |
| Аспирант СФУ | _________________ подпись, дата | М.А. Александрова (раздел 5) |
| Аспирант СФУ | _________________ подпись, дата | О.А. Вшивкова (раздел 5) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | А.М. Кондик (раздел 5) |
| Магистр ИФБиБТ СФУ | _________________ подпись, дата | А.В. Орлова (раздел 5) |
| Магистр ИФБиБТ СФУ | _________________ подпись, дата | А.В. Архипова (раздел 5) |
| Аспирант СФУ | _________________ подпись, дата | Д.В. Гульнов (раздел 5) |
| Аспирант СФУ | _________________ подпись, дата | И.А. Денисов (раздел 5) |
| Студентка ИФБиБТ СФУ | _________________ подпись, дата | А.Е. Безруких (раздел 5) |
| Студентка ИФБиБТ СФУ | _________________ подпись, дата | Г.А. Кудряшева (раздел 5) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | К.А. Лукьяненко (раздел 5) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | А.Г. Туманян (раздел 5) |
| Магистр ИФБиБТ СФУ | _________________ подпись, дата | Н.С. Бука (раздел 5) |
| Студентка ИФБиБТ СФУ | _________________ подпись, дата | Н.А. Зайцева (раздел 5) |
| Магистр ИФБиБТ СФУ | _________________ подпись, дата | Е.В. Васюнькина (раздел 5) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | О.С. Сутормин (раздел 5) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | А.С. Якимов (раздел 5) |
| Студентка ИФБиБТ СФУ | _________________ подпись, дата | Т.И. Авсиевич (раздел 5) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | В.А. Черняев (раздел 5) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | Е.С. Мамаева (раздел 1-3) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | Е.С. Балакина (раздел 1-3) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | Д.А. Митрюшкина (раздел 1-3) |
| Аспирант ИБФ СО РАН | _________________ подпись, дата | Н.О. Ронжин (раздел 1-3) |
| К.х.н., н.с. ИФБ СО РАН | _________________ подпись, дата | Н.В. Белогурова (раздел 5) |
| Инженер СФУ | _________________ подпись, дата | Р.Р. Алиева (раздел 5) |
| Координатор НОЦ «Енисей» | _________________ подпись, дата | А.Ю. Денисова (раздел 5) |
| Референт ИБФ СО РАН | _________________ подпись, дата | Г.Е. Касаева (раздел 1-3) |
| Д.б.н., в.н.с., зав. лабораторией ИБФ СО РАН | _________________ подпись, дата | В.С. Бондарь (реферат, раздел 1-3, заключение) |
| К.б.н., н.с. ИБФ СО РАН | _________________ подпись, дата | К.В. Пуртов (раздел 1-3) |
| К.б.н., н.с. ИБФ СО РАН | _________________ подпись, дата | Г.А. Выдрякова (введение, разделы 1-3) |
| К.б.н., с.н.с. ИБФ СО РАН | _________________ подпись, дата | С.Е. Медведева (реферат, введение, разделы 1-4, заключение) |
| К.б.н., в.н.с. ИБФ СО РАН | _________________ подпись, дата | Э.К. Родичева (раздел 2) |
| Лаборант ИБФ СО РАН | _________________ подпись, дата | Д.А. Котов (раздел 2) |
| Инженер-технолог ИБФ СО РАН | _________________ подпись, дата | А.И. Петров (раздел 3) |
| К.б.н., с.н.с. ИБФ СО РАН | _________________ подпись, дата | Н.С. Мануковский (разделы 2-3) |
| К.б.н., с.н.с. ИБФ СО РАН | _________________ подпись, дата | В.С. Ковалев (раздел 2-3) |
| Лаборант ИБФ СО РАН | _________________ подпись, дата | Н.Н. Озимок (раздел 3) |
| С.н.с. ИБФ СО РАН | _________________ подпись, дата | А.П. Пузырь (раздел 2-3) |
| К.б.н., с.н.с. ИБФ СО РАН | _________________ подпись, дата | О.А. Могильная (раздел 2-3) |
| К.б.н., зав. лабораторией ИБФ СО РАН | _________________ подпись, дата | Г.С. Калачева (раздел 3) |
| К.б.н., с.н.с. ИБФ СО РАН | _________________ подпись, дата | Н.А. Тюлькова (разделы 1) |
| К.т.н., доцент ИКиИТ СФУ | _________________ подпись, дата | В.А. Комаров (раздел 5) |
| Аспирант центра технологий электронного обучения СФУ | _________________ подпись, дата | А.А.Трухин (раздел 5) |
| Электроник центра обслуживания систем обработки данных СФУ | _________________ подпись, дата | Д.Ю.Худоногов (раздел 5) |
| Нормоконтролер | _________________ подпись, дата | О.С. Максимова (весь отчет и документы) |
УДК 001.891[047]:006.354 МКС 01.140.20 Т62 ОКСТУ 0007
Ключевые слова: научно-технический документ, отчет, научно-исследовательская работа, заключительный отчет, промежуточный отчет
РЕФЕРАТ
Отчет _7_ с., ?.ч, 41_ рис., _13_ табл., _61_ источник
КЛЮЧЕВЫЕ СЛОВА: БИОЛЮМИНЕСЦЕНЦИЯ, ЛЮЦИФЕРАЗА, СВЕТЯЩИЕСЯ БАКТЕРИИ, СВЕТЯЩИЕСЯ ГРИБЫ, МИКРООКРУЖЕНИЕ, ИММОБИЛИЗАЦИЯ, ВЯЗКОСТЬ СРЕДЫ, СТАБИЛИЗАЦИЯ ФЕРМЕНТОВ, МОДЕЛИРОВАНИЕ, ВКЛЮЧЕНИЕ В ГЕЛЬ, ИННОВАЦИОННОЕ ОБРАЗОВАНИЕ
Проект направлен на понимание механизма биолюминесценции светящихся грибов и использования этого природного явления для создания аналитических систем предельно высокой чувствительности для применения в биологических исследованиях, медицине и биотехнологии.
В отчете по второму этапу представлены результаты исследования биолюминесценции грибов, механизм которого остается не расшифрованным, и результаты разработки путей использования этого явления для аналитических целей.
Цель проекта: Разработка и исследование физико-химических экспериментальных моделей для изучения функционирования цепей сопряжения ферментов и механизмов стабилизации ферментов внутри клетки и в растворе на примере люминесцентной системы светящихся бактерий и грибов.
Цель второго этапа проекта: Изучение молекулярно-клеточного механизма биолюминесценции грибов
План НИР второго этапа работы (2010 г.) над проектом включал следующие основные задачи:
1. Разработка оптимальной среды для поддержания длительного стабильного излучения грибных систем.
2. Исследование условия выделения компонентов грибной биолюминесцентной системы из мицелия и плодовых тел.
3. Изучение клеточной организации биолюминесцентной системы грибов.
4 Изучение биофизических параметров грибной биолюминесценции.
За отчетный период получены следующие основные результаты:
- Молекулярно-биологическими методами установлено, что культура вьетнамского гриба является представителем вида Neonothopanus nambi, ранее описанный вьетнамским исследователем Дао Тхи Ван (2002) как Omphalotus af. illudent.
- Исследованы параметры роста культуры N. nambi на средах разного состава. Подобраны питательные среды на основе стандартных реагентов и сибирских растений (осина, сосна, береза), выбраны оптимальные условия культивирования гриба, определены основные параметры роста. Поиск заменителей вьетнамского субстрата (опилки гевеи и неочищенные зерна риса) для культивирования гриба на более доступных субстратах показал, что мицелий гриба N. nambi успешно развивается на субстрате, основу которого составляют опилки березы или осины. При этом морфология роста гриба на опилках осины аналогична росту на опилках гевеи. Опилки сосны менее пригодны для выращивания N. nambi ввиду очень слабого роста на них мицелия. Эксперименты также показали, что зерно пшеницы успешно заменяет зерно риса в процессе искусственного выращивания гриба N. nambi. Среди нескольких относительно дешевых и легко доступных сред предпочтение отдано картофельной среде, на которой хорошо развивается мицелий с высоким уровнем свечения. Свечение мицелия наблюдается после прекращения его роста. Предположительно фактором, лимитирующим рост, является азот. Интенсивное свечение сопровождалось локальным потемнением мицелия и выделением в глубину агара темно-зеленого экссудата, который со временем становился темно-коричневым. При механическом повреждении мицелия (надрезе колонии) интенсивность свечения и выделение экссудата в зоне надреза резко нарастали в течение 1-2 часов и длилось 3-5 суток. Мицелий в зоне свечения постепенно покрывается темно-коричневым налетом, таким же, каким над зоной свечения покрывается стекло. Это может свидетельствовать о сопряженности выделения окрашенных летучих компонентов и реакции свечения. Кроме того, по нашим наблюдениям процесс свечения сопровождает процесс накопления окрашенных веществ в среде, что подтверждается отдельными данными о сопряжении процессов лигнинолиза и биолюминесценции.
- Методом масс-спектрометрии исследован липидный и жирнокислотный состав экстрактов, полученных из сухой биомассы плодовых тел гриба N. nambi. При этом в исследованных экстрактах гриба не обнаружен иллудин - компонент высших грибов, обладающий цитостатическим действием. Выявлено низкое содержание липидов (5,3% сухого вещества) в биомассе исследуемой культуры N. nambi. Содержание неомыляемой фракции не превышало 6,0 % от общего количества липидов. Омыляемые компоненты, в состав которых входят жирные кислоты ациллипидов, составили 30,2% от суммы липидов. Жирнокислотный состав экстрактов, полученных из сухой биомассы плодовых тел гриба N. nambi, исследован методом масс-спектрометрии. Жирнокислотный состав исследуемого гриба оказался весьма необычным. Обнаружены жирные кислоты с количеством атомов углерода от 8 до 26. Особенностью жирнокислотного состава N. nambi оказалось также большое количество изомеров линолевой кислоты (С18:2): в зрелых плодовых телах – 7-8 изомеров, в мицелии и молодых плодовых телах – 3-4. При этом количество некоторых изомеров достигало 45% от общего количества жирных кислот. Данные о положении двойных связей в изомерах были подтверждены масс-спектрометрией ДМОК (диметилоксазолиновых) производных соответствующих жирных кислот, поскольку введение в цепь жирной кислоты оксазолинового кольца позволяет точно определить положение двойной связи в молекуле.
- Получены первичные данные о структурно-функциональной организации и физико-химических свойствах люминесцентной системы светящегося гриба N. nambi. Показано, что образцы мицелия, выращенные на твердых и жидких питательных средах, обладают способностью длительной светопродукции – выход люминесцентного сигнала на максимум достигается в течение от 40 мин до 5 часов от момента помещения образца в измерительную кювету. При этом установлено, что биолюминесценция мицелия может иметь бифазный или монофазный характер, в зависимости от состава питательной среды. Показано, что люминесцентная система N. nambi является кислородзависимой и, вероятно, локализована в клеточной мембране гриба, так как в гомогенатах, полученных после разрушения мицелия, люминесцентная активность не обнаруживается. Ионы двухвалентных металлов оказывают действие на люминесцентную систему гриба, ионы марганца активируют светоизлучение, a ионы Ni, Co, Mg ингибируют ее, не влияют на излучение ионы Ca. Показано, что супероксид анион радикал не принимает участия в реакции светоизлучения N nambi, что отличает эту люминесцентную систему от люминесцентных систем светящихся грибов P. stipticus, A. mellea, M. citricolor, P. japonicus, O. olearius, M. lux-coeli.
- Выявлен низкомолекулярный термостабильный компонент, значительно (на 2 порядка) повышающий светопродукцию светящегося мицелия гриба.
- Показана возможность длительного поддержания свечения мицелия (20 суток и более), что открывает возможность создания долго действующих («ждущих») сигнальных тестов на появление токсикантов в водных и воздушных средах.
Работа имеет высокую практическую значимость: понимание механизма биолюминесценции и длительное свечение мицелия грибов являются основой для создания нового класса биолюминесцентных сенсоров, работающих в режиме ожидания и выдающих тревожный сигнал при появлении токсикантов в воздушной или водной среде.
Проведены поисковые исследования для определения биохимических и биофизических параметров свечения гриба N. nambi, которые позволили установить ряд ранее неизвестных явлений и фактов: зарегистрирован спектр излучения N. nambi, обнаружен эффект стимуляции его свечения ионами Mn и Cu ингибирования ионами Ca и Mg. Показана возможность многократного усиления свечения N. nambi.Эти результаты существенны для продвижения к пониманию механизма свечения грибов, до настоящего времени не расшифрованного, и для создания тест-системы на основе биолюминесцентной системы гриба N. nambi
Научно-образовательный процесс.
Показана возможность использования биолюминесцентной системы N. nambi для визуализации биохимических и биофизических процессов, что дает ряд очевидных дидактических преимуществ при преподавании биохимии и биофизики в университетах.
Сотрудниками ИБФ разработан информационно-образовательный портал «Биолюминесценция и светящиеся организмы» (http://bl.ibp.ru), представляющий сведения обо всех аспектах биолюминесценции и ее использовании, о коллективах России и других стран, занимающихся изучением биолюминесценции различных организмов. Студенты, аспиранты СФУ и другие пользователи сети имеют свободный доступ к выставленным на портале ресурсам. Полученные в ходе проекта данные также будут представлены в соответствующем разделе портала.
Содержание (страницы надо выверить!!! Вставить пропущенные в содержание)
РЕФЕРАТ…………………………………………………………………………………… …….…7
СОДЕРЖАНИЕ……………………………………………………………………………….11
ОПРЕДЕЛЕНИЯ, ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ………………….……… ……...13
ВВЕДЕНИЕ…………………………………………………………………………………..14
РАЗДЕЛ 1 ОПИСАНИЕ ПРОБЛЕМЫ И ПУТИ РЕШЕНИЯ………….…………….17
1.1 Актуальность проблематики………………………………………………………………...17
1.2 Предлагаемые подходы………………………………………………………………………19
1.3 Практическая значимость……………………………………………………………………20
РАЗДЕЛ 2 МЕТОДЫ ИССЛЕДОВАНИЯ…………………………………………..21
2.1 Источники культур светящихся грибов, использованных для работы по проекту………21
2.1.1 Отбор светящихся культур грибов из коллекций ……………………………………….21
2.1.2. Выделение светящихся культур грибов из природных источников…………………….21
2.2 Культивирование грибов……………………………………………………………………..21
2.2.1 Способы культивирования………………………………………………………………..21
2.2.2. Питательные среды…………………………………………………………………………..22
2.2.3. Определение показателей роста и свечения мицелия грибов…………………………….22.
2.3 Молекулярная идентификация культуры светящихся грибов…………………………......23
2.4 Метод атомной абсорбции…………………………………………………………………....24
2.5 Регистрация свечения мицелия грибов……………………………………………………....25
2.6 Влияние модельных токсикантов на биолюминесценцию грибов…………………………25
РАЗДЕЛ 3 ИЗУЧЕНИЕ МОЛЕКУЛЯРНО-КЛЕТОЧНОГО МЕХАНИЗМА БИОЛЮМИНЕСЦЕНЦИИ ГРИБОВ………………………………………………….…...27
3.1 Разработка оптимальной среды для поддержания стабильного и длительного излучения грибных систем…………………………………………………………………………………….27
- Отбор культур – кандидатов для применения в биолюминесцентных тест системах…27
3.1.2 Уточнение таксономического положения культуры Omphalotus af. Illudent……………..29
3.1.3. Содержание основных компонентов в древесине гевеи и зольных элементов базидиом гриба N. nambi………………………………………………………………………….31
3.1.4. Подбор компонентов питательной среды для выращивания гриба N. nambi……………..33
3.1.5. Влияние добавок Fe, Cu и Mn на рост гриба N. nambi ……………………………………..35
3.1.6. Рост гриба N. nambi на различных сахарах………………………………………………..37
3.1.7. Рост и биолюминесценция гриба N. nambi на богатых органических средах…………..39
3.1.8. Рост и биолюминесценция гриба N. nambi на различных природных лигноцеллюлозных субстратах……………………………………………………………………………………………40
3.2. Исследование условия выделения компонентов грибной биолюминесцентной системы из мицелия и плодовых тел............................................................................………………………...45
3.2.1. Приготовление образцов…………………………………………………………………….45
3.2.2. Экспериментальная оценка возможности выделения компонентов биолюминесцентной системы гриба N. nambi……………………………………………………………………………..45
3.3. Изучение клеточной организации биолюминесцентной системы грибов..…….…...47
3.3.1. Морфология светящихся грибов Armellaria borealis……………………………………….47
3.3.2. Морфология светящихся грибов Neonothopanus nambi…………………………………….48
3.3.3. Микроморфология светящихся грибов Neonothopanus nambi…………………………......50
3.3.4. Биохимический состав биомассы светящихся грибов Neonothopanus nambi…………… 53
3.3.5. Поиск субстрата биолюминесцентной реакции…………………………………………….58
3.3.6. Состав питательных сред, используемых для выращивания культуры гриба N. nambi….60
3.4. Изучение биофизических параметров грибной биолюминесценции……………………..61
3.4.1. Характеристика биолюминесценции гриба N. nambi……………………………………….61
3.4.2. Спектр биолюминесценции гриба N. nambi………………………………………………….62
- Оценка возможности использования светящихся грибов
в биолюминесцентном анализе…………………………………………………………………….63
РАЗДЕЛ 4 НАУЧНО-ОБРАЗОВАТЕЛЬНЫЙ ПРОЦЕСС……………………………..69
Раздел 5. Достижение Программных индикаторов. Комментарии…………………………..70
Заключение……………………………………………………………………………………79
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ……………………………...83
ОПРЕДЕЛЕНИЯ, ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
| Биолюминесценция | - свечение живых организмов |
| Хемилюминесценция | - излучение света в результате дезактивации молекул, образованных в ходе химической реакции |
| Люцифераза | - фермент, катализирующий биолюминесцентную реакцию |
| Эмиттер | - молекула в электронно-возбужденном состоянии, ответственная за излучение регистрируемой люминесценции |
| I | - интенсивность люминесценции |
| С14 | - тетрадеканаль |
| ФМН | - флавинмононуклуотид |
| ФМНН2 | - восстановленный флавинмононуклеотид |
| ТВ | - токсические вещества |
ВВЕДЕНИЕ
Исследование биолюминесценции грибов преследует двоякую цель:
- фундаментальную – раскрытие механизма излучения грибов;
- прикладную – разработка биотехнологических основ биолюминесцентного тестирования с использованием люминесцентных систем грибов.
В отличие от биолюминесцентных систем бактерий и многих видов животных (одноклеточных – жгутиковые, кишечнополостных, (включая полипы, медузы, грибневики), ракообразных, моллюсков и рыб, которые удалось расшифровать за последние десятилетия, светоизлучающая система грибов остается нераспознанной. Дискутируется два альтернативных представления: что свечение грибов обеспечено классической фермент-субстратной системой люцифераза-люциферин и в противоположность ему, что свечение грибов в отличие от всех ранее описанных видов биолюминесценции бактерий и животных вызывается окислением органических субстратов без участия специализированного фермента. наличие фунгальной люциферазы подвергается сомнению или вообще отрицается. Поскольку грибы представляют собой третье царство живой природы, эволюционно удаленное от двух остальных – растений и животных, познание механизма их люминесценции представляет фундаментальный интерес. Биохимия грибов весьма своеобразна и это дает основание ожидать, что их биолюминесцентная система может оказаться принципиально иной, нежели уже описанные биолюминесцентные системы бактерий и животных. В этом фундаментальный интерес изучения грибной биолюминесценции.
Но это же обстоятельство определяет и практический интерес биолюминесценции грибов.
В последние десятилетия получило интенсивное развитие новое направление в аналитике – создание биолюминесцентных тестов для использования в биологии и медицине, биотехнологии и экологическом контроле такие тесты создаются на уровне геномов, ферментов, клеток и целых организмов. Их разработка и предложение потребителям стало предметом конкуренции. Каждая вновь открытая или генносконструированная биолюминесцентная тест-система становится предметом патентования и дорого стоит. конкурентная погоня за новыми тест-системами, в которой участвуют многие компании, прежде всего фармакологические и биотехнологические весьма остра.
Поэтому перспективен поиск новых биолюминесцентных систем для практического использования. Светящиеся грибы в этом отношении заслуживают особого внимания, прежде всего потому, что в силу удаленности этого таксона от других форм жизни можно ожидать, что и их светоизлучающая система окажется весьма своеобразной.
Открыто к настоящему времени уже более 80 видов светящихся грибов, относящихся к разным таксонам высших грибов. Ярких отличий в их свечении пока не выявлено, но поскольку эта способность представлена среди видов грибов мозаично, можно ожидать, что видовые различия существуют и будут открываться по мере описания генов и ферментов, обеспечивающих эту функцию у грибов. Каждый вновь описанный в этом отношении вид может быть предметом патентования.
Еще две особенности свечения грибов привлекательны для решения на их основе весьма актуальной в настоящее время задачи – создания т.н. «ждущих» аларм-тестов для оперативного обнаружения токсичности, появляющейся в водной и воздушной среде, в закрытых помещениях, в особенности.
Преимуществом грибных биолюминесцентных систем в этом отношении является длительность их свечения и возможность экспозиции тест-системы в воздушной среде.
На этапе работы по проекту, результаты которого представляются в настоящем отчете, ставились задачи:
1). введение в биотехнологическую культуру ряда видов светящихся грибов из дикой природы и из коллекций с целью выбора наиболее удобных для работы штаммов, выбор штаммов для дальнейшей детальной работы (не более 2-3);
2). описание классическими – культуральными и морфологическими методами - избранного штамма гриба и его точное таксономическое определение генетическими методами. разработка рецепта питательной среды для получения препаративных количеств биомассы светящихся грибов.
3). изучение биохимического состава биомассы мицелия и плодовых тел избранного вида, изучение биофизических параметров свечения избранного вида, кинетики излучения и его спектра. подготовка создания аларм-теста на основе биолюминесцентной системы грибов.
4). разработка и подбор субстрата и питательной среды для обеспечения длительного (неделями и в пределе месяцами) роста грибной культуры, используемой в качестве тест-объекта в «ждущих» системах.
Как видно из нижеследующего изложения по всем этим направлениям за отчетный этап получены существенные результаты, обеспечивающие дальнейшее развитие работы.
Стартовой кадровой основой для организации работ по проекту является коллектив сотрудников СФУ и Института биофизики СО РАН, который сформировался в 1999 году после получения гранта русско-американской программы CRDF и Минобразования РФ «Фундаментальные исследования и высшее образование» и создания научно-образовательного центра (НОЦ) «Енисей». Образовательные идеи и научные достижения НОЦ «Енисей» послужили основой инновационной образовательной программы в рамках проекта «Разработка современной системы подготовки отечественных профессионалов для проведения коммерчески ориентированных научных исследований в области физико-химической, молекулярной и клеточной технологий», реализуемой в Институте фундаментальной биологии и биотехнологии (ИФБиБТ) СФУ. Предлагаемые в проекте исследования являются естественным продолжением исследований, проводимых в НОЦ «Енисей» в предыдущие годы.
На основе этих научных исследований разрабатывается современная система подготовки отечественных профессионалов для проведения коммерчески ориентированных научных исследований в области физико-химической, молекулярной и клеточной технологий.
План НИР второго этапа 2010 года работы над проектом включал следующие основные задачи:
1. Разработка оптимальной среды для поддержания длительного стабильного излучения грибных систем.
2. Исследование условия выделения компонентов грибной биолюминесцентной системы из мицелия и плодовых тел.
3. Изучение клеточной организации биолюминесцентной системы грибов.
4 Изучение биофизических параметров грибной биолюминесценции
Другой целью настоящего проекта являлось вовлечение молодежи в научную деятельность. Реализация этой цели осуществлялась путем привлечения студентов и аспирантов к выполнению работ, связанных с темой проекта, в лаборатории нанобиотехнологии и биолюминесценции Института биофизики.
Раздел 1. Описание проблемы и пути решения.
- Актуальность проблематики
Биолюминесценция - способность живых организмов излучать видимый свет, весьма широко распространенное природное явление. При изучении светящихся организмов достигнуты существенные результаты в понимании механизмов светоизлучения: охарактеризована структурно-функциональная организация нескольких люминесцентных систем, из некоторых светящихся организмов выделены и ферменты (люциферазы), катализирующие реакции преобразования энергии химических связей субстратов (люциферинов) в кванты видимого света, определены их первичная и пространственная структуры, определены структуры некоторых субстратов. С помощью методов молекулярной биологии и генной инженерии выделены, клонированы и экспрессированы в клетках-реципиентах гены ряда люцифераз, что открыло возможности получения надежных источников сырья для выделения этих ферментов в больших количествах. Это интенсифицировало изучение физико-химических свойств светоизлучающих ферментов и механизма их действия и стимулировало поиск вариантов их практического использования. Как сами светящиеся организмы, так и люциферазы являются весьма перспективными биомаркерами для высокочувствительных методов микроанализа, используемых при решении широкого спектра биологических, биотехнологических и медицинских задач.
В биолюминесцентном анализе широко используются генетически модифицированные бактерии, несущие lux-гены светящихся бактерий и других светящихся организмов [1-3]. Однако с помощью бактериальных биотестов не всегда можно оценить воздействие веществ на эукариотические организмы и обнаружить токсичные вещества в воздушной среде. Разработка и использование биотестов более высоко организованных видов (дрожжи, черви, грибы), несущих гены люминесцентной системы, открывает новые перспективы развития биолюминесцентного анализа. Способностью излучать видимый свет обладают некоторые высшие грибы - известно около 80 светящихся видов [4-7], которые обнаружены в разных регионах Земного шара (Северная и Южная Америка, Европа, Азия, в том числе в Сибири, Австралия, Африка, Бразилия). Длительное свечение грибов (от нескольких дней до нескольких недель) в широком температурном диапазоне (4 до 500С [8]), наличие воздушного мицелия делают перспективным создание на их основе новых биолюминесцентных биотестов непрерывного действия, которые могут быть использованы для обнаружения токсичности, в том числе и в воздушной среде.
До настоящего времени лишь несколько групп исследователей во всем мире (в Германии, Англии и Бразилии) предприняли попытки использования светящихся грибов в качестве потенциальных объектов для создания биотестов. Например, светящиеся грибы A. mellea, Micena citricolor и Gerronema viridilucens были использованы для разработки тестов на токсичность [9-11]. Weitz с соавторами [12] проводили исследование биотестов на основе светящихся грибов для определения токсичности 3,5 – дихлорфенола (ДХФ), пентахлорфенола (ПХФ) и солей тяжелых металлов (меди и цинка). Соли цинка ингибировали свечение мицелия A. mellea. При воздействии 3,5-ДХФ, ПХФ и меди на Armillaria mellea и Mycena citricolor наблюдалось уменьшение интенсивности люминесценции мицелия, причем мицелий A. mellea был существенно менее чувствителен к 3,5 ДХФ, чем мицелий M. citricolor. Показатель ЕС50 для 3,5-ДХФ, ПХВ и меди (но не цинка) для светящихся грибов был того же порядка, что и у бактериальных биотестов.
Близкие результаты были получены на рекомбинантных бактериальных биотестах Pseudomonas fluorescens 8866 Tn luxCDABE при воздействии этих же токсичных веществ [13], а также на дрожжевых и нематодных рекомбинантных биотестах [14,15]. Однако, культура A. mellea была более чувствительна к меди, чем P. fluorescens 8866 и P. putida F1, тогда как M. citricolor оказалась менее чувствительной.
Известны успешные попытки получить рекомбинантные светящиеся грибы для создания биосенсора на токсичность веществ. Подходящими видами для этих целей признаны Neurospors sp и Aspergillus sp., у которых получены люминесцирующие или флюоресцирующие нити грибов [16]. Люминесцирующие белки включают люциферазу Gaussia и обелин, а кодирующий ген находится в этих объектах под индуцибельным промотором или усилителем чувствительности к тест-веществу. Генетически модифицированные биолюминесцентные грибы Aspergillus awamori с геном рекомбинантного экворина были использованы для определения ионов кальция [17]. Чуть позже Mendes&Stevani [10] показали возможность использовать в качестве тест-объекта для определения токсичности ионов металлов (Pb(II), Cd(II), Al(III)) бразильский светящийся гриб Gerronema viridilucens.
Сравнение чувствительности люминесценции светящихся грибов и рекомбинантных бактериальных люминесцентных биотестов к различным токсическим веществам (ТВ) показало, что культура грибов A. mellea была более чувствительной к меди, чем бактериальные культуры P. fluorescens 8866 и P. putida F1, в то время как культура гриба M. citricolor оказалась менее чувствительной к этому ТВ [9,13].
Светящийся глобулярный мицелий A. mellea и Mycena citricolor был использован в качестве тест-объектов британскими и новозеландскими исследователями [9,10,13]. При использовании биотестов на основе светящихся грибов для определения токсичности фенолов и солей тяжелых металлов показано, что для светящихся грибов падение люминесценции на 50 % (ЕС50) после действия фенолов и меди было того же порядка, что и для бактериальных биотестов [10]. Известны успешные попытки получить рекомбинантные светящиеся грибы Neurospora sp., and Aspergillus sp, содержащие гены люциферазы веслоногого рачка рода Gaussia и фотопротеина обелина для создания биосенсора [18]. Генетически модифицированные биолюминесцентные грибы Aspergillus awamori с геном рекомбинантного экворина были использованы для определения изменения концентрации ионов кальция под воздействием различных ТВ [19].
Несмотря на значительное число работ, посвященных исследованиям люминесценции высших грибов, механизмы их свечения пока остаются не расшифрованными, в отличие от биолюминесцентной системы бактерий. Противоречивы мнения относительно структурно-функциональной организации люминесцентных систем светящихся высших грибов и структуре люцифераз и люциферинов светящихся грибов [5,10-26]. Изучение именно этих вопросов представляет не только фундаментальный академический интерес, но и имеет очевидное практическое значение для использования светящихся грибов для биолюминесцентной аналитики. Исходя из этого, значительное внимание на данном этапе работы было уделено также изучению биохимических аспектов люминесценции светящегося гриба Neonothopanus nambi, как основного объекта исследований.
1.2 Предлагаемые подходы
При выполнении данного этапа работы основные усилия фокусировались на изучении светящегося гриба Neonothopanus nambi, как основного объекта исследований. Отличительными особенностями данного вида светоизлучающего гриба и преимуществами как объекта исследований являются продолжительное свечение, отмечающееся для всех стадий роста, и культивируемость и сравнительно быстрый рост в лабораторных условиях. Поскольку в литературе отсутствуют данные об исследованиях люминесцентной системы N. nambi, все технологии и приемы проведения экспериментов разрабатывались впервые, а полученные в ходе исследований результаты являются новыми и имеют приоритетный характер. Основу методологической базы комплексных исследований за отчетный период составили:
Микробиологические методы: Разработка и оптимизация технологий культивирования светящегося гриба N. nambi, с целью получения исходной биомассы с устойчивым уровнем биолюминесценции.
Биохимические методы: Исследования структурно-функциональной организации и физико-химических свойств люминесцентной системы гриба N. nambi. Скрининг данного вида гриба с целью выявления в нем практически значимых продуктов (лектины, иллуидин) биолого-медицинского назначения.
Аналитические методы: Изучение возможностей применения светоизлучающего гриба N. nambi в создании новых люминесцентных индикаторных и диагностических тест-систем для биологических и медицинских приложений.
Молекулярно-биологические методы: Определение видовой принадлежности культуры вьетнамского светящегося гриба методом ДНК-типирования и сравнение полученных нуклеотидных последовательностей ДНК сиквенсами баз данных GenBank в программе BLAST.
1.3 Практическая значимость
Реализация целей проекта нужна как для решения фундаментальной проблемы механизма биолюминесценции грибов, так и для прикладных задач биолюминесцентного анализа, в котором использование биолюминесцентных систем грибов обещает, по крайней мере, два существенных преимущества в сравнении с бактериальными биотестами – длительность свечения грибов, достигающая недель и месяцев, что важно для создания «ждущих» аларм-тестов, и возможность прямого определения токсикантов в воздушной среде. Показанная на этом этапе исследования возможность длительного (20 суток и более) поддержания свечения на подобранных средах подтвердила перспективность этого пути.
Раздел 2. Методы исследования
2.1. Источники культур светящихся грибов, использованных для работы по проекту
2.1.1 Отбор светящихся культур грибов из коллекций
Культуры светящихся грибов были получены из трех коллекций:
- Коллекции культур базидиомицетов Ботанического Института им. В.Л. Комарова РАН (Санкт-Петербург). Отбор проводили визуально по свечению мицелия, после выращивания грибов на чашках Петри на сусло-агаре (4 и 1,5 % соответственно) и картофельно-декстрозном агаре (Biokar diagnostics, 39 г/л) в темной камере при 26оС., Свечение наблюдали уже на 3-и сутки роста невооруженным глазом через 3-5 минут после адаптации к темноте.
- частной коллекции штаммов Dao T.V. (BIO-LUMI Co., Ltd., Ho Chi Minh City, Vietnam)
- Коллекции культур Института леса СО РАН (Красноярск)
2.1.2 Выделение светящихся культур грибов из природных источников
Сбор светящихся грибов осуществляли маршрутным методом:
В экспедиционном маршруте по Южному Вьетнаму были обследованы грибы из лесных сообществ Национального парка Кат Тьен и двух территорий Заповедника Винь Кыу: локального участка сохранившегося диптерокарпового леса и окрестности лесной станции TW Cuc вдоль реки Ма Да.
Собранные образцы (базидиомы и ткани плодового тела) светящихся грибов фиксировали с использованием фотодокументирования и необходимых дополнительных описаний, высушивали на электросушилке и упаковывали в зип-пакеты на подложках из бумажных салфеток с добавлением в каждый пакет силикагеля.
2.2. Культивирование грибов
2.2.1. Способы культивирования
- Периодическое культивирование на жидкой и твердой среде
- Глубинное культивирование
- Твердофазное культивирование гриба в пластиковых мешках
2.2.2. Питательные среды
Питательные среды стерилизовали 30 мин при 1 атм. Основные среды, используемые для выращивания светящихся грибов:
- Среда с отваром пшеничного зерна – для поддержания маточного материала.
Для приготовления отвара пшеничное зерно замачивали в воде (1 кг на 2 литра), нагревали, кипятили в течение 10-15 минут, не допуская разваривания зерна, затем настаивали в течение часа при комнатной температуре. По окончании жидкость – отвар пшеничного зерна, фильтровали и стерилизовали. Перед употреблением концентрат отвара разводили в 2,5 - 3 раза.
- Среда Сабуро: 40 г глюкозы, 10 г пептона, 1 л дист. воды.
- Среда с молочной сывороткой: смесь отфильтрованной сыворотки и воды (1:0), (1:1), (1:2).
- Среда с картофельным отваром: 200 г картофеля кипятили 10 мин, 20 г сахарозы, 1 л воды.
- Субстрат для твердофазного культивирования гриба в пластиковых мешках:
Для приготовления субстрата опилки вымачивали в 1 - 0,5 % растворе извести в течение суток. Затем к 1 кг влажных опилок добавляли 20 г на кукурузного экстракта, 3 г сернокислого аммония, 2 г MgSO47H2O, и 1 г KH2PO4. Субстрат помещали в пластиковые мешки, общей массой общей массой 1 кг.
2.2.3. Определение показателей роста и свечения мицелия грибов.
Влияние органических и неорганических соединений на рост мицелия грибов оценивали стандартными методами путем измерения радиальной скорости роста (Kr) колоний на поверхности агаризованой среды в период линейной фазы роста (рис.2.1.1).
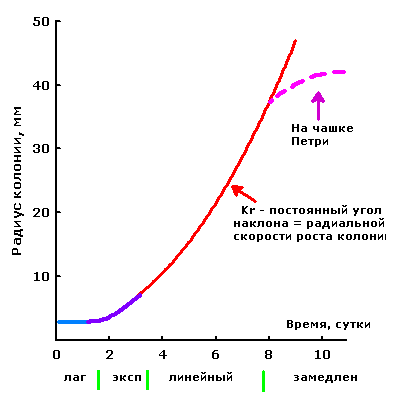
Рис. 2.1.1 Фазы роста колонии гриба на поверхности агаровой среды.
Культуры грибов выращивали в чашках Петри в термостате при 28оС. Для каждого варианта использовали пять чашек (пять повторностей). Колонии измеряли один раз в сутки в течение 7-10 суток подряд. По окончании каждой серии измерений определяли среднюю величину Kr, стандартное отклонение и доверительные интервалы. Затем в течение 15- 20 суток продолжали фиксировать интенсивность свечения мицелия. Интенсивность свечения оценивали в относительных единицах с помощью люминометра, а также визуально. Дополнительно учитывали плотность мицелия, выделение окрашенных экссудатов и другие проявления активности культуры гриба.
2.3. Молекулярная идентификация культуры светящихся грибов
Уточнение видовой принадлежности культуры, описанного ранее как Omphalotus af. Illudent, проводили метод ДНК-типирования. Область ITS1-5.8S-ITS2 (Internal Transcribed Spacer = внутренние транскрибируемые спейсеры) геномной рибосомальной ДНК амплифицировали с использованием комбинации праймеров: NS5-fw (5'-TGGAAGTAAAAGTCGTAACAAGG-3') и NS4-rev (5'-TCCTCCGCTTATTGATATGC-3') [27]. ПЦР-продукты секвенировали и полученные нуклеотидные последовательности ДНК сравнивались с сиквенсами баз данных GenBank в программе BLAST. Амплифицированные ITS фрагменты ДНК использовали в для клонирования и последующего сиквенса, на основании которого был проведен филогенетический анализ полученных клонов.
2.4. Метод атомной абсорбции. (Брицке, 1982)
Пробу определенного объема предварительно минерализовали смесью кислот азотной и хлорной при нагревании. Минерализат переносили в мерную колбу и в растворе определяли содержание металлов на атомно-абсорбционном спектрофотометре Квант-2а (Россия). Одновременно проводили холостое определение для выяснения чистоты реактивов. Калибровочные графики строили по растворам соответствующих солей металлов. Растворы готовили из государственных стандартных образцов.
1. Калий и натрий определяли из тех же минерализатов, но методом пламенной фотометрии на пламенном фотометре Flapho ( Карал Цейс, Германия).
2. Липиды экстрагировали смесью растворителей хлороформ-изопропанол в соотношении 1:1 по объему.
Метиловый эфиры жирных кислот (МЭЖК) получали после кислотного метанолиза липидов. Метанолиз липидов проводили в смеси метанола и серной кислоты (50:1 по объему) при температуре 900 С в течение двух часов на водяной бане, используя обратный холодильник. МЭЖК анализировали на хромато-масс-спектрометре Agilent 5975Inert (Agilent, США), используя капиллярную колонку HP-FFAP длиной 30 м и внутренним диаметром 0.25 мм. Условия хроматографирования: газ-носитель – гелий, скорость 1 мл/мин; температура ввода проб – 220 0 С, начальная температура хроматографирования 1200 С, подъем температуры до 1900 С со скоростью 30 С/мин, 5 мин изотермальный режим, и далее до 2300 С со скоростью 100 С/мин и 20 мин иотермальный режим: температура интерфейса - 2400 С, температура ионного источника -1750 С; режим электронного удара при 70 eV; режим сканирования фрагментов от 45 до 450 m/z при 0.5 с/сек. Положение двойных связей в ненасыщенных ЖК устанавливали по масс-спектрам диметилоксазолиновых производных (ДМОЗ) жирных кислот. ДМОЗ были приготовлены следующим образом: 0.2 мл 2-амино-2-метил-1- пропанола было добавлено к омыленным липидам, через раствор пропускался гелий, колба плотно закрывалась и нагревалась до 1900 С в течение 2 часов. Затем к реакционной смеси добавлялось 2 мл дистиллированной воды, раствор подкисляли, ДМОЗ экстрагировали смесью гексана-ацетона (96:4 по объему).
3. Анализ аминокислот. 50 мг пробы переносили в ампулу из толстого стела 12х120 мм и добавляли 20 мл 6N HCl. Ампулу запаивали, гидролиз сухого остатка проводили в термостате при 1100С в течение 22 часов. После гидролиза содержимое ампулы охлаждали, фильтровали и переносили в выпарительную чашку. Выпаривание производили на кипящей водяной бане. Сухой остаток растворяли в 20 мл буфера рН 2.2, отбирали 1900 мкл и добавляли 100 мкл диметилсульфоксида (ДМС). 100 мкл раствора пропускали через специальный патрон для очистки раствора аминокислот от примесей. Патрон промывали 1000 мкл буфера (буфер рН2.2 + 5% (ДМС). Анализ проводили на аминокислотном анализаторе A0326V2 (Knauer, Германия). На колонку А0992-13vl наносили 20 мкл образца, разделение аминокислот проходило в градиенте температуры и элюента по прописи, предлагаемой фирмой. Задание условий хроматографирования, расшифровку хроматограмм по предлагаемому фирмой стандарту и обсчет результатов проводили по специальной программе, прилагаемой к прибору.
4. Выделение иллудина из биомассы грибов проводили по методу [28], анализ этой фракции проводили на хромато-масс-спектрометре Agilent 5975Inert (Agilent, США) на колонке HP-5S.
2.5. Регистрация свечения мицелия грибов
Для измерения биолюминесценции образцов мицелия использовали кюветные люминометры (модель БЛМ 8801 и модель БЛМ 8802) отечественного производства (СКТБ «Наука», Красноярск, Россия), калиброванные по радиоактивному стандарту Гастингса-Вебера (одна люминесцентная единица составляет 108 фотонов в 1 секунду). Люминесцентные сигналы регистрировали с помощью самописца (модель 2210) фирмы «LKB» (Швеция). Для ряда исследований использовали также планшетный люминометр (модель Luminoscan Ascent) фирмы «ThermoElectron Co» (Финляндия).
Для регистрации спектра люминесценции гриба N. nambi использовали спектрофлуориметр (модель Aminco-Bowman, Series 2 luminescent spectrometer) фирмы Thermo Spectronic (USA).
2.6. Влияние модельных токсикантов на биолюминесценцию грибов
В качестве модельных токсикантов использовали водные растворы солей, в том числе тяжелых металлов: Na2WO4, NiSO4, CoCl2, (NH4)2MoO4, CrSO4, ZnSO4, Li2SO4, AlCl3, MnCl2, CsCl, CdSO4*8H2O, SnCl2, HgCl2, ацетата свинца Рb(ОСОСН3)2, а также бензохинона, фенантренхинона (PNQ), 5-амино-2-3 дигидро- 1,4-фталазиндиона (A-DHFD) и 1,2-нафтохинон- 4-сульфоновой кислоты (NQ-SA) в концентрациях 10-5, 10-4, 10-3, 10-2, 10-1, и 1 мг/мл.
Эксперименты по действию токсикантов проводили при наличии видимого свечения мицелия грибов рода Armillaria, выращенных на агаризованной среде Сабуро при комнатной температуре. Измерения проводили на кюветном люминометре БЛМ-8802 (Красноярск, СКТБ Наука) и на планшетном люминометре Luminoscan Ascent «ThermoElectron Co», (Финляндия). Кусочки агаризованной среды площадью около 33 мм2 с растущей светящейся культурой грибов помещали в лунки планшета (куда предварительно для предотвращения высыхания агара вносили 50 мкл стерильной дистиллированной воды), после чего измеряли исходную интенсивность люминесценции. После добавления 200 мкл исследуемого вещества в лунки с культурой повторно измеряли люминесценцию через 5, 10, 15, 20, 25 и 30 мин. В контрольных вариантах вносили 200 мкл дистиллированной воды. Действие токсикантов на свечение мицелия грибов N.nambi, выращенных при температуре 25-27оС на жидкой среде с картофельным отваром, регистрировали после выдерживания мицелиальной пленки в дистиллированной воде не менее 2 суток, чтобы создать условия стабильного высокого уровня свечения.
Токсичность исследуемых растворов оценивали по величине биолюминесцентного индекса (BI), который рассчитывали по формуле: BI=Io/Ik, где Io – нормированное относительно исходного значение интенсивности свечения грибного мицелия в опыте, Ik – нормированное относительно исходного значение интенсивности люминесценции грибного мицелия в контроле. Нормированные значения рассчитывали по отношению к исходному свечению. Растворы исследуемых веществ считали токсичными, если отклонение величины биолюминесцентного индекса от 1 (нормированное значение контроля) превышало 20%.
Раздел 3. Изучение молекулярно-клеточного механизма биолюминесценции грибов
3.1. Разработка оптимальной среды для поддержания стабильного и длительного излучения грибных систем.
- Отбор культур – кандидатов для применения в биолюминесцентных тест системах
Отбор, культур грибов для создания перспективных тест систем и биосенсоров включал несколько этапов. На первом этапе критерием отбора было различимое, невооруженным глазом свечение образцов мицелия или базидиом гриба (Рис. 3.1.1.).
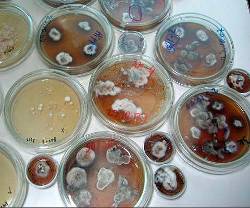
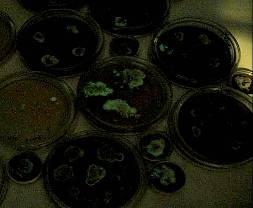
Рис. 3.1.1. Культуры светящихся грибов при дневном свете и в темноте
На этом этапе из всех доступных источников было отобрано 11 культур (8 видов):
- из Коллекции культур базидиомицетов Ботанического Института им. В.Л. Комарова РАН, Санкт-Петербург:
1043 Armillaria gallica - Пермская область, Россия
0350 A. mellea – Ленинградская область, Россия
0356 A. mellea – Минская область, Беларусь
0358 A. mellea – Богемия, Чешская республика
0918 A. mellea – Иркутская область, Россия
0491 Lampteromyces japonicus, Англия
- из частной коллекции Dao Thi Van (BIO-LUMI Co., Ltd., Ho Chi Minh City, Vietnam)
Omphalotus af. illudent – Провинции Бинь Фыок (Binh Phuoc) и Бинь Зыонг (Binh Duong), Южный Вьетнам
- из Коллекции культур Института леса СО РАН (Красноярск)
Armillaria borealis.
- из образцов плодовых тел светящихся грибов собранных в экспедиционной поездке по Южному Вьетнаму
Roridomyces roridus
Mycena sp.
Filoboletus manipularis
На втором этапе культуры сравнивали по интенсивности и продолжительности свечения грибного мицелия. По этим параметрам культуры Armillaria borealis и Omphalotus af. illudent имели наилучшие показатели. Таксономическое положение и фото базидиом этих видов в естественных условиях даны на рисунках 3.1.2 и 3.1.3.
 | Царство: | Fungi |
| Отдел: | Basidiomycota | |
| Класс: | Agaricomycetes | |
| Порядок: | Agaricales | |
| Семейство: | Physalacriaceae | |
| Род: | Armillaria | |
| Вид: | borealis | |
| Armillaria borealis Marxm. & Korhonen | ||
Рис. 3.1.2. Внешний вид и таксономическое положение гриба Armillaria borealis
Дереворазрушающий гриб Armillaria borealis (опенок осенний северный). Базидиомы диаметром 2 8,5 см. от желтовато-коричневого до ярко-охристого цвета. Ризоморфы дихотомически разветвленные до 3-5 мм в диаметре. Распостранен в Северной Европе, Скандинавии, России. Встречается как на лиственных, так и хвойных деревьях. Часто является возбудителем комлевой гнили растущих деревьев (англ. - butt rot): гниль, поражающая комель. Сравнительно недавно выделен в обособленный вид. Ранее его рассматривали как морфологический вариант гриба Armillaria mellea (Vahl: Fr.) Kumm. [29]. У данного вид, как и у других представителей рода Armillaria, светится только мицелий в зоне роста (обычно это край колонии). На агаровых средах колония растет относительно медленно. Линейная скорость роста составляет в среднем 0,75 мм за сутки.
 | Царство: | Fungi |
| Отдел: | Basidiomycota | |
| Класс: | Basidiomycetes | |
| Порядок: | Boletales | |
| Семейство: | Paxillaceae | |
| Род: | Omphalotus | |
| Вид: | af. illudent | |
| Omphalotus af. Illudent | ||
Рис. 3.1.3. Внешний вид и таксономическое положение гриба Omphalotus af.illudent.
Согласно описанию (Dao, 2002; 2006) плодовые тела гриба O. af. illudent встречаются на стволах погибших деревьев гевеи (Hevea brasiliensi) в Южных провинциях Вьетнама. Базидиомы этого вида белого цвета диаметром 2,5 – 5 см. Споровый порошок белого цвета. Споры имеют яйцевидную форму 1,8-2 x 1,2-1,3 в диаметре. Свечение наблюдается в фазе замедления или/и после прекращения роста. Светится и мицелий, и базидиомы (плодовые тела). Максимальная интенсивность свечения отмечена на питательной среде, один литр которой содержит 20 г глюкозы 50 г сухого дрожжевого экстракта, 1,6 мл 1N HCl и 15 г агара. Для выращивания гриба Dao Thi Van [30,31] рекомендует использовать более богатые питательные среды, приготовленные на основе дрожжевого сусла с добавлением глюкозы и пептона. Линейная скорость роста мицелия на этих средах составляет 3-3,5 мм за сутки.
3.1.2 Уточнение таксономического положения культуры Omphalotus af. illudent
Культура светящегося дереворазрушающего гриба была выделена в 2002 году Дао Тхи Ван и описана как Omphalotus af. illudent [30]. Её определение и описание было сделано по краткому определителю Jean-Marie Polese, [32]. В доступной нам микологической литературе, а также на специализированных сайтах Интернета нет описания вида, относящегося к роду Omphalotus под таким видовым названием. Имеется описание вида со схожим названием: Omphalotus illudens (Schwein.) Bresinsky & Besl. Для уточнения видовой принадлежности гриба было проведено ДНК-типирование. Сравнение полученных нуклеотидных последовательностей ДНК с сиквенсами баз данных выявило их 98 % совпадение с сиквенсами типовой культуры Neonothopanus nambi (Speg.) R.H. Petersen & Krisai 1999 (синонимы: Agaricus nambi Speg., 1883; Dendrosarcus nambi (Speg.) Kuntze, 1898; Pleurotus nambi (Speg.), 1887).
Проведенное с помощью кластерного анализа более детальное сравнение с другими культурами и видами родов Omphalotus и Neonothopanus [33] показало тесную связь культур N. nambi из Вьетнама Малайзии и Австралии. (рис. 3.1.4). Культура N. nambi из Пуэрто-Рико попадает в тот же самый кластер, что и малазийская, австралийская и вьетнамская, но отстоит от них на расстоянии, близком межвидовому внутри группы, включающей различные виды рода Omphalotus. Это означает, что культуры из Юго-Восточной Азии отличаются от культуры из Южной Америки.
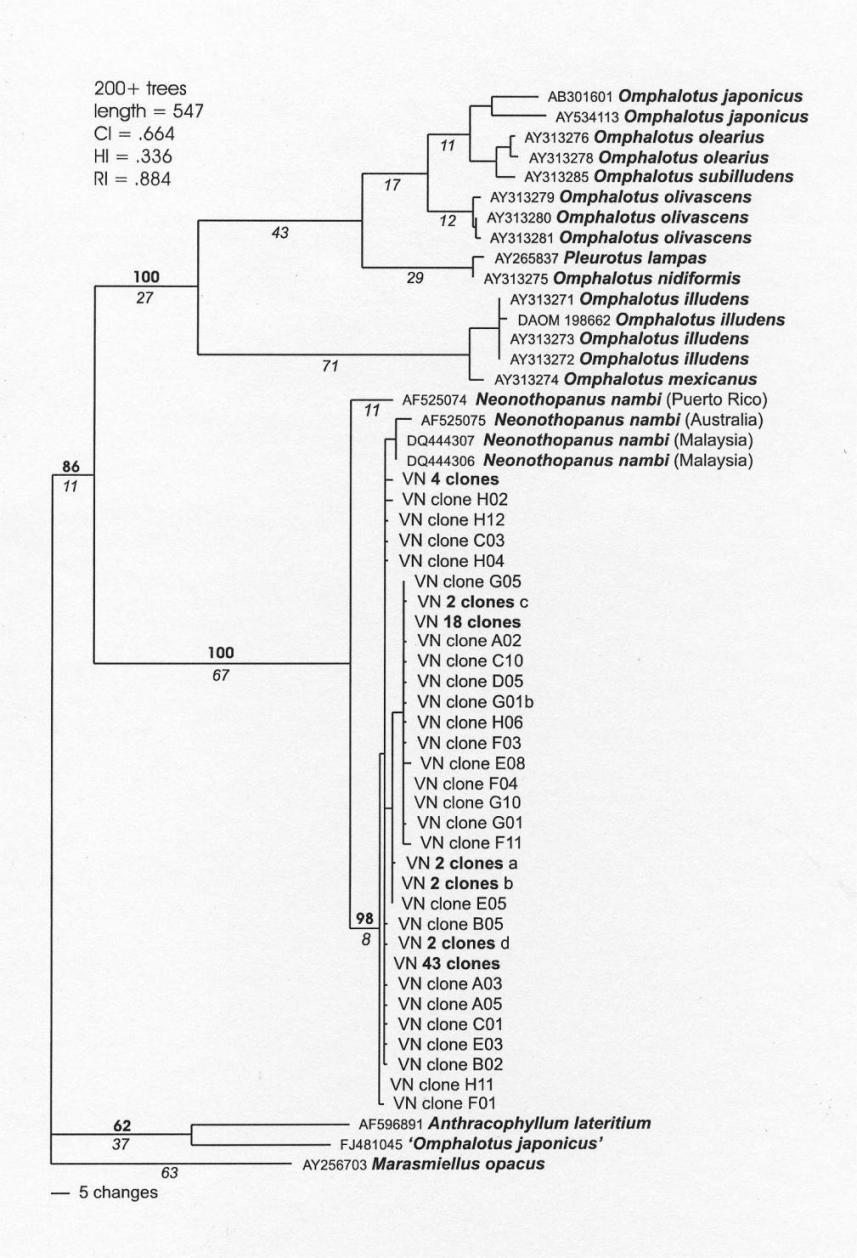
Рис. З.1.4 Анализ сходства полученных клонов с представителями рода Omphalotus
Дополнительным биохимическим признаком, характеризующим принадлежность культуры к роду Omphalotus является наличие в биомассе гриба иллудина [34,35]. Иллудин - секвитерпен, продукт вторичного метаболизма, обладающий противоопухолевой активностью. Содержание иллудина в грибах составляет от 60-70 мкг до 12 мг на грамм сырой биомассы. Для выявления иллудина тестировали экстракты, как сухой, так и сырой биомассы плодовых тел вьетнамского гриба, собранных Дао Тхи Ван в 2009 г. в природной среде обитания. В качестве контроля использовали экстракты гриба Lampteromyces japonicus (штамм 0491 Коллекции базидиомицетов БИНа) продуцента иллудина [28]. На хромато масс-спектрограмме спиртового экстракта L. japonicus, подготовленного по методу Kanamori-Kataoka с соавторами присутствуют пики со временем удержания 38,047 и 39,731 мин, соответствующие изомерам иллудина S и M. На хромато масс-спектрограмме экстрактов вьетнамской гриба N.nambi пики с таким временем удержания не обнаружены.
Таким образом, светящийся гриб, распространенный в южном Вьетнаме и описанный ранее как Omphalotus aff. illudent [30,31], идентифицирован нами как Neonothopanus nambi (Speg.) R.H. Petersen & Krisai 1999 (Рис. 3.1.5.).
 | Царство: | Fungi |
| Отдел: | Basidiomycota | |
| Класс: | Agaricomycetes | |
| Порядок: | Agaricales | |
| Семейство: | Marasmiaceae | |
| Род: | Neonothopanus | |
| Вид: | nambi | |
| Neonothopanus nambi (Speg.) R.H. Petersen & Krisai 1999 | ||
Рис. 3.1.5. Внешний вид и таксономическое положение гриба Neonothopanus nambi
3.1.3. Содержание основных компонентов в древесине гевеи и зольных элементов базидиом гриба N. nambi
Вид N. nambi встречается в тропических лесах Южного Вьетнама, в основном на погибших стволах гевеи (Hevea brasiliensi) иногда на древесине ореха кешью (Anacardium occidentale) а также лагерстремии (Lagerstroemia spp.). Согласно литературным данным [36-38] древесина гевеи, имеет типичный для лиственных пород качественный и количественный состав биополимеров (Таб. 3.1.1).
Таблица 3.1.1
Содержание основных компонентов в древесине гевей (% на сухую массу)
| Компонент | Содержание, % |
| Экстрактивные вещества | 2,7-6,5 |
| Зола | 0,2 - 1,8 |
| Древесина свободная от экстрактивных в-в | |
| Целлюлоза | 50 – 52,1 |
| Лигнин | 17,8 – 24,8 |
| Нецеллюлозные полисахариды (гемицеллюлозы) В составе нецеллюлозных полисахаридов: Ксилоза Манноза Галактоза Арабиноза Рафиноза Уроновые кислоты Крахмал | 24 – 30,7 11- 22 2-3,2 1,2-2 0,2 -07 0,4 1,5-3,4 6,3 |
| Протеины | 0,8 |
Состав экстрактивных веществ определяли методом хромато-масс-спектрометрии после обработки образцов древесины спирт-хлороформной смесью. Из коры экстрагировалось 1,5 %, а из древесины около 4,5 % органических соединений в пересчете на сухое вещество образца. Экстракты содержали несколько функциональных групп химических соединений: жирные кислоты, производные фенолов, терпены, фталаты, более 10 компонентов стероидного ряда, из которых были идентифицированы стигмастерол, -ситостерол, спинастерол и стигма-4-ен-3-он Результаты анализа представлены в таблице 3.1.2.
Таблица 3.1.2
Состав спирт-хлороформенного экстракта коры и древесины гевее в % от суммы
| Органическое соединение | Кора | Древесина |
| Фенольные соединения | 11.5 | 34.68 |
| Ванилин | 1,08 | 1,00 |
| Сквален | 4,04 | 3,41 |
| 14:0 | 0,37 | 0,90 |
| 15:0 | - | 0,37 |
| 16:0 | 4,22 | 16,60 |
| 16:1 | - | 0,76 |
| 17:0 | - | 0,36 |
| 18:0 | 3,10 | 6,21 |
| 18:1 | - | 9,65 |
| Сумма стеринов | 74,99 | 26,06 |
| из них: | ||
| Стигмастерол | 40,53 | 10,49 |
| -Ситостерол | 12,48 | 4,64 |
| Спинастерол | 1,75 | 4,07 |
| Стигма-4-ен-3-он | 5,70 | 0,34 |
Для изучения потребностей гриба в химических элементах было проведено определение их содержания в древесине гевеи и биомассе базидиом, собранных непосредственно в ареале распространения N. nambi. Результаты определения представлены в таблице 3.1.3.
Таблица 3.1.3
Содержание химических элементов в древесине гевее и биомассе базидиом гриба N. nambi
| Объект | Макроэлементы, г/кг | Микроэлементы мг/кг | |||||||||
| K | Na | Ca | Mg | Fe | Cu | Zn | Mn | Ni | Co | Cr | |
| Древесина | 7,92 | 0,05 | 1,77 | 0,55 | 68,68 | 3,38 | 33,63 | 82,05 | 0,77 | 0,04 | 2,48 |
| Гриб | 27,0 | 0,23 | 0,014 | 0,88 | 588,2 | 24,9 | 52,99 | 17,59 | 1,88 | 0,05 | 4,52 |

