На правах рукописи
АБСАЛЯМОВА Оксана Владиславовна
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ГЕНЕТИЧЕСКИХ ХАРАКТЕРИСТИК ОЛИГОДЕНДРОГЛИАЛЬНЫХ ОПУХОЛЕЙ
- - онкология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва 2009г.
Работа выполнена в НИИ нейрохирургии имени акад. Н.Н. Бурденко РАМН
Научные руководители:
доктор медицинских наук,
профессор Личиницер Михаил Романович
доктор медицинских наук,
профессор Коршунов Андрей Геннадьевич
Официальные оппоненты:
доктор медицинских наук,
профессор Борисов Василий Иванович
доктор медицинских наук, Чмутин Геннадий Егорович
Ведущая организация:
ФГУ Московский научно-исследовательский онкологический институт им. П.А. Герцена
Защита состоится «___»_______________2009 года в «____» часов на заседании диссертационного совета при Российском Онкологическом Научном Центре имени Н.Н. Блохина РАМН по адресу 115478, Москва, Каширское шоссе, д.24.
Автореферат разослан «___»_______________2009 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Барсуков Ю.А.
Общая характеристика работы
Актуальность темы исследования
По данным Central Brain Tumor Registry of the United States (CBTRUS), среди всех опухолей головного мозга, зарегистрированных в США с 1990 по 1997 г., олигодендроглиальные опухоли составили 4,2%: олигодендроглиомы - 2,6%, анапластические олигодендроглиомы – 0,6%, смешанные (олигоастроцитарные) глиомы, без уточнения степени злокачественности - 1%. В последнем десятилетии отмечен рост числа олигодендроглииальных опухолей за счет расширения гистологических критериев диагностики.
Больные с олигодендроглиальными опухолями имеют лучшую выживаемость как среди глиом низкой степени злокачественности (общая выживаемость: астроцитомы - 4,7 лет, олигоастроцитомы -7,1 лет, олигодендроглиомы - 9,8 лет), так и среди глиом высокой степени злокачественности (общая выживаемость: глиобластома – 10-12 мес., анапластическая астроцитома – 3-4 года, анапластическая олигодендроглиома - 6-7 лет). При этом по своему клиническому течению олигодендроглиальные опухоли чрезвычайно гетерогенны, выживаемость больных варьирует от 6-12 мес. до 10-15 и более лет, что определяет важность выявления прогностических факторов для этой нозологии.
Данные современных исследований, посвященных выявлению прогностически значимых факторов у больных с олигодендроглиальными опухолями неоднозначны. Например, в 6 из 9 работ по этой тематике, возраст больного оказывал влияние на прогноз, а в 3 – не оказывал; общий статус больного являлся прогностически значимым лишь в части приведенных исследований. В силу редкости описываемой нозологии, число больных, учитываемых в исследовании, как правило, невелико.
Генетические изменения в опухоли оказались, по данным литературы, надежным фактором прогноза. Определен спектр хромосомных аберраций, имеющих значение при олигодендроглиальных опухолях. Среди них выделены аберрации, имеющие как положительное, так и отрицательное прогностическое значение. Эти работы являются небольшими по объему, ряд работ описывает лишь один из генов и не касается их комплексной оценки. Было выполнено 2 рандомизированных исследования, посвященных этой проблеме, но при собственной оценке авторами отдаленных результатов, были выявлены определенные противоречия со сделанными ранее выводами.
Стандартов лечения больных с олигодендроглиальными опухолями на сегодняшний день не существует. Выбор тактики лечения в настоящее время основывается на данных зарубежных авторов, которые демонстрируют неоднозначные результаты.
Таким образом, представляется актуальным анализ большого количества случаев на предмет выявления клинических, морфологических и генетических факторов прогноза у больных с олигодендроглиальными опухолями, а также оценка эффективности применения различных методов лечения у этих больных.
Цель исследования
Определить влияние ряда хромосомных изменений на выживаемость больных с олигодендроглиальными опухолями.
Задачи исследования
- Оценить частоту встречаемости генетических изменений в олигодендроглиальных опухолях: коделеции 1p/19q, амплификации гена EGFR на хромосоме 7, делеции гена PTEN на хромосоме 10, делеции гена CDKN 2A на хромосоме 9
- Провести анализ клинических и морфологических характеристик, влияющих на выживаемость при олигодендроглиальных опухолях.
- Изучить влияние генетических изменений в опухолях на прогноз больных с олигодендроглиальными опухолями
- Оценить выживаемость больных с олигодендроглиальными опухолями, получавших различные варианты лечения
Научная новизна
Впервые на значительном количестве материала оценены клинические и морфологические факторы прогноза больных с олигодендроглиальными опухолями. С использованием методики флюоресцентной in-situ гибридизации проведен анализ ряда генных изменений, впервые показано их комплексное влияние на прогноз больных, основанное на оценке большого числа случаев. Впервые на значительном количестве материала проведен сравнительный анализ эффективности разных методов лечения больных с олигодендроглиальными опухолями.
Практическая значимость
Установлен ряд генетических изменений, оказывающих влияние на прогноз больных с олигодендроглиальными опухолями. Определена частота их встречаемости в различных видах олигодендроглиальных опухолей. Сформированы три прогностические группы больных с различными комбинациями генетических нарушений. Определение этих хромосомных аберраций внедрено в практику НИИ нейрохирургии им. акад. Н.Н. Бурденко. Выделены методы лечения, применение которых обеспечило наилучшие результаты выживаемости у больных с олигодендроглиальными опухолями различной степени злокачественности. Все это позволяет уточнить тактику лечения больных с олигодендроглиальными опухолями
Положения, выносимые на защиту
- Частота встречаемости генетических изменений в различных типах олигодендроглиальных опухолей неодинакова: коделеция 1p19q чаще встречается в олигодендроглиомах и анапластических олигодендроглиомах; делеции генов CDKN2A, PTEN, и амплификация гена EGFR встречаются преимущественно в опухолях grade III.
- Больные, c олигодендроглиальными опухолями grade III, в которых выявлена коделеция 1p19q, имеют наиболее благоприятный прогноз. При наличии в опухоли делеции генов CDKN2A, PTEN, амплификации гена EGFR или их комбинаций прогноз неблагоприятен.
- Одновременное или последовательное применение лучевой терапии и химиотерапии после оперативного лечения у больных с олигодендроглиальными опухолями grade III позволяет достичь у них наилучшей выживаемости
- У больных с опухолями grade II наиболее эффективным методом послеоперационного лечения является лучевая терапия
Публикации
По теме диссертации опубликовано 6 печатных работ, их них
- 1 в виде статьи в журнале;
- 5 в виде тезисов на профильных съездах, конгрессах и конференциях.
Апробация работы
Результаты работы были доложены и обсуждены на IV съезде нейрохирургов России (Москва, 2006); Европейском конгрессе нейрохирургов (Глазго, 2007); ежегодной конференции «Перспективы в лечении злокачественных образований центральной нервной системы» (Варшава, 2007); Конгрессе нейрохирургов стран Причерноморья (Ольгинка, Россия, 2007); 111-ом заседании Московского общества нейрохирургов (Москва, 2007); V Конференции молодых ученых России с международным участием (Москва, 2008); сессии Ученого совета НИИ нейрохирургии им. акад. Н.Н.Бурденко по итогам научно-исследовательских работ, завершенных в 2008 г., (Москва, 2009). Апробация диссертации состоялась 07 мая 2009 г. на заседании проблемной комиссии «Биология и комплексное лечение внутримозговых опухолей» НИИ нейрохираргии имени Н.Н. Бурденко РАМН с участием сотрудников Российского онкологического научного центра РАМН.
Структура и объем диссертации
Диссертация изложена на 141 машинописной странице, состоит из введения, шести глав, заключения и выводов. Библиография содержит 112 литературных источника, из них 9 отечественных и 103 зарубежных авторов, содержит 40 рисунков и 34 таблицы.
Материалы и методы
В исследование были включены 263 больных с вновь выявленными олигодендроглиальными опухолями, оперированные в НИИ нейрохирургии им. Н.Н.Бурденко с 2000 г. по 2005 г. Критериями включения явились: возраст старше 15 лет, гистологически подтвержденная опухоль олигодендроглиального ряда, нормальные исходные гематологические показатели (гемоглобин 10 г/дл, нейтрофилы 2х109/л, тромбоциты 150х109/л), нормальные исходные биохимические показатели (билирубин, аланинаминотрансфераза, аспартатаминотрансфераза, креатинин 1.5 Х верхняя граница нормы). Критериями исключения явились: тяжелые сопутствующие заболевания, инфекционные заболевания, наличие онкологического заболевания в анамнезе, для женщин – беременность или кормление грудью, неадекватная контрацепция.
Средний возраст больных был 39 лет (16-66), мужчин было 139, женщин – 124. Статус по шкале Карновского составил от 40 до 100 баллов, в среднем – 80 баллов.
Дооперационное обследование больных включало неврологический, нейроофтальмологический, осмотры, КТ и/или МРТ головного мозга с контрастным усилением, электороэнцефалография. После операции в течение 5-7 суток проводилась КТ головного мозга с контрастированием, нейроофтальмологический осмотр. Последующие контрольные обследования включали МРТ или КТ головного мозга с контрастированием и неврологический осмотр, проводились каждые 3-4 месяца в период проведения лечения, в период последующего наблюдения – 2 раза в год. При наличии клинических показаний обследование производилось ранее намеченного срока.
Наиболее часто – у 121 больного (46%) - опухоль локализовалась в лобной области. У 23 из них опухоль распространялось на обе лобные доли и колено мозолистого тела. У 35 больных (13,3%) опухоль локализовалась в лобно-височной области, у 16 (6%) больных – в лобно-теменной области.
Далее по частоте локализации в порядке убывания следуют височная, теменная, затылочная доли (см. табл. 1). У 11 (4,2%) больных опухоль занимала более 2 областей (лобно-теменно-височная область).
Таблица 1. Варианты локализации опухоли
| Область головного мозга | Число больных | |
| лобная | 98 | Всего с вовлечением лобных областей – 121 (46%) |
| бифронтально с вовлечением колена мозолистого тела | 23 | |
| лобно-теменная | 16 (6%) | |
| лобно-височная | 35 (13,3%) | |
| лобно-теменно-височная | 11 (4,3%) | |
| теменная | 20 (7,6%) | |
| височная | 33 (12,6%) | |
| теменно-височная | 11 (4,2%) | |
| теменно-затылочная | 7 (2,6%) | |
| другие | 9 (3,4%) | |
При оценке клинической картины заболевания различные неврологические симптомы были суммированы по неврологическим синдромам: эписиндром, головная боль, застойные диски зрительных нервов (как объективное проявление синдрома внутричерепной гипертензии), нарушения памяти, гемипарез, нарушения речи, нарушения полей зрения, психические нарушения.
Дооперационная неврологическая симптоматика оценена у 233 больных. Основным клиническим проявлением болезни был эписиндром. Он присутствовал у 196 (84,1%) больных. У 62 (26,6%) отмечалась головная боль. Застойные диски зрительных нервов выявлены при нейроофтальмологическом осмотре у 52 (23,3%) больных. Остальные синдромы представлены в таблице 2.
Таблица 2. Неврологические синдромы у больных с олигодендроглиальными опухолями
| Клинические синдромы | n | % |
| Эписиндром | 196 | 84,1% |
| Головная боль | 62 | 26,6% |
| Застойные диски зрительных нервов | 52 | 22,3% |
| Нарушения памяти | 12 | 5,1% |
| Гемипарез | 10 | 4,3% |
| Нарушения речи | 8 | 4,3% |
| Нарушения полей зрения | 7 | 3% |
| Психические нарушения | 4 | 1,7% |
Все больные подверглись оперативному вмешательству. Удаление опухоли проведено у 200 больных. (Описание хирургии)………..
Хирургическое удаление опухоли не проводилось в следующих случаях:
- диффузно растущая опухоль, располагавшаяся в функционально значимых зонах головного мозга;
- диффузное поражение опухолью полушарий головного мозга;
- глубинные межполушарные опухоли головного мозга;
- первично-множественные опухоли головного мозга;
- другие случаи при отсутствии неврологического дефицита и/или отказе больного от удаления опухоли.
Этим больным (62 чел.) была выполнена стереотаксическая биопсия опухоли с использованием стереотаксического оборудования СRW и ВRW (Radionics, Trent Wells, США). В 2 случаях выполнена открытая биопсия.
Во всех случаях проведено гистологическое исследование - морфологический диагноз устанавливался на основании светооптического и в ряде случаев иммуногистохимического исследования материала, полученного во время удаления или биопсии опухоли. Для формулировки гистологического заключения использовалась классификация ВОЗ опухолей ЦНС в редакции 2000 г. Опухоли 2 степени злокачественности (grade II) выявлены в 140 случаях: олигодендроглиома (ОД) - 63, олигоастроцитома (ОА) –77; опухоли 3 степени злокачественности (grade III) выявлены у 123 больных: анапластическая олигодендроглиома (АОД) –76, анапластическая олигоастроцитома (АОА) – 47.
Генетические исследования выполнены у 86 больных в лаборатории патоморфологии НИИ нейрохирургии им. Н.Н. Бурденко под руководством проф. А.Г.Коршунова методом флюоресцентной in-situ гибридизации (FISH). Использовались пробы фирмы Vysis к плечам хромосомы 1p36/1q25, к плечам хромосомы 19p13/19q13, гену-супрессору PTEN (локус 10q23)/центромерная проба хромосомы 10, онкогену EGFR/ центромерная проба хромосомы 7, гену-спрессору CDKN2A (локус 9р21)/центромерная проба хромосомы 9.
План лечения. Поскольку наша работа является ретроспективной, а стандартов лечения больных с олигодендроглиальными опухолями нет, в ряде случаев больным проведено различное лечение в одинаковых клинических ситуациях и наоборот. Основными принципами выбора тактики лечения являлись следующие.
Больные с олигодендроглиальными опухолями grade III. В этой ситуации послеоперационное противоопухолевое лечение проводилось всем больным. Единственными определяющими моментами выбора того или иного вида лечения явились оценка состояния глазного дна и размеров опухоли – в случаях наличия застойных дисков зрительных нервов и/или больших размеров опухоли лечение начиналось с химиотерапии (ХТ). Четкого определения – до каких размеров опухоль может быть подвергнута лучевой терапии без риска жизнеугрожающих осложнений – не существует. Решение принималось путем совместного обсуждения ситуации радиологами и химиотерапевтами. В спорных ситуациях предпочтение отдавалось химиотерапии в связи с имеющимися данными о высокой химиочувствительности олигодендроглиальных опухолей. Части этих больных по мере регресса застойных дисков зрительных нервов после завершения химиотерапии или в ходе ее проведения была проведена ЛТ. В силу организационных причин ряду больных была проведена только ХТ.
Больные с олигодендроглиальными опухолями grade II. В этих случаях рассматривалось наличие неблагоприятных факторов прогноза, показанных Pignatti с соавторами для глиом низкой (1-2) степени злокачественности: возраст старше 40 лет, максимальный размер опухоли более 6 см, пересечение опухолью срединной линии, наличие неврологического дефицита. В случае отсутствия этих признаков больной находился под наблюдением – противоопухолевое лечение не проводилось, КТ или МРТ с контрастным усилением выполнялись каждые 3-4 месяца. Наличие одного или нескольких вышеупомянутых признаков определяло показания к назначению послеоперационного противоопухолевого лечения. В этих случаях проводилась ЛТ или химиотерапия. Лечение начиналось с ХТ в случаях, когда после операции сохранялись застойные диски зрительных нервов и/или размеры опухоли были велики. Порядок выбора тактики лечения был аналогичен таковому при опухолях grade III.
Лучевая терапия использовалась в лечении 61 больного с опухолями grade III и 30 больных с опухолями grade II.
Лечение большинству пациентов проводилась на ускорителе «Примус» (Primus) фирмы Siemens, Германия на базе отделения радиологии НИИ нейрохирургии имени Н.Н.Бурденко. Режим фракционирования: по 1.8 - 2.0 Гр по 80 % изодозе, 1 раз в день, 5 раз в неделю, с интервалом между ежедневными фракциями 24 часа, и еженедельным интервалом (каждые 5 дней) 72 часа. СОД=50-60 Гр. Для планирования использовались данные предоперационного и послеоперационного МРТ и/или КТ. Планирование осуществлялось по программе Xio (см.рис.2.14). Объем облучения включает в себя область измененного сигнала по данным КТ и/или МРТ, соответствующую опухоли с захватом 2-3 см во все стороны, с исключением внемозговых образований и по возможности с защитой глаз, хиазмы, оптических нервов, ушного прохода свинцовыми блоками.
Химиотерапия проведена 72 больным с опухолями grade III и 29 больным и опухолями grade II. Использовались следующие лечебные схемы:
- Комбинация «PCV»:
- ломустин (СCNU) 110 мг/м перорально, день 1
- винкристин 1 мг/м (но не более 2 мг) внутривенно струйно, дни 1 и 8
- прокарбазин (натулан) 50 мг/м перорально, дни 1-14
Такие курсы повторяются каждые 6 недель, считая от первого дня курса.
- Комбинация «PNV»:
- нимустин (ACNU, нидран) 100 мг/м внутривенно струйно, день 1
- винкристин 1 мг/м (но не более 2 мг) внутривенно струйно, дни 1 и 8
- прокарбазин (натулан) 50 мг/м перорально, дни 1-14
Такие курсы повторяются каждые 6 недель, считая от первого дня курса.
- Ряд больных получали вышеописанные режимы лечения без включения в комбинация прокарбазина (натулана).
- Монотерапия фотемустином (мюстофораном)
- индукционный курс: фотемустин 100 мг/м внутривенно капельно 1,8, 15 дни
- консолидирующий курс проводился через 4-5 недель после индукционного и состоял из 3 введений фотемустина в дозе 100 мг/м внутривенно капельно каждые 4-5 недель.
Токсичность и коррекция доз. Оценку побочных эффектов химиотерапии мы проводили в соответствии с критериями ВОЗ. Для оценки токсичности еженедельно выполнялись общие анализы крови, один раз в месяц проводились биохимические анализы крови и клиническая оценка токсичности, включая неврологический осмотр. При появлении какого-либо вида токсичности обследования производились чаще, в зависимости от клинических показаний.
Новый курс химиотерапии начинался только при числе тромбоцитов 100 х 109/л и нейтрофилов 1,5 х 109/л. В противном случае проведение курса откладывалось на 1 нед. При сохраняющейся гематологической токсичности более 2 недель от планируемого введения препарата химиотерапия прекращалась.
При выявлении тромбоцитопении 2 ст (50 х 109Тр<75 х 109) и/или нейтропении 3 степени (0,5 х 109Нейтр<1,0 х 109), в последующие введения препараты применялись в дозе, составляющей 75% от исходной. При выявлении тромбоцитопении 3-4 ст (Тр<50 х 109) и/или нейтропении 4 степени (Н<0,5 х 109) последующие введения препараты вводились в дозе, составляющей 50% от исходной.
При развитии любого вида негематолоической токсичности 2 степени в последующие введения препараты применялись в дозе, составляющей 75% от исходной. При развитии любого вида негематолоической токсичности 3-4 степени (кроме алопеции и тошноты/рвоты 3 степени) обратимого характера, очередное введение осуществлялось только после снижения токсичности до 2 степени и ниже, при этом препараты применялись в дозе, составляющей 50% от исходной. При сохранении вышеописанной токсичности более 2 недель или рецидивирования ее после двукратных попыток снижения дозы проведение химиотерапии прекращалось.
Критерии эффективности и статистическая обработка. Главным критерием оценки принималось время до прогрессирования опухоли. Время до прогрессирования рассчитывалось как время, прошедшее от даты верификации диагноза до даты прогрессирования болезни. Прогрессирование устанавливалось согласно критериям эффективности по McDonald. В этом случае для оценки размеров опухоли используют произведение двух максимальных взаимно перпендикулярных диаметров на наибольшем по площади срезе опухоли, полученном при компьютерной томографии (КТ) с контрастным усилением или в Т1-взвешенном режиме магнитно-резонансной томографии (МРТ) с гадолинием. Полная ремиссия определяется как исчезновение контрастируемой части опухоли при двух идентичных КТ- или МРТ-исследованиях, интервал между которыми не менее 6 недель при условии стабильных или снижающихся доз кортикостероидов или отсутствия необходимости стероидной терапии; частичная ремиссия – уменьшение опухоли в размерах не менее чем на 50%; прогрессирование болезни– увеличение размеров опухоли на 25% и более; другие ситуации расцениваются как стабилизация болезни.
В анализ эффективности химиотерапии вошли больные, получившие 3 и более курсов. Исключение составили те случаи, когда прогрессирование болезни было зафиксировано на фоне проводимой терапии. Больные, прекратившие химиотерапию в связи с явлениями токсичности или по иным, не связанным с прогрессированием, причинам, в группы получавших химиотерапию не вошли.
Статистическая обработка данных включала расчет показателей выживаемости методом Каплан-Майера, оценку достоверности различий (р, или Log-rank тест). Расчеты осуществлялась с помощью пакета программ SPSS версия 13 и Statistica версия 7.0.
Влияние клинических показателей на прогноз больных с олигодендроглиальными опухолями
Для рассмотрения мы выбрали следующие параметры, описываемые к литературе как прогностически значимые: возраст и общий статус больного, наличие неврологического дефицита, застойные диски зрительных нервов, локализация опухоли. Оценка влияния этих факторов на прогноз проводилась раздельно для больных с опухолями grade II и grade III. Распределение частоты встречаемости различных градаций этих признаков показано в таблице 3.
Возраст больного. Достоверных различий медианы времени до прогрессирования (МВП) больных с олигодендроглиальными опухолями grade II в возрасте 40 лет и моложе 40 лет не получено. У больных с олигодендроглиальными опухолями grade III выявлены достоверные различия времени до прогрессирования в зависимости от возраста: МВП больных 40 лет и младше составила 30 мес., старше 40 лет - 52 мес., р=0,007.
Таблица 3. Распределение частоты встречаемости исследуемых прогностических признаков
| Grade II | Grade III | |
| Возраст: оценено больных | 140 | 123 |
| 40 лет n / % | 92 / 65% | 63 / 50,5% |
| <40 лет n / % | 48 / 35% | 60 / 49,5% |
| Статус по шкале Карновского: оценено больных | 114 | 88 |
| 70 баллов n / % | 22 / 19,3% | 22 / 25% |
| 80 баллов n / % | 92 / 80,7% | 66 / 75% |
| Наличие неврологического дефицита: оценено больных | 129 | 104 |
| выявлена n / % | 14 / 10,8% | 20 / 19,2% |
| Не выявлена n / % | 115 / 89,2% | 84 / 80,3% |
| Наличие застойных дисков зрительных нервов: оценено больных | 121 | 101 |
| выявлены n / % | 18 / 14,9% | 34 / 33,7% |
| не выявлены n / % | 103 / 85,1% | 67 / 66,3% |
| Локализация опухоли: оценено больных | 140 | 123 |
| лобная область n / % | 67 / 47,8% | 53 / 43,0% |
| вне лобной области n / % | 73 / 52,2% | 70 / 57,0% |
Статус по шкале Карновского. Оценивался дооперационный статус больных на основании записей в историях болезни. Достоверные различия времени до прогрессирования в зависимости от исходного статуса получены у больных с олигодендроглиальными опухолями grade III: МВП у больных, имеющих статус 80 и более баллов, составила 36 мес.; 70 и менее баллов – 23 мес., р=0,014. Достоверных различий МВП больных с олигодендроглиальными опухолями grade II имеющих статус а) 80 и более баллов и б) 70 и менее баллов не получено.
Наличие неврологического дефицита Под понятием «неврологический дефицит» подразумевались неврологические симптомы и синдромы, связанные с наличием внутримозговой опухоли и вызывающие недостаточность тех или иных функций: нарушения памяти, гемипарез, нарушения речи, нарушения полей зрения, психические нарушения. Эписиндром, головная боль и признаки внутричерепной гипертензии к неврологическому дефициту не относились. Неврологический дефицит имел прогностическое значение у больных с опухолями как grade II, так и grade III. В первом случае МВП у больных без неврологического дефицита составила 47,2 мес., при его наличии – 29,9 мес., р=0,008. Для больных с опухолями grade III эти цифры составили 34,8 и 23,7 мес. соответственно, Р=0,008.
Наличие застойных дисков зрительных нервов Состояние глазного дна оценивалось при нейроофтальмологическом осмотре сотрудниками группы офтальмоневрологических исследований НИИ нейрохирургии им. Н.Н. Бурденко под руководством проф. Н.К. Серовой. У больных с опухолями grade II наличие застойных дисков зрительных нервов не влияло на прогноз болезни. У больных с опухолями grade III получены достоверные различия медианы времени до прогрессирования при выявлении и отсутствии застойных дисков зрительных нервов: в первом случае МВП составила 24 мес., во втором - 43 мес., р=0,015.
Локализация опухоли Сравнивались медианы времени до прогрессирования больных со следующими вариантами расположения опухоли: а) в лобной области (в эту группу вошли больные с опухолями, расположенные как в одной, так и в обеих лобных долях с возможным распространением на колено мозолистого тела); б) любой другой локализации. По полученным нами данным, локализация опухоли, независимо от ее степени злокачественности, не влияла на время до прогрессирования.
Таким образом, среди изученных факторов, прогностическое значение у больных с олигодендроглиальными опухолями grade II имело лишь наличие неврологического дефицита, что приводило к сокращению сроков выживаемости. В случаях олигодендроглиальных опухолей grade III прогноз был хуже у больных моложе 40 лет, и/или с дооперационным статусом по шкале Карновского 70 и менее балов, и/или имеющих застойные диски зрительных нервов, и/или с неврологическим дефицитом.
Влияние морфологической структуры опухоли на прогноз лечения и выживаемости больных с олигодендроглиальными опухолями
Сравнивалось время до прогрессирования у больных с опухолями grade II (140 чел.) и grade III (123 чел). Оценивалось влияние присутствия в опухоли астроцитарного компонента, для чего сравнивалась выживаемость больных с олигодендроглиомой (63 чел.) и олигоастроцитомой (77 чел.), а так же анапластической олигодендроглиомой (76 чел.) и анапластической олигоастроцитомой (47 чел.). Выживаемость была ниже у больных с опухолями grade III - 34,8 мес., чем у больных с опухолями - grade II 46,6 мес., р=0,036. Медиана времени до прогрессирования больных с ОД и ОА не различалась и составила 46,6 мес. Различная гистологическая принадлежность опухолей grade III также не приводила к изменению выживаемости – МВП больных с анапластической олигодендроглиомой составила 34,3 мес., с АОА - 36,1 мес., р=0,17.
Больные были распределены на несколько групп в зависимости от проведенного послеоперационного лечения. В каждой из этих групп эффективность лечения оценивалось раздельно у больных с опухолями grade II (ОД + ОА) и grade III (АОД + АОА).
а) группа лучевой терапии – в нее вошли больные, получавшие после операции только лучевую терапию (ЛТ), различия по подведенной суммарной очаговой дозе не учитывались. Таких больных было 20 с опухолями grade II и 25 с опухолями grade III.
б) группа химиотерапии (ХТ) - здесь объединены больные, получавшие различные химиотерапевтические режимы в качестве единственного послеоперационного противоопухолевого лечения. Таких больных было 29 с опухолями grade II и 36 с опухолями grade III. Эффективность каждого из примененных режимов не сравнивалась.
в) группа ЛТ + ХТ - в нее вошли больные, получавшие после операции и лучевую терапию и химиотерапию, последовательность применения этих методов не учитывалась. Таких больных было 10 с опухолями grade II и 36 с опухолями grade III. Больные, которым ЛТ или ХТ проводилась в связи с прогрессированием болезни на фоне проведения предыдущего вида лечения, в эту группу не вошли.
г) группа наблюдения – сюда включены 54 больных с опухолями grade II, находившихся под наблюдением, т.е. не получавших послеоперационного противоопухолевого лечения.
Вышеописанные группы больных не являются однородными по клиническому составу, поскольку, из-за отсутствия стандартов лечения олигодендроглиальных опухолей, в ряде случаев больные с различными прогностически значимыми, по нашим данным, клиническими показателями получили одинаковый объем лечения. Как говорилось выше, единственным фактором прогноза для больных с опухолями grade II, по нашим данным, явилось наличие у больных неврологического дефицита. Наибольшее число таких больных оказалось в группе ХТ – 13,8 % и группе ХТ+ЛТ – 10%. В группе только ЛТ таких больных не было, в группе наблюдения неврологический дефицит отмечен у 3,4% больных.
Таблица 4. Частота выявления неблагоприятных факторов прогноза у больных с опухолями grade III в различных лечебных группах (%)
| ЛТ | ХТ | ХЛТ | |
| Застойные диски зрительных нервов, % | 15,7 | 35 | 42 |
| Моложе 40 лет, % | 45,5 | 40 | 48,6 |
| Статус по шкале Карновского 70 баллов и менее, % | 2,8 | 2,5 | 10 |
| Наличие неврологического дефицита, % | 12 | 16,7 | 25 |

У больных с опухолями grade III прогностическими неблагоприятными факторами, по нашим данным, явились: возраст моложе 40 лет, статус по шкале Карновского 70 баллов и менее, наличие неврологического дефицита, застойные диски зрительных нервов. Процент больных моложе 40 лет не различался существенно в каждой из лечебных групп, составив 45, 5%, 40% и 48,6% в группах ЛТ, ХТ и ХЛТ, соответственно. Как видно из таблицы 4 и рис. 1, частота встречаемости других прогностических факторов в каждой из лечебных групп существенно рознилась. Самой «благоприятной» оказалось группа ЛТ – частота встречаемости неблагоприятных факторов прогноза (кроме возраста) была здесь наименьшей. В группе ЛТ+ХТ каждый из перечисленных неблагоприятных прогностических факторов встречался чаще, чем в остальных группах. Больные группы ХТ обладали промежуточными прогностическими параметрами.
У больных с опухолями grade II самая высокая выживаемость отмечена в группе ЛТ – медиана времени до прогрессирования составила 81,8 мес. У больных группы ЛТ+ХТ медиана времени до прогрессирования не достигнута (медиана времени наблюдения – 58 мес.). У больных группы наблюдения и группы химиотерапии МВП составила 45,5 мес. и 35.7 мес. соответственно.
У больных с опухолями grade III медиана времени до прогрессирования существенно не различалась в группе ЛТ и группе ЛТ+ХТ, составив 42,3 мес. и 45,0 мес. соответственно. То есть, несмотря на то, что по клиническим параметрам больные группы ЛТ+ХТ обладали значительно менее благоприятным прогнозом, чем больные группы ЛТ, у них удалось достичь выживаемости, сравнимой и даже несколько превышающей выживаемость больных группы ЛТ, которые имели наиболее благоприятные клинические показатели среди больных с опухолями grade III. У больных группы химиотерапии МВП была наименьшей – 29,6 мес.
У 4 больных с опухолями grade III зафиксировано прогрессирование болезни на фоне проводимого лечения (химиотерапии): у 3 – при плановой МРТ после проведения 3 курсов лечения и у 1 больной - при МРТ, выполненной ранее намеченного срока в связи с ухудшением состояния. В ходе проведения ЛТ случаев прогрессии опухоли не отмечено. Прогрессирования заболевания на фоне лечения у больных с опухолями grade II не наблюдалось.
Таким образом, степень злокачественности олигодендроглиальных опухолей является значимым прогностическим фактором. Гистологическая принадлежность олигодендроглиальных опухолей одинаковой степени злокачественности на прогноз не влияет. Больные с олигодендроглиальными опухолями grade II при проведении в послеоперационном периоде ЛТ имели лучшую выживаемость, чем при остальных вариантах лечебной тактики. Выживаемость больных с опухолями grade III существенно не различалась в группах ЛТ и ЛТ+ХТ. Учитывая клинические особенности больных этих групп, можно говорить о преимуществе проведения больным с олигодендроглиальными опухолями grade III и лучевой терапии и химиотерапии в сравнении с только ЛТ.
Влияние генетических изменений на прогноз больных с олигодендроглиальными опухолями
Генетический анализ проведен у 86 больных (АОД - 38, АОА – 18, ОД - 16, ОА - 14). Результаты показаны в таблице 5.
Таблица 5. Частота выявления генетических нарушений в различных олигодендроглиальных опухолях
| AO | AOA | O | OA | Всего | |
| Число исследованных опухолей | 38 | 18 | 16 | 14 | 86 |
| Делеция 1p | 21 | 6 | 13 | 4 | 44 |
| Делеция 1p19q | 19 | 6 | 13 | 3 | 41 |
| Делеция 9p | 6 | 0 | 0 | 0 | 6 |
| Делеция PTEN | 5 | 1 | 0 | 0 | 6 |
| Амплификация EGFR | 3 | 0 | 0 | 1 | 4 |
Делеция 1p выявлена у 44 больных, делеция 19q - у 45. В 41 случае наблюдалась сочетанная делеция 1р и 19q (коделеция 1p19q). Делеции генов CDKN2A, PTEN, амплификация гена EGFR выявлены у 6, 6 и 4 больных соответственно (табл.). Коделеция 1p19q, чаще выявлялась в олигодендроглиомах (grade II – ОД - в 13 из исследованных 16 образцов, т.е. у 81,2% больных, grade III – АОД- в 19 из 38, т.е. в 50% случаев), чем в смешанных, олигоастроцитарных, опухолях (grade II - ОА - в 3 из исследованных 14 образцов, т.е. у 28,5% больных, grade III – АОА - в 6 из 18 т.е. у 33,3%). В опухолях, несущих коделецию 1p19q, других исследованных хромосомных изменений не выявлялось. Аберрации, определяющие «неблагоприятный прогноз» – делеция генов CDKN2A, PTEN, амплификация гена EGFR – выявлялись по большей части в опухолях 3 степени злокачественности, при этом коделеции 1p19q в этих опухолях не было.
Как показал анализ выживаемости, изменения на хромосоме 1 имеют прогностическое значение только для олигодендроглиальных опухолей 3 степени злокачественности и только при одновременном наличии делеции 19q, т.е. в случаях коделеции 1p19q. Время до прогрессирования больных с олигодендроглиальными опухолями grade III, в которых обнаружена коделеция 1p19q – 46 мес. - оказалось достоверно выше, чем у больных с тем же гистологическим вариантом опухоли, но не имеющих коделеции 1p19q – 20,1 мес., р<0,001. Достоверных различий медианы времени до прогрессирования больных с опухолями grade II при наличии и отсутствии коделеции 1p19q не получено. При выявлении в опухоли делеции гена CDKN2A (хромосома 9) медиана времени до прогрессирования составила 6,4 мес., что достоверно ниже МВП больных, в опухолях которых делеции гена CDKN2A не обнаружена – 31,2 мес. (р=0,028). В связи с малым числом прослеженных случаев, прогностическая значимость делеции PTEN и амплификации EGFR как отдельных факторов не анализировалась. Дальнейший анализ прогностического влияния генетических изменений проводился только в случаях опухолей grade III, поскольку у больных с опухолями grade II изменения хромосом 1 и 19 не влияли на выживаемость, а остальные исследованные аберрации практически не встречались. Согласно литературным данным, присутствие в опухоли делеции 1р или коделеции 1p19q ведет к увеличению выживаемости, а наличие в опухоли делеции гена CDKN2A и/или гена PTEN, и/или амплификации гена EGFR - к ее снижению.
Учитывая эти и собственные данные, а также особенности сочетанного выявления различных аберраций в одном образце (отсутствие «неблагоприятных» изменений при наличии в опухоли коделеции 1p19q ),
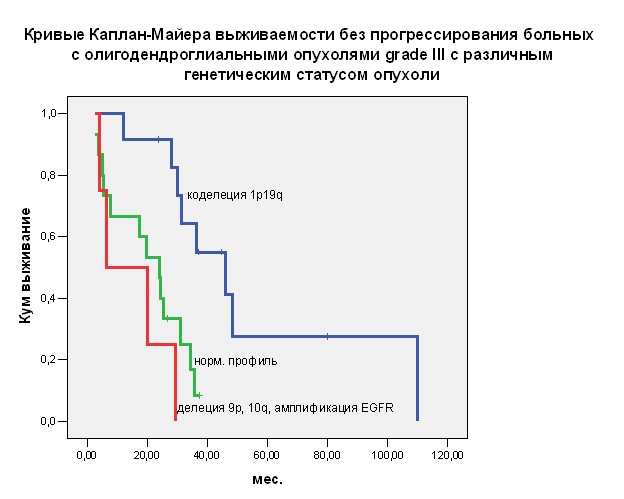
мы разделили все исследованные случаи на 3 группы. В первую группу вошли больные с коделецией 1p19q в клетках опухоли. Две другие группы составили: а) больные со сбалансированным хромосомным профилем опухоли и б) больные, у которых выявлена делеция гена CDKN2A и/или гена PTEN и/или амплификация гена EGFR. Выживаемость была наилучшей в случаях выявления в опухоли коделеции 1p19q – медиана времени до прогрессирования составила 46,0 мес., наихудшей - при наличии делеции гена CDKN2A и/или гена PTEN и/или амплификации EGFR - МВП составила 6,4 мес. Промежуточное положение заняли больные со сбалансированным генетическим профилем опухоли – МВП 24 мес., р=0,002
Выводы
- Установлено влияние ряда генетических аберраций (коделеции 1p/19q, делеции генов CDKN2A, PTEN, амплификации EGFR) на прогноз больных с олигодендроглиальными опухолями
- Коделеция 1p/19q чаще выявляется в олигодендроглиомах (grade II – 81,2%, grade III – 50%), чем в смешанных, олигоастроцитарных, опухолях (grade II – 21,4%, grade III – 33,3%).
- Делеция генов CDKN2A, PTEN, амплификация EGFR выявляется в олигодендроглиальных опухолях редко - в 4-6% случаев, в основном в grade III опухолях.
- Наилучшие показатели выживаемости среди больных с ОО grade III получены в случае присутствия коделеции 1p19q - 46 мес.; наименьшие - при делеции генов CDKN2A, PTEN или амплификации EGFR, или их комбинаций, – 6,4 мес.; средние - 24 мес. -при сбалансированном хромосомном профиле
- Для ОО grade II с различным генетическим профилем достоверных различий продолжительности времени до прогрессирования не получено
- Среди больных с ОО grade II наилучшие показатели выживаемости без прогрессирования достигнуты в случае проведения радиотерапии – медиана времени до прогрессирования составила 81,8 мес.
У больных с ОО grade III - при проведении лучевой и химиотерапии медиана времени до прогрессирования составила 45 мес.
Практические рекомендации
- Определение в олигодендроглиальных опухолях коделеции 1p/19q, делеции генов CDKN2A, PTEN, амплификации EGFR рекомендовано ведущим научно-исследовательским учреждениям с целью определения прогноза заболевания, а также для стратификации пациентов при проведении клинических исследований.
- Больным с олигодендроглиальными опухолями grade III рекомендовано удаление опухоли с последующим проведением лучевой терапии и химиотерапии. В случае сохраняющихся признаков внутричерепной гипертензии и/или значительного объема опухоли (застойных дисков зрительных нервов) лечение рекомендовано начинать с химиотерапии.
- Больным с олигодендроглиальными опухолями grade II рекомендовано удаление опухоли с последующим поведением лучевой терапии. Проведение химиотерапии возможно при наличии показаний к послеоперационному противоопухолевому лечению (возраст старше 40 лет, размеры опухоли более 6 см, пресечение опухолью срединой линии, неврологический дефицит) и невозможности проведения лучевой терапии (при наличии застойных дисков зрительных нервов и/или опухоли больших размеров)
Список работ, опубликованных по теме диссертации
- Абсалямова О. В., Коршунов А. Г., Кобяков Г. Л., Голанов А. В., Ураков С.В., Аманов Р.Д., Личиницер М. Р. Влияние молекулярно-генетических факторов на прогноз больных с олигодендроглиальными опухолями // Журнал Вопросы нейрохирургии им. акад. Н.Н.Бурденко. Москва, 2009, №1, с 17-24.
- Абсалямова О.В., Коршунов А. Г., Лошаков В. А, Кобяков Г. Л., Голанов А. В., Ураков С.В., Аманов Р.Д. Влияние молекулярно-генетических факторов на прогноз больных с олигодендроглиальными и смешанными опухолями // Вестник Российской Академии Медицинских Наук. Москва, 2008, № 6, приложение, с 6.
- Абсалямова О. В., Кобяков Г.Л., Аманов Р.Д., Лошаков В. А, Иноземцева М.И, Личиницер М. Р., Елисеева Н.М., Ураков С.В., Коршунов А. Г. Нитрозопроизводные в качестве первой линии лечения анапластических олигодендроглиальных и смешанных опухолей // Материалы Конгресса нейрохирургов стран Причерноморья, Ольгинка, 2007.
- Кобяков Г.Л., Абсалямова О. В., Аманов Р.Д., Личиницер М. Р., Елисеева Н.М., Ураков С.В., Коршунов А. Г. Применение темозоломида при рецидиве олигодендроглиальных опухолей: опыт НИИ нейрохирургии им. акад. Н.Н.Бурденко // Материалы ежегодной конференции «Перспективы в лечении злокачественных образований центральной нервной системы». Варшава, 2007.
- Кобяков Г.Л., Абсалямова О. В., Аманов Р.Д., Лошаков В. А, Иноземцева М.И, Личиницер М. Р., Елисеева Н.М., Ураков С.В., Коршунов А. Г. Фотемустин (PCNU) в качестве первой линии лечения олигодендроглиальных опухолей // Материалы Европейского конгресса нейрохирургов, Глазго, 2007.
- Абсалямова О.В., Коршунов А.Г., Личиницер М.Р., Лошаков В. А, Кобяков Г. Л., Пронин И.Н., Голанов А.В., Елисеева Н.М. Генетические факторы химиочувствительности олигодендроглиальных опухолей. Материалы IV съезда нейрохирургов России. Москва 2006.

